Yamagata 系乙型流感病毒血凝素蛋白单克隆抗体制备及双抗体夹心ELISA 检测方法的建立
2023-11-08程林芳杨帆刘福民姚航平吴南屏吴海波
程林芳 杨帆 刘福民 姚航平 吴南屏 吴海波
浙江大学医学院附属第一医院传染病重症诊治全国重点实验室,国家感染性疾病临床医学研究中心,感染性疾病诊治协同创新中心,杭州 310003
乙型流感病毒是引起季节性流感的主要病原之一,有研究表明,每隔7 个流感季会出现1 次乙型流感病毒主导的流感暴发[1]。 根据流感病毒表面蛋白血凝素(hemagglutinin,HA)蛋白,乙型流感病毒分为两个谱系:B/Victoria/2/87 为代表毒株的Victoria (V) 系和B/Yamagata/16/88 为代表毒株的Yamagata(Y)系[2-3]。2 种谱系乙型流感病毒在全球交替流行[4-5],目前,传统流感病毒鉴定方法依赖于临床样本中病毒分离,但这些方法耗时长,灵敏度低[6],而常用流感治疗药物越早服用效果越好。 因此,开发一种快速、准确的乙型流感病毒检测方法对临床早期诊断具有重要意义。
当前临床常用流感病毒诊断方法主要为实时荧光定量PCR 法,但该方法需要特殊设备条件(荧光定量PCR 仪),手工操作步骤多,易造成污染,不适用于基层地区或现场检测。 胶体金免疫层析技术是当前另一种常用的、适合居家自检的抗原检测技术,但其灵敏度较低,易导致漏检。 因此,本研究基于1 对靶向Y 系乙型流感病毒HA 的特异性单克隆抗体,建立1 种ELISA 双抗体夹心法,该方法具有灵敏度高、特异性好、操作简便、无需其他昂贵的实验仪器等优点,能快速、灵敏地检测Y 系乙型流感病毒,能较早发现流感病毒感染,控制疫情扩散。
材料与方法
一、细胞株和实验动物
小鼠骨髓瘤细胞SP2/0 和MDCK 细胞由浙江大学传染病重症诊治全国重点实验室保存。 BALB/c小鼠购自上海斯莱康实验动物有限公司。
二、流感病毒株
本研究使用的流感病毒株由浙江大学传染病重症诊治全国重点实验室保存:B/Phuket/3073/2013(Y 系)、B/Shang Hai/361/2002 (Y 系)、B/Florida/4/2006(Y 系)、B/Hubei-Wujiagang/158/2009(Y 系)、B/Massachusetts/2/2012 (Y 系)、B/Malaysia/2506/2004(V 系)、B/Brisbane/60/2008(V 系)、B/Washington/02/2019(V 系)、A/Michigan/45/2015(H1N1)和A/Texas/50/2012(H3N2)。
三、乙型流感病毒血凝素蛋白单克隆抗体的制备
选择6~8 周龄BALB/c,雌性小鼠,以纯化的Y系乙型流感病毒(B/Phuket/3073/2013)HA 蛋白对小鼠进行免疫[7-8]。 细胞融合前3 天,对小鼠进行加强免疫。 分离小鼠脾细胞,在聚乙二醇作用下与SP2/0细胞进行融合。 杂交瘤细胞在含次黄嘌呤-鸟嘌呤-磷酸核糖转移酶的DMEM 培养基进行选择性培养。2 周后,吸取细胞培养上清液进行ELISA 实验,筛选阳性克隆。 通过4 次有限稀释,筛选获得稳定高效表达抗Y 系乙型流感病毒的单克隆杂交瘤细胞株。选择8 周BALB/c 小鼠,每只接种含5×106个杂交瘤细胞,7~10 d 后收集小鼠腹水。 通过亲和纯化法(Protein G 琼脂凝胶)纯化腹水中的单克隆抗体,采用Bio-Rad 公司小鼠单克隆抗体免疫球蛋白分型试剂盒分析。
四、单克隆抗体特性分析
将收集5×106个目标单克隆杂交瘤细胞用1 mL的Trizol 裂解后提取RNA,并委托北京义翘神州股份有限公司进行抗体重链、轻链可变区测序[9]。
通过免疫荧光方法检测单克隆抗体特异性[7],将MDCK 细胞提前1 天以每孔4×104个细胞接种在48 孔板中。 用PBS 稀释后的病毒 (感染复数为0.5)感染细胞16 h。用4%多聚甲醛固定细胞30 min,用0.5% Triton-X100 通透细胞30 min, 用3% 血牛清白蛋白溶液封闭1 h。 每孔加入10 μg/mL 单克隆抗体,4 ℃孵育过夜。 同时设置同型对照(无关同型抗体)和阴性对照(PBS)。用PBS 洗细胞3 遍后加入用5 μg/mL 荧光二抗(Abcam),37 ℃下避光孵育90 min。用4',6-二脒基-2-苯基吲哚(DAPI)染色细胞核,室温下避光孵育10 min。 在荧光显微镜下观察实验结果,观察到绿色荧光即为阳性。
通过ELISA 检测单克隆抗体亲和力[9]。 将抗体用PBS 稀释到起始浓度(10 μg/mL)。 将PBS、正常小鼠血清和免疫小鼠血清分别用作空白、阴性和阳性对照。 将所有待测样本做2 个复孔,并用PBS 进行2 倍倍比稀释(10、5、2.5、1.25、0.63、0.31、0.15、0.08、0.04、0.02 和0.01 μg/mL)。 将所有样本加入用B/Phuket/3073/2013 HA 蛋白包被的ELISA 酶标板中进行检测。
五、双抗体夹心-ELISA 检测方法的建立
本研究中包被液、 封闭液、TMB 显色液和终止液均购自湖州英创生物科技有限公司。 以单克隆抗体1F7 为捕获抗体、单克隆抗体2H6 为检测抗体建立检测Y 系乙型流感病毒的双抗体夹心ELISA法[10-12]。 在10 mL 包被液中加入100 μL 的40 μg/mL单克隆抗体1F7,混匀后加入96 孔酶标板中(100 μL/孔),4 ℃过夜包板。 洗板3 次后,在96 孔酶标板中每孔加入200 μL 封闭液,室温封闭2 h。 洗板3 次后,在酶标板每孔中加入100 μL 待检样本,室温孵育2 h。洗板3 次后,在酶标板每孔中加入100 μL 的1 μg/mL经辣根过氧化酶(HRP)标记试剂盒标记单克隆抗体2H6,室温孵育1 h。洗板5 次后,在酶标板每孔中加入100 μL TMB 显色液,室温避光反应5 min 后,在酶标板每孔中加入100 μL 终止液终止反应。 于450 nm 处测定其光密度值,以测定值除以阴性≥2.1判定为阳性。
六、双抗体夹心ELISA 灵敏度和特异性验证
用2 倍倍比稀释的Y 系乙型流感病毒尿囊液和HA 蛋白(B/phuket/3073/2013)验证双抗体夹心ELISA 灵敏度。 将Y 系乙型流感病毒(B/phuket/3073/2013) 依次稀释至27、26、25、24、23、22、21、20、2-1、2-2、2-3和2-4血凝素单位(HAU),将100 μL 待检样本加入ELISA 板中进行检测。 将来自B/phuket/3073/2013 纯化HA 蛋白依次稀释至10、5、2.5、1.25、0.63、0.31、0.15、0.08、0.04、0.02 和0.01 μg/mL, 将100 μL 待检样本加入ELISA 板中进行检测,设阴性对照(空白尿囊液或PBS)。结果判定:空白孔和阴性孔未显色提示该双抗体夹心ELISA 有效, 否则无效;以测定值除以阴性≥2.1 判定为阳性。
为了验证双抗体夹心ELISA 方法特异性,将30份已知临床咽拭子样本加入ELISA 板中进行检测,包括9 份Y 系乙型流感病毒阳性样本、6 份V 系乙型流感病毒阳性样本、4 份H1N1 甲型流感病毒(H1N1)阳性样本、2 份H3N2 甲型流感病毒(H3N2)阳性样本以及2 份呼吸道合胞病毒(RSV) 阳性样本、2 份鼻病毒(RhV)阳性样本、3 份腺病毒(ADV)阳性样本、2 份SARS-CoV-2 阳性样本。
七、双抗体夹心ELISA 的临床样本检测初步应用
自2020 年1 月至2022 年12 月, 本研究共收集了100 份来自浙江大学医学院附属第一医院的人鼻咽拭子样本。 涉及的临床样本和病例的采集经浙江大学医学院附属第一医院伦理委员会批准(伦理审批号: IIT2021694)。 所有临床样本分别进行甲乙型流感病毒核酸联合测定试剂盒(荧光PCR 法)和双抗体夹心ELISA 检测结果比较,初步评价双抗体夹心ELISA 在检测临床样本的一致性[6]。取100 μL样本用磁珠法提取RNA,并用甲乙型流感病毒核酸测定试剂盒进行检测, 另取100 μL 样本用双抗体夹心ELISA 检测。 比较两者的检测结果,并计算双抗体夹心ELISA 的特异性和灵敏度。
结果
一、单克隆抗体特性分析
本研究共获得了2 株靶向Y 系乙型流感病毒(B/phuket/3073/2013) 血凝素蛋白单克隆抗体1F7和2H6。 同时亚型分析显示这2 株单克隆抗体均为IgG1,κ 型。
先前的研究表明乙型流感病毒株的进化速度低于甲型流感病毒[13],其中B/Massachusetts/2/2012(Y 系) 和B/Phuket/3073/2013 (Y 系) 分别作为2014—2015 年和2015—2023 年WHO 推荐的北半球4 价流感疫苗中的Y 系流感病毒疫苗成分,而B/Brisbane/60/2008(V 系)和B/Washington/02/2019(V系) 分别作为2014—2018 年和2020—2022 年WHO 推荐的北半球4 价流感疫苗中的V 系流感病毒疫苗成分。 因此本研究共选取8 株乙型流感病毒株,包括B/Shanghai/361/2002(Y 系)、B/Florida/2006(Y 系)、B/Hubei-Wujiagang/158/2009 (Y 系)、B/Massachusetts/2/2012 (Y 系)、B/Phuket/3073/2013(Y系)、B/Malaysia/2506/2004 (V 系)、B/Brisbane/60/2008(V 系)和B/Washington/02/2019(V 系),作为代表毒株通过免疫荧光实验检测单克隆抗体1F7 和2H6 的特异性。 实验结果提示单克隆抗体1F7 和2H6 与2002—2013 年Y 系乙型流感病毒能够特异性结合,与V 系乙型流感病毒、甲型H1N1 和甲型H3N2 流感病毒均无交叉反应(图1)。
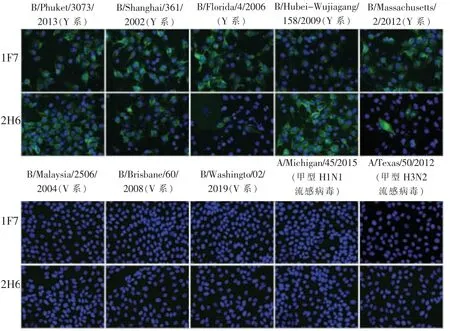
图1 单克隆抗体的特异性检测结果(20×,DAPI 染核)
通过ELISA 法分析单克隆抗体1F7 和2H6 的亲和力,结果提示这2 株单克隆抗体与乙型流感病毒HA 蛋白均具有较好的亲和力(图2)。

图2 单克隆抗体亲和力检测结果
二、双抗体夹心ELISA 的建立
将捕获抗体1F7 结合在96 孔酶标板表面上,用HRP 标记检测抗体2H6。抗原与固相载体表面的特异性抗体1F7 结合,再与HRP-抗体2H6 结合。加入TMB 底物显色液,底物即被酶催化成有色产物而显色。 显色程度与抗原的量直接相关,因此可根据显色的深浅进行定性或定量分析。
三、双抗体夹心ELISA 的灵敏度和特异性验证
将Y 系乙型流感病毒尿囊液和血凝素蛋白(B/phuket/3073/2013)进行2 倍倍比稀释,分析双抗体夹心ELISA 检测法的灵敏度。 如图3 所示,本研究中建立的双抗体夹心ELISA 能检测Y 系乙型流感病毒,灵敏度为2-1HAU。
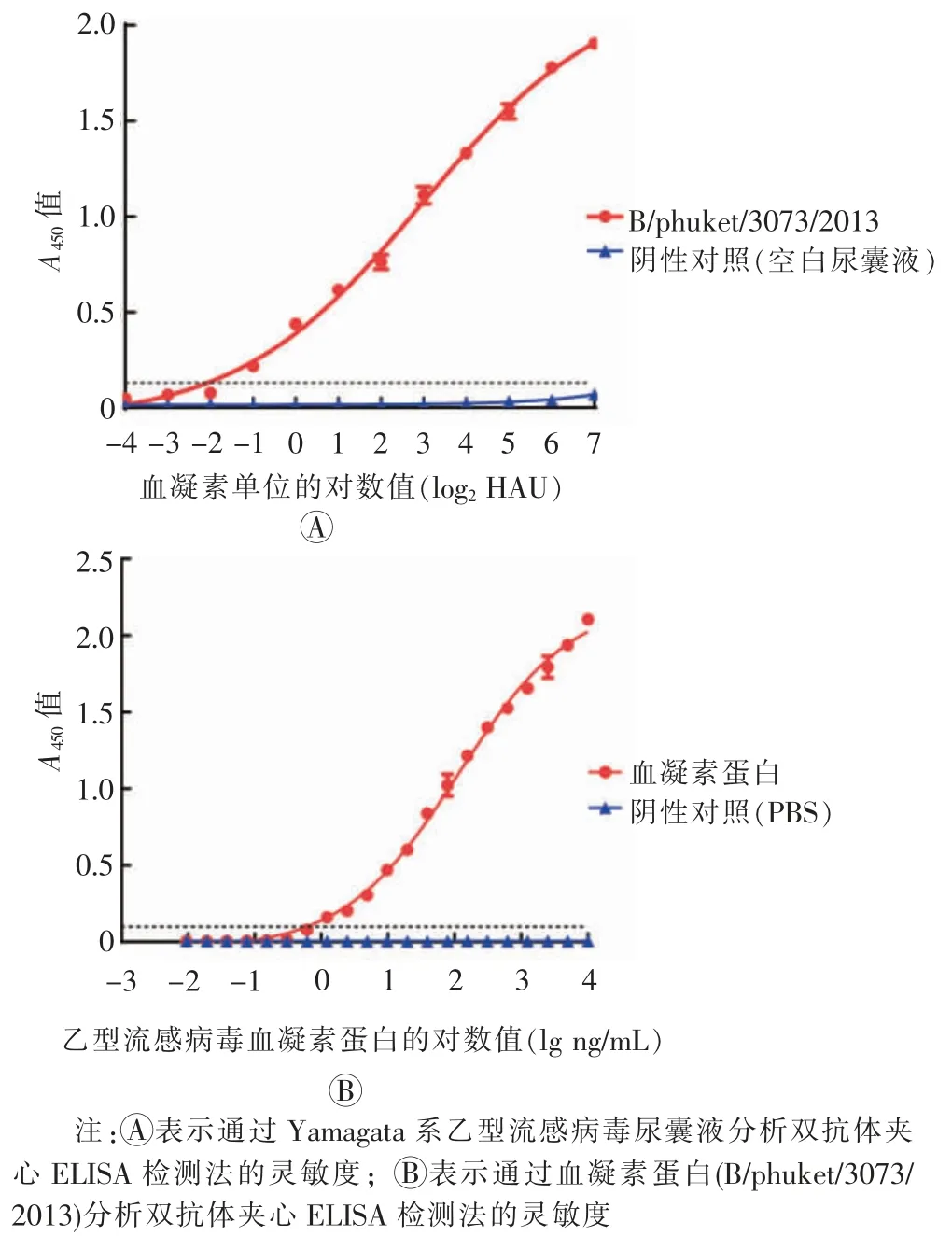
图3 双抗体夹心ELISA 检测法的灵敏度
特异性分析显示,本研究中建立的双抗体夹心ELISA 检测法能特异性检测Y 系乙型流感病毒,与其他病毒无交叉反应(表1)。
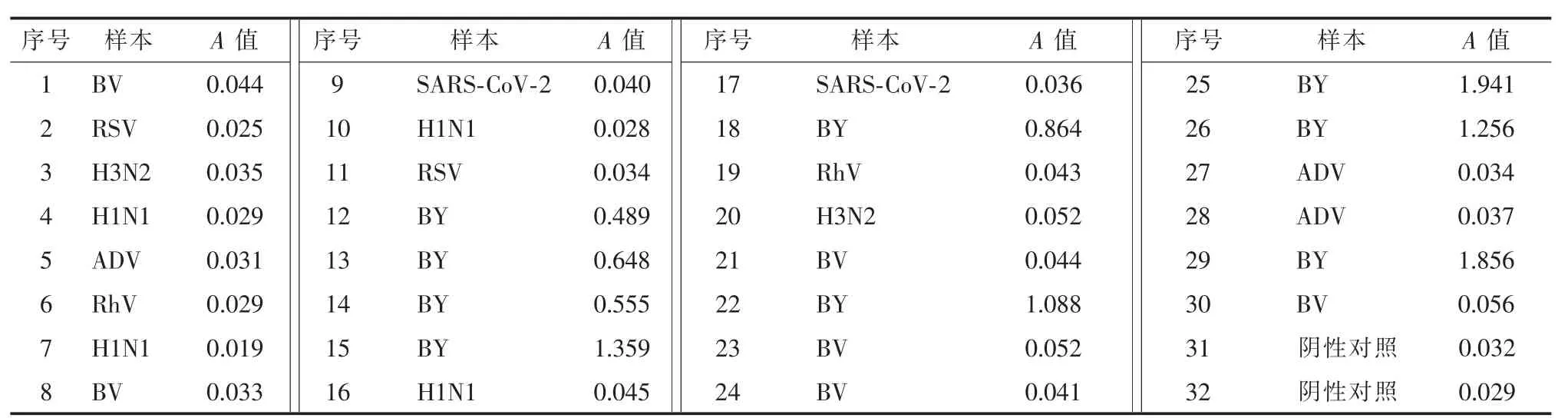
表1 双抗体夹心ELISA 检测法的特异性分析
四、双抗体夹心ELISA 检测法的重复性
双抗体夹心ELISA 的重复性实验显示批内(表2)和批间(表3)重复变异系数均小于5%,提示本研究组装的双抗体夹心ELISA 具有较好的重复性。
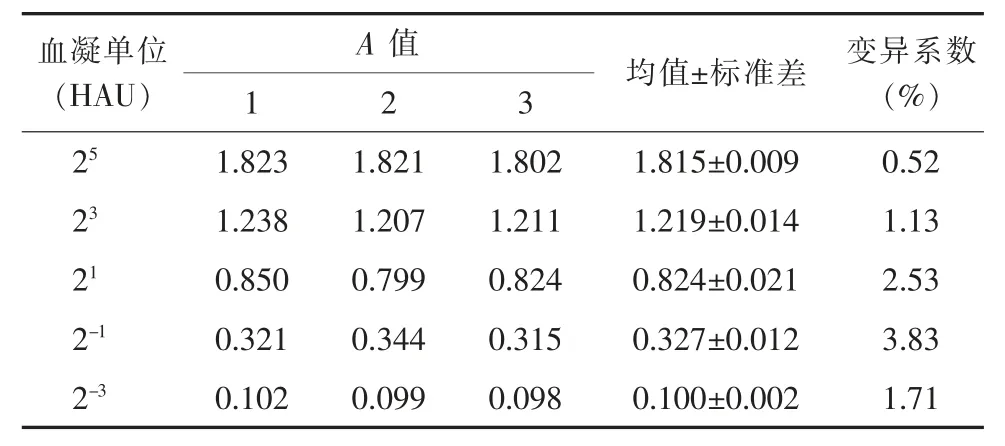
表2 双抗体夹心ELISA 的批内重复实验结果
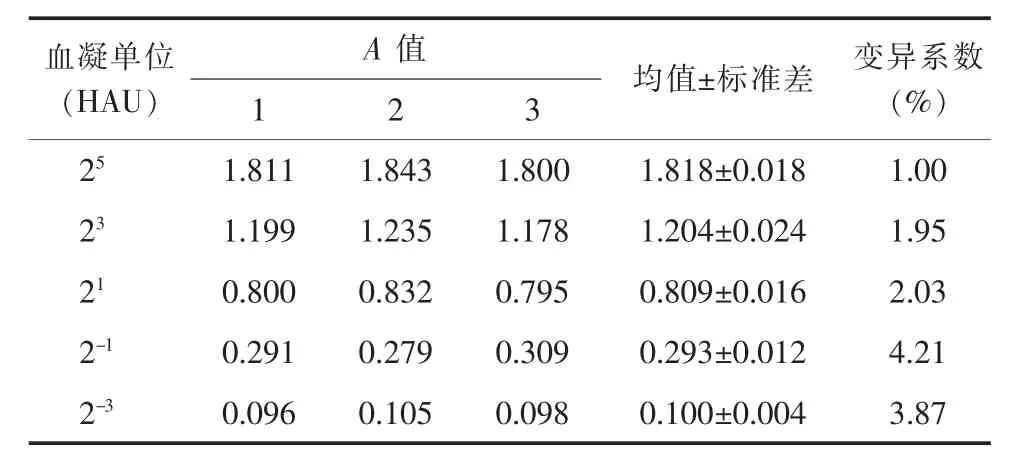
表3 双抗体夹心ELISA 的批间重复实验结果
五、双抗体夹心ELISA 检测法的临床应用
用本研究建立的双抗体夹心ELISA 试剂盒和甲乙型流感病毒核酸联合测定试剂盒 (荧光PCR法) 一起检测100 份来自浙江地区人鼻咽拭子样本。 在23 份经甲乙型流感病毒核酸联合测定试剂盒(荧光PCR 法) 检测阳性的样本中, 双抗体夹心ELISA 检测法的阳性率为91.30%(21/23)。 结果显示,该ELISA 法的阳性准确率91.30%(21/23),阴性准确率为98.70%(76/77)。
讨论
当前流感病毒检测方法主要包括病毒分离、实时荧光定量PCR 和免疫学抗原检测等方法[14-15]。 由于临床样本在转运过程中可能因保存条件不当而导致病毒失活,使其阳性率大大降低。 此时,流感病毒抗原快速检测,例如实时荧光定量PCR 和ELISA等方法,展现了其在样本初筛时特有的快速、简便、准确和分型诊断等优点。 其中, 双抗体夹心ELISA检测法通常利用一对识别不同抗原表位的单克隆抗体作为捕获抗体和检测抗体,通常靶向抗原的非重叠区域,因此该方法特异性高,但获得一对最佳的抗体配对是当前的技术难点。 目前,双抗体夹心ELISA 检测法已广泛应用于检测不同亚型流感病毒抗原, 包括甲型H5、H6、H7 和H9 流感病毒和乙型流感病毒[10,16-19]。 丘立文等[19]制备了针对乙型流感病毒核衣壳蛋白单克隆抗体并建立了一种乙型流感病毒的双抗体夹心ELISA 检测试剂盒,具有较高特异性和灵敏度,与病毒分离和RT-PCR 相当。徐菱等[20]也建立了检测乙型流感病毒核蛋白的双抗体夹心ELISA 试剂盒,其最低检出限为13.26 ng/mL。
本研究共获得2 株抗Y 系乙型流感病毒HA蛋白的单克隆抗体1F7 和2H6,对获得的单克隆细胞株的重、轻链可变区基因进行测序,这些序列的获得可用于下一步重组表达工程抗体和三维结构模拟[9]。另外,单克隆抗体1F7 和2H6 分别作为捕获和检测抗体组装了Y 系乙型流感病毒的双抗体夹心ELISA 检测试剂盒。 通过各项条件优化,该检测方法具有良好的特异性, 能检测Y 系乙型流感病毒,且与其他病毒不发生交叉反应,该检测方法的灵敏度达到1.22 ng/mL(HA 蛋白)或2-1HAU/100 μL乙型流感病毒,具有良好的灵敏度;与甲、乙型流感病毒核酸联合测定试剂盒(荧光PCR)相比,该检测方法的阳性准确率和阴性准确率分别为91.30%(21/23)和98.70%(76/77)。 不同于丘立文等[19]和徐菱等[20]建立的针对乙型流感病毒的保守蛋白(核蛋白)的乙型流感病毒的双抗体夹心ELISA 检测试剂盒, 本研究针对乙型流感病毒HA 蛋白筛选了特异性单克隆抗体1F7 和2H6, 并基于单克隆抗体1F7和2H6 建立了主要针对Y 系乙型流感病毒的双抗体夹心ELISA 检测试剂盒,可以快速、准确地对Y系乙型流感病毒株进行检测和分型。 同时,必要时该双抗体夹心ELISA 检测试剂盒可以与其他检测V 系乙型流感病毒的检测试剂盒联用, 拓宽其在临床检测中的应用。
综上,本研究基于Y 系乙型流感病毒HA 蛋白制备了2 株特异性单克隆抗体,并进一步建立了检测Y 系乙型流感病毒的双抗体夹心ELISA 法,该方法操作简便,适用于检测大批量样本,具有潜在的临床应用价值。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明程林芳:实施研究、采集数据、起草文章、统计分析;杨帆:采集数据、分析/解释数据、起草文章;刘福民:实施研究、采集数据;姚航平:分析/解释数据、统计分析、获取研究经费、行政和技术支持;吴南屏:对文意的知识性内容作批评性审阅、统计分析、行政和技术支持;吴海波:酝酿和设计实验、分析/解释数据、获取研究经费、指导、支持性贡献
