川穹嗪调节SIRT1/AMPK/PGC1α信号通路对偏头痛大鼠镇痛作用及神经元损伤的影响
2023-11-08胡滨王大斌郭茂
胡滨 王大斌 郭茂
摘要:目的 探究川穹嗪(TMP)通過调控沉默信息调节因子2相关酶1(SIRT1)/腺苷酸活化蛋白激酶(AMPK)/过氧化物酶体增殖物激活受体γ共激活因子1α(PGC1α)信号通路对偏头痛大鼠发挥镇痛和神经元损伤的保护作用。方法 通过硝酸甘油诱导建立偏头痛大鼠模型,造模成功后随机分为模型(M)组、TMP低剂量(TMP-L)组(50 mg/kg)、TMP中剂量(TMP-M)组(100 mg/kg)、TMP高剂量(TMP-H)组(200 mg/kg)、TMP(200 mg/kg)+SIRT1抑制剂(EX527,5 mg/kg)组,每组10只;另取10只作为正常对照(NC)组。连续灌胃2周。给药结束24 h后,记录各组大鼠在连续30 min内出现挠头、爬笼的次数,进行行为学评分;测定机械性刺激及热刺激痛阈;酶联免疫吸附试验法检测血清中一氧化氮(NO)、白细胞介素(IL)-6、IL-1β含量和脑组织中5-羟色胺(5-HT)、去甲肾上腺素(NE)、多巴胺(DA)含量;TUNEL染色观察脑组织神经元凋亡情况;Western blot法检测脑组织中SIRT1、AMPK、p-AMPK、PGC1α蛋白表达。结果 与NC组比较,M组大鼠行为学评分,血清中NO、IL-6、IL-1β水平,神经元凋亡率升高(P<0.05);机械性刺激痛阈值降低,热刺激潜伏期缩短(P<0.05);脑组织中5-HT、NE、DA水平,p-AMPK/AMPK比值,SIRT1、PGC1α蛋白表达降低(P<0.05)。与M组比较,TMP各剂量组大鼠行为学评分,血清中NO、IL-6、IL-1β水平,神经元凋亡率降低(P<0.05);机械性刺激痛阈值升高,热刺激潜伏期延长(P<0.05);脑组织中5-HT、NE、DA水平,p-AMPK/AMPK比值,SIRT1、PGC1α蛋白表达升高(P<0.05);与TMP-H组比较,TMP+EX527组可显著逆转TMP对偏头痛大鼠的作用。结论 TMP可能通过调节SIRT1/AMPK/PGC1α信号通路的表达,改善神经元损伤,发挥对偏头痛大鼠的镇痛作用。
关键词:偏头痛;镇痛;神经元;AMP活化蛋白激酶类;过氧化物酶体增殖物激活受体γ共激活因子1α;一氧化氮;白细胞介素6;白细胞介素1β;川穹嗪;沉默信息调节因子2相关酶1
中图分类号:R285.5文献标志码:ADOI:10.11958/20220873
Effects of tetramethylpyrazine on analgesia and neuronal damage in migraine rats by regulating SIRT1/AMPK/PGC1α signaling pathway
HU Bin, WANG Dabin, GUO Mao
Department of Pain, Luzhou People's Hospital, Luzhou 646000, China
Corresponding Author E-mail: 1044915644@qq.com
Abstract: Objective To explore the effects of tetramethylpyrazine (TMP) on analgesia and neuronal injury protection in migraine rats by regulating silent mating type information regulation 2 homolog 1 (SIRT1)/AMP activated protein kinase (AMPK)/peroxisome proliferator-activated receptor γ coactivator 1α (PGC1α) signaling pathway. Methods The migraine rat model was established by nitroglycerin induction. After successful modeling, rats were randomly divided into the model (M) group, the TMP low dose (TMP-L) group (50 mg/kg), the TMP medium dose (TMP-M) group (100 mg/kg), the TMP high dose (TMP-M) group (200 mg/kg) and the TMP (200 mg/kg) + SIRT1 inhibitor (EX527, 5 mg/kg) group, 10 rats in each group. Another 10 rats were regarded as the normal control (NC) group. Rats were continuously gavaged for 2 weeks. Twenty-four hours after the end of the administration, the times of scratching head scratching and cage climbing of rats within 30 minutes were recorded in each group, and the behavioral score was carried out. The pain threshold for mechanical stimulation and thermal stimulation were determined. ELISA method was applied to measure serum levels of nitric oxide (NO), interleukin-6 (IL-6), interleukin-1β (IL-1β), and 5-hydroxytryptamine (5-HT), norepinephrine (NE) and dopamine (DA) in brain tissue. TUNEL staining was applied to observe neuronal apoptosis in brain tissue. Western blot assay was applied to measure the protein expression levels of SIRT1, AMPK, p-AMPK and PGC1α protein in brain tissue. Results Compared with the NC group, the behavioral score, serum levels of NO, IL-6 and IL-1β, and neuron apoptosis rate were significantly increased in the M group (P<0.05). The pain threshold of mechanical stimulation was significantly reduced, and the latency of thermal stimulation was significantly shortened (P<0.05). The levels of 5-HT, NE and DA in brain tissue, the ratio of p-AMPK/AMPK, and the protein expressions of SIRT1 and PGC1α were significantly decreased (P<0.05). Compared with the M group, the behavioral score, the serum levels of NO, IL-6 and IL-1β, and neuron apoptosis rate were significantly decreased in the TMP groups (P<0.05). The pain threshold of mechanical stimulation was significantly increased, and the latency of thermal stimulation was significantly prolonged (P<0.05). The levels of 5-HT, NE and DA in brain tissue, the ratio of p-AMPK/AMPK, and the protein expressions of SIRT1 and PGC1α were significantly increased (P<0.05). Compared with the TMP-H group, TMP+EX527 group showed that it significantly reversed the effect of TMP on migraine rats. Conclusion TMP may improve neuronal damage by regulating the expression of SIRT1/AMPK/PGC1α signaling pathway and exert analgesic effect on migraine rats.
Key words: migraine; analgesia; neurons; AMP-activated protein kinases; peroxisome proliferator-activated receptor gamma coactivator 1α; nitric oxide; interleukin-6; interleukin-1beta; tetramethylpyrazine; silent mating type information regulation 2 homolog 1
偏头痛是临床常见的一种慢性神经系统疾病,主要表现为一侧或双侧搏动性剧烈头痛,伴随恶心、呕吐、畏光、畏声等[1-2]。目前临床上多采用曲普坦类药物进行治疗,但存在一定不良反应,且不能从根本上治愈[3]。川穹嗪(TMP)是中药川穹的主要生物活性成分,常被用于治疗神经退行性疾病[4]。已有研究证实TMP能够通过抑制c-fos/ERK信号通路表达,有效改善硝酸甘油诱导的大鼠偏头痛[5]。硝酸甘油是一氧化氮(NO)的供体,能够通过激活三叉神经末梢释放降钙素基因相关肽诱导神经源性炎症反应,引起偏头痛[6]。沉默信息调节因子2相关酶1(SIRT1)/腺苷酸活化蛋白激酶(AMPK)/过氧化物酶体增殖物激活受体γ辅助激活因子1α(PGC1α)信号通路在细胞凋亡、氧化应激和炎症反应中发挥重要作用[7]。本研究通过硝酸甘油诱导建立偏头痛大鼠模型,探究TMP能否通过调控SIRT1/AMPK/PGC1α信号通路对偏头痛大鼠起到镇痛和神经元损伤保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级6周龄SD雄性大鼠60只,体质量200~220 g,购自上海杰思捷实验动物有限公司,动物生产许可证号:SCXK(沪)2018-0004,质量合格证号201000546402。实验前适应性饲养1周,室温20~25 ℃,相对湿度45%~55%,明暗12 h/12 h,自由饮水、摄食,遵守实验动物管理条例和3R原则。
1.1.2 試剂与仪器 硝酸甘油(CS-O-11467)购自深圳海思安生物技术有限公司;TMP(RQ1824)购自上海谱科生物技术有限公司;SIRT1抑制剂EX527(纯度99.69%,M00182)购自北京百奥莱博科技有限公司;NO(A012-1-2)、白细胞介素-6(IL-6,H007-1-1)、IL-1β(H002)、5-羟色胺(5-HT,H104-1-1)、去甲肾上腺素(NE,H096)、多巴胺(DA,H170)酶联免疫吸附试验(ELISA)检测试剂盒均购自南京建成生物工程研究所;RIPA蛋白裂解液(R0010)、BCA蛋白浓度测定试剂盒(PC0020)、ECL显色液(PE0010)均购自北京索莱宝科技有限公司;兔抗鼠SIRT1抗体(2493S)、兔抗鼠AMPK抗体(4150S)、兔抗鼠p-AMPK抗体(5759S)、兔抗鼠PGC1α抗体(2178S)及羊抗兔二抗(7074S)均购自美国CST公司。Von Frey Hairs纤毛机械刺激针购自上海博士仪器有限公司;光照测痛仪购自北京智鼠多宝生物科技有限责任公司;OlympusBX53半电动荧光显微镜购自日本奥林巴斯公司;GelDoc Go凝胶成像系统购自伯乐生命医学产品(上海)有限公司。
1.2 研究方法
1.2.1 模型建立与分组给药 参照文献[8],采用腹腔注射10 mg/kg硝酸甘油制备大鼠偏头痛模型,造模4 h后观察大鼠行为,当大鼠连续30 min出现耳红、挠头、爬笼等行为时,提示造模成功。将造模成功的大鼠依据随机数字表法分为模型(M)组、TMP低剂量(TMP-L)组、TMP中剂量(TMP-M)组、TMP高剂量(TMP-H)组及TMP+EX527组,每组10只。其中TMP-L组、TMP-M组、TMP-H组根据成人与大鼠体表面积比进行剂量换算后,分别灌胃50、100、200 mg/kg TMP溶液[9],TMP+EX527组灌胃TMP溶液200 mg/kg以及尾静脉注射5 mg/kg的EX527[10]。另取10只大鼠作为正常对照(NC)组。M组与NC组给予等体积生理盐水灌胃。每日1次,连续灌胃2周。
1.2.2 大鼠行为学观察 给药结束24 h后,记录各组大鼠在连续30 min内出现挠头、爬笼的次数,每个症状出现1次记为1分[11]。以给药结束24 h记为初始时间(即0 min),记录0~30 min、60~90 min、120~150 min 3个时间段行为学评分。
1.2.3 大鼠机械性刺激及热刺激痛阈测定 机械性刺激痛阈测定:采用纤毛机械刺激针,从最小刺激强度开始刺激大鼠须垫部,不能引起大鼠缩头反应调大一级,以出现缩头反应时的纤毛针强度为机械性刺激痛阈值,重复测试3次,取平均值作为最终结果。
热刺激痛阈测定:于光照测痛仪上固定大鼠,待其平静后将校准光对准大鼠须垫部,打开开关使灯头发出刺激强光(强光反射器不可移动),感应器感应到大鼠出现缩头反应时熄灭刺激强光,显示器上显示的时间记为热刺激潜伏期,重复测试3次后取其平均值。
1.2.4 ELISA法检测血清中NO、IL-6、IL-1β含量 痛阈测定结束后,腹腔注射戊巴比妥钠麻醉大鼠,运用采血管进行腹主动脉取血,静置2 h,4 ℃、3 500 r/min离心10 min,收集上清液,按照ELISA检测试剂盒说明书进行操作,检测各组大鼠血清中NO、IL-6、IL-1β水平。
1.2.5 TUNEL染色观察脑组织神经元凋亡情况 取血完成后,断头处死大鼠,冰上迅速分离出脑干。取一部分脑干置于4%多聚甲醛中固定,另一部分保存于-80 ℃冰箱中。固定好的组织进行常规石蜡包埋、切片,再将切片脱蜡至水,蛋白酶K修复抗原,洗涤后加入TUNEL反应液,封片镜检并拍照,选择5个随机视野计算阳性细胞率(即细胞凋亡率)。凋亡率=阳性凋亡细胞数/总细胞数×100%。
1.2.6 ELISA法检测脑组织中5-HT、NE、DA含量 取-80 ℃冰箱中的脑干组织制备组织匀浆液,采用ELISA检测试剂盒检测各组大鼠脑组织中5-HT、NE、DA含量。
1.2.7 Western blot法检测脑组织中SIRT1、AMPK、p-AMPK、PGC1α蛋白表达 取-80 ℃冰箱中保存的脑干组织,解冻后充分匀浆,加入RIPA蛋白裂解液提取总蛋白,离心后取上清液,采用BCA法测定蛋白浓度。取50 μg蛋白上样进行SDS-PAGE,转膜,5%脱脂奶粉室温封闭2 h后洗膜,加入SIRT1、AMPK、p-AMPK、PGC1α一抗(稀释倍数1︰1 000),4 ℃孵育过夜后洗膜;加入二抗(稀释倍数1︰2 000),室温孵育2 h,采用ECL显色,凝胶成像系统观察蛋白条带并分析灰度值。以β-actin为内参,计算各组目的蛋白的相对表达量。
1.3 统计学方法 采用GraphPad Prism 8.0软件进行数据分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
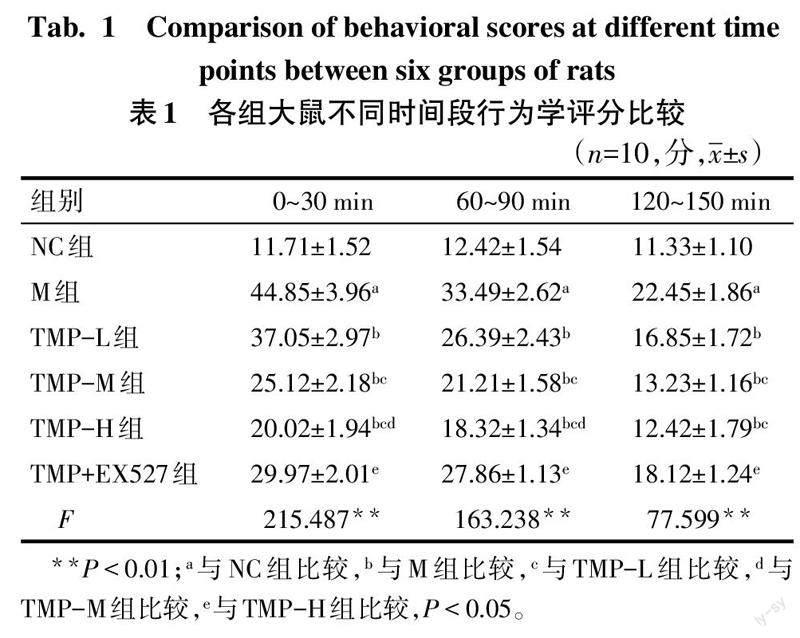
2.1 各组大鼠行为学改变 NC组大鼠未见行为学异常表现;与NC组比较,M组大鼠在0~30 min、60~90 min、120~150 min 3个时间段挠头次数与爬笼次数均增加,行为学评分升高(P<0.05);与M组比较,TMP各剂量组大鼠在0~30 min、60~90 min、120~150 min 3个时间段内行为学评分降低(P<0.05),且在0~30 min、60~90 min时间段内TMP各剂量组间具有剂量效应;与TMP-H组比较,TMP+EX527组在3个时间段内行为学评分升高(P<0.05),见表1。
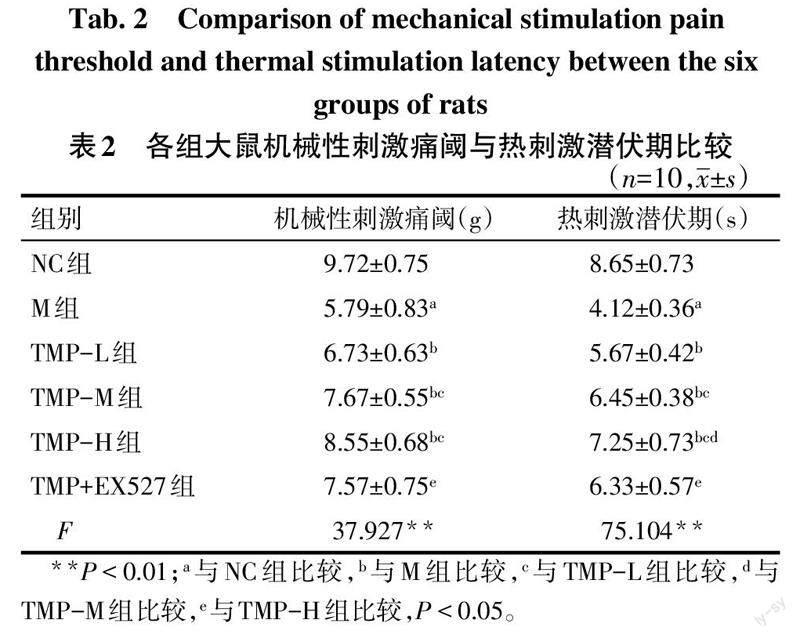
2.2 各组大鼠机械性刺激痛阈及热刺激痛阈比较 与NC组比较,M组大鼠机械性刺激痛阈值降低,热刺激潜伏期缩短(P<0.05);与M组比较,TMP各剂量组大鼠机械性刺激痛阈升高,热刺激潜伏期延长(P<0.05),且TMP各剂量组间热刺激潜伏期具有剂量效应;TMP+EX527组与TMP-H组比较,机械性刺激痛阈值降低,热刺激潜伏期缩短(P<0.05),见表2。
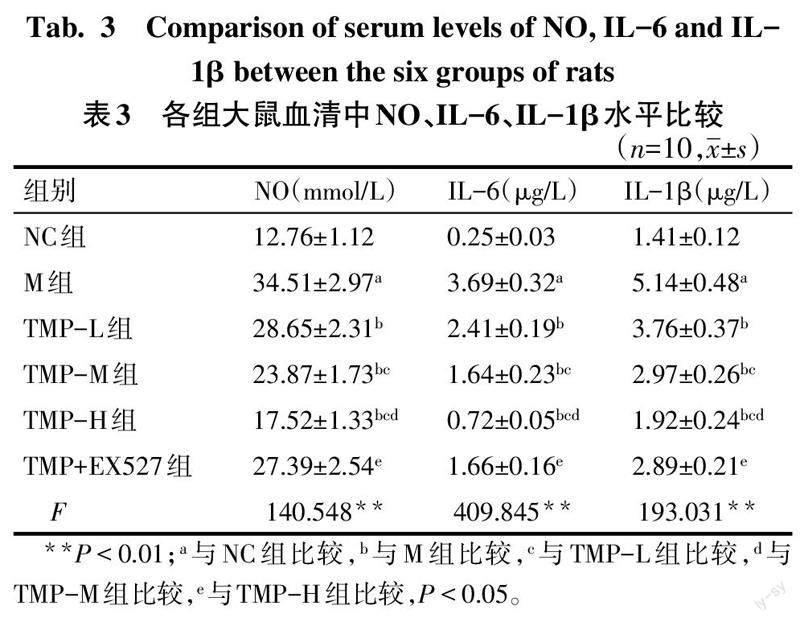
2.3 各组大鼠血清中NO含量及炎性因子水平比较 与NC组比较,M组大鼠血清中NO、IL-6、IL-1β水平升高(P<0.05);与M组比较,TMP各剂量组大鼠血清中NO、IL-6、IL-1β水平降低(P<0.05),且TMP各剂量组间具有剂量效应;TMP+EX527组与TMP-H组比较,血清中NO、IL-6、IL-1β水平升高(P<0.05),见表3。
2.4 各组大鼠脑组织神经元凋亡情况 各组间神经元凋亡率差异有统计学意义(n=10,F=249.777,P<0.01)。与NC组(7.32%±0.75%)比较,M组(36.57%±2.91%)大鼠脑组织神经元凋亡率显著升高(P<0.05);与M组比较,TMP-L组(31.49%±2.87%)、TMP-M组(24.12%±2.33%)、TMP-H组(16.31%±1.45%)大鼠脑组织神经元凋亡率显著降低(P<0.05),且TMP各劑量组间具有剂量效应;TMP+EX527组(25.62%±1.33%)与TMP-H组比较神经元凋亡率显著升高(P<0.05),见图1。
2.5 各组大鼠脑组织中生化指标比较 与NC组比较,M组大鼠脑组织中5-HT、NE、DA水平均降低(P<0.05);与M组比较,TMP各剂量组大鼠脑组织中5-HT、NE、DA水平均升高(P<0.05),且TMP-L组、TMP-M组、TMP-H组间具有剂量效应;与TMP-H组比较,TMP+EX527组大鼠脑组织中5-HT、NE、DA水平均降低(P<0.05),见表4。
2.6 各组大鼠脑组织中SIRT1、AMPK、p-AMPK、PGC1α蛋白表达的影响 与NC组比较,M组大鼠脑组织中AMPK磷酸化水平降低,即p-AMPK/AMPK比值降低,SIRT1、PGC1α蛋白表达降低(P<0.05);与M组比较,TMP-L组、TMP-M组、TMP-H组大鼠脑组织中p-AMPK/AMPK比值和SIRT1、PGC1α蛋白表达均升高(P<0.05),且TMP各剂量组间具有剂量效应;与TMP-H组比较,TMP+EX527组p-AMPK/AMPK比值和SIRT1、PGC1α蛋白表达降低(P<0.05),见图2、表5。
3 讨论
3.1 TMP改善偏头痛大鼠的炎症反应和痛觉敏感性 中医认为偏头痛的主要病因是情志内伤、久病致瘀、痰瘀阻络等[12]。偏头痛根治困难、极易复发,患者常伴有焦虑、抑郁等症状,严重时还可出现精神障碍[13]。目前硝酸甘油诱导偏头痛是建立动物模型的常用方法。本研究结果显示,硝酸甘油诱导的偏头痛大鼠表现为挠头次数以及爬笼次数均显著增加,大鼠机械性刺激痛与热刺激痛阈值下降,血清中NO含量及IL-6、IL-1β水平均显著升高,提示大鼠体内炎症反应过度,大鼠痛觉敏感度升高,出现偏头痛症状,模型建立成功。TMP可通过抑制氧自由基释放,下调NO产生,抑制炎性因子的表达,保护缺血再灌注脑损伤[14]。本研究结果显示,TMP各剂量组能够不同程度地减轻大鼠行为学变化,降低血清中NO水平,抑制IL-6、IL-1β表达,改善大鼠痛觉敏感性。
3.2 TMP减轻偏头痛大鼠神经元损伤 研究发现,5-HT、NE、DA等神经递质在偏头痛发作期水平下降,引起血管扩张,加剧大鼠偏头痛和神经损伤[15-17]。包括5-HT、NE和DA在内的单胺类物质在中枢和外周神经系统广泛表达,影响血管舒缩功能和痛觉传递。腹腔注射硝酸甘油作为外部刺激可刺激颞叶兴奋性信号传导,影响5-HT、NE和DA的释放,进而导致偏头痛的发生[18-19]。本研究结果显示,偏头痛大鼠脑组织中5-HT、NE、DA水平降低,神经元凋亡增加,与Hou等[16]的研究一致,缩血管因子NE和DA的下降反向证实了模型大鼠的血管扩张,提示偏头痛大鼠神经受损。不同剂量TMP处理后大鼠脑组织中5-HT、NE、DA水平升高,神经元凋亡降低,表明TMP可改善偏头痛大鼠神经元损伤。
3.3 TMP激活偏头痛大鼠体内SIRT1/AMPK/PGC-1α通路 SIRT1参与调节多种细胞的生理过程,在氧化应激、炎症反应以及能量代谢中发挥关键作用[20]。AMPK与SIRT1功能相似,是调节氧化应激与能量代谢的关键因子[21]。SIRTI与AMPK作为PGC-1α的上游因子,通过抑制PGC-1α乙酰化,上调PGC-1α表达,抑制氧化应激与炎症反应、减少细胞凋亡,发挥神经保护作用[22]。本研究发现,不同剂量TMP处理后大鼠脑组织中AMPK磷酸化和SIRT1、PGC1α蛋白表达上调,提示TMP能够激活SIRT1/AMPK/PGC-1α通路,抑制炎症反应,减轻神经元凋亡,改善神经元损伤。但SIRT1抑制剂EX527干预后,TMP对大鼠的镇痛和神经元损伤保护作用被部分逆转,因此调控SIRT1/AMPK/PGC-1α通路可能是TMP对偏头痛大鼠的治疗机制之一。
綜上所述,TMP可能通过调控SIRT1/AMPK/PGC-1α通路有效改善偏头痛大鼠的行为异常和痛觉敏感,减轻神经元凋亡,抑制炎症反应和NO表达,上调5-HT、NE、DA水平,从而发挥镇痛作用和神经元损伤保护作用。但由于偏头痛发病机制复杂,TMP的治疗作用还需要后续进一步深入探索。
参考文献
[1] SPECK R M,COLLINS E M,LOMBARD L,et al. A qualitative study to assess the content validity of the 24-hour migraine quality of life questionnaire in patients with migraine[J]. Headache,2020,60(9):1982-1994. doi:10.1111/head.13915.
[2] BARRA M,DAHL F A,VETVIK K G,et al. A Markov chain method for counting and modelling migraine attacks[J]. Sci Rep,2020,10(1):3631. doi:10.1038/s41598-020-60505-5.
[3] HIRATA K,UEDA K,KOMORI M,et al. Unmet needs in Japanese patients who report insufficient efficacy with trip-tans for acute treatment of migraine:Retrospective analysis of real-world data[J]. Pain Ther,2021,10(1):415-432. doi:10.1007/s40122-020-00223-y.
[4] MENG Z,CHEN H,MENG S. The roles of tetramethylpyrazine during neurodegenerative disease[J]. Neurotox Res,2021,39(5):1665-1677. doi:10.1007/s12640-021-00398-y.
[5] LI H,BAI F,CONG C,et al. Effects of ligustrazine on the expression of neurotransmitters in the trigeminal ganglion of a rat migraine model[J]. Ann Transl Med,2021,9(16):1318-1328. doi:10.21037/atm-21-3423.
[6] 王欢,王淑敏,陈长宝,等. 黄绿卷毛菇对硝酸甘油诱导偏头痛大鼠的镇痛、抗炎作用[J]. 菌物学报,2020,39(5):917-922. WANG H,WANG S M,CHEN C B,et al. Anti-inflammatory and analgetic effects of the aqueous extract of Floccularia luteovirens on NTG-induced migraine in rats[J]. Mycosystema,2020,39(5):917-922. doi:10.13346/j.mycosystema.190384.
[7] ZHENG Y,LIU T,WANG Z,et al. Low molecular weight fucoidan attenuates liver injury via SIRT1/AMPK/PGC1α axis in db/db mice[J]. Int J Biol Macromol,2018,112:929-936. doi:10.1016/j.ijbiomac.2018.02.072.
[8] 刘洁,李利民,宁楠,等. 半夏泻心汤介导的cAMP/PKA信号通路对偏头痛模型大鼠c-fos/c-jun基因的调控作用[J]. 中药药理与临床,2019,35(3):37-40. LIU J,LI L M,NING N,et al. The regulation of c-fos/c-jun by (Banxiaxiexintang) BXT mediated CAMP/PKA signaling pathway in migraine rat model[J]. Pharmacology and Clinics of Chinese Materia Medica,2019,35(3):37-40. doi:10.13412/j.cnki.zyyl.2019.03.008.
[9] 李莉,张琼果,潘巧虹,等. 基于胞外信号调节激酶/胞浆型磷脂酶A2信号通路分析川穹嗪对膜性肾病大鼠肾保护作用[J]. 中国临床药理学杂志,2020,36(12):1665-1668. LI L,ZHANG Q G,PAN Q H,et al. Study on renal protection effect of tetramethylpyrazine on membranous nephropathy rats based on extracellular signal-regulated kinase/cytosolic phospholipase A2 signaling pathway[J]. Chin J Clin Pharmacol,2020,36(12):1665-1668. doi:10.13699/j.cnki.1001-6821.2020.12.017.
[10] 肖志博,谢海,金辉,等. 丙泊酚基于SIRT1/Foxo1信号缓解脑缺血再灌注造成血脑屏障损伤[J]. 微循环学杂志,2022,32(1):12-18. XIAO Z B,XIE H,JIN H,et al. Protection of propofol on blood-brain barrier injury induced by ischemia/reperfusion based on SIRT1/Foxo1 signal[J]. Chinese Journal of Microcirculation,2022,32(1):12-18. doi:10.3969/j.issn.1005-1740.2022.01.003.
[11] 王萌萌,于晓华,耿炜,等. 疏肝调神针法对偏头痛大鼠行为学及血中相关神经肽、炎性物质表达的影响[J]. 针刺研究,2018,43(6):375-379. WANG M M,YU X H,GENG W,et al. Effect of manual acupuncture preconditioning on behavior and contents of serum CGRP,SP,IL-1β and TNF-α levels in migraine rats[J]. Acupuncture Research,2018,43(6):375-379. doi:10.13702/j.1000-0607.170415.
[12] 姚庆萍,邵淑娟. 偏头痛中醫药治疗研究近况[J]. 内蒙古中医药,2017,36(11):97-99. YAO Q P,SHAO S J. Recent research on TCM treatment of migraine[J]. Inner Mongolia Journal of Traditional Chinese Medicine,2017,36(11):97-99. doi:10.16040/j.cnki.cn15-1101.2017.11.096.
[13] EDVINSSON L,HAANES K A,WARFVINGE K,et al. CGRP as the target of new migraine therapies - successful translation from bench to clinic[J]. Nat Rev Neurol,2018,14(6):338-350. doi:10.1038/s41582-018-0003-1.
[14] ZHANG C,SHEN M,TENG F,et al. Ultrasound-enhanced protective effect of tetramethylpyrazine via the ROS/HIF-1A signaling pathway in an in vitro cerebral Ischemia/reperfusion injury model[J]. Ultrasound Med Biol,2018,44(8):1786-1798. doi:10.1016/j.ultrasmedbio.2018.04.005.
[15] 邢娟,范崇桂,沈雷,等. 基于PKC/P2X3通路探讨正天丸对偏头痛大鼠的保护作用[J]. 上海中医药杂志,2020,54(5):87-92. XING J,FAN C G,SHEN L,et al. Protective effect of Zhengtian pill on migraine rats based on PKC/P2X3 pathway[J]. Shanghai Journal of Traditional Chinese Medicine,2020,54(5):87-92. doi:10.16305/j.1007-1334.2020.05.008.
[16] HOU M,TANG Q,XUE Q,et al. Pharmacodynamic action and mechanism of Du Liang soft capsule,a traditional Chinese medicine capsule,on treating nitroglycerin-induced migraine[J]. J Ethnopharmacol,2017,195:231-237. doi:10.1016/j.jep.2016.11.025.
[17] 刘宇光,王欢,王淑敏,等. 药用真菌中麦角甾醇对偏头痛大鼠的作用机制[J]. 食品工业科技,2021,42(15):327-331. LIU Y G,WANG H,WANG S M,et al. Effects of ergosterol from medicinal fungi on migraine rats[J]. Science and Technology of Food Industry,2021,42(15):327-331. doi:10.13386/j.issn1002-0306.2020090049.
[18] WEN W,CHEN H,FU K,et al. Fructus Viticis methanolic extract attenuates trigeminal hyperalgesia in migraine by regulating injury signal transmission[J]. Exp Ther Med,2020,19(1):85-94. doi:10.3892/etm.2019.8201.
[19] SUN X,ZHU F,ZHOU J,et al. Anti-migraine and anti-depression activities of Tianshu capsule by mediating Monoamine oxidase[J]. Biomed Pharmacother,2018,100:275-281. doi:10.1016/j.biopha.2018.01.171.
[20] ZHANG Y M,QU X Y,TAO L N,et al. XingNaoJing injection ameliorates cerebral ischaemia/reperfusion injury via SIRT1-mediated inflammatory response inhibition[J]. Pharm Biol,2020,58(1):16-24. doi:10.1080/13880209.2019.1698619.
[21] YUN Y C,JEONG S G,KIM S H,et al. Reduced sirtuin 1/adenosine monophosphate-activated protein kinase in amyotrophic lateral sclerosis patient-derived mesenchymal stem cells can be restored by resveratrol[J]. J Tissue Eng Regen Med,2019,13(1):110-115. doi:10.1002/term.2776.
[22] 劉垚君,张玉琴,方雅玲,等. 黄精多糖调控SIRT1/AMPK/PGC-1α信号通路改善H2O2诱导的HT22细胞氧化损伤[J]. 中国现代应用药学,2021,38(16):1952-1957. LIU Y J,ZHANG Y Q,FANG Y L,et al. Regulation of SIRT1/AMPK/PGC-1α signaling pathway by polygonatum polysaccharide improves H2O2-induced oxidative damage in HT22 cells[J]. Chin J Mod Appl Pharm,2021,38(16):1952-1957. doi:10.13748/j.cnki.issn1007-7693.2021.16.005.
(2022-06-07收稿 2022-09-01修回)
(本文编辑 李鹏)
