拟红紫珠中1个新的木脂素葡萄糖苷化合物
2023-11-08刘翰飞林开琴李金玉潘卫东娄华勇
赵 兴,刘翰飞,王 欢,林开琴,李金玉,潘卫东,娄华勇*,孙 超*
拟红紫珠中1个新的木脂素葡萄糖苷化合物
赵 兴1, 3,刘翰飞1, 2,王 欢1, 3,林开琴1, 3,李金玉1, 2,潘卫东1,娄华勇1, 2*,孙 超1, 2*
1. 贵州医科大学 省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014 2. 贵州省天然产物研究中心,贵州 贵阳 550014 3. 贵州医科大学药学院,贵州 贵阳 550025
研究拟红紫珠的化学成分及其生物活性。利用多种色谱手段(硅胶、Sephadex LH-20、RP-18反相硅胶柱色谱和半制备型HPLC等)进行分离纯化,运用理化性质结合现代波谱学(紫外、红外、核磁、质谱等)技术进行结构鉴定。采用RSL3诱导的HT22小鼠海马神经元细胞模型铁死亡抑制活性进行筛选。从拟红紫珠中分离得到11个化合物,分别鉴定为(7,7ʹ,8,8ʹ,9)-芝麻素-9----葡萄糖苷(1)、(+)-松脂素-4β--葡萄糖苷(2)、(7,7′,7″,7‴,8,8′,8″,8‴)-4″,4‴-二羟基-3,3′,3″,3‴,5,5′-六甲氧基-7,9′;7′,9-二环氧-4,8″;4′,8‴-双氧-8,8′-双新木脂素- 7″,7‴,9″,9‴-四醇(3)、(7,7′,7″,7‴,8,8′,8″,8‴)-4″,4‴-二羟基-3,3′,3″,3‴,5,5′-六甲氧基-7,9′;7′,9-二环氧-4,8″;4′,8‴-双氧-8,8′-双新木脂素-7″,7‴,9″,9‴-四醇(4)、泡桐素(5)、4-氧代芝麻素(6)、芝麻素(7)、β-谷甾醇(8)、熊果酸(9)、3β-羟基豆甾-5烯-7-酮(10)和3β-羟基豆甾-5,22-二烯-7-酮(11)。生物活性结果显示,化合物7、10和11对RSL3诱导的HT22细胞铁死亡较模型组有明显的抑制活性,其细胞存活率分别为30.37%、31.93%和36.57%(模型组为23.4%)。化合物1为新化合物,命名为拟红紫珠苷A。所有化合物均为首次从拟红紫珠中分离得到,且3个化合物显示出潜在的铁死亡抑制活性。
拟红紫珠;木脂素糖苷;拟红紫珠苷A;芝麻素;熊果酸;3β-羟基豆甾-5烯-7-酮;铁死亡抑制
唇形科药用植物资源丰富,药用部位广且药效多样,开发潜力巨大[1]。如紫苏(L.) Britt.的叶、茎、成熟果实可作3种不同药材入药[2];罗勒L的茎叶、种子、全草均具有药用价值,其嫩叶可食用作茶饮,还可用作调香原料、配制化妆品以及牙膏、漱口剂[3]。近年来,本课题组一直致力于黔产唇形科植物中活性物质基础的挖掘,先后开展了夏枯草[4-5]、贵州鼠尾草[6-7]等药用植物的系统研究,获得的结构类型主要包括二萜、三萜、倍半萜、甾体和黄酮等,并从中发现了许多结构新颖的活性先导物。紫珠属Linn.是唇形科的代表属植物之一,具有收敛止血、清热解毒的功效,常用于治疗各种内、外出血,也可治疗烧伤烫伤,现代药理研究表明其还具有神经保护等活性[8-9]。与此同时,经系统文献调研发现,紫珠属植物拟红紫珠H. T. Chang的化学成分及其活性研究至今未见系统报道。为了进一步研究该植物的化学成分,阐明其主要的药效物质基础。本课题组对采自贵州兴义的拟红紫珠进行了化学成分研究,从中分离获得了11个化合物,分别鉴定为(7,7ʹ,8,8ʹ,9)-芝麻素- 9--β--葡萄糖苷(1)、(+)-松脂素-4β--葡萄糖苷[(+)-pinoresinol-β--glucopyranoside,2]、(7,7′,7″, 7‴,8,8′,8″,8‴)-4″,4‴-二羟基-3,3′,3″,3‴,5,5′-六甲氧基-7,9′;7′,9-二环氧-4,8″;4′,8‴-双氧-8,8′-双新木脂素-7″,7‴,9″,9‴-四醇 [(7,7′,7″,7‴,8,8′,8″,8‴)- 4″,4‴-dihydroxy-3,3′,3″,3‴,5,5′-hexamethoxy-7′,9′;7′,9-diepoxy-4,8″;4′,8‴-bisoxy-8,8′-dineo-lignan-7″,7‴,9″,9‴- tetraol,3]、(7,7′,7″,7‴,8, 8′,8″,8‴)-4″,4‴-二羟基-3,3′,3″,3‴,5,5′-六甲氧基-7,9′;7′,9-二环氧-4,8″;4′,8‴-双氧-8,8′-双新木脂素-7″,7‴,9″,9‴-四醇[(7,7′,7″,7‴,8,8′,8″,8‴)-4″,4‴-dihydroxy-3,3′, 3″,3‴,5,5′-hexamethoxy-7,9′;7′,9-diepoxy-4,8″;4′,8‴- bisoxy-8,8′-dineolignan-7″,7‴,9″,9‴-tetraol,4]、泡桐素(paulownin,5)、4-氧代芝麻素(4-oxosesamin,6)、芝麻素(sesamin,7)、β-谷甾醇(β-sitosterol,8)、熊果酸(ursolic acid,9)、3β-羟基豆甾-5烯-7-酮(3β-hydroxystigmast-5-en-7-one,10)和3β-羟基豆甾-5,22-二烯-7-酮(3β-hydroxy-stigmast-5,22-dien-7-one,11)。其中化合物1为新化合物,所有化合物均为首次从拟红紫珠中分离获得,并评价了所得化合物对RSL3诱导的HT22小鼠海马神经元细胞模型的铁死亡抑制活性。
1 仪器与材料
ZX201701048 高分辨液质联用仪(赛默飞世尔科技有限公司);Chirascane圆二色谱仪(Rigaku/日本);MCP·500旋光仪(Anton·Paar/法国);MPA-100 OptiMelt显微熔点测定仪(北京泰克仪器有限公司);Agilent 1100高效液相色谱仪(美国安捷伦公司);Waters C18半制备色谱柱(250 mm×10 mm,5 μm);Hei-VAP Digital G3旋转蒸发仪(德国Heidolph公司);INOVA-600 MHz核磁共振仪(美国Varian公司);ZF-7N智能暗箱式三用紫外分析仪(上海嘉鹏科技有限公司);ME204E/02电子分析天平(瑞士Mettler Toledo公司);DLSB-5/20低温冷却液循环泵(郑州长城科工贸有限公司);柱色谱硅胶(60~80、300~400目,青岛海洋化工厂);薄层硅胶板(烟台江友硅胶发展有限公司);色谱甲醇、氘代甲醇 [萨恩化学技术(上海)有限公司];其他试剂均为分析纯,水为超纯水。
二氧化碳细胞培养恒温箱[力申科学仪器(上海)有限公司];十万分之一电子天平[赛多利斯科学仪器(北京)有限公司];超净工作台[孚夏医疗科技(浙江)有限公司];低速离心机[湘立科学仪器(湖南)有限公司];高速离心机[卢湘仪离心机仪器(上海)有限公司];倒置显微镜[舜宇光学科技(浙江)有限公司];酶标仪[赛默飞世尔科技(美国)公司];恒温水浴锅[鼎鑫宜实验设备(深圳)有限公司];鼓风干燥箱[苏珀仪器(绍兴)有限公司];移液枪 [艾本德生命科学(德国)公司];立式压力蒸汽灭菌锅 [博迅医疗生物仪器股份(上海)有限公司];细胞培养板 [耐思生物科技(上海)有限公司];DMEM高糖培养基(gibco);青链霉素混合液(Solarbio);微孔滤膜(BioFIL);胰蛋白酶(Solarbio);噻唑蓝(Solarbio);PBS缓冲液 [赛维尔生物科技(武汉)有限公司]。
植物于2021年8月采集于贵州省黔西南兴义市的南盘江流域,由贵州省黔西南喀斯特区域发展研究院邓朝义研究员鉴定为唇形科紫珠属植物拟红紫珠H. T. Chang,标本(NHZZ20210801)保存于贵州省天然产物研究中心。
2 方法
2.1 提取与分离
拟红紫珠全草20.0 kg,粉碎后以95%的乙醇回流提取2次,每次2 h。合并提取液,减压浓缩后用石油醚和醋酸乙酯分别萃取4次,浓缩干燥得石油醚萃取物192.7 g、醋酸乙酯萃取物253 g。醋酸乙酯萃取物用硅胶柱色谱分离,以二氯甲烷-甲醇(100∶1→1∶1)系统洗脱,得到8个洗脱组分FE. 1~8,其中FE.5(18 g)经反相硅胶柱色谱分离,以50%~100%甲醇梯度洗脱,得到8个组分FE. 5-1~5-8,FE.5-3经正相硅胶柱色谱以二氯甲烷-甲醇(100∶1→1∶1)梯度洗脱后得到2个组分FE.5-3a和5-3b。FE.5-3a经HPLC纯化(甲醇-水55∶45,2 mL/min)得化合物1(3 mg,R=25 min)。FE.5-1(2 g)经半制备型高效液相(甲醇-水60∶40,2 mL/min)得3个组分FE.5-1a~1c,FE.5-1b(105 mg)经HPLC纯化(甲醇-水33∶67,2 mL/min)得化合物2(5 mg,R=37 min);FE.3(38 g)经反相硅胶柱色谱分离,以40%~100%甲醇梯度洗脱,得到5个组分FE. 3-1~3-5,Fr. 3-3(2 g)经Sephadex LH-20凝胶柱色谱(二氯甲烷-甲醇1∶1)后经HPLC纯化(甲醇-水47∶53,2 mL/min),得化合物3(3 mg,R=30 min)和4(4 mg,R=40 min)。
石油醚萃取物采用正相硅胶柱色谱分离,以石油醚-醋酸乙酯(100∶1→0∶1)梯度洗脱,得到10个组分Fr. 1~10,其中Fr. 5(76 g)经反相硅胶柱色谱分离,以50%~100%甲醇梯度洗脱,得到10个组分Fr. 5-1~5-20。Fr. 5-10(1 g)经Sephadex LH-20凝胶柱色谱(二氯甲烷-甲醇1∶1)洗脱后再经HPLC纯化(甲醇-水55∶45,2 mL/min),得化合物5(10 mg,R=22 min);Fr. 5-12(118 mg)经Sephadex LH-20凝胶柱色谱(二氯甲烷-甲醇1∶1)后经HPLC纯化(甲醇-水60∶40,2 mL/min)得化合物6(9 mg,R=31 min);Fr. 5-20(108 mg)经半制备型高效液相(乙腈-水76∶24,2 mL/min)纯化后得到化合物7(10 mg,R=17 min)。Fr. 7(25 g)经正相硅胶柱色谱以石油醚-醋酸乙酯(25∶1→1∶1)梯度洗脱,得到8个组分Fr. 7-1~7-8。其中Fr. 7-6 (300 mg)中有结晶析出,得到化合物8(20 mg)。Fr. 7-8(15 g)经反相硅胶柱色谱分离,以50%~100%甲醇梯度洗脱,得到6个组分Fr. 7-8a~7-8f。Fr. 7-8d(20 mg)经正相硅胶柱色谱以石油醚-醋酸乙酯(25∶1→1∶1)梯度洗脱后得到得化合物9(6 mg);Fr. 7-8e(52 mg)经HPLC纯化(甲醇-水30∶70,2 mL/min)得化合物10(8 mg,R=17 min)和11(9 mg,R=19 min)。
2.2 化合物1的水解
取化合物2.0 mg,加入2 mol/L的盐酸5 mL,在80 ℃条件下水解6 h,水解液用醋酸乙酯萃取即得到苷元和单糖萃取物,单糖萃取物与标准品通过TLC检识(醋酸乙酯-乙醇-水7∶2∶1),其Rf值和比旋光值与-葡萄糖对照品一致,故确定该糖片段为-葡萄糖。
2.3 化合物1的ECD计算
化合物1经Spartan软件进行构象搜索后,最优构象用gaussian 16的b3lyp/6-31(d) 基组进行构象优化,确定无虚频后,得到的构象用gaussian16的b3lyp/6-311+(d, p) 基组进行电子圆二色谱(electrostatic circular dichroism,ECD)计算,得到的数据经 SpecDis软件生成图像文件,再与化合物1的测试ECD进行对比,最终确定化合物的绝对构型。
2.4 RSL3诱导的HT22细胞铁死亡抑制活性测试
用DMEM高糖培养基[含10%胎牛血清(FBS),含青霉素链霉素双抗]培养HT22细胞。将细胞置于37 ℃、5% CO2细胞培养箱中进行传代培养,取对数生长期细胞用于实验。将处于对数生长期的HT22细胞按3×103个/mL接种于96孔板,每孔90 μL,设置空白对照、阴性对照、Ferrostatin-1(Fer-1)为阳性对照,每组3个平行,培养24 h,每孔同时加入10 μL RSL3诱导剂(1 μmol/L)和10 μL样品(20 μmol/L),孵育48 h;加入10 μL的MTT染色剂,4 h后,吸取上清液,加入150 μL DMSO,测定吸光度()值。
3 结构鉴定
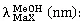

表1 化合物1的1H-NMR和13C-NMR数据(600/150 MHz, CD3OD)
化合物2:白色固体(甲醇),[α]25 D+15.9°(0.32, CDCl3),mp 102~104 ℃, ESI-MS/: 519.4 [M-H]−。分子式为C26H32O11;1H-NMR (600 MHz, DMSO-6):7.04~6.71 (6H, m, Ar-H), 4.87 (1H, d,= 7.2 Hz, Glc-H-1), 4.66 (1H, d,= 4.2 Hz, H-6), 4.60 (1H, d,= 4.2 Hz, H-2), 4.14 (2H, dd,= 6.6, 2.3 Hz, H-4, 8), 3.76 (3H, s, 7′-OMe), 3.76 (3H, s, 7″-OMe), 3.74 (2H, m, H-4, 8);13C-NMR (150 MHz, DMSO-6): 148.9 (C-3′), 147.5 (C-3″), 145.8 (C-4′), 145.8 (C-4″), 135.2 (C-1′), 132.2 (C-1″), 118.7 (C-6″), 118.2 (C-6′), 115.1 (C-5′, 5″), 110.5 (C-2′), 110.4 (C-2″), 100.1 (Glc-C-1), 85.2 (C-6), 84.9 (C-2), 77.0 (Glc-C-5), 77.0 (Glc-C-3), 73.2 (Glc-C-2), 71.0 (C-8), 71.0 (C-4), 69.7 (Glc-C-4), 60.7 (Glc-C-6), 55.7 (-OMe), 55.6 (-OMe), 53.7 (C-1), 53.6 (C-5)。上述数据与文献报道数据基本一致[13],故鉴定化合物2为(+)-松脂素-4β--葡萄糖苷。
化合物3:白色粉末(甲醇),mp 210~212 ℃,ESI-MS/: 833.3 [M+Na]+,分子式C42H50O16;1H-NMR (600 MHz, DMSO-6):6.91 (2H, t,= 2.4 Hz, H-2″, 2‴), 6.71 (2H, m, H-5″, 5‴), 6.69 (2H, dd,= 8.4, 1.4 Hz, H-6″, 6‴), 6.64 (4H, d,= 1.2 Hz, H-2, 6, 2′, 6′), 4.79 (2H, dd,= 4.8, 3.0 Hz, H-7″, 7‴), 4.66 (2H, d,= 3.6 Hz, H-7, 7′), 4.19 (2H, m, H-9β, 9′β), 4.10 (2H′, m, H-8″, 8″), 3.82 (2H, dd,= 9.0, 3.0 Hz, H-9α, 9′α), 3.76 (12H, s, 3, 5, 3′, 5′-OMe), 3.73 (6H, d,= 1.8 Hz, 3″, 3-OMe), 3.70 (2H, d,= 4.8 Hz, H-9″β, 9‴β), 3.06 (2H, m, H-8, 8′);13C-NMR (150 MHz, DMSO-6): 152.7 (C-3, 5), 152.7 (C-3′, 5′), 146.9 (C-3″, 3‴), 145.2 (C-4″, 4‴), 136.8 (C-1, 1′), 134.8 (C-4, 4′), 133.4 (C-1″, 1‴), 119.4 (C-6″, 6‴), 114.6 (C-5″, 5‴), 110.9 (C-2″, 2‴), 103.3 (C-2, 6, 2′, 6′), 86.2 (C-7′, 7), 85.1 (C-8″, 8‴), 72.0 (C-7″, 7‴), 71.4 (C-9, 9′), 53.7 (C-8, 8′), 59.7 (C-9″, 9‴), 56.0 (3, 5, 3′, 5′-OMe), 55.5 (3″, 3‴-OMe)。上述数据与文献报道数据基本一致[14],故鉴定化合物3为(7,7′,7″,7‴,8,8′,8″,8‴)-4″, 4‴-二羟基-3,3′, 3″,3‴,5,5′-六甲氧基-7,9′;7′,9-二环氧-4,8″;4′,8‴-双氧- 8,8′-双新木脂素-7″,7‴,9″,9‴-四醇。

图1 化合物1的关键1H-1H COSY、HMBC和NOESY相关信号
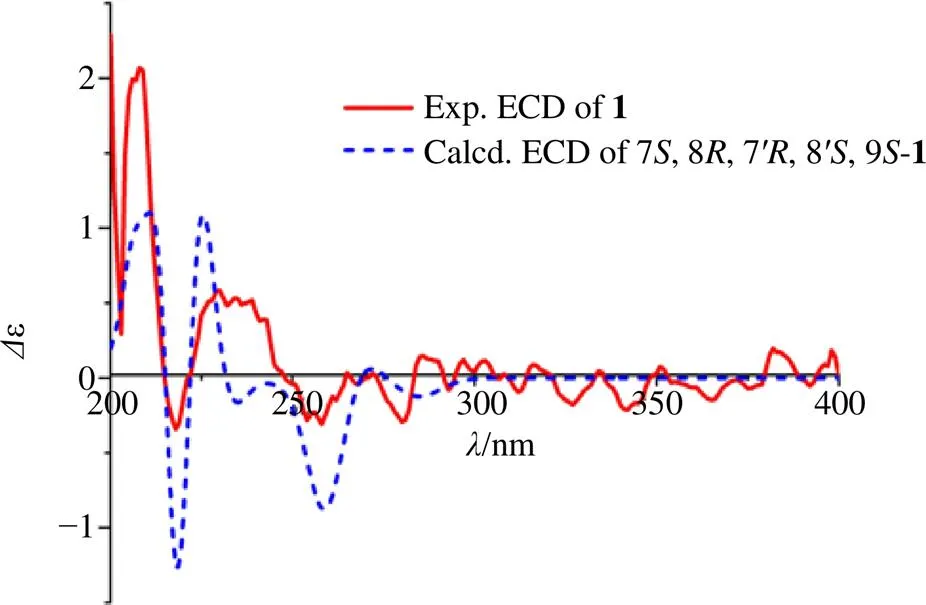
图2 化合物1的测试和计算ECD谱
化合物4:白色粉末(甲醇),ESI-MS/: 833.4 [M+Na]+,分子式C42H50O16;1H-NMR (600 MHz,DMSO-6): 6.96 (1H, d,= 1.8 Hz, H-2″), 6.91 (1H, t,= 2.4 Hz, H-2‴), 6.78 (1H, d,= 7.8 Hz, H-6″), 6.72 (1H, dt,= 7.8, 1.8 Hz, H-6‴), 6.69 (2H, m, H-5″, 5‴), 6.64 (4H, d,= 2.4 Hz, H-2, 6, 2′, 6′), 4.83 (1H, d,= 4.8 Hz, H-7″), 4.79 (1H, dd,= 4.8, 3.0 Hz, H-7‴), 4.66 (2H, d,= 3.6 Hz, H-7, 7′), 4.20 (2H, m, H-9β, 9′β), 4.10 (1H, qd,= 4.8, 2.4 Hz, H-8″), 3.98 (1H, qd,= 4.8, 1.8 Hz, H-8‴), 3.82 (2H, m, H-9α, 9′α), 3.76 (6H, s, 3, 3′-OMe), 3.74 (6H, s, 5, 5′-OMe), 3.73 (3H, d,= 1.8 Hz, H-3″), 3.72 (3H, s, 3‴-OMe), 3.68 (2H, m, H-9″β, 9β‴), 3.38 (2H, ddd,= 11.8, 3.9, 2.4 Hz, H-9α″, 9‴α), 3.06 (2H, m, H-8, 8′);13C-NMR (150 MHz, DMSO-6): 152.6 (C-3), 152.6 (C-5), 152.5 (C-3′, 5′), 146.9 (C-3″), 146.8 (C-3‴), 145.2 (C-4″, 4‴), 136.9 (C-1), 136.8 (C-1′), 134.80 (C-4, 4′), 133.0 (C-1″), 132.8 (C-1‴), 119.4 (C-6″), 119.2 (C-6‴), 114.5 (C-5″, 5‴), 110.9 (C-2″, 2‴), 103.3 (C-2, 6, 2′, 6′), 87.0 (C-7), 85.1 (C-7′), 85.1 (C-8″, 8‴), 72.10 (C-7″, 7‴), 71.3 (C-9, 9′), 60.1 (C-9‴), 59.7 (C-9″), 56.0 (3, 5, 3′, 5′-OMe), 55.5 (3″, 3‴-OMe), 53.7 (C-8, 8′)。上述数据与文献报道数据基本一致[14],故鉴定化合物4为 (7,7′,7″,7‴, 8,8′,8″,8‴)-4″,4‴-二羟基-3,3′,3″,3‴,5,5′-六甲氧基-7,9′;7′,9-二环氧-4,8″;4′,8‴-双氧-8,8′-双新木脂素- 7″,7‴,9″,9‴-四醇。
化合物5:白色粉末(甲醇),ESI-MS/: 371.3 [M+H]+,分子式C20H18O7;1H-NMR (600 MHz, CDCl3): 6.94 (1H, d,= 1.8 Hz, H-2′), 6.91 (1H, d,= 1.8 Hz, H-2), 6.87 (1H, m, H-6, 6′), 6.85 (1H, m, H-5), 6.79 (1H, d,= 8.4 Hz, H-5′), 5.98 (2H, s, -OCH2O-), 5.95 (2H, s, -OCH2O-), 4.84 (1H, d,= 4.8 Hz, H-7′), 4.81 (s, 1H, H-7), 4.50 (1H, dd,= 9.0, 8.4 Hz, H-9′b), 4.04 (1H, d,= 9.6 Hz, H-9b), 3.90 (1H, d,= 9.6 Hz, H-9a), 3.83 (1H, dd,= 9.2, 6.1 Hz, H-9′a), 3.04 (1H, m, H-8′);13C-NMR (150 MHz, CDCl3):148.3 (C-4), 148.2 (C-4′), 148.1 (C-3), 147.4 (C-3′), 134.7 (C-1′), 129.3 (C-1), 120.3 (C-6), 120.0 (C-6′), 108.7 (C-5), 108.4 (C-5′), 107.6 (C-2), 107.0 (C-2′), 101.4 (-OCH2O-), 101.3 (-OCH2O-), 91.8 (C-8), 87.6 (C-7), 85.9 (C-7′), 74.9 (C-9), 71.8 (C-9′), 60.5 (C-8′)。上述数据与文献报道数据基本一致[15],故鉴定化合物5为泡桐素。
化合物6:白色无定形粉末,ESI-MS/: 369.07 [M+H]+分子式为C20H16O7;1H-NMR (600 MHz, CDCl3):6.76~6.87 (6H, m, H-2, 2′, 5, 5′, 6, 6′), 5.98 (2H, s, -OCH2O-), 5.95 (2H, s, -OCH2O-), 5.31 (1H, d,= 3.6 Hz, H-7′), 5.29 (1H, d,= 3.6 Hz, H-7), 4.32 (1H, dd,= 9.6, 6.6 Hz, H-9α), 4.01 (1H, dd,= 9.6, 4.8 Hz, H-9β), 3.42 (1H, dd,= 9.0, 3.6 Hz, H-8′), 3.20 (1H, m, H-8);13C-NMR (150 MHz, CDCl3): 176.8 (C-9′), 148.5 (C-3′), 148.2 (C-4′), 148.2 (C-3), 147.4 (C-4), 134.5 (C-1′), 133.1 (C-1), 119.2 (C-6′), 118.9 (C-6), 108.7 (C-2′), 108.5 (C-2), 106.1 (C-5′), 105.9 (C-5), 101.6 (-OCH2O-), 101.3 (-OCH2O-), 84.5 (C-7′), 83.5 (C-7), 72.8 (C-9), 53.4 (C-8), 50.1 (C-8′)。上述数据与文献报道数据基本一致[16],故鉴定化合物6为4-氧代芝麻素。
化合物7:无色针状(甲醇),mp 119~121 ℃,ESI-MS/: 355.10 [M+H]+,分子式为C20H18O6;1H-NMR (600 MHz, CDCl3): 6.85 (2H, d,= 1.8 Hz, H-2′, 2″), 6.80 (2H, dd,= 8.4, 1.8 Hz, H-6′, 6″), 6.78 (2H, d,= 7.9 Hz, H-5′, 5″), 5.94 (4H, s, -OCH2O-), 4.71 (2H, d,= 4.2 Hz, H-2, 6), 4.23 (2H, dd,= 9.0, 6.6 Hz, H-4eq, 8eq), 3.87 (2H, dd,= 9.0, 3.6 Hz, H-4ax, 8ax), 3.04 (2H, ddt,= 5.4, 3.0, 1.8 Hz, H-1, 5);13C-NMR (150 MHz, CDCl3): 148.1 (C-4′, 4″), 147.2 (C-3′, 3″), 135.2 (C-1′, 1″), 119.4 (C-6′, 6″), 108.3 (C-5′, 5″), 106.6 (C-2′, 2″), 101.2 (-OCH2O-), 85.9 (C-2, 6), 71.8 (C-4, 8), 54.4 (C-1, 5)。上述数据与文献报道数据基本一致[17],故鉴定化合物7为芝麻素。
化合物8:无色针状结晶(甲醇),mp 132~134 ℃,ESI-MS/: 415.2 [M+H]+,分子式为C29H50O;10%硫酸乙醇液加热呈紫红色,经与β-谷甾醇纯品对照后,发现其Rf值一致,故鉴定化合物8为β-谷甾醇。
化合物9:白色针晶(氯仿),mp 285~288 ℃,ESI-MS/: 455.13 [M-H]−,分子式C30H48O3;1H-NMR (600 MHz, DMSO-6): 5.13 (1H, t,= 3.6 Hz, H-12), 3.00 (1H, m, H-3), 1.04 (3H, s, H-27), 0.91 (3H, s,= 6.6 Hz, H-29), 0.90 (3H, s, H-26), 0.80 (3H, s, H-23), 0.81 (1H, d,= 6.6 Hz, H-30), 0.75 (3H, s, H-24), 0.68 (3H, s, H-25);13C-NMR (150 MHz, DMSO-6): 178.3 (C-28), 138.2 (C-13), 124.6 (C-12), 76.9 (C-3), 54.8 (C-5), 52.4 (C-18), 47.0 (C-17), 46.8 (C-9), 41.7 (C-14), 39.1 (C-8), 38.5 C-20), 38.5 (C-4), 38.4 (C-19), 38.3 (C-1), 36.5 (C-10), 36.3 (C-22), 32.7 (C-15), 30.2 (C-7), 28.3 (C-23), 27.6 (C-21), 27.0 (C-2), 23.8 (C-11), 23.3 (C-27), 22.9 (C-16), 21.1 (C-30), 18.0 (C-6), 17.0 (C-29), 16.9 (C-24), 16.1 (C-25), 15.2 (C-26)。上述数据与文献报道数据基本一致[18],故鉴定化合物9为熊果酸。
化合物10:无色针状结晶(甲醇),mp 170~171 ℃,ESI-MS/: 429.3 [M+H]+,分子式为C29H48O2;1H-NMR (600 MHz, CDCl3): 5.69 (1H, s, H-6), 3.68 (1H, m, H-3), 1.20 (3H, s, H-19), 0.93 (3H, d,= 6.6 Hz, H-21), 0.84 (3H, d,= 3.6 Hz, H-29), 0.83 (3H, d,= 3.0 Hz, H-26), 0.81 (3H, d,= 6.6 Hz, H-27), 0.68 (3H, s, H-18);13C-NMR (150 MHz, CDCl3): 202.5 (C-7), 165.2 (C-5), 126.3 (C-6), 70.7 (C-3), 54.8 (C-17), 50.1 (C-9), 50.1 (C-14), 46.0 (C-24), 45.6 (C-8), 43.2 (C-13),42.0 (C-4), 38.8 (C-10), 38.4 (C-12), 36. (C-1), 36.2 (C-20), 34.1 (C-22), 31.3 (C-2), 21.4 (C-11), 26.2 (C-15), 28.7 (C-16), 12.1 (C-18), 17.5 (C-19), 19.1 (C-21), 26.5 (C-23), 29.3 (C-25), 20.0 (C-26), 19.2 (C-27), 23.2 (C-28), 12.1 (C-29)。上述数据与文献报道数据基本一致[19],故鉴定化合物10为3β-羟基豆甾-5烯-7-酮。
化合物11:白色固体,ESI-MS/:427.3 [M+H]+,分子式为C29H46O2;1H-NMR (600 MHz, CDCl3): 5.69 (1H, s, H-6), 5.17 (1H, dd,= 15.0, 8.4 Hz, H-22), 5.02 (1H, dd,= 15.0, 8.4 Hz, H-23), 3.67 (1H, m, H-3), 1.20 (3H, s, H-19), 1.02 (3H, d,= 6.6 Hz, H-21), 0.84 (3H, d,= 6.0 Hz, H-29), 0.81 (3H, d,= 7.2 Hz, H-26), 0.79 (3H, d,= 6.6 Hz, H-27), 0.69 (3H, s, H-18);13C-NMR (150 MHz, CDCl3): 202.4 (C-7), 165.2 (C-5), 138.2 (C-22), 129.6 (C-23), 126.2 (C-6), 70.7 (C-3), 54.8 (C-17), 51.4 (C-24), 50.2 (C-14), 50.1 (C-9), 45.5 (C-8), 43.1 (C-13), 42.0 (C-4), 40.0 (C-20), 38.7 (C-10), 38.4 (C-12), 36.5 (C-1), 32.0 (C-25), 31.3 (C-2), 29.2 (C-16), 26.6 (C-15), 25.5 (C-28), 21.6 (C-26), 21.4 (C-27), 21.2 (C-11), 19.1 (C-21), 17.5 (C-19), 12.4 (C-29), 12.3 (C-18)。上述数据与文献报道数据基本一致[20],故鉴定化合物11为3β-羟基豆甾-5,22-二烯-7-酮。
4 生物活性测定结果
细胞铁死亡是一种区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式[21]。越来越多的研究表明,细胞铁死亡与许多神经系统疾病有关,如神经退行性疾病和中风等,因此抑制细胞铁死亡是治疗神经系统疾病的一种很有前途的策略[22]。紫珠属植物的现代药理研究表明具有较好神经保护等活性,但相关的细胞铁死亡的抑制活性研究报道较少。本研究中,除了量少的化合物3和4外,所有化合物均开展了RSL3诱导的HT22细胞铁死亡抑制活性评价。结果显示,与模型组比较(23.4%),化合物7、10和11在20 μmol/L浓度下显示出了明显的铁死亡抑制活性,其细胞存活率分别为30.37%、31.93%和36.57%,而其余化合物在此浓度下未显示出明显的铁死亡抑制活性。
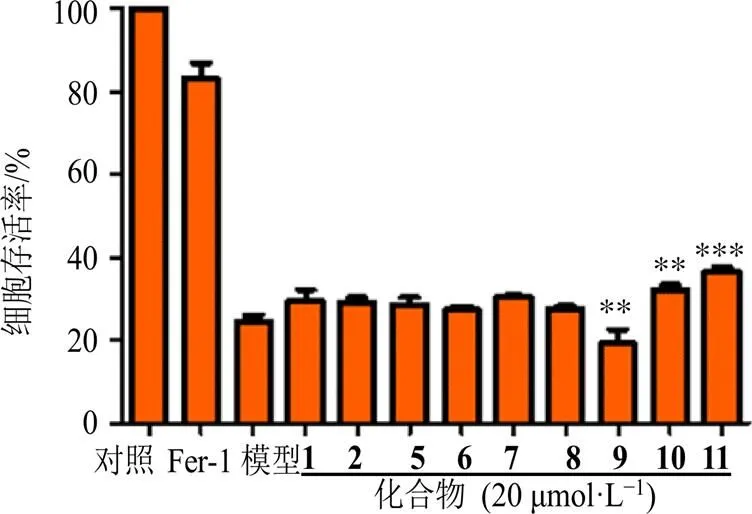
与模型组比较:**P<0.01 ***P<0.001
5 讨论
本研究从拟红紫珠的乙醇提取物的石油醚和醋酸乙酯萃取部位中分离鉴定了11个单体化合物,其中包括7个木脂素、2个三萜和2个甾体,所有化合物均为首次从拟红紫珠中分离得到。初步的活性筛选发现其中的2个甾体化合物表现出明显的铁死亡抑制活性。紫珠属植物已报道的特征性成分是二萜类化合物,本研究结果显示木脂素也是该属植物的特征性成分之一。通过该论文的研究,进一步丰富了紫珠属植物的化合物结构类型,为深入阐明该属植物中的特征性成分提供理论基础,也为该植物的深入开发利用提供科学基础。
利益冲突 所有作者均声明不存在利益冲突
[1]邱晓萍, 张懿, 陈煜林, 等. 中国唇形科药用植物资源及利用现状和开发潜力 [J]. 应用与环境生物学报, 2023, 29(2): 346-356.
[2]中国药典 [S]. 一部. 2020:354.
[3]国家中医药管理局《中华本草》编辑委员会. 中华本草(藏药卷) [M]. 上海: 上海科学技术出版社, 2002.
[4]Lou H Y, Zheng S, Li T L,. Vulgarisin A, a new diterpenoid with a rare 5/6/4/5 ring skeleton from the Chinese medicinal plant[J]., 2014, 16(10): 2696-2699.
[5]Lou H Y, Jin L, Huang T,. Vulgarisins B-D, three novel diterpenoids with a rare skeleton isolated fromLinn [J]., 2017, 58(5): 401-404.
[6]梁会, 赵玉敏, 刘翰飞, 等. 贵州鼠尾草中1个新的姜黄素类化合物 [J]. 中草药, 2022, 53(18): 5593-5599.
[7]赵玉敏, 周谣, 刘翰飞, 等. 贵州鼠尾草化学成分研究 [J]. 热带亚热带植物学报, 2023, 31(4): 595-601.
[8]杨国栋, 刘昱甫, 刘永林, 等. 紫珠属的萜类成分和药理作用研究进展 [J]. 中国药物化学杂志, 2022, 32(12): 957-973.
[9]中国科学院中国植物志编辑委员会. 中国植物志-第65(1)卷 [M]. 北京: 科学出版社, 1982: 25.
[10]Yuasa K, Ide T, Otsuka H,. Premnafolioside, a new phenylethanoid, and other phenolic compounds from stems ofvar.[J]., 1993, 56(10): 1695-1699.
[11]Zhao H Y, Wang Y Q, Li Y C,. Flavonol glycosides and phenylpropanoid glycosides with inhibitory effects on microglial nitric oxide production from[J]., 2021, 151: 104877.
[12]Zhou L, Han F Y, Lu L W,. Isolation of enantiomeric furolactones and furofurans fromL. with neuroprotective activities [J]., 2019, 164: 122-129.
[13]张冬梅, 胡立宏, 叶文才,等. 白蜡树的化学成分研究 [J]. 中国天然药物, 2003, 1(2): 79-81.
[14]夏召, 张海新, 许天启, 等. 苍耳子中苯丙素类化学成分的研究 [J]. 中国药学杂志, 2021, 56(1): 13-22.
[15]冯薇, 杨峻山. 木蹄层孔菌化学成分研究 [J]. 中国药学杂志, 2010, 45(20): 1528-1530.
[16]李月婷, 庞道然, 朱枝祥, 等. 牡荆子的化学成分与生物活性研究 [J]. 中国中药杂志, 2016, 41(22): 4197-4203.
[17]Hsieh T J, Chen C H, Lo W L,. Lignans from the stem of[J]., 2006, 1(1): 21-25.
[18]贾瑞芳, 刘荷秀, 黄美玲, 等. 苏藿香化学成分研究 [J]. 中草药, 2021, 52(10): 2884-2889.
[19]尚小雅, 王若兰, 尹素琴, 等. 紫红曲代谢产物中的甾体成分 [J]. 中国中药杂志, 2009, 34(14): 1809-1811.
[20]吴蕾, 李金杰, 钟祥健, 等. 云南兔儿风的化学成分研究 [J]. 广西植物, 2020, 40(9): 1375-1380.
[21]Dixon S J, Lemberg K M, Lamprecht M R,. Ferroptosis: An iron-dependent form of nonapoptotic cell death [J]., 2012, 149(5): 1060-1072.
[22]Tan Q, Fang Y, Gu Q,. Mechanisms of modulation of ferroptosis and its role in central nervous system diseases [J]., 2021, doi: 10.3389/fphar.2021. 657033.
One new lignan glucoside from
ZHAO Xing1, 3, LIU Han-fei1, 2, WANG Huan1, 3, LIN Kai-qin1, 3, LI Jin-yu1, 2, PAN Wei-dong1, LOU Hua-yong1, 2, SUN Chao1, 2
1. State Key Laboratory of Functions and Applications of Medicinal Plants, Guizhou Medical University, Guiyang 550014, China 2. Natural Products Research Center of Guizhou Province, Guiyang 550014, China 3. School of Pharmaceutical Sciences, Guizhou Medical University, Guiyang 550025, China
To study the chemical constituents ofand their biological activities.The chemical constituents were isolated and purified by silica gel, Sephadex LH-20, RP-18 reversed phase silica gel column chromatography and semi-preparative high performance liquid chromatography (HPLC). Then their structures were elucidated by modern spectroscopic analyses (UV, IR, NMR, and HRESIMS) and physicochemical properties. All isolates were evaluated for their inhibitory effect on RSL3-induced ferroptosis in HT22 mouse hippocampal neuronal cells.A total of eleven compounds were isolated fromand identified as (7,7ʹ,8,8ʹ,9)-sesamin-9--β--glucopyranoside (1), (+)- pinoresinol-4--β--glucopyranoside (2), (7,7′,7″,7‴,8,8′,8″,8‴)-4″,4‴-dihydroxy-3,3′,3″,3‴,5,5′-hexamethoxy-7′,9′,7′,9-diepoxy-4,8″,4′,8‴- bisoxy-8,8′-dineolignan-7″,7‴,9″,9‴-tetraol (3), (7,7′,7″,7‴,8,8′,8″,8‴)-4″,4‴-dihydroxy-3,3′,3″,3‴,5,5′-hexamethoxy-7,9′, 7′,9-diepoxy-4,8″,4′,8‴-bisoxy-8,8′-dineolignan-7″,7‴,9″,9‴-tetraol (4), paulownin (5), 4-oxosesamin (6), sesamin (7), β-sitosterol (8), ursolic acid (9), 3β-hydroxystigmast- 5-en-7-one (10), and 3β-hydroxystigmast-5,22-dien-7-one (11). Compared with the model group, compounds 7, 10 and 11 exhibited obvious inhibitory activity on RSL3-induced HT22 cells ferroptosis, with the survival rate of 30.37%, 31.93% and 36.57%, respectively (23.4% in model group).Compound 1 is a new compound, named as callicoside A. And all compounds are isolated fromfor the first time. Moreover, compounds 7, 10 and 11 exhibit obvious inhibitory activity against RSL3-induced HT22 cells ferroptosis.
H. T. Chang; lignan glucoside; callicoside A;sesamin; ursolic acid; 3β-hydroxystigmast-5-en- 7-one; anti-ferroptosis activity
R284.1
A
0253 - 2670(2023)21 - 6953 - 08
10.7501/j.issn.0253-2670.2023.21.004
2023-05-27
国家自然科学基金资助项目(32060100);国家自然科学基金资助项目(32100322);贵州省科技计划项目(黔科合基础-ZK [2021]534,QKHZC[2021]411,QKHZC [2022]019);贵州省科技计划项目(黔科中引地[2022]4015)
赵 兴(1998—),男,硕士研究生,研究方向为中药药效物质基础研究。E-mail: 2652674828@qq.com
通信作者:娄华勇(1987—),博士,副研究员,研究方向为天然药物化学。E-mail: loouhy@126.com
孙 超(1970—),学士,研究员,研究方向为药用植物引种驯化与质量控制。E-mail: chao_sun2000@hotmail.com
[责任编辑 王文倩]
