金藤清痹颗粒治疗急性痛风性关节炎的作用机制研究
2023-11-08卫博文高晶月王爱华岳青云顾庆香卡玉秀林芳芳苟小平
卫博文,高晶月#,刘 维*,王爱华,岳青云,顾庆香,卡玉秀,林芳芳,苟小平,王 文
金藤清痹颗粒治疗急性痛风性关节炎的作用机制研究
卫博文1, 2,高晶月1, 2#,刘 维1, 2*,王爱华1, 2,岳青云1, 2,顾庆香1, 2,卡玉秀1, 2,林芳芳1, 2,苟小平1, 2,王 文1, 2
1. 天津中医药大学第一附属医院,天津 300193 2. 国家中医针灸临床医学研究中心,天津 300193
应用网络药理学分析金藤清痹颗粒治疗急性痛风性关节炎(acute gouty arthritis,AGA)的作用机制,并建立AGA大鼠模型进行验证。在清热解毒、活血止痛治法指导下,通过TCMSP数据库搜集金藤清痹颗粒的活性成分及靶点,利用GeneCards、NCBI数据库等搜集AGA相关靶点,与金藤清痹颗粒作用靶点整合后,构建共有靶点蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络和“金藤清痹颗粒-中药-活性成分-靶点-AGA”网络,并进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。雄性SD大鼠随机分为空白组、模型组、秋水仙碱(0.3 mg/kg)组和金藤清痹颗粒低、中、高剂量(1.05、2.10、4.20 g/kg)组,每组6只,踝关节注射单钠尿酸盐(monosodium urate,MSU)晶体建立AGA大鼠模型。采用游标卡尺测量大鼠踝关节直径,计算踝关节肿胀度;采用全自动生化仪检测血清尿酸(serum uric acid,SUA)、C反应蛋白(C-reactive protein,CRP)水平;采用苏木素-伊红(HE)染色观察踝关节组织病理变化;采用qRT-PCR、ELISA和Western blotting检测踝关节组织及血清中关键靶点和信号通路的表达。共检索到金藤清痹颗粒110种活性成分、212个作用靶点,272个AGA治疗靶点,共有靶点29个,关键靶点有白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子(tumor necrosis factor,TNF)及IL-6,涉及TNF信号通路、IL-17信号通路和NOD样受体信号通路等。大鼠踝关节注射MSU晶体后明显肿胀(<0.01),SUA及CRP显著升高(<0.05、0.01),滑膜组织增生明显、结构紊乱,有大量炎症细胞浸润,NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、NIMA相关蛋白激酶7(NIMA-related kinases 7,NEK7)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)、消皮素D(gasdermin D,GSDMD)、IL-18、IL-1β、IL-6及TNF-α表达水平明显升高(<0.01);秋水仙碱或金藤清痹颗粒治疗后,有效缓解踝关节肿胀(<0.05、0.01),SUA及CRP均显著降低(<0.05、0.01),关节滑膜增生、炎症细胞浸润均得到改善,同时显著抑制IL-1β、TNF-α及IL-6等靶点和NOD样受体信号通路的表达(<0.05、0.01)。金藤清痹颗粒对AGA大鼠具有明显的保护作用,其机制可能与抑制NOD样受体信号通路的异常激活,降低炎症因子水平,改善关节滑膜增生、炎症细胞浸润有关。
网络药理学;金藤清痹颗粒;急性痛风性关节炎;NOD样受体信号通路;炎症因子;清热解毒;活血止痛
急性痛风性关节炎(acute gouty arthritis,AGA)是由于机体嘌呤代谢异常和(或)尿酸排泄减少,导致血尿酸升高,单钠尿酸盐析出、沉积于关节所致的疾病,具有高发病率和致残率。近年来,随着生活水平提高,痛风患病率呈逐年上升趋势,且发病年龄趋于年轻化[1-2]。2020年美国风湿病学会痛风管理指南[3]推荐秋水仙碱、非甾体抗炎药和糖皮质激素为治疗AGA的药物。西医可有效缓解患者症状,但目前用于治疗AGA的药物会导致患者出现中枢神经系统及胃肠道不良反应[4],因此有必要寻找安全有效的治疗药物。中医药治疗AGA历史悠久,具有疗效显著、不良反应小等优势,在长期临床实践中积累了丰富经验。
金藤清痹颗粒为“四妙勇安汤”加减化裁而来,由金银花、青风藤、鹿衔草、山慈菇、蜈蚣等11味中药组成,有清热解毒、活血止痛之功,具有抗炎、止痛、解热和免疫调节作用[5-6]。临床上金藤清痹颗粒也常用于AGA的治疗,但相关研究鲜有报道。本研究以刘维教授的“毒痹论”为指导思想[7-8],以金藤清痹颗粒作为清热解毒、活血止痛治法的载体,将网络药理学[9]与动物实验相结合,通过踝关节注射单钠尿酸盐(monosodium urate,MSU)晶体建立AGA大鼠模型,评价金藤清痹颗粒治疗AGA的疗效,并探索其相关作用机制,以期为临床治疗提供理论依据。
1 材料
1.1 动物
SPF级雄性SD大鼠36只,6周龄,体质量(200±10)g,购自北京斯贝福实验动物有限公司,许可证号SCXK(京)2019-0010。大鼠饲养于天津市南开医院清洁级动物房,12 h光照循环,普通饲料喂养,自由进食饮水。所有操作及动物处理均严格遵守相关动物保护及使用规定,伦理批准号NKYY-DWLL-2023-043。
1.2 药品与试剂
金藤清痹颗粒(国药准字Z20123065,批号28180061)由鲁南厚普制药有限公司提供;MSU(批号BCCF5862)、聚山梨酯80(批号096K00781)购自美国Sigma公司;秋水仙碱片(国药准字H20113208,批号20220302)购自广东彼迪药业有限公司;白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-18、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号分别为2023032947R、2023032990R、2023032994R、2023032980R)购自江苏酶免实业有限公司;HRP标记的羊抗鼠IgG二抗(批号20000671)、HRP标记的羊抗兔IgG二抗(批号20000679)、半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)抗体(批号00121900)、消皮素D(gasdermin D,GSDMD)抗体(批号00122309)、β-actin抗体(批号10025459)购自美国Proteintech公司;NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)抗体(批号5123)购自美国SAB公司;凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)抗体(批号10w2797)、NIMA相关蛋白激酶7(NIMA-related kinases 7,NEK7)抗体(批号59y9138)购自美国Affinity公司;RNA提取试剂盒(批号M3211080)购自上海翌圣生物科技有限公司;反转录试剂盒(批号0202122021)、荧光定量预混液(批号0202010531)北京兰博利德生物科技有限公司;引物序列由上海生工设计合成。
1.3 仪器
ASP300S型自动脱水机、HistocoreArcadia H包埋机、RM2265型超薄全自动半薄轮式切片机(德国Leica公司);BX43型正置光学显微镜、AU480型全自动生化仪(日本Olympus公司);Grinder-96型研磨仪(杭州佑宁仪器有限公司);54178型低温高速离心机(德国Eppendorf公司);Colibri超微量分光光度计(德国Berthold Technologies公司);ABI7500型qRT-PCR仪(美国Thermo Fisher Scientific公司);Synergy II全波段酶标仪(美国Bio-Tek公司);1645050型MINI电泳仪、1703810型垂直电泳系统、1658004型湿法电转印系统(美国Bio-Rad公司)。
1.4 数据库与软件
TCMSP数据库(http://tcmspw.com/);Uniprot数据库(http://www.uniprot.org/);GeneCards数据库(http://www.genecards.org/);NCBI数据库(https:// pubmed.ncbi.nlm.nih.gov/);OMIM数据库(https:// omim.org/);String数据库(https://string-db.org/);微生信(http://www.bioinformatics.com.cn/);上海生工(https://www.sangon.com/);Cytoscape v3.7.2软件;Rv4.2.1软件;SPSS 20.0软件。
2 方法
2.1 网络药理学分析
2.1.1 金藤清痹颗粒成分及靶点搜集 分别以金藤清痹颗粒的中药“金银花”“青风藤”“鹿衔草”“山慈菇”“蜈蚣”“白花蛇舌草”“白芍”“当归”“甘草”“生地黄”“玄参”为关键词,在TCMSP数据库中以口服生物利用度≥30%且类药性≥0.18为条件检索、筛选活性成分及其靶点,并用Uniprot数据库对靶点名称进行校正。
2.1.2 AGA靶点采集、筛选以“acute gouty arthritis”和“gouty arthritis”为关键词,在GeneCards、NCBI和OMIM数据库中搜索疾病靶点。
2.1.3 共有靶点的筛选及网络构建 筛选金藤清痹颗粒与AGA的共有靶点,上传至String数据库构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI网络,导入Cytoscape软件呈现,并应用R软件绘制度值直方图。利用DAVID数据库对共有靶点进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,结果提交至微生信可视化,并应用Cytoscape构建“金藤清痹颗粒-中药-活性成分-靶点-AGA”网络。
2.2 动物实验验证
2.2.1 分组、造模及给药 36只大鼠随机分成空白组、模型组、秋水仙碱(0.3 mg/kg)组和金藤清痹颗粒低、中、高剂量(1.05、2.10、4.20 g/kg)组,每组6只。称取400 mg MSU,加入2 mL聚山梨酯80,以生理盐水补足至20 mL,超声溶解后加热搅拌,配成质量浓度为20 mg/mL的MSU晶体混悬液。除空白组外,其余各组参照Coderre等[10]方法制备AGA模型,大鼠麻醉后,用碘伏消毒大鼠右后肢踝关节,弯曲踝关节成直角,针头从踝关节外侧与胫骨呈45°插入踝关节腔内,每只注射MSU晶体混悬液0.2 mL(空白组注射等量无菌生理盐水),用棉签按压几秒避免药液漏出,以踝关节囊的对侧隆起作为成功注射的标准。造模前2 d开始,各给药组ig相应药物,模型组和空白组ig等体积蒸馏水,3次/d,连续给药5 d。末次给药2 h后,ip 10%水合氯醛麻醉,经腹主动脉采血,静置1 h后3000 r/min离心15 min,分离血清,于−20 ℃冻存。取血后处死大鼠,剥离右侧后足踝关节进行后续分析。
2.2.2 踝关节肿胀度测量 于造模前及造模后6、24、48 h,用游标卡尺测量大鼠右踝关节同一部位关节直径,计算踝关节肿胀度。
踝关节肿胀度=(造模后关节直径-造模前关节直径)/造模前关节直径
2.2.3 血清生化指标检测 采用全自动生化仪检测大鼠血清尿酸(serum uric acid,SUA)、C反应蛋白(C-reactive protein,CRP)水平。
2.2.4 苏木素-伊红(HE)染色观察踝关节病理 大鼠踝关节在4%多聚甲醛中固定48 h后,经脱钙、梯度乙醇脱水后,石蜡包埋切片,常规脱蜡复水,苏木素10 min、分化液2 s、伊红1 min进行染色,脱水封片后在光学显微镜下观察切片并采集图像进行分析。
2.2.5 qRT-PCR检测踝关节、、、、、、、、mRNA表达 按照试剂盒说明书提取踝关节中总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。

表1 引物序列
2.2.6 ELISA检测血清IL-1β、IL-18、IL-6、TNF-α水平 按照ELISA试剂盒说明书检测血清中IL-1β、IL-18、IL-6、TNF-α水平。
2.2.7 Western blotting检测踝关节NLRP3、ASC、Caspase-1、NEK7、GSDMD蛋白表达 取大鼠踝关节滑膜组织,加入RIPA强效裂解液,研磨仪60 Hz研磨3 min,转至冰上裂解30 min。4 ℃、12 000 r/min离心20 min后,取上清液,加入上样缓冲液混匀,100 ℃金属浴10 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,5%脱脂牛奶封闭1 h,加入一抗4 ℃孵育过夜,加入二抗室温孵育1 h后显影曝光,采用Image J软件分析条带灰度,检测NLRP3、ASC、Caspase-1、NEK7、GSDMD蛋白表达情况。

3 结果
3.1 网络药理学分析
3.1.1 PPI网络构建 经TCMSP数据库及相关文献检索,纳入金藤清痹颗粒110个活性成分及212个相关靶点;经Genecard、OMIM和NCBI数据库检索,共获得AGA相关靶点271个,两者共有靶点29个,PPI网络(图1)中关键节点包括IL-1β、TNF、IL-6。
3.1.2 共有靶点富集分析 通过构建“金藤清痹颗粒-中药-活性成分-靶点-AGA”网络,直观地呈现了金藤清痹颗粒治疗AGA的11味中药、110种活性成分、29个共同靶点间的关联模式(图2)。
GO分析显示,金藤清痹颗粒可能干预的生物过程涉及炎症反应、细胞凋亡等,与之有关的细胞组分涉及分泌、细胞外基质等,相对应的分子功能有氧化还原酶、细胞因子等(图3-A)。经KEGG富集分析,前20个关键信号通路涉及代谢、凋亡、炎症等相关信号通路,包括TNF信号通路、IL-17信号通路和NOD样受体信号通路等(图3-B)。
3.2 动物实验验证
3.2.1 金藤清痹颗粒对AGA大鼠踝关节肿胀度的影响 如表2所示,大鼠踝关节注射MSU晶体后逐渐发生肿胀,6 h达到高峰。与空白组比较,大鼠造模后6、24、48 h踝关节肿胀度均显著增加(<0.01),提示大鼠AGA模型成功。与模型组比较,秋水仙碱组各时间点踝关节肿胀度显著降低(<0.01);金藤清痹颗粒中、高剂量组各时间点踝关节直径显著降低(<0.05、0.01),金藤清痹颗粒低高剂量组造模后48 h踝关节肿胀度显著降低(<0.05)。

图1 共有靶点PPI网络 (A) 及top 20高靶标阵列(B)

红色菱形代表中药,蓝色箭头代表活性成分,墨绿色圆形代表靶点
3.2.2 金藤清痹颗粒对AGA大鼠血清SUA、CRP水平的影响 如图4所示,与空白组比较,模型组大鼠血清SUA及CRP水平均明显升高(<0.05、0.01);与模型组比较,各给药组SUA及CRP水平均显著降低(<0.05、0.01)。
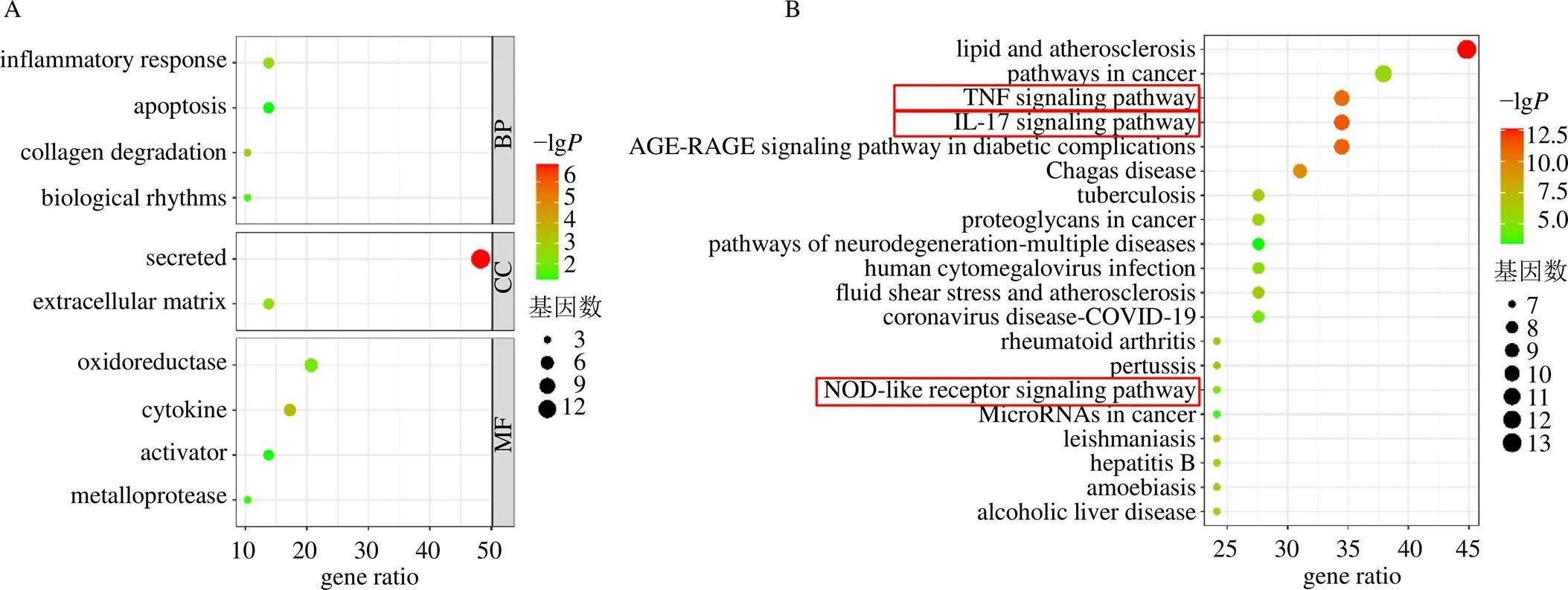
图3 共有靶点GO功能(A) 及KEGG通路(B) 富集分析

表2 金藤清痹颗粒对AGA大鼠踝关节肿胀度的影响(, n = 6)
与空白组比较:##<0.01;与模型组比较:*<0.05**<0.01,下表同
##< 0.01control group;*< 0.05**< 0.01model group, same as below tables
与对照组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01,图6同
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group, same as fig. 6


3.2.3 金藤清痹颗粒对AGA大鼠踝关节滑膜组织病理变化的影响 如图5所示,空白组大鼠踝关节组织结构清晰,滑膜细胞排列正常,无细胞增生、炎性细胞浸润及血管充血。与空白组比较,模型组滑膜组织增生明显、结构紊乱,大量炎性细胞浸润,血管充血。与模型组比较,秋水仙碱组滑膜增生及炎症浸润程度明显降低,血管充血明显缓解;金藤清痹颗粒各剂量组可显著降低AGA大鼠关节滑膜增生及炎症浸润程度,改善血管充血。以上结果提示,金藤清痹颗粒与秋水仙碱均具有改善AGA大鼠踝关节滑膜增生及炎症浸润等组织病理的作用。
3.2.4 金藤清痹颗粒对AGA大鼠踝关节滑膜组织、、、、、、、和mRNA表达的影响 如表3所示,与空白组比较,模型组大鼠滑膜组织中、、、、、、、和mRNA表达水平均显著上升(<0.01);与模型组比较,秋水仙碱组和金藤清痹颗粒高剂量组大鼠滑膜组织中、、、、、、、和mRNA表达水平均显著下降(<0.05、0.01),金藤清痹颗粒中剂量组、、、和mRNA表达水平均显著下降(<0.05、0.01),金藤清痹颗粒低剂量组、、、、、、和mRNA表达水平均显著下降(<0.05、0.01)。

图5 金藤清痹颗粒对AGA大鼠踝关节滑膜组织病理变化的影响(HE, ×100)

表3 金藤清痹颗粒对AGA大鼠踝关节滑膜组织NLRP3、NEK7、ASC、Caspase-1、GSDMD、IL-18、IL-1β、IL-6和TNF-αmRNA表达的影响(, n = 6)
3.2.5 金藤清痹颗粒对AGA大鼠血清中TNF-α、IL-1β、IL-18和IL-6水平的影响 如表4所示,与空白组比较,模型组大鼠血清中TNF-α、IL-1β、IL-18和IL-6水平均明显升高(<0.01);与模型组比较,各给药组TNF-α、IL-1β、IL-18和IL-6水平均显著降低(<0.01)。
3.2.6 金藤清痹颗粒对AGA大鼠踝关节滑膜组织NLRP3、NEK7、ASC、Caspase-1和GSDMD蛋白表达的影响 如图6所示,与空白组比较,模型组大鼠滑膜组织中NLRP3、NEK7、ASC、Caspase-1和GSDMD蛋白表达水平均显著上升(<0.01);与模型组比较,秋水仙碱组NLRP3、NEK7、ASC和GSDMD蛋白表达水平均显著降低(<0.01),金藤清痹颗粒高剂量组NLRP3、NEK7、ASC、Caspase-1和GSDMD蛋白表达水平显著降低(<0.01),金藤清痹颗粒中剂量组NEK7、ASC、Caspase-1和GSDMD蛋白表达水平均显著降低(<0.05、0.01),金藤清痹颗粒低剂量组ASC、Caspase-1和GSDMD蛋白表达水平均显著降低(<0.01)。

表4 金藤清痹颗粒对AGA大鼠血清中TNF-α、IL-1β、IL-18和IL-6水平的影响(, n = 6)

图6 金藤清痹颗粒对AGA大鼠踝关节滑膜组织NLRP3、NEK7、ASC、Caspase-1和GSDMD蛋白表达的影响(, n = 3)
4 讨论
AGA是尿酸钠晶体沉积于关节腔中,募集巨噬细胞、中性粒细胞等免疫细胞,引起大量炎性因子和趋化因子释放,而诱发的炎症性疾病[11]。AGA以急慢性关节炎、痛风石等为临床特征,严重者可致关节畸形、肾尿酸结石、痛风性肾病及肾功能不全等病变[12]。因此,本病的治疗原则和目标在于缓解急性期症状,维持SUA水平持续达标,减少痛风发作,减少合并症的发生[13]。
中医学将AGA归属“痹证”“历节”“痛风”等范畴,朱丹溪最早提出“痛风”病名,《格致余论·痛风论》记载:“痛风者,大率因血受热,已自沸腾,其后或涉冷水,或立湿地,或扇风取凉,或卧当风,寒凉外搏,热血得寒,汗浊凝涩所以作痛,夜则痛甚,行于阴也”。在刘维教授“毒痹论”思想指导下,本研究认为AGA的病机为禀赋不足,脾肾亏虚,湿浊内停,湿浊郁久化热,与浊毒搏结,流注经络关节,而湿浊内停,日久阻滞气血运气,导致瘀血内生而发病。金藤清痹颗粒中金银花、青风藤清热解毒,通痹止痛,为君药;鹿衔草、山慈菇和白花蛇舌草清热解毒、补血活血,强筋健骨,缓急止痛,为臣药;金银花配伍玄参、当归、甘草为四妙勇安汤,既能清热解毒活血又可养阴扶正,配白芍,滋阴凉血,泻火解毒,为佐药;蜈蚣既可以解毒通络止痛,又可引药入经,直达病所,为使药,全方共奏清热解毒、活血止痛的功效,具有抗炎、止痛、解热和免疫调节作用[14]。
本研究通过网络药理学方法构建“金藤清痹颗粒-中药-活性成分-靶点-AGA”网络,预测金藤清痹颗粒治疗AGA的目标靶点及其潜在机制,结果显示靶点呈现多机制多通路的多层次趋势,主要靶点包括IL-1β、TNF及IL-6,涉及TNF信号通路、IL-17信号通路和NOD样受体信号通路等。为了进一步验证网络药理学结果,阐明金藤清痹颗粒治疗AGA的机制,本研究采用踝关节注射MSU晶体诱导大鼠AGA,经金藤清痹颗粒ig治疗后,踝关节肿胀度有效缓解,SUA及CRP均显著降低,踝关节滑膜增生、炎性细胞浸润得到改善,同时显著抑制IL-1β、TNF-α及IL-6等靶点和NOD样受体信号通路的表达。
NOD样受体信号通路在痛风的发病中具有重要的作用,NLRP3炎性小体由先天免疫传感器NLRP3、ASC和Caspase-l组成[15],活化的NLRP3与ASC聚合形成ASC斑点,导致Caspase-l的活化,促进IL-1β前体和IL-18前体的切割,产生成熟的IL-1β和IL-18[16-17],并分泌到细胞外引发炎症反应,因此在先天免疫和炎症中起着核心作用。研究显示,MSU可激活NLRP3,促使ASC完成NLRP3炎性小体的装配,从而激活Caspase-l,促使IL-1β和IL-18的成熟与分泌。而在NLRP3、ASC、Caspase-1缺乏的细胞中,MSU的刺激不能产生成熟的IL-1β[18]。Caspase-l是胱氨酸天冬氨酸蛋白酶家族的成员之一,含有胱天氨酸募集结构域以及p20、p10 2个发挥活性的区域[19],ASC一端可与NLRP3聚合,一端可与Caspase-1聚合,是炎性小体重要的接头分子[20-21]。活性Caspase-1执行了GSDMD氨基末端的切割,这是焦亡必经的过程[22]。Gasdermins蛋白家族是一类具有打孔效应的蛋白,可使细胞膜穿孔导致细胞焦亡,其中GSDMD可被Caspase切割为具有成孔作用的GSDMD-N和自抑制的GSDMD-C,因此GSDMD也被称为细胞焦亡的“执行者”[23-24]。当模式识别受体(pattern recognition receptors,PRRs)识别病原体/损伤相关分子模式(pathogen-or damage-associated molecular patterns,PAMPs/DAMPs)细胞内K+外流[25],线粒体损伤、活性氧释放增加[26-27],溶酶体破裂、组织蛋白酶漏出[28-29],均可导致NLRP3活化。NEK7是丝氨酸/苏氨酸激酶家族成员,作用于K+外流的下游,在ROS的诱导下与NLRP3结合,调节NLRP3的寡聚和激活,其缺乏导致NLRP3无法与ASC聚合,ASC斑点无法形成,抑制Caspase-1的切割和IL-1β的释放,提示NEK7在NLRP3上游的炎症体激活中起着特异性的作用[30-32]。TNF-α是一种高度多效性的细胞因子,具有细胞增殖、代谢激活、炎症反应和细胞死亡等多种生物学功能[33]。而IL-6对感染和组织损伤反应迅速,通过刺激急性期反应、造血作用和免疫反应来增强机体防御和维持内环境稳定[34]。研究表明,MSU诱导的痛风大鼠滑膜组织和血清中TNF-α和IL-6水平均明显升高,与AGA炎症反应的发病机制显著相关,而IL-1β可以促进其产生[35-36]。因此,调节免疫炎症反应是缓解AGA患者临床症状的主要方法。
综上,本研究采用网络药理学结合动物实验的方法,探究清热解毒、活血止痛治法载体金藤清痹颗粒对大鼠AGA的保护作用及机制,结果表明,金藤清痹颗粒能够降低SUA及CRP,有效缓解踝关节肿胀,其机制可能与抑制NOD样受体信号通路的异常激活,降低炎症因子水平,改善踝关节滑膜增生、炎性细胞浸润有关。本研究丰富了清热解毒、活血止痛法治疗AGA的研究,为临床应用金藤清痹颗粒提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1]中华医学会. 临床诊疗指南: 风湿病分册 [M]. 北京: 人民卫生出版社, 2005: 120-126.
[2]Dalbeth N, Gosling A L, Gaffo A,. Gout [J]., 2021, 397(10287): 1843-1855.
[3]FitzGerald J D, Dalbeth N, Mikuls T,. 2020 American college of rheumatology guideline for the management of gout [J]., 2020, 72(6): 744-760.
[4]邓雪蓉, 王昱, 张卓莉. 2016年痛风治疗理念和治疗建议的更新 [J]. 中国实用内科杂志, 2017, 37(3): 217-220.
[5]郑新春, 杨德才. 金藤清痹颗粒治疗类风湿关节炎疗效观察 [J]. 湖北中医杂志, 2013, 35(3): 15-16.
[6]唐今扬, 周彩云, 王鑫, 等. 金藤清痹颗粒通过调节免疫微环境对类风湿关节炎大鼠的干预作用 [J]. 中成药, 2022, 44(11): 3459-3468.
[7]刘维. 毒痹论 [J]. 中国中医基础医学杂志, 2007, 13(1): 15.
[8]刘维, 于海浩, 吴沅皞. 毒痹论续 [J]. 中华中医药杂志, 2013, 28(3): 718-721.
[9]牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[10]Coderre T J, Wall P D. Ankle joint urate arthritis (AJUA) in rats: An alternative animal model of arthritis to that produced by Freund’s adjuvant [J]., 1987, 28(3): 379-393.
[11]Desai J, Steiger S, Anders H J. Molecular pathophysiology of gout [J]., 2017, 23(8): 756-768.
[12]Lorenzo J P P, Sollano M H M Z, Salido E O,. 2021 Asia-Pacific League of Associations for Rheumatology clinical practice guideline for treatment of gout [J]., 2022, 25(1): 7-20.
[13]刘维. 痛风及高尿酸血症中西医结合诊疗指南 [J]. 中医杂志, 2023, 64(1): 98-106.
[14]翟弋焱, 陈美琳, 时锐, 等. 基于网络药理学的金藤清痹颗粒治疗类风湿关节炎的作用机制研究 [J]. 中国医院用药评价与分析, 2023, 23(4): 385-392.
[15]Martinon F, Mayor A, Tschopp J. The inflammasomes: Guardians of the body [J]., 2009, 27: 229-265.
[16]Chen G, Shaw M H, Kim Y G,. NOD-like receptors: Role in innate immunity and inflammatory disease [J]., 2009, 4: 365-398.
[17]Yang J, Liu Z H, Xiao T S. Post-translational regulation of inflammasomes [J]., 2017, 14(1): 65-79.
[18]Martinon F, Burns K, Tschopp J. The inflammasome: A molecular platform triggering activation of inflammatory caspases and processing of proIL-beta [J]., 2002, 10(2): 417-426.
[19]Martinon F, Tschopp J. Inflammatory caspases: Linking an intracellular innate immune system to autoinflammatory diseases [J]., 2004, 117(5): 561-574.
[20]Park H H, Lo Y C, Lin S C,. The death domain superfamily in intracellular signaling of apoptosis and inflammation [J]., 2007, 25: 561-586.
[21]Kohl A, Grütter M G. Fire and death: The pyrin domain joins the death-domain superfamily [J]., 2004, 327(12): 1077-1086.
[22]Shi J J, Zhao Y, Wang K,. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death [J]., 2015, 526(7575): 660-665.
[23]Van Opdenbosch N, Lamkanfi M. Caspases in cell death, inflammation, and disease [J]., 2019, 50(6): 1352-1364.
[24]Broz P, Pelegrín P, Shao F. The gasdermins, a protein family executing cell death and inflammation [J]., 2020, 20(3): 143-157.
[25]Katsnelson M A, Rucker L G, Russo H M,. K+efflux agonists induce NLRP3 inflammasome activation independently of Ca2+signaling [J]., 2015, 194(8): 3937-3952.
[26]Bruchard M, Mignot G, Derangère V,. Chemotherapy-triggered cathepsin B release in myeloid-derived suppressor cells activates the Nlrp3 inflammasome and promotes tumor growth [J]., 2013, 19(1): 57-64.
[27]Kim Y K, Koppula S, Shim D W,. Inhibitory effect and mechanism ofextractinflammasome activation [J]., 2018, 2018: 6346734.
[28]Amaral E P, Riteau N, Moayeri M,. Lysosomal cathepsin release is required for NLRP3-inflammasome activation byin infected macrophages [J]., 2018, 9: 1427.
[29]Orlowski G M, Sharma S, Colbert J D,. Frontline Science: Multiple cathepsins promote inflammasome-independent, particle-induced cell death during NLRP3-dependent IL-1β activation [J]., 2017, 102(1): 7-17.
[30]Xu X J, Zhang L, Ye X C,. Nrf2/ARE pathway inhibits ROS-induced NLRP3 inflammasome activation in BV2 cells after cerebral ischemia reperfusion [J]., 2018, 67(1): 57-65.
[31]He Y, Zeng M Y, Yang D H,. NEK7 is an essential mediator of NLRP3 activation downstream of potassium efflux [J]., 2016, 530(7590): 354-357.
[32]Shi H X, Wang Y, Li X H,. NLRP3 activation and mitosis are mutually exclusive events coordinated by NEK7, a new inflammasome component [J]., 2016, 17(3): 250-258.
[33]Jing Z T, Liu W, Xue C R,. AKT activator SC79 protects hepatocytes from TNF-α-mediated apoptosis and alleviates d-Gal/LPS-induced liver injury [J]., 2019, 316(3): G387-G396.
[34]Tanaka T, Narazaki M, Kishimoto T. IL-6 in inflammation, immunity, and disease [J]., 2014, 6(10): a016295.
[35]Li C, Wang C, Guo Y J,. Research on the effect and underlying molecular mechanism of Cangzhu in the treatment of gouty arthritis [J]., 2022, 927: 175044.
[36]So A K, Martinon F. Inflammation in gout: Mechanisms and therapeutic targets [J]., 2017, 13(11): 639-647.
Mechanism of Jinteng Qingbi Granules in treatment of acute gouty arthritis
WEI Bo-wen1, 2, GAO Jing-yue1, 2, LIU Wei1, 2, WANG Ai-hua1, 2, YUE Qing-yun1, 2, GU Qing-xiang1, 2, KA Yu-xiu1, 2, LIN Fang-fang1, 2, GOU Xiao-ping1, 2, WANG Wen1, 2
1. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China 2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China
To study the mechanism of Jinteng Qingbi Granules (金藤清痹颗粒) in treating acute gouty arthritis (AGA) by network pharmacology and establish AGA rat model for verification.The active components and targets of Jinteng Qingbi Granules were collected by TCMSP database, and AGA-related targets were collected by GeneCards and NCBI database under the guidance of clearing heat and detoxification, promoting blood circulation and relieving pain. After integrating with the targets of Jinteng Qingbi Granules, protein-protein interaction (PPI) and “Jinteng Qingbi Granules-traditional Chinese medicine-active component-target-AGA” network was constructed, gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis were carried out. Male SD rats were randomly divided into blank group, model group, colchicine (0.3 mg/kg) group and Jinteng Qingbi Granules low-, medium- and high-dose (1.05, 2.10, 4.20 g/kg) groups, with six rats in each group. The AGA rat model was established by ankle injection of monosodium urate (MSU) crystals. The diameter of ankle joint in rats was measured by vernier caliper, and the swelling degree of ankle joint was calculated. Serum uric acid (SUA) and C-reactive protein (CRP) levels were detected by automatic biochemical analyzer. HE staining was used to observe the pathological changes of ankle joint. qRT-PCR, ELISA and Western blotting were used to detect the expressions of key targets and signal pathways in ankle joint tissue and serum.A total of 110 active ingredients, 212 targets and 272 AGA therapeutic targets were retrieved, with a total of 29 common targets. The key targets were interleukin-1β (IL-1β), tumor necrosis factor (TNF) and IL-6, involving TNF signaling pathway, IL-17 signaling pathway and NOD-like receptor signaling pathway. After injecting MSU crystal into the ankle joint of rats, the swelling was obvious (< 0.01), SUA and CRP were significantly increased (< 0.05, 0.01), synovial tissue proliferated obviously, the structure was disordered, and a large number of inflammatory cells infiltrated. NOD-like receptor thermal protein domain associated protein 3 (NLRP3), NIMA-related kinases 7 (NEK7), apoptosis-associated speck-like protein containing a CARD (ASC), cystein-aspartate protease-1 (Caspase-1), gasdermin D (GSDMD), IL-18, IL-1β, IL-6 and TNF-α expression levels were significantly increased (< 0.01). After treatment with colchicine or Jinteng Qingbi Granules, ankle swelling was effectively relieved (< 0.05, 0.01), SUA and CRP were significantly decreased (< 0.05, 0.01), synovial hyperplasia and inflammatory cell infiltration of joints were improved, and the expressions of IL-1β, TNF-α and IL-6 and NOD-like receptor signaling pathway were significantly inhibited (< 0.05, 0.01).Jinteng Qingbi Granules has significant protective effects on AGA rats, and the mechanism may be related to the inhibition of abnormal activation of NOD-like receptor signaling pathway, reducing inflammatory factor levels, and improvement of synovial hyperplasia and inflammatory cell infiltration in joints.
network pharmacology; Jinteng Qingbi Granules; acute gouty arthritis; NOD-like receptor signaling pathway; inflammatory factor; clearing heat and detoxification; promoting blood circulation and relieving pain
R285.5
A
0253 - 2670(2023)21 - 7086 - 10
10.7501/j.issn.0253-2670.2023.21.017
2023-07-01
国家自然科学基金资助项目(82074377);中医药传承与创新“百千万”人才工程(岐黄工程)岐黄学者(20210602-1);国家中医药管理局名老中医传承工作室(975022);金藤清痹颗粒二次开发项目(20220626-1)
卫博文,男,博士研究生,研究方向为风湿免疫类疾病发病机制及中药防治研究。E-mail: 278713948@qq.com
通信作者:刘 维,女,主任医师,教授,博士生导师,研究方向为风湿免疫类疾病发病机制及中药防治研究。E-mail: fengshiliuwei@163.com
高晶月,女,主治医师,博士,研究方向为中西医结合诊疗风湿病。E-mail: gaojingyue0603@163.com
[责任编辑 李亚楠]
