基于紧密连接通路探讨芍药苷改善胆汁淤积的作用机制
2023-11-08章方玲吴和霏李煜兵邓昕雨胡启超
章方玲,谢 进,吴和霏,李煜兵,邓昕雨,陈 沅,胡启超,马 骁*
•药理与临床•
基于紧密连接通路探讨芍药苷改善胆汁淤积的作用机制
章方玲1,谢 进2#,吴和霏1,李煜兵1,邓昕雨1,陈 沅1,胡启超1,马 骁1*
1. 成都中医药大学药学院 西南特色中药资源国家重点实验室,四川 成都 611137 2. 解放军总医院医疗保障中心 药剂科,北京 100039
基于蛋白组学和实验验证探讨芍药苷通过紧密连接通路改善胆汁淤积的作用。SD大鼠随机分为对照组、模型组、熊去氧胆酸(60 mg/kg)组和芍药苷高、中、低剂量(200、100、50 mg/kg)组,每组8只。连续7 d ig相应药物,于第4天给药2 h后ig α-萘异硫氰酸酯(60 mg/kg)诱导肝内胆汁淤积大鼠模型。末次给药后,采用试剂盒测定大鼠血清中肝功能指标;苏木素-伊红(HE)染色观察大鼠肝脏组织病理变化;蛋白组学及生物信息学技术筛选芍药苷改善胆汁淤积的关键通路;分子对接确定芍药苷与相关靶点的结合能;qRT-PCR和Western blotting验证大鼠肝组织中关键靶点闭锁小带蛋白-1(zonula occludens-1,ZO-1)、闭合蛋白(Occludin)、密封蛋白1/2/3(Claudin 1/2/3)和连接黏附分子-A(junctional adhesion molecule-A,JAM-A)的表达。药效学结果显示,与对照组比较,模型组大鼠血清中天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)活性及总胆汁酸(total bile acid,TBA)、总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)水平均显著升高(<0.01),肝组织可见大量炎性细胞浸润,伴随着肝细胞变性坏死,而经芍药苷治疗后上述指标得到显著改善(<0.05、0.01)。蛋白组学结果表明芍药苷主要通过凋亡途径、免疫炎症过程、代谢通路、细胞周期通路、胆汁酸分泌通路与紧密连接通路等发挥改善胆汁淤积的作用。选择紧密连接通路进行验证,验证结果表明,与对照组比较,模型组大鼠肝组织、、、、和mRNA表达水平均显著降低(<0.01),ZO-1、Occludin和Claudin 3蛋白表达水平均显著降低(<0.05、0.01),经芍药苷干预后以上紧密连接通路相关蛋白及基因表达显著升高(<0.05、0.01)。芍药苷可以多途径、多靶点缓解大鼠胆汁淤积,是治疗胆汁淤积的潜在药物,紧密连接通路可能是芍药苷改善胆汁淤积的关键通路。
芍药苷;胆汁淤积;肝损伤;蛋白组学;紧密连接
胆汁淤积是指肝内胆汁形成和排泄障碍,或肝外胆道受阻,导致胆汁酸或胆盐潴留的一种病理状态[1]。临床上,胆汁淤积的早期表现为碱性磷酸酶(alkaline phosphatase,ALP)和γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)活性升高,随着疾病的发展会出现黄疸、瘙痒等症状。胆汁淤积与原发性胆汁性肝硬化(primary biliary cholangitis,PBC)、原发性硬化性胆管炎(primary sclerotic cholangitis,PSC)等多种严重性肝病紧密相关。熊去氧胆酸(ursodesoxycholic acid,UDCA)可以减缓PBC的进展,被广泛应用于胆汁淤积的治疗。然而,临床研究发现部分患者对UDCA反应不佳,且UDCA的治疗并不能提高PSC患者的生存率[2]。奥贝胆酸同样在临床上常被用于胆汁淤积的治疗,但是奥贝胆酸被报道会引起患者严重的瘙痒[3]。由于这种有限的治疗,寻找和挖掘更多的替代疗法与潜在药物显现出极大的必要性。
芍药苷是1963年首次从芍药Pall.中提取的一种水溶性单帖化合物[4]。已经有大量研究表明,芍药苷具有广泛的抗炎和免疫调节作用。此外,芍药苷还具有抗氧化、抗抑郁、抗血栓、抗惊厥、抗肿瘤等药理活性[5]。现有研究发现,芍药苷可以通过线粒体依赖途径抑制细胞凋亡;可以抑制核因子-κB(nuclear factor-κB,NF-κB)通路,上调胆汁淤积中胆盐输出泵(bile salt export pump,BSEP)、多药耐药相关蛋白2(multidrug resistance protein 2,MRP2)、牛磺胆酸钠转运蛋白(Na+taurocholate cotransporting polypeptide,NTCP)等转运蛋白的表达;可以激活沉默调节蛋白1(sirtuin 1,SIRT1)-法尼醇受体(farnesoid X receptor,FXR)信号通路,多途径地改善大鼠胆汁淤积性肝损伤[6-8]。然而,肝内胆汁淤积的病理机制复杂,涉及多种因素。因此,基于分子生物学的单因素研究可能无法系统、准确地解释肝内胆汁淤积的发病机制。
高通量分子生物技术被广泛应用于揭示复杂的生物学过程和表型。蛋白组学旨在识别和理解组织或细胞中特定蛋白质的结构和功能,有助于在翻译水平上确定基因表达、了解蛋白修饰以及蛋白之间相互作用,可以深层次地挖掘药物作用的关键因子,为药物的作用提供更全面的理解[9]。因此,本研究基于蛋白组学分析,构建生物体机制调控网络,筛选具备潜在研究价值的显著性作用通路,并进一步利用分子生物学手段对潜在通路进行验证,旨在为芍药苷治疗胆汁淤积的生物学机制提供理论依据。
1 材料
1.1 动物
SPF级雄性SD大鼠48只,6周龄,体质量200~220 g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号SCXK(京)2019-0010,使用许可证号SYXK(川)2020-124。动物饲养于成都中医药大学实验动物中心,环境温度(25±3)℃,相对湿度(50±5)%,12 h/12 h光暗周期。所有动物适应性喂养1周,并可自由获得足够的标准饮食。动物实验经成都中医药大学动物实验伦理委员会批准(批准号2020-0312)。
1.2 药品与试剂
芍药苷(批号CHB-S-016,质量分数≥98%)购自成都克洛玛生物科技有限公司;α-萘异硫氰酸酯(α-naphthylisothiocyanate,ANIT,批号STBH7289)购自美国Sigma公司;UDCA(批号L21056A)购自德国Losan Pharma GmbH;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆汁酸(total bile acid,TBA)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、ALP和γ-GT试剂盒(批号分别为C009-2-1、E003-2-1、C010-2-1、C019-1-1、C019-2-1、A059-2-2、C017-2-1)购自南京建成生物工程研究所;苏木素染液(批号517-28-2)、伊红染液(批号17372-87-1)购自北京中科万邦生物科技有限公司;胰蛋白酶购自美国Promega公司;串联质谱标签(tandem mass tags,TMT)同量异序质量标签试剂盒(批号WF322713)、三色预染蛋白Marker(批号26619)、增强型化学发光底物(批号34579)购自美国Thermo Fisher Scientific公司;逆转录试剂盒(批号G3337)、核酸扩增试剂盒(批号G3326)购自武汉塞维尔生物科技有限公司;BCA蛋白浓度测定试剂盒(批号P0012)购自碧云天生物技术;兔源β-actin抗体(批号AC026)、兔源二抗(批号AS014)购自武汉爱博泰克生物技术有限公司;兔源连接黏附分子-A(junctional adhesion molecule-A,JAM-A)抗体(批号DF6373)、兔源闭锁小带蛋白-1(zonula occludens-1,ZO-1)抗体(批号AF5145)、兔源密封蛋白3(Claudin 3)抗体(批号AF0129)购自美国Affinity公司;兔源闭合蛋白(Occludin)抗体(批号27260-1-AP)购自美国Proteintech公司;引物序列由北京擎科生物科技有限公司设计合成。
1.3 仪器
THZ-92A型气浴恒温振荡器(上海博迅医疗生物仪器股份有限公司);DG5032型酶标仪(南京华东电子集团有限公司);JB-P7型包埋机(武汉俊杰电子有限公司);RM2235型病理切片机(德国Leica公司);CI-S型倒置显微镜、DS-U3型成像系统(日本Nikon公司);nanoUPLC EASYnLC1200型高效液相色谱仪、Q Exactive HFX质谱仪(美国Thermo Fisher Scientific公司);XBridge BEH C18XP色谱柱(美国Waters公司);ReprosilPur 120 C18-AQ色谱柱(德国Dr. Maisch);JY96 IIN型细胞超声破碎仪(上海净信科技有限公司);1600R型低温离心机(上海力申科学仪器有限公司);KZ-Ⅱ高速组织研磨仪(武汉赛维尔生物科技有限公司);CFX96型实时荧光定量PCR系统、ChemiDoc型化学发光成像系统(美国Bio-Rad公司);VE-180B型垂直电泳槽、VE-586型转移电泳槽(上海天能科技有限公司)。
2 方法
2.1 动物分组、造模及给药
48只大鼠适应性喂养1周后,随机分为对照组、模型组、UDCA(60 mg/kg)组和芍药苷高、中、低剂量(200、100、50 mg/kg)组,每组8只。各给药组ig相应药物(10 mL/kg),对照组和模型组ig等体积生理盐水,1次/d,连续7 d。于第4天给药2 h后造模,造模前禁食不禁水12 h,模型组和各给药组ig ANIT(60 mg/kg),对照组ig等体积橄榄油。末次给药后,采用20%乌来糖麻醉大鼠,收集大鼠血液及肝脏样本。血液样本3000 r/min离心10 min,分离血清,于−80 ℃保存。肝脏样本一部分固定于4%多聚甲醛溶液中,用于进行后续组织病理学观察,另一部分分装于无酶冻存管,−80 ℃保存,用于蛋白组学检测。
2.2 肝功能指标检测
按照试剂盒说明书检测各组大鼠血清中AST、ALT、ALP、γ-GT活性和TBA、TBIL、DBIL水平。
2.3 苏木素-伊红(HE)染色观察肝组织病理变化
各组大鼠肝组织用4%多聚甲醛固定后,乙醇梯度脱水、二甲苯透明、石蜡包埋后切成4 μm切片。随后,脱蜡切片水洗后进行HE染色,显微镜下观察各组肝脏组织病理变化。
2.4 蛋白质提取与TMT标记
分别取对照组、模型组和芍药苷高剂量组5份肝组织样本,每份样本称取40 mg肝组织,加入适量RIPA裂解液充分混匀,经低温研磨、冰浴超声后充分裂解样本。样本于4 ℃、12 000 r/min离心15 min,取上清液,使用BCA法测定蛋白含量。每个样品中收集100 μg总蛋白,丙酮沉淀。将蛋白沉淀溶解,加入5 mmol/L二硫苏糖醇(dithiothreitol,DTT),在55 ℃下振荡孵育20 min,还原二硫键。随后将样品冷却至室温,加入碘乙酰胺至15 mmol/L,避光反应30 min,将已还原的二硫键烷基化。用重悬缓冲液将胰蛋白溶解至0.5 g/L,室温孵育5 min,然后将胰蛋白酶与蛋白按1∶50的比例充分混匀。样品于37 ℃振荡孵育过夜。最后,按照TMT标记试剂盒说明书对样品进行标记。
2.5 Nano-UP LC-MS/MS检测
利用Nano-UPLC液相系统分离样本中多肽,再联用质谱仪进行数据采集。采用Reprosil-Pur 120 C18-AQ色谱柱(150 mm×100 μm,1.9 μm)进行色谱分离。质谱分析采用数据依赖采集模式和正离子检测模式,一级扫描范围/350~1600,分辨率120 000@/200;AGC为3E6,最大离子注入时间为30 ms。二级扫描固定最小/为110,分辨率为45 000。根据色谱峰峰宽,将动态排除时间设定为45 s。
2.6 搜库鉴定和蛋白定量
原始数据文件利用Proteome Discoverer软件及内置的Sequest HT搜索引擎进行搜库分析。数据库匹配参数设置见表1。

表1 蛋白组学数据库匹配参数
2.7 差异表达蛋白的筛选与分析
2组间显著性差异表达蛋白的筛选条件为<0.05、FC≥1.2或FC≤0.83。火山图分析与聚类分析分别由ggplot2(R package,version 3.3.6)与pheatmap(R package,version 1.0.12)软件完成。利用String(https://cn.string-db.org/)数据库构建蛋白互作关系。利用基因本体(gene ontology,GO,http://www.geneontology.org/)功能富集分析对组间差异表达蛋白进行功能注释。利用基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG,(https://www.kegg.jp/kegg/)通路富集分析筛选组间差异表达蛋白显著富集的通路,当<0.05时认为差异表达蛋白在该GO条目或KEGG通路中显著富集。
2.8 分子对接验证芍药苷与相关靶点的亲和力
对于蛋白组学筛选出的关键通路,利用分子对接技术进一步预测芍药苷与关键靶点的结合能力。从PubChem数据库(https://pubchem.ncbi.nlm.nih. gov/)下载芍药苷的3D结构,利用PyMOL软件将结构文件转化成PDB文件格式,从RCSB PDB数据库(https://www.rcsb.org/)下载相关靶点的3D结构PDB文件,并去除靶点蛋白中的小配体、水分子和氢键。运用AutoDuckTools 4.2软件进行对接后将结果进行可视化处理。
2.9 qRT-PCR检测肝组织相关靶点mRNA表达
利用TRIzol试剂提取肝组织总RNA,微量分光光度计检测总RNA的浓度、纯度,按照逆转录试剂盒说明书配制逆转录反应体系,将RNA逆转录成cDNA后进行PCR的扩增。扩增条件:95 ℃预变性30 s;95 ℃变性15 s,60 ℃退火/延伸30 s,40个循环。GAPDH为内参基因,利用2−ΔΔCt法计算各目的基因的相对表达量。引物序列见表2。
2.10 Western blotting检测肝组织相关蛋白表达
称取大鼠肝组织约50 mg,加入500 μL含PMSF和蛋白酶抑制剂的裂解液,提取总蛋白。BCA法测定蛋白浓度,加入上样缓冲液后,沸水浴加热使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭、洗膜后,分别加入β-actin(1∶100 000)、Occludin(1∶1000)、ZO-1(1∶1000)、Claudin 3(1∶1000)、JAM-A(1∶1000)一抗,4 ℃孵育过夜;加入二抗(1∶6000),室温孵育90 min,ECL法显色。利用Image J软件分析条带灰度值。

表2 引物序列
2.11 统计学分析
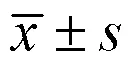
3 结果
3.1 药效学考察
3.1.1 芍药苷对胆汁淤积大鼠肝功能的影响 如图1所示,与对照组比较,模型组大鼠血清中ALT、AST、ALP、γ-GT活性和TBA、TBIL、DBIL水平均显著升高(<0.01);与模型组比较,各给药组血清中ALT、AST、ALP、γ-GT活性和TBA、TBIL、DBIL水平均显著降低(<0.05、0.01)。
3.1.2 芍药苷对胆汁淤积大鼠肝组织病理变化的影响 如图2所示,对照组大鼠肝组织结构正常,肝细胞索状排列整齐,肝细胞间肝窦明显,无明显组织病理学损伤。模型组大鼠肝组织汇管区及肝窦可见大量炎性细胞浸润,汇管区伴随大面积肝细胞肿胀、坏死,部分肝细胞质中可见大小不等的空泡样脂滴,提示肝细胞变性。各给药组大鼠肝组织中汇管区炎性细胞浸润及小叶间胆管破坏明显减弱。
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同
3.2 蛋白质组学分析
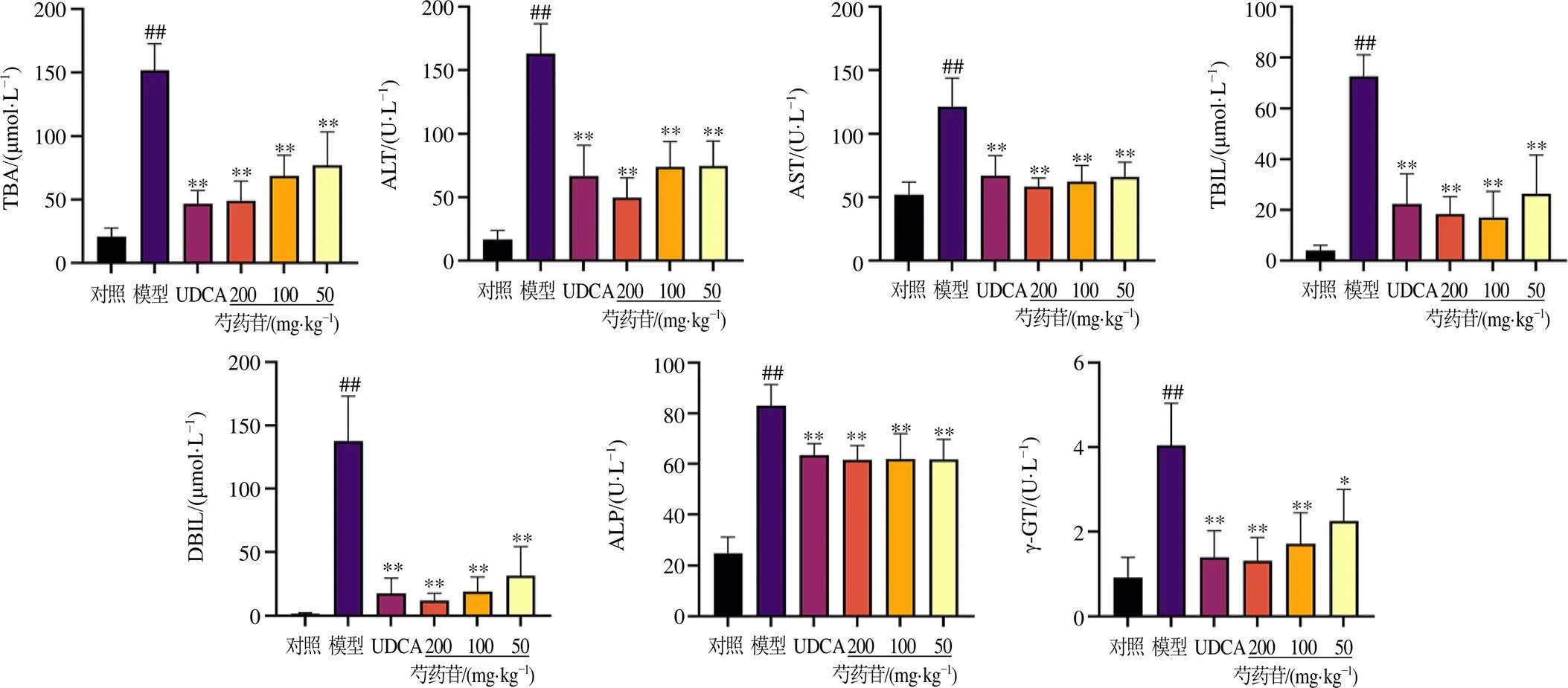
3.2.1 火山图分析与聚类分析 火山图分析以灰色代表非显著性差异蛋白,红色和蓝色代表显著性差异蛋白,其中红色表示上调蛋白,蓝色表示下调蛋白。聚类分析选取值最小的Top50差异蛋白,颜色由蓝色→白色→红色表示表达量从低到高,红色表示高表达蛋白,蓝色表示低表达蛋白。分析结果表明,与对照组比较,模型组有96个蛋白上调,111个蛋白下调(图3-A)。与模型组比较,芍药苷高剂量组有224个蛋白上调,704个蛋白下调(图3-B)。对照组与模型组2组内聚类关系相近,组间基因的差异表达明显;芍药苷高剂量组与模型组聚类分析中存在个别离群值,整体上2组间的蛋白表达模式仍有显著差异(图3-C、D)。
3.2.2 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析 利用String数据库对芍药苷高剂量组与模型组的差异表达蛋白构建PPI网络,设定最小互作分为0.400。结果显示与凋亡途径相关的半胱氨酸蛋白酶-3(Caspase-3,Casp3)蛋白度值最高。此外,度值较高的节点还涉及免疫炎症途径的整合素β2(integrinβ2,Itgb2)、整合素αM(integrin subunit alpha M,Itgam),胆汁酸分泌过程的ATP结合盒转运蛋白C3(ATP-binding cassette sub-family C member 3,Abcc3)、细胞色素P450家族成员7A1(cholesterol 7α-hydroxylase,Cyp7a1),紧密连接途径的连接黏附分子-A(Junctional adhesion molecule A,F11r)、密封蛋白3(Claudin-3,Cldn3),见图4-B。
A-模型组与对照组比较的差异表达蛋白火山图 B-芍药苷高剂量组与模型组比较的差异表达蛋白火山图 C-模型组与对照组比较的差异表达蛋白热图 D-芍药苷高剂量组与模型组比较的差异表达蛋白热图
3.2.3 GO富集分析 进一步对芍药苷高剂量组与模型组的差异表达蛋白进行GO功能富集分析,GO分析包括细胞组成(cellular component,CC)、分子功能(molecular function,MF)、生物学过程(biological process,BP)3个部分,共富集得到2613个条目。取BP中值最小的前15的条目,展开相关信息。如图4-A所示,与模型组比较,芍药苷高剂量组差异蛋白主要富集于小分子代谢、羧酸代谢、有机酸代谢等多种生物代谢过程,富集程度最高的为肌动蛋白细胞骨架组织,与紧密连接途径相关。
3.2.4 KEGG富集分析 对芍药苷高剂量组与模型组的差异表达蛋白进行KEGG通路富集分析,共得到71个条目。取值最小的Top10的通路,以气泡图的形式进行展示。如图4-C所示,与模型组比较,芍药苷高剂量组在代谢通路富集蛋白数目最多,且富集程度最高,代谢通路涉及范围极为宽泛,涵盖了初级胆汁酸生物合成、次级胆汁酸生物合成、淀粉和蔗糖新陈代谢等多种生物过程。在代谢通路以外,2组间差异蛋白显著富集的通路还包括紧密连接通路、细胞周期通路、胆汁酸分泌通路等。
3.3 芍药苷与相关紧密连接蛋白的分子对接
基于蛋白组学结果的综合分析,结合现有的研究现状,选择对药物作用贡献较大,并且在胆汁淤积上游病理发生途径中发挥重要功能的紧密连接通路进行验证。将芍药苷与紧密连接通路重要靶点进行结合能力预测,结果显示芍药苷与ZO-1、Occludin、Claudin 1、Claudin 2、Claudin 3及JAM-A的结合能为−10~−40 kJ/mol,均<0,表明芍药苷与上述靶点具有相对良好的结合能力(表3)。利用PyMOL软件对芍药苷与各个靶点的对接结果进行可视化(图5)。
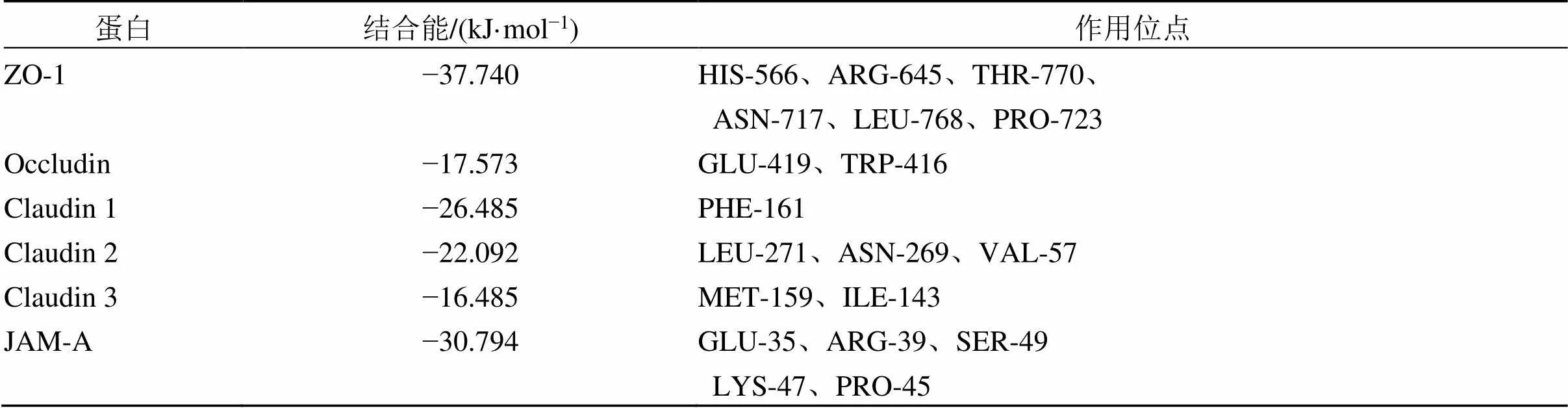
表3 芍药苷与相关紧密连接蛋白的对接结合能
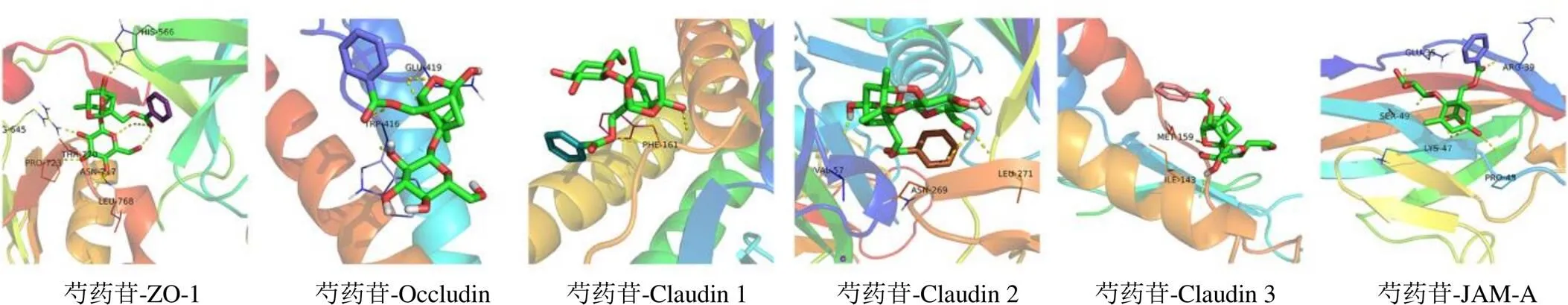
图5 芍药苷与相关紧密连接蛋白的分子对接可视化
3.4 芍药苷对胆汁淤积大鼠肝组织ZO-1、Occludin、Claudin 1、Claudin 2、Claudin 3和JAM-A mRNA表达的影响
如图6所示,与对照组比较,模型组大鼠肝组织中、、、、和mRNA表达水平均显著降低(<0.01);与模型组比较,芍药苷各剂量组、和mRNA表达水平均显著升高(<0.05、0.01),芍药苷高剂量组、和mRNA表达水平均显著升高(<0.05、0.01)。
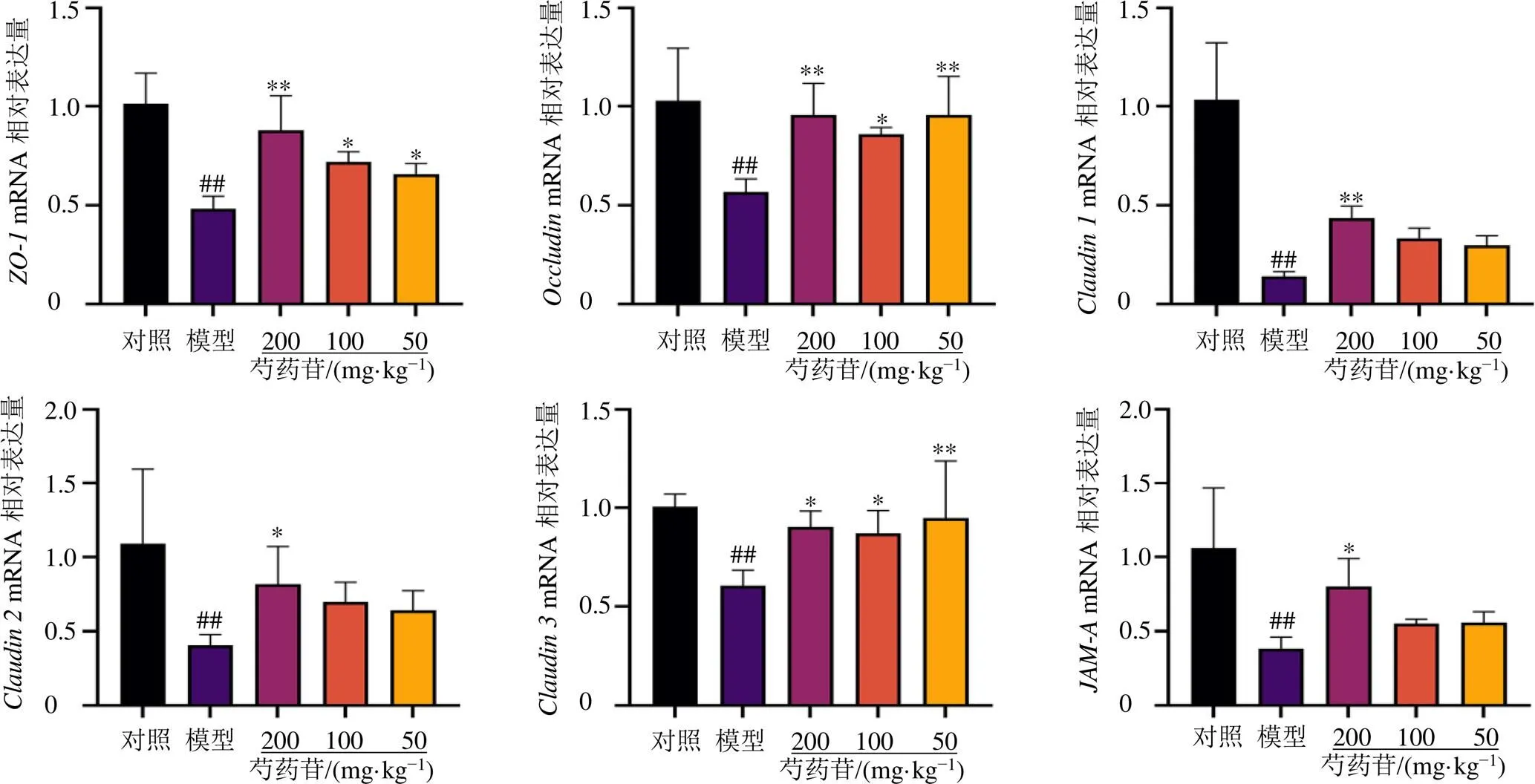
图6 芍药苷对胆汁淤积大鼠肝组织ZO-1、Occludin、Claudin 1、Claudin 2、Claudin 3和JAM-A mRNA表达的影响(, n = 4)
3.5 芍药苷对胆汁淤积大鼠肝组织ZO-1、Occludin、Claudin 3和JAM-A蛋白表达的影响
根据上述结果,芍药苷高剂量组在药效与qRT-PCR考察中均表现出显著的影响,因此,选择高剂量组进一步考察芍药苷对肝组织关键紧密连接蛋白表达的影响。如图7所示,与对照组比较,模型组大鼠肝组织中Claudin 3、Occludin和ZO-1蛋白表达水平均显著降低(<0.05、0.01),JAM-A蛋白表达呈降低趋势;与模型组比较,芍药苷高剂量组大鼠肝组织中Claudin 3、Occludin和ZO-1蛋白表达水平均明显升高(<0.05),JAM-A蛋白表达呈升高趋势。
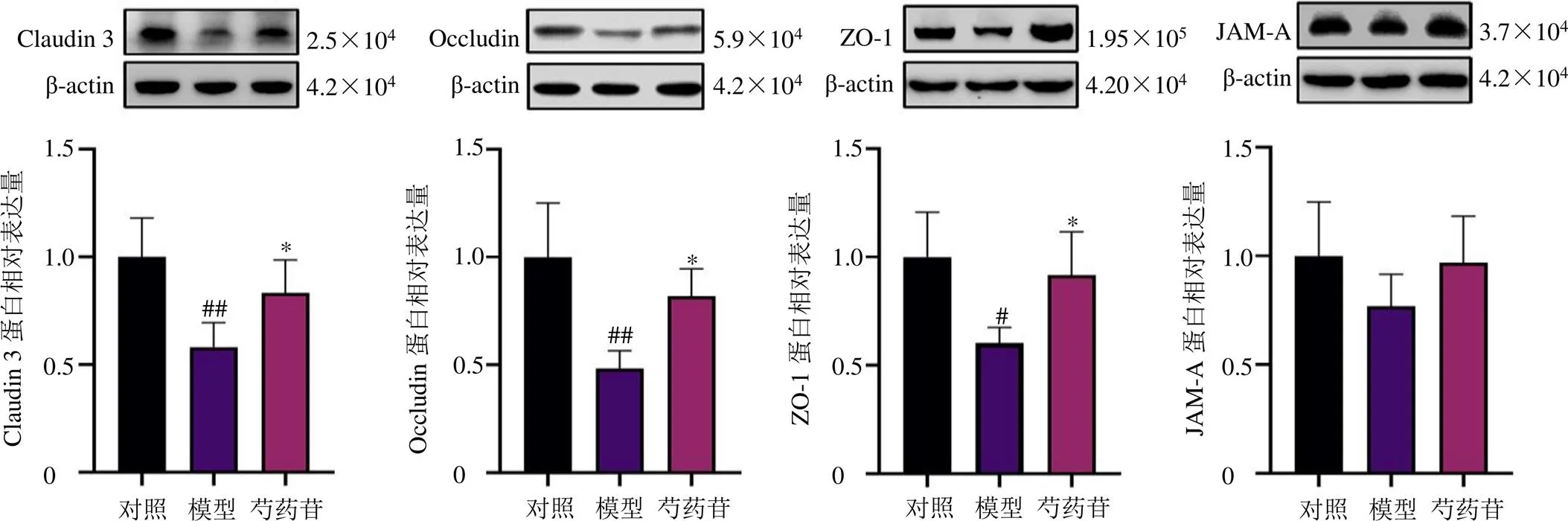
图7 芍药苷对胆汁淤积大鼠肝组织ZO-1、Occludin、Claudin 3和JAM-A蛋白表达的影响(, n = 4)
4 讨论
基于中医理论,胆汁淤积归属中医“黄疸”“淤黄”范畴。胆汁淤积发病机制复杂,《伤寒杂病论》指出胆汁淤积的病因包括寒湿、湿热、火邪与淤血,湿邪被认为是胆汁淤积的主要诱因。现代中医学认为,寒湿内停,日久而生痰,阴盛阳偏虚,致郁阻中焦,肝失疏泄,胆内瘀阻,继而引发黄疸[10]。基于“湿”“热”“瘀”的病因病机或可有效干预胆汁淤积的发展。中药赤芍酸苦性寒,有清热凉血、散瘀止痛之功。在近代临床实践中,重用赤芍已经被大量研究证实可有效治疗重症胆汁淤积性肝炎[11-13]。芍药苷是赤芍的主要活性成分,是赤芍防治肝病的关键物质基础[14-15]。课题组前期已经充分探讨了赤芍及赤芍有效成分芍药苷对于胆汁淤积的疗效[16],然而,芍药苷对胆汁淤积的作用机制尚不完全清楚。本研究在确证芍药苷治疗胆汁淤积的药效学基础上,首次利用蛋白组学技术,预测芍药苷在ANIT诱导的胆汁淤积模型中的关键作用机制。
目前临床对于胆汁淤积的诊断标准及疗效标准尚未统一,胆汁淤积最具特征性的早期表现是血清ALP及γ-GT活性的升高,这2项指标对于胆汁淤积诊断的灵敏性和特异性较高,在表现为同时升高的时候可以判断存在肝细胞及胆管细胞的损伤[17]。黄疸是胆汁淤积的临床表现之一,对于血清TBIL与DBIL的检测便于对肝细胞性、溶血性及阻塞性黄疸进行判断[18]。另外,胆汁淤积发生时,胆汁的分泌会下降,胆汁酸贮存量的分布迅速发生改变,造成血清、尿液中胆汁酸浓度显著升高,所以血清TBA水平的测定是对于胆汁淤积的一种灵敏、特异的检测方法[17]。此外,血清ALT、AST是药物性肝损伤以及肝衰竭前期的重要检测指标,对于肝损伤的诊断极为关键[18-20]。故本研究对各组大鼠血清ALT、AST、ALP、γ-GT活性及TBA、TBIL、DBIL水平进行检测,并结合肝脏病理组织的观察,以形成完整的药效学考察体系。药效学结果表明,芍药苷可显著改善大鼠血清中ALT、AST、ALP、γ-GT活性和TBA、TBIL、DBIL水平的异常升高,减轻大鼠汇管区炎性细胞浸润及肝细胞坏死情况,提示芍药苷的干预可有效缓解大鼠胆汁淤积中的肝功能障碍,改善胆汁淤积大鼠肝脏病理损伤。蛋白组学分析结果显示,芍药苷对于胆汁淤积的调控主要涉及凋亡途径、免疫炎症过程、代谢通路、紧密连接通路、胆汁酸分泌通路与细胞周期通路。
在胆汁淤积中,胆汁流动受损导致胆汁酸在肝脏中积聚,引起肝细胞、胆道损伤和炎症反应。胆汁酸稳态失衡是导致胆汁淤积的核心因素[21-[22]。紧密连接被认为在多种疾病中都起着关键作用。在肝脏中,紧密连接蛋白在肝细胞、胆管细胞及包括内皮细胞在内的非实质细胞上表达,具有多种功能[23-24]。一方面,它们作为黏附肝细胞或胆管细胞之间的细胞旁扩散的“守门员”,形成血-胆屏障并维持组织稳态,防止胆道胆汁反流;另一方面,在非连接定位中,它们通过招募信号蛋白来响应细胞外刺激,参与细胞分化、增殖和迁移等关键的细胞功能的调节[25]。肝胆紧密连接在胆道稳态和肝脏疾病领域的研究还比较少,但已有研究证明在胆汁淤积等慢性肝脏和胆道疾病中伴有紧密连接结构、蛋白表达和定位紊乱[26-27]。此外,近期一项研究表明胆汁酸受体Takeda G蛋白偶联受体5(Takeda G protein-coupled receptor 5,TGR5)可以通过影响紧密连接蛋白JAM-A的表达和磷酸化,调节胆汁淤积小鼠胆道上皮屏障功能,保护小鼠免受胆汁淤积引起的肝损伤[28],揭示了紧密连接在胆汁淤积中的重要功能。在胆汁淤积过程中,肝胆细胞间的紧密连接结构被破坏,血-胆屏障受损,毒性胆汁酸可进入导管周区域,破坏胆汁酸稳态,同时促进免疫细胞浸润,导致炎症驱动肝损伤进展。因此,紧密连接通路在胆汁酸稳态的上游靶点调控中至关重要。介于此,本研究选择了蛋白组学筛选结果中的紧密连接通路进行了后续验证。
首先利用分子对接技术确定芍药苷与几种关键紧密连接蛋白的结合能力,在确定芍药苷与ZO-1、JAM-A、Occludin、Claudin 1、Claudin 2、Claudin 3紧密连接靶点具有良好的亲和力后,进一步利用qRT-PCR、Western blotting技术验证在药物作用下,这些靶点在ANIT诱导的胆汁淤积模型中的变化。结果显示,芍药苷可以显著升高ANIT诱导的、、、、和mRNA的低表达。介于芍药苷高剂量组在前期实验测定中都呈现出比芍药苷中、低剂量组更显著的效果,所以在药物治疗组中,仅选择芍药苷高剂量组进行蛋白表达量的测定,结果显示,模型组ZO-1、Occludin、Claudin 3蛋白表达较对照组均明显降低,而芍药苷高剂量组ZO-1、Occludin、Claudin 3蛋白表达较模型组明显升高。这些结果表明,在ANIT作用下,大鼠肝脏内细胞旁屏障功能被损害,芍药苷可有效调控紧密连接的表达,维持细胞旁屏障功能的完整性以维持组织稳态。
综上,芍药苷可以显著改善胆汁淤积大鼠血清中肝功能指标异常,缓解肝脏病理损伤,可能是有效治疗胆汁淤积的潜在药物。芍药苷可以通过调节紧密连接通路以增强胆汁淤积中细胞旁屏障功能,维持胆汁酸稳态,进而缓解肝内胆汁淤积大鼠的肝损伤。紧密连接通路可能是芍药苷治疗胆汁淤积的关键上游通路。然而,胆汁淤积是一个动态过程,本研究目前没有对胆汁酸稳态进行监控,后续研究可以结合药动学,进一步观察在芍药苷作用下,药物与胆汁酸池之间所反映的量-时-效的动态变化。此外,本研究所取样本为肝组织样本,肝脏中有丰富的毛细胆管,因此本研究关注的紧密连接为肝胆混合表达的紧密连接,初步对肝胆屏障功能进行了考察。然而,肝、胆不同部位的紧密连接,尤其是胆管紧密连接在芍药苷作用下的具体变化还有待进一步研究。后续研究有必要在细胞层面,聚焦芍药苷对于胆管上皮屏障功能的影响,以深入探讨芍药苷调控胆汁酸稳态的路径。
利益冲突 所有作者均声明不存在利益冲突
[1]Woolbright B L, Jaeschke H. Inflammation and cell death during cholestasis: The evolving role of bile acids [J]., 2019, 19(3): 215-228.
[2]Ghonem N S, Assis D N, Boyer J L. Fibrates and cholestasis [J]., 2015, 62(2): 635-643.
[3]Fiorucci S, Distrutti E. The pharmacology of bile acids and their receptors [J]., 2019, 256: 3-18.
[4]Xiang Y J, Zhang Q, Wei S J,. Paeoniflorin: A monoterpene glycoside from plants of Paeoniaceae family with diverse anticancer activities [J]., 2020, 72(4): 483-495.
[5]Zhou Y X, Gong X H, Zhang H,. A review on the pharmacokinetics of paeoniflorin and its anti-inflammatory and immunomodulatory effects [J]., 2020, 130: 110505.
[6]Zhou H Q, Liu W, Wang J,. Paeoniflorin attenuates ANIT-induced cholestasis by inhibiting apoptosisvia mitochondria-dependent pathway [J]., 2017, 89: 696-704.
[7]Zhao Y L, He X, Ma X,. Paeoniflorin ameliorates cholestasis via regulating hepatic transporters and suppressing inflammation in ANIT-fed rats [J]., 2017, 89: 61-68.
[8]Chen L S, Wei S Z, Liu H H,. Paeoniflorin protects against ANIT-induced cholestatic liver injury in rats via the activation of SIRT1-FXR signaling pathway [J]., 2021, 2021: 8479868.
[9]Aslam B, Basit M, Nisar M A,. Proteomics: Technologies and their applications [J]., 2017, 55(2): 182-196.
[10]周厚琴, 张璐, 陆小华, 等. 中医药治疗淤胆型肝炎的研究进展 [J]. 中国医院用药评价与分析, 2018, 18(12): 1588-1590.
[11]贺江平, 汪承柏. 系列处方对重度黄疸肝炎消退黄疸的研究 [J]. 中医杂志, 1991, 32(2): 35-36.
[12]解从君, 李瑞池, 张丽霞, 等. 重用赤芍治疗重症胆汁淤积型肝炎的体会 [J]. 四川中医, 2008, 26(2): 67-68.
[13]张永艳, 赵文霞. 赤芍防治肝病的作用及机理研究 [J]. 陕西中医, 2003, 24(7): 655-656.
[14]Chen L S, Zhao X, Wei S Z,. Mechanism of paeoniflorin on ANIT-induced cholestatic liver injury using integrated metabolomics and network pharmacology [J]., 2021, 12: 737630.
[15]Ma X, Chi Y H, Niu M,. Metabolomics coupled with multivariate data and pathway analysis on potential biomarkers in cholestasis and intervention effect ofPall [J]., 2016, 7: 14.
[16]吴和霏, 章方玲 ,邓昕雨, 等. 芍药苷通过调控肠道菌群改善α-异硫氰酸酯诱导胆汁淤积大鼠的作用机制研究 [J]. 中草药, 2022, 53(22): 7091-7101.
[17]陈成伟, 成军, 窦晓光, 等. 胆汁淤积性肝病诊断和治疗共识(2015) [J]. 临床肝胆病杂志, 2015, 31(12): 1989-1999.
[18]郑功泽. 淤胆型肝炎的治疗体会 [J]. 中医临床研究, 2016, 8(7): 47-48.
[19]于乐成, 茅益民, 陈成伟. 药物性肝损伤诊治指南 [J]. 临床肝胆病杂志, 2015, 31(11): 1752-1769.
[20]中华医学会感染病学分会肝衰竭与人工肝组, 中华医学会肝病学分会重症肝病与人工肝学组. 肝衰竭诊治指南 (2018年版) [J]. 临床肝胆病杂志, 2019, 35(1): 38-44.
[21]Fuchs C D, Trauner M. Role of bile acids and their receptors in gastrointestinal and hepatic pathophysiology [J]., 2022, 19(7): 432-450.
[22]Li T G, Apte U. Bile acid metabolism and signaling in cholestasis, inflammation, and cancer [J]., 2015, 74: 263-302.
[23]Kojima T, Sawada N. Expression and function of claudins in hepatocytes [J]., 2011, 762: 233-244.
[24]Farkas A E, Capaldo C T, Nusrat A. Regulation of epithelial proliferation by tight junction proteins [J]., 2012, 1258: 115-124.
[25]Roehlen N, Roca Suarez A A, El Saghire H,. Tight junction proteins and the biology of hepatobiliary disease [J]., 2020, 21(3): 825.
[26]Sonoi R, Hagihara Y. Tight junction stabilization prevents HepaRG cell death in drug-induced intrahepatic cholestasis [J]., 2021, 10(6): bio058606.
[27]Stremmel W, Lukasova M, Weiskirchen R. The neglected biliary mucus and its phosphatidylcholine content: A putative player in pathogenesis of primary cholangitis-a narrative review article [J]., 2021, 9(8): 738.
[28]Merlen G, Kahale N, Ursic-Bedoya J,. TGR5-dependent hepatoprotection through the regulation of biliary epithelium barrier function [J]., 2020, 69(1): 146-157.
Mechanism of paeoniflorin on alleviating cholestasis based on tight junction pathway
ZHANG Fang-ling1, XIE Jin2, WU He-fei1, LI Yu-bing1, DENG Xin-yu1, CHEN Yuan1, HU Qi-chao1, MA Xiao1
1. State Key Laboratory of Southwestern Chinese Medicine Resources, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. Department of Pharmacy, Chinese PLA General Hospital, Beijing 100039, China
To investigate the effect of paeoniflorin on cholestasis through tight junction pathway based on proteomics and experimental verification.SD rats were randomly divided into control group, model group, ursodesoxycholic acid (60 mg/kg) group and paeoniflorin high-, medium- and low-dose groups (200, 100, 50 mg/kg), with eight rats in each group. The rat model of intrahepatic cholestasis was induced by ig α-isothiocyanate (60 mg/kg) after 7 d of ig corresponding drugs for 2 h on 4th day. After the last administration, the indexes of liver function in serum of rats were determined by kit. HE staining was used to observe the pathological changes of rat liver. Proteomics and bioinformatics techniques were used to screen the key pathways of paeoniflorin on ameliorating the cholestasis. Molecular docking was used to determine the binding energy of paeoniflorin to the relevant targets. qRT-PCR and Western blotting were used to verify the expressions of key targets such as zonula occludin-1 (ZO-1), Occludin, Claudin 1/2/3 and junction adhesion molecule-A (JAM-A) in liver tissue.The pharmacodynamic results showed that compared with control group, activities of aspartate aminotransferase (AST), alanine aminotransferase (ALT), alkaline phosphatase (ALP), γ-glutamyl transpeptidase (γ-GT) and levels of total bile acid (TBA), total bilirubin (TBIL), direct bilirubin (DBIL) in serum of rats in model group were significantly increased (< 0.01). A large number of inflammatory cells infiltrated in liver tissue, accompanied by degeneration and necrosis of hepatocytes, and the above indexes were significantly improved after paeoniflorin treatment (< 0.05, 0.01). Proteomics results indicated that paeoniflorin mainly exerted its effects in improving cholestasis through apoptosis pathway, immune-inflammatory processes, metabolic pathways, cell cycle pathway, bile acid secretion pathway, and tight junction pathway. The tight junction pathway was selected for validation, and the results showed that compared with control group,,,,,andmRNA expressions in liver tissue of rats in model group were significantly decreased (< 0.01), ZO-1, Occludin and Claudin 3 protein expressions were significantly decreased (< 0.05, 0.01), after the intervention of paeoniflorin, the expressions of proteins and genes related to the tight junction pathway were significantly increased (< 0.05, 0.01).Paeoniflorin can relieve cholestasis in rats in multiple ways and multiple targets, and it is a potential drug for treating cholestasis. Tight junction pathway may be the key pathway for paeoniflorin to improve cholestasis.
paeoniflorin; cholestasis; liver injury; proteomics; tight junction
R285.5
A
0253 - 2670(2023)21 - 7055 - 11
10.7501/j.issn.0253-2670.2023.21.014
2023-08-15
国家自然科学基金资助项目(82274187);四川省自然科学基金项目(2023NSFSC0687)
章方玲,硕士研究生,研究方向为中药理论与应用。E-mail: fangzhang1112@163.com
通信作者:马 骁,硕士生导师,副教授,研究方向为中药理论与应用。E-mail: tobymaxiao@cdutcm.edu.cn
谢 进,副主任药师,研究方向为临床中药学。E-mail: xiejin613@126.com
[责任编辑 李亚楠]
