西洋参中2个新型丙二酰人参皂苷的分离鉴定
2023-11-08武建发屈春园李嘉星李泽文
崔 颖,武建发,屈春园,李嘉星,李泽文,刘 志
•化学成分•
西洋参中2个新型丙二酰人参皂苷的分离鉴定
崔 颖,武建发,屈春园,李嘉星,李泽文,刘 志*
吉林农业大学中药材学院,吉林 长春 130118
对西洋参鲜根中丙二酰人参皂苷化学成分进行研究。采用80%乙醇水超声提取,依次用石油醚和正丁醇萃取,用D101大孔吸附树脂、硅胶干柱、ODS硅胶柱和半制备型高效液相色谱对提取物进行分离纯化;利用高分辨质谱和核磁共振波谱等谱学技术对化合物结构进行解析与鉴定。从西洋参鲜根80%乙醇提取物的D101大孔树脂60%乙醇水洗脱部位中分离鉴定出2个丙二酰人参皂苷,分别鉴定为3--[6--丙二酰基-β吡喃葡萄糖基- (1→2)-β吡喃葡萄糖基]-20--[β吡喃葡萄糖基-(1→6)-β吡喃葡萄糖基]-达玛-23-烯-3β,12β,20(),25-四醇(1)和3--[6--丙二酰基-β吡喃葡萄糖基-(1→2)-β吡喃葡萄糖基]-20--[β吡喃葡萄糖基-(1→6)-β吡喃葡萄糖基]-达玛-22-烯-3β,12β,20(),25-四醇(2)。化合物1和2为新化合物,分别命名为丙二酰三七皂苷A(malonyl notoginsenoside A)和丙二酰高丽人参皂苷R2(koryoginsenoside R2)。
西洋参;丙二酰三七皂苷A;丙二酰高丽人参皂苷R2;丙二酰人参皂苷;丙二酰基团
西洋参L. 为五加科多年生草本植物,在中国、美国、加拿大和法国均有种植[1-3]。现代药理学研究表明,西洋参具有抗糖尿病、抗氧化、抗炎和抗肿瘤的活性[4-7]。作为世界性的畅销药材之一,西洋参已广泛应用于临床用药和保健食品,在《中国药典》、和等药典中均有收录。植物化学研究表明,中性人参皂苷(如人参皂苷Rb1、Rb2、Rc、Rd、Rg3、Rh2和CK)和丙二酰人参皂苷(malonyl ginsenoside,MG,如MG-Rb1、MG-Rb2、MG-Rc、MG-Rd、MG-Rg1和MG-Re)是西洋参中的主要生物活性成分[8]。MG是西洋参中的天然原生苷,约占人参皂苷含量的50%,具有抗糖尿病、调血脂和保护神经系统等作用[9-10]。然而,与中性人参皂苷不同,MG因具有热不稳定性而难以分离、鉴定和检测,导致西洋参中MG测定的不准确,严重影响了西洋参的质量评价及其药理作用研究。因此,为了充分利用西洋参的药用资源并扩大其应用范围,本课题组对西洋参根中的化学成分进行了深入研究,并从其鲜根的80%乙醇提取物的D101大孔树脂60%乙醇水洗脱部位中分离鉴定了2个新化合物,分别为3--[6--丙二酰基-β吡喃葡萄糖基-(1→2)-β吡喃葡萄糖基]-20--[β吡喃葡萄糖基-(1→6)-β吡喃葡萄糖基]-达玛-23-烯-3β, 12β,20(),25-四醇{3--[6--malonyl-βglucopyra- nosyl-(1→2)-βglucopyranosyl]-20--[βglucopyra- nosyl-(1→6)-βglucopyranosyl]-dammar-23-ene-3β, 12β,20(),25-tetraol,1}和3--[6--丙二酰基-β吡喃葡萄糖基-(1→2)-β吡喃葡萄糖基]-20--[β吡喃葡萄糖基-(1→6)-β吡喃葡萄糖基]-达玛-22-烯-3β,12β,20(),25-四醇{3--[6--malonyl-βglucopyranosyl-(1→2)-βglucopyranosyl]-20--[βglucopyranosyl-(1→6)-βglucopyranosyl]-dammar- 22-ene-3β,12β,20(),25-tetraol,2}。化合物1和2为新化合物,分别命名为丙二酰三七皂苷A(malonyl notoginsenoside A)和丙二酰高丽人参皂苷R2(koryoginsenoside R2)。
1 仪器与材料
Bruker AV III 600型核磁共振波谱仪(德国Bruker公司),LCMS-IT-TOF型质谱仪(析迈科学仪器有限公司),COSMOSIL 5C18-MS-II型色谱柱(250 mm×4.6 mm,5 µm,日本Nacalai Tesque公司),KQ-250DB型数控超声波清洗器(昆山超声波仪器公司),LC-20AT型高效液相色谱仪(日本岛津公司),ELSD-UM5800 Plus型蒸发光检测器(上海通微分析技术有限公司),Telstar*LyoQuest型冷冻干燥机(北京昊诺斯科技有限公司),METTLER TOLEDO型电子分析天平(梅特勒-托利多国际贸易有限公司),D101大孔树脂(青岛海洋化工厂),ODS反相硅胶色谱柱(日本YMC公司),薄层硅胶板(青岛海洋化工厂),200~300目柱色谱硅胶(青岛海洋化工厂);色谱纯乙腈(美国Fisher公司),分析纯甲醇、无水乙醇、三氯甲烷、正丁醇、醋酸、醋酸乙酯(北京化工厂)。
西洋参于2021年采购自吉林省抚松县,经吉林农业大学中药材学院郑毅男教授鉴定为4年生西洋参L. 的新鲜根部。
2 方法
2.1 提取与分离
取5 kg西洋参鲜根切碎,用10倍量的80%乙醇水超声提取5次,每次1 h;将滤液合并浓缩至干,加入适量水溶解后用等体积的石油醚反复萃取4~5次,再用水饱和正丁醇反复萃取4~5次后得到正丁醇层和水层部分。水层部分浓缩后,用D101大孔树脂柱进行柱色谱,依次以水、30%乙醇水和60%乙醇水为流动相梯度洗脱,收集洗脱液浓缩得到水相、30%乙醇水相和60%乙醇水相。
将60%乙醇水相减压回收至无醇味后冷冻干燥,称取10 g冻干粉末,甲醇溶解,采用ODS反相硅胶柱,以甲醇-水(20%~80%)梯度洗脱,得到3个流分Fr. 1~3。取流分Fr. 1(0.68 g)采用硅胶干柱色谱,以三氯甲烷-甲醇-水(6∶4∶1)为流动相等度洗脱,得到4个组分Fr. 1-1~1-4。组分Fr. 1-1采用半制备高效液相制备纯化(203 nm,35%乙腈,COSMOSIL 5C18-MS-II,2.5 mL/min),得到化合物1(15 mg,R=12.4 min,2 mL/min)和2(17 mg,R=13.6 min,2 mL/min)。
2.2 化合物的酸水解反应
称取待测化合物2 mg,加浓度为2 mol/L的H2SO4溶液2 mL,90 ℃回流反应2 h,然后用NaOH溶液中和至pH 7,用等体积的醋酸乙酯萃取3次。收集水层浓缩至干,采用HPLC-ELSD测定糖的种类。
3 结构鉴定
化合物1:白色无定形粉末,熔点197~200 ℃,极易溶于甲醇,Libermann-Burchard和Molish反应均为阳性,与10%的浓硫酸-乙醇溶液于薄层色谱硅胶板上加热后显紫红色,提示该化合物可能为三萜皂苷类化合物。由高分辨质谱得1 249.561 1 [M+K]+(理论值1 249.562 0,C57H94KO27),结合其1H-和13C-NMR谱图,确定其分子式为C57H94O27。
化合物1的13C-NMR (100 MHz, Pyr-5) 谱共给出57个碳信号,低场区观察到142.58 和123.72特征双键碳信号,提示分子中可能存在双键,以及羰基的特征碳信号172.90 和171.28,同时还观察到105.46、106.29、98.68、105.30,推测为糖基的端基碳信号;结合DEPT谱图,在低场区观察到8个甲基碳信号16.83、17.13、17.37、17.94、24.13、28.90、30.89和31.17。结合1H-NMR (400 MHz, Pyr-d) 谱中高场区给出的8个特征单峰甲基质子信号0.91 (3H, s)、0.98 (3H, s)、1.11 (3H, s)、1.16 (3H, s)、1.36 (3H, s)、1.71 (3H, s)、1.70 (6H, s),根据HMQC和HMBC谱,将其分别归属于C-18 (16.83)、C-30 (17.94)、C-29 (17.37)、C-19 (17.13)、C-28 (28.90)、C-21 (24.13)、C-26 (31.17)、C-27 (31.17),综上推测该化合物为含有2个羰基和1个碳碳双键的达玛烷型四环三萜四糖苷。
与文献对比后,化合物1与三七皂苷A(notoginsenoside A)[11]的碳信号基本一致,但多出3个碳信号171.2、5.60和172.90,与MG-Rb1[12]对比后发现,这些信号为丙二酰基的特征碳信号。酸水解实验结果表明分子中有葡萄糖的存在,结合13C-NMR及1H-NMR低场区的4个端基质子信号4.96 (1H, d,= 7.2 Hz), 5.33 (1H, d,= 7.7 Hz), 5.26 (1H, d,= 7.6 Hz), 5.10 (1H, d,= 7.8 Hz),进一步确定结构中存在4个葡萄糖基(Glc),且根据偶合常数判断其端基质子均为β构型。由HMBC谱(图1)可知,葡萄糖基(Glc′)的端基质子信号4.96 (1H, d,= 7.2 Hz) 与母核C-3 (90.56) 存在远程相关,因此判断该糖基连接在皂苷元母核的C-3位;另一葡萄糖基(Glc′′)的端基质子信号5.33 (1H, d,= 7.7 Hz) 与Glc′的C-2′ (84.16) 存在远程相关,推测其连接方式为C-1′′→C-2′;同时由于丙二酰基的影响,C-6′′的化学位移向高场移动至65.47,说明其丙二酰化位点位于连接Glc′′的C-6′′-OH处;此外,葡萄糖基(Glc′′′)的端基质子信号5.26 (1H, d,= 7.6 Hz) 与母核C-20 (84.66) 存在远程相关,因此判断Glc′′′连接在皂苷元母核的C-20位,另一葡萄糖基(Glc′′′′)的端基质子信号5.10 (1H, d,= 7.8 Hz) 与Glc′′′的C-6′′′ (71.29) 存在远程相关,推测其连接方式为C-1′′′′→C-6′′′。

图1 化合物1的主要HMBC和1H-1H COSY相关
因此,化合物1被确定为3--[6--丙二酰基-β吡喃葡萄糖基-(1→2)-β吡喃葡萄糖基]-20--[β吡喃葡萄糖基-(1→6)-β吡喃葡萄糖基]-达玛-23-烯-3β,12β,20(),25-四醇{3--[6-- malonyl-βglucopyranosyl-(1→2)-βglucopyrano-syl]-20--[βglucopyranosyl-(1→6)-βglucopyra- nosyl]-dammar-23-ene-3β,12β,20(),25-tetraol}。因其与三七皂苷A(notoginsenoside A)仅相差1个丙二酰基,因此命名为丙二酰三七皂苷A(malonyl notoginsenoside A),结构如图1所示。
化合物2:白色无定形粉末,mp 195~202 ℃,极易溶于甲醇,Libermann-Burchard和Molish反应均为阳性,与10%的浓硫酸-乙醇溶液于薄层色谱硅胶板上加热后显紫红色,提示该化合物可能为三萜皂苷类化合物。由高分辨质谱得/1 249.560 9 [M+K]+(理论值1 249.562 0,C57H94KO27),结合其1H-和13C-NMR谱图,确定其分子式为C57H94O27。
化合物2的13C-NMR (100 MHz, Pyr-d) 谱共给出57个碳信号,低场区观察到138.67 和127.62特征双键碳信号,提示分子中可能存在双键,以及羰基的特征碳信号171.96 和173.60,同时还观察到105.41、106.21、98.73、105.49,推测为糖基的端基碳信号;结合DEPT谱图,在低场区观察到8个甲基碳信号16.89、17.18、17.43、17.99、24.18、25.86、26.30和28.96。结合1H-NMR (400 MHz, Pyr-d) 谱中高场区给出的8个特征单峰甲基质子信号0.91 (3H, s)、1.01 (3H, s)、1.14 (3H, s)、1.00 (3H, s)、1.74 (3H, s)、1.35 (3H, s)、1.72 (6H, s),根据HMQC和HMBC谱,将其分别归属于C-19 (16.89)、C-18 (17.18)、C-29 (17.43)、C-30 (17.99)、C-21 (24.18)、C-28 (28.96)、C-26 (26.30)、C-27 (25.86),综上推测该化合物为含有2个羰基和1个碳碳双键的达玛烷型四环三萜四糖苷。
与文献对比后发现,化合物2与高丽人参皂苷R2(koryoginsenoside R2)[13]的碳信号基本一致,仅多出的171.96、45.77和173.60信号与之不同,与MG-Rb1[12]对比后发现,这些信号为丙二酰基的特征碳信号。酸水解实验结果表明分子中有葡萄糖基的存在,结合13C-及1H-NMR低场区的4个端基质子信号5.53 (1H, d,= 8.2 Hz)、5.33 (1H, d,= 7.1 Hz)、5.26 (1H, d,= 7.0 Hz)、5.08 (1H, d,= 7.1 Hz),进一步确定结构中存在4个Glc基,且根据耦合常数判断其端基质子均为β构型。由HMBC谱(图2)可知,Glc′的端基质子信号5.53 (1H, d,= 8.2 Hz) 与母核C-3 (90.69) 存在远程相关,因此判断该糖基连接在皂苷元母核的C-3位;Glc′′的端基质子信号5.33 (1H, d,= 7.1 Hz) 与Glc′的C-2′ (84.03) 存在远程相关,推测其连接方式为C-1′′→C-2′;同时由于丙二酰基的影响,C-6′′的化学位移向高场移动至65.40,说明其丙二酰化位点位于连接Glc′′的C-6′′-OH处;此外,Glc′′′的端基质子信号5.26 (1H, d,= 7.0 Hz) 与母核C-20 (84.75) 存在远程相关,因此判断Glc′′′连接在皂苷元母核的C-20位,Glc′′′′的端基质子信号5.08 (1H, d,= 7.1 Hz) 与Glc′′′的C-6′′′ (70.61) 存在远程相关,推测其连接方式为C-1′′′′→C-6′′′。

图2 化合物2的主要HMBC和1H-1H COSY相关
因此,化合物2被确定为3--[6--丙二酰基- β吡喃葡萄糖基-(1→2)-β吡喃葡萄糖基]-20--[β吡喃葡萄糖基-(1→6)-β吡喃葡萄糖基]-达玛-22-烯-3β,12β,20(),25-四醇{3--[6-- malonyl-βglucopyranosyl-(1→2)-βglucopyra-nosyl]-20--[βglucopyranosyl-(1→6)-βgluco-pyranosyl]-dammar-22-ene-3β,12β,20(),25-tetraol}。因其与高丽人参皂苷R2(koryoginsenoside R2)仅相差1个丙二酰基,因此命名为丙二酰高丽人参皂苷R2(malonyl koryoginsenoside R2),结构如图2所示。
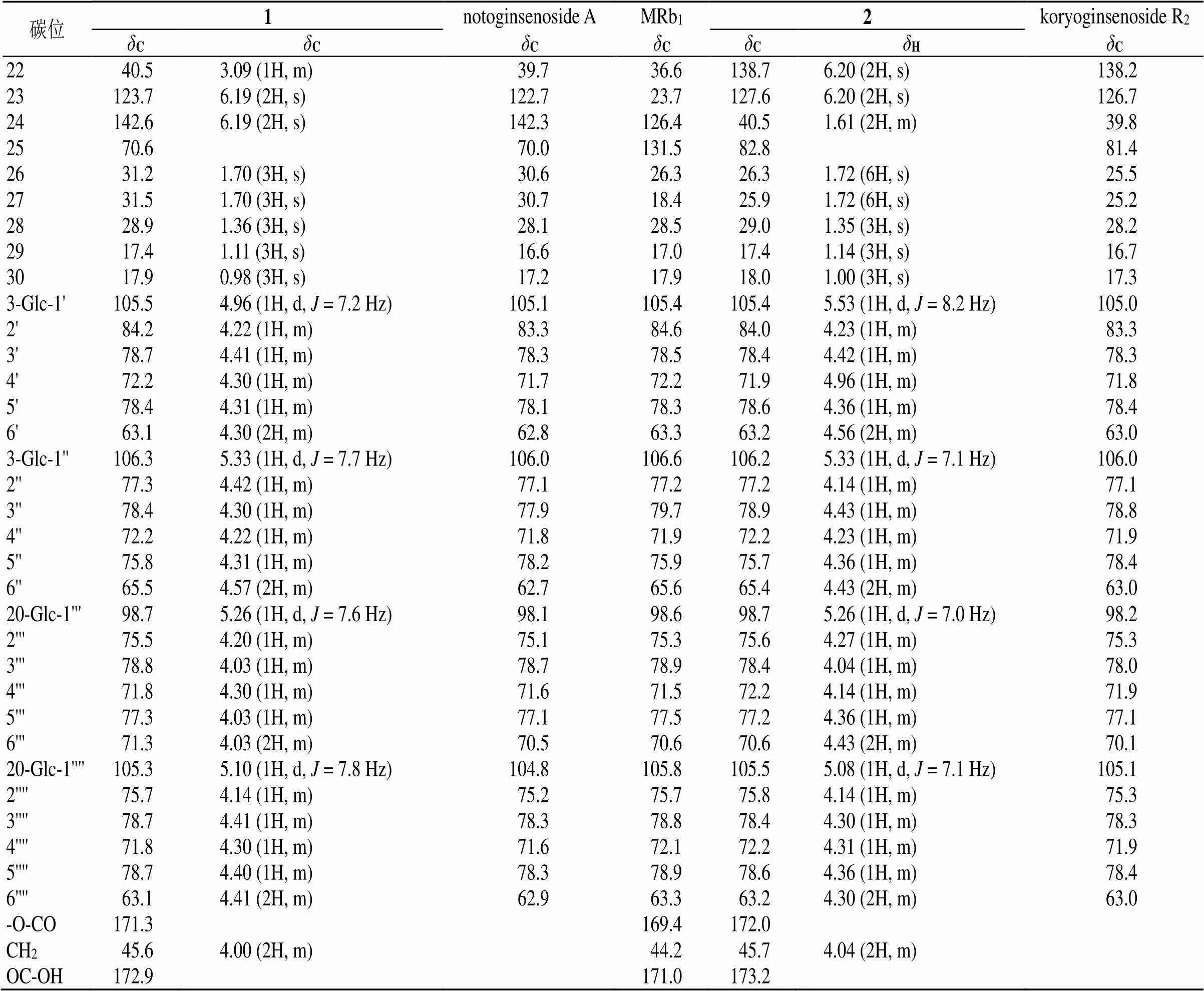
上述结合1D和2D(HSQC、HMBC和COSY)核磁谱图,对化合物1和2进行碳氢归属,见表1。

表1 化合物1和2的1H-NMR (400 MHz) 和13C-NMR (100 MHz) 数据(C5D5N+D2O)
续表1
4 讨论
本研究从西洋参鲜根的80%乙醇水提取液中分离出2个新型丙二酰人参皂苷。丙二酰人参皂苷是天然人参皂苷,存在于鲜西洋参和生晒西洋参中,以前发表的研究表明,西洋参中的丙二酰人参皂苷的含量占总皂苷的50%[14-15]。丙二酰人参皂苷是西洋参的主要活性成分,文献报道具有抗氧化、抗糖尿病、调血脂等药理活性[9,16]。本研究为丙二酰基人参皂苷的提取分离纯化提供了基础数据,同时为合理开发和利用西洋参资源提供了科学的依据。
利益冲突 所有作者均声明不存在利益冲突
[1]Hao M Z, Zhou Y H, Zhou J H,. Cold-induced ginsenosides accumulation is associated with the alteration in DNA methylation and relative gene expression in perennial American ginseng (L.) along with its plant growth and development process [J]., 2020, 44(5): 747-755.
[2]Huang X, Liu Y, Zhang Y,. Multicomponent assessment and ginsenoside conversions ofquinquefolium L. roots before and after steaming by HPLC-MS(n) [J]., 2019, 43(1): 27-37.
[3]Yao H, Li X W, Liu Y,. An optimized microwave-assisted extraction method for increasing yields of rare ginsenosides fromL [J]., 2016, 40(4): 415-422.
[4]Attele A S, Wu J A, Yuan C S. Ginseng pharmacology: Multiple constituents and multiple actions [J]., 1999, 58(11): 1685-1693.
[5]Yuan C S, Wang C Z, Wicks S M,. Chemical and pharmacological studies of saponins with a focus on American ginseng [J]., 2010, 34(3): 160-167.
[6]Shao Z H, Xie J T, Vanden Hoek T L,. Antioxidant effects of American ginseng berry extract in cardiomyocytes exposed to acute oxidant stress [J]., 2004, 1670(3): 165-171.
[7]Qi L W, Wang C Z, Yuan C S. Ginsenosides from American ginseng: Chemical and pharmacological diversity [J]., 2011, 72(8): 689-699.
[8]Sun G Z, Li X G, Liu Z,. Isolation and structure characterization of malonyl-notoginsenoside-R4from the root of[J]., 2007, 28, 1316-1318.
[9]Liu Z, Qu C Y, Li J X,. Hypoglycemic and hypolipidemic effects of malonyl ginsenosides from American ginseng (L.) on type 2 diabetic mice [J]., 2021, 6(49): 33652-33664.
[10]Abe K, Cho S I, Kitagawa I,. Differential effects of ginsenoside Rb1 and malonylginsenoside Rb1 on long-term potentiation in the dentate gyrus of rats [J]., 1994, 649(1/2): 7-11.
[11]Yoshikawa M, Murakami T, Ueno T,. Bioactive saponins and glycosides. VIII. Notoginseng (1): New dammarane-type triterpene oligoglycosides, notoginsenosides- A, -B, -C, and-D, from the dried root of(Burk.) F. H. Chen [J]., 1997, 45(6): 1039-1045.
[12]Wang Y S, Jin Y P, Gao W,. Complete (1)H-NMR and (13)C-NMR spectral assignment of five malonyl ginsenosides from the fresh flower buds of[J]., 2016, 40(3): 245-250.
[13]Kim D S, Chang Y J, Zedk U,. Dammarane saponins from[J]., 1995, 40(5): 1493-1497.
[14]Dai S, Hong Y, Xu J,Ginsenoside Rb2promotes glucose metabolism and attenuates fat accumulation via AKT-dependent mechanisms [J]., 2018, 100: 93-100.
[15]李嘉欣, 李梦瑶, 张单丽, 等. HPLC法同时测定不同生长年限、部位西洋参中2类成分 [J]. 中成药, 2020, 42(10): 2670-2674.
[16]张单丽, 李梦瑶, 王东升, 等.不同加热方式对丙二酰基人参皂苷降解的影响及抗氧化活性的变化 [J]. 吉林农业大学学报, 2023, doi:10.13327/j.jjlau.2022.5604.
Isolation and identification of two new malonyl ginsenosides from
CUI Ying, WU Jian-fa, QU Chun-yuan, LI Jia-xing, LI Ze-wen, LIU Zhi
College of Chinese Medicine Materials, Jilin Agricultural University, Changchun 130118, China
To investigate the chemical compositions of malonyl ginsenosides from the fresh roots of.Thewere extracted by ultrasonic extraction with 80% ethanol, followed by petroleum ether and-butanol, and separated and purified using D101 macroporous sorbent resin, silica gel dry column, ODS silica gel column and semi-preparative high performance liquid chromatography. The structures of the compounds were resolved and identified using spectroscopic techniques such as high-resolution mass spectrometry and nuclear magnetic resonance spectroscopy.Two malonyl ginsenosides were isolated and identified from the 60% ethanol water elution site of D101 macroporous resin of 80% ethanol extracts of the fresh root of. The structures of the new compounds were identified as 3--[6--malonyl-βglucopyranosyl-(1→2)-βglucopyranosyl]-20--[βglucopyranosyl-(1→6)-βglucopyranosyl]-dammar-23-ene-3β,12β,20(),25-tetraol (1), and 3--[6--malonyl-βglucopyranosyl-(1→2)-βglucopyranosyl]-20--[βglucopyranosyl- (1→6)-βglucopyranosyl]-dammar-22-ene-3β,12β,20(),25-tetraol (2), respectively.Compound 1 and 2 are new compounds named as malonyl notoginsenoside A and malonyl koryoginsenoside R2.
L.; malonyl notoginsenoside A; malonyl koryoginsenoside R2; malonyl ginsenoside; malonyl group
R284.1
A
0253 - 2670(2023)21 - 6940 - 06
10.7501/j.issn.0253-2670.2023.21.002
2023-07-09
国家自然科学基金资助项目(31770378);吉林省自然科学基金资助项目(20180101183JC);吉林省科技发展计划项目(20200301037RQ)
崔 颖,硕士生,研究方向为中药化学。E-mail: cuiying626@163.com
通信作者:刘 志,副教授,硕士生导师,主要从事中药药效物质基础与作用机制。E-mail: lzhiiu@126.com
[责任编辑 王文倩]
