人参调控神经递质代谢的研究进展
2023-11-08卢增辉郑清烟梁琼麟
卢增辉,郑清烟,张 雪,韩 强,梁琼麟*
人参调控神经递质代谢的研究进展
卢增辉1,郑清烟2,张 雪1,韩 强1,梁琼麟1*
1. 清华大学 中药现代化研究中心,国家中医药管理局中药化学三级实验室,北京市中医药交叉研究所,北京 100084 2. 古汉中药有限公司,湖南 衡阳 421003
人参具有大补元气、安神益智等功效,其主要有效成分为三萜皂苷、多糖和多肽等,可用于中枢神经系统疾病的治疗。人参化学成分及其活性代谢物对氨基酸类、单胺类和乙酰胆碱等神经递质的体内代谢过程等具有广泛的调节作用,其作用途径包含调节脑部代谢微环境、透过血脑屏障直接作用于神经元以及调节神经-内分泌网络等。在人参“安神益智”的理论指导下,结合人参化学成分和神经递质的体内代谢过程综述了人参调节大脑神经递质代谢的主要作用机制,以期为人参的深入研究提供依据。
人参;神经递质;内源性代谢;血脑屏障;安神益智
人参et为五加科植物人参C. A. Mey.的干燥根和根茎,人参归脾、肺、心、肾经,具有大补元气、复脉固脱、补脾益肺、生津养血、安神益智的功效[1]。研究表明人参可直接促进脑部血管新生以直接改善脑部血液循环,还可通过改善心血管功能以提高大脑的血流供应[2-5],有证据显示人参化学成分对血脑屏障(blood brain barrier,BBB)具有一定的调节作用[6],这些结果提示人参可以影响血液及其携带的营养物质在脑组织中的扩散过程而为大脑提供更好的代谢环境,促进神经细胞与内环境间的物质交换等。大脑功能区如皮层、海马体和中缝核等含有丰富的神经递质,这些信号分子参与神经传递与神经细胞分化等过程,如乙酰胆碱(acetylcholine,ACh)、5-羟色胺(5-hydroxytryptamine,5-HT)和去甲肾上腺素(noradrenaline,NE)及其代谢产物等[7]。人参皂苷对ACh、谷氨酸(glutamate,Glu)及5-HT等15种常见的神经递质具有一定的调节作用,极性不同的皂苷组分对兴奋性/抑制性神经递质的调节作用不同,从而发挥不同的中枢神经系统(central nervous system,CNS)调节活性,如调节精神节律、抗应激、改善睡眠、提高记忆力和防止脑疲劳等[8]。在已知人参对脑部神经递质代谢具有多种调控作用的背景下[9],为深入探讨人参化学成分特别是有效组分对脑部内源性代谢的影响及其机制[10-11],笔者以“人参”“神经递质”或“ginseng”“neurotransmitter”为检索词,在中国知网、PubMed数据库和谷歌学术搜索为资料来源,重点检索2018—2023年发表的有关于人参调控神经递质代谢及其机制的文献以反映本领域的最新进展,同时为体现相关研究方向的历史脉络,对部分重要文献进行了追溯性的文献检索,以期为人参用于脑部疾病的基础研究及临床应用提供参考。
1 人参的化学成分及体内过程
人参皂苷是人参最主要的化学成分[12-13],根据母核结构可分为达玛烷型、齐墩果酸型和奥克梯隆型。其中又以达玛烷型人参皂苷为主,其属于四环三萜,可根据C-6位是否有取代基而分为人参二醇型皂苷、人参三醇型皂苷,二者均有手性碳原子C-20进而可根据取代基位置细分为和型;人参还含有多糖、挥发油、聚乙炔类、氨基酸和多肽类成分[14-16]。
药动学研究表明,药物代谢酶、肠道菌群和胃酸等均可参与人参化学成分的吸收与代谢过程,人参皂苷及其代谢产物在包括脑在内的多种组织器官中均有分布[17-20]。例如,二醇型人参皂苷Rd和三醇型人参皂苷Re、Rg1可跨过BBB[19,21],人参皂苷Rd在机体内可以沿着“Rd→Rh2→Compound K(CK)→20()-protopanaxadiol(PPD)”转化,人参皂苷Re和Rg1在机体内可沿着“Re(Rg1)→ F1→20()-protopanaxatriol(PPT)”转化[22];代谢产物CK和PPD同样可以透过BBB,并且CK可以上调大鼠海马体中5-HT、DA等神经递质水平而发挥抗抑郁作用,PPD能与脑型肌酸激酶结合而改善小鼠认知缺陷[23-25]。达玛烷型人参皂苷及代谢产物的结构见图1。人参皂苷原型及其代谢产物可透过BBB且对大脑功能具有一定的影响,而人参皂苷的代谢与吸收又涉及肠道及肠道菌群。这种多层次的转化关系及作用机制提示基于静态的单一成分作用单个靶点的表达模式难以准确地表征人参的药效,需要整合药物代谢及其整体调控作用加以分析。
2 人参改善大脑的代谢环境
CNS由脑和脊髓组成,脑的代谢环境与体内其他器官的代谢环境有所区别,前者在与循环血发生物质交换时需要跨过BBB,后者则可以与循环血直接交换物质。大脑皮层由神经细胞组成,包括神经元和星形胶质细胞等其他支持细胞,神经元之间形成大量的突触连接。大脑皮层含有丰富的小分子物质,包括葡萄糖、氨基酸、胺类、脂质等,这些小分子物质与大脑皮层的生长、发育及其生物学功能密切相关,因此部分氨基酸和生物胺类物质也被称为神经递质。
人参可以提高组织细胞对苛刻环境的耐受能力,人参皂苷Rg1可抑制脑组织氧化应激和神经元凋亡,对缺血/缺氧所造成的脑损伤起到保护作用[29-30]。人参寡肽能上调血液中红细胞数量、血红蛋白水平,提高脑组织乳酸脱氢酶活力并降低缺氧环境下乳酸的水平,促进缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的基因表达水平,最终通过改善血液携氧能力、增加脑容量及促进血管生成等方式发挥抗缺氧作用[31]。来源于人参的溶血磷脂酸(lysophosphatidic acid,LPA)蛋白复合物gintonin可以作用于LPA受体并激活RhoA相关蛋白激酶(Rho-associated coiled-coil containing kinase,ROCK)通路,影响BBB细胞间紧密连接相关蛋白(Occludin、ZO-1和Claudin-5等)的表达以提高BBB的渗透性,体现了人参可通过调节屏障体系以影响脑内代谢环境[6]。
3 人参调节能量代谢为神经递质合成提供能量及物质基础
大脑掌控着认知、学习及思维等高级生理功能,以约5%的体积占比消耗了机体20%~25%的能量,而葡萄糖是大脑主要的能量底物,大脑灰质中葡萄糖的代谢速率高于白质,其他的供能小分子还有短链脂肪酸、氨基酸等[32]。脑内神经递质的代谢过程离不开三磷酸腺苷(adenosine triphosphate,ATP)的供能,能量代谢过程为脑部生命活动提供ATP的同时,其下游代谢产物是部分神经递质的重要前体,如Glu、天冬氨酸等氨基酸类神经递质不能透过BBB,而必须依赖于葡萄糖代谢产物α-酮戊二酸(α-ketoglutaric acid,α-KG)等进行脑内合成而得[33]。
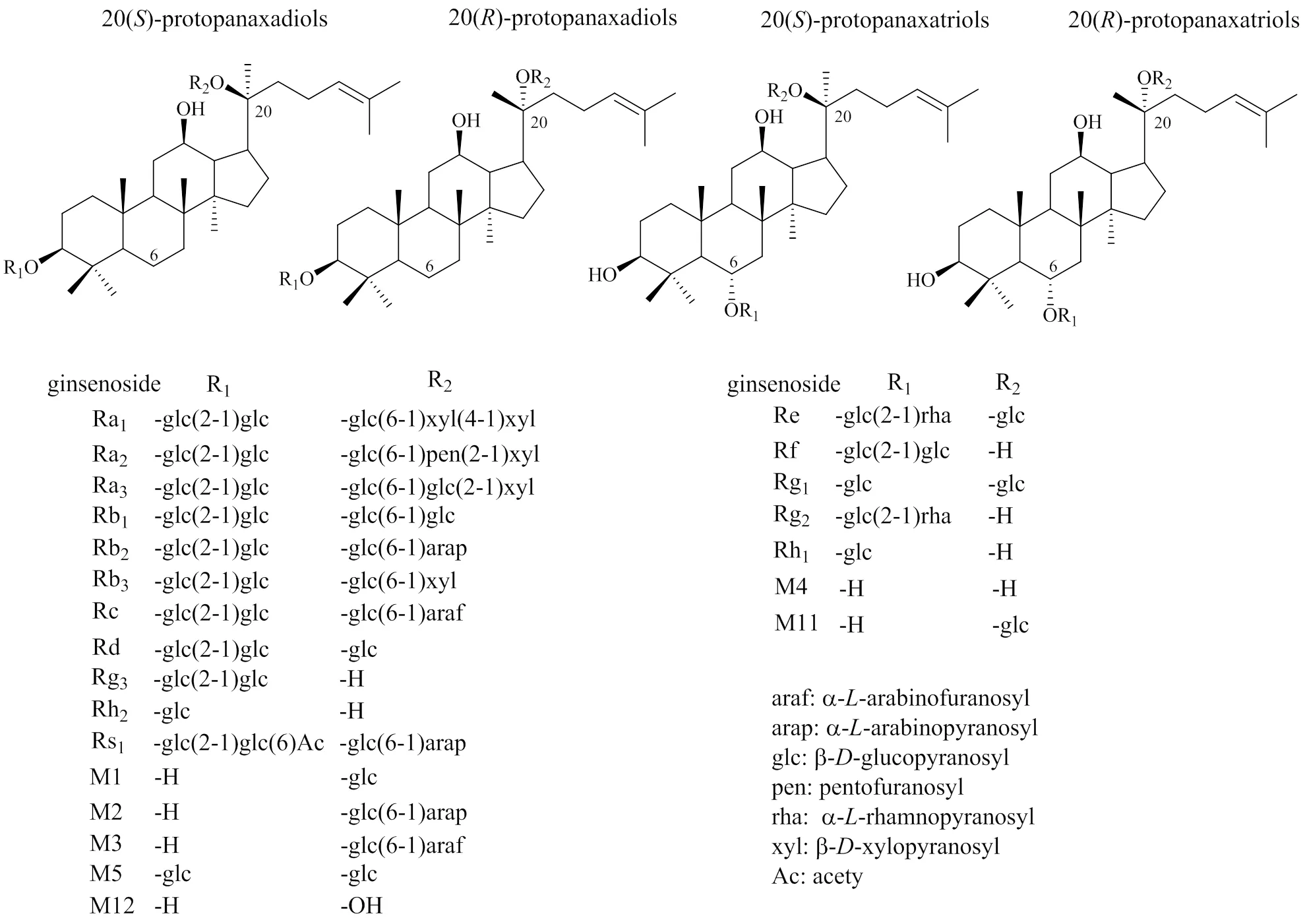
图1 达玛烷型人参皂苷及代谢产物的结构[26-28]
3.1 葡萄糖摄取
神经细胞膜表面存在钠非依赖性葡萄糖转运体(sodium-independent glucose transporters,GLUTs),GLUTs可以从动脉血或组织液中将葡萄糖转运至细胞内,其中神经胶质细胞主要表达GLUT1,而GLUT3和GLUT4则主要存在于神经元。大脑对葡萄糖的高消耗使得脑区葡萄糖浓度降低,这与血糖形成浓度差而保持长期大量摄入葡萄糖[34]。神经细胞膜GLUTs的表达受到激活腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)通路、环磷腺苷效应元件结合蛋白(cyclic adenosine monophosphate response element-binding protein,CREB)通路和HIF-1等通路的调控,人参皂苷Rg1可以通过激活AMPK通路而上调细胞GLUT4的表达,人参皂苷Re不能直接上调GLUT4表达水平却可以通过激活过氧化物酶体增生物激活受体γ2(peroxisome proliferator-activated receptor γ2,PPARγ2而促进GLUT4的转运,两者均可以加强细胞对葡萄糖的摄取能力[35-37]。
3.2 葡萄糖氧化
葡萄糖进入细胞后经过己糖激酶磷酸化生成葡萄糖-6-磷酸,从而参与葡萄糖的不同细胞内代谢途径。机体对能量的利用是通过ATP的生成与转化实现的,线粒体与该过程密切相关,神经信号传导相关过程需要消耗细胞内约70%的ATP,其中约80%的能量用于兴奋性神经元[38]。当机体因衰老等因素导致烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)水平降低时,线粒体呼吸链受损,这导致神经细胞ATP合成降低而对大脑生理功能产生影响[39]。人参总皂苷可以促进神经细胞基础耗氧量,增加ATP合成,其机制与NAD+依赖的沉默信息调节因子-1(silent information regulator-1,Sirt-1)激活有关,具体反映在给药后细胞内“丙酮酸-柠檬酸-富马酸-苹果酸”等一系列葡萄糖有氧氧化中间产物含量显著上调[40]。
3.3 线粒体保护作用
人参多糖可提高红细胞膜Band 3蛋白水平,改善糖酵解关键酶丙酮酸激酶、己糖激酶、果糖-6-磷酸激酶的活力,有助于红细胞损伤修复并行使正常的氧气运输等生理功能[41]。人参皂苷Compound K(CK)是人参皂苷在体内的活性代谢产物,实验表明CK可以促进小鼠海马神经元细胞(HT22)GLUT1和GLUT3的表达,提高细胞内ATP的含量[18]。人参皂苷Re可以通过活性氧/凋亡信号调节激酶-1(reactive oxygen species/apoptosis signal-regulating kinase-1,ROS/ASK-1)介导的线粒体凋亡过程降低β-淀粉样蛋白(amyloid-beta peptide,Aβ)引起的SH-SY5Y细胞线粒体损伤,体现了人参对线粒体功能的保护作用[42]。
4 人参对氨基酸类神经递质代谢的调控作用
动物体需不断摄入必需氨基酸,否则将影响生长发育、神经细胞的过度激活及大脑局部表面积下降等[43-44]。Glu、γ-氨基丁酸(gamma aminobutyric acid,GABA)等被认为是重要的神经递质[7]。氨基酸在皮质、海马体等大脑不同区域具有量的差异,如GABA主要集中于皮质层且前端有明显富集,研究表明人参对大脑中不同部位的多种氨基酸均有一定的调控作用[45]。目前已经在体内发现50多种氨基酸转运体,这些转运体的存在有利于维持体内氨基酸平衡,如-型氨基酸转运体-2(-type amino acid transporter-2,LAT-2)/溶质转运蛋白家族3成员2重链(solute carrier family 3 member 2 heavy chain,SLC3A2)与血浆-脑脊液中谷氨酰胺的转运有关[46]。除了BBB会对脑部氨基酸代谢产生影响以外,一些疾病如脑损伤可通过脑-肠轴影响肠道微生物的结构组成,从而影响氨基酸的体内代谢[47]。与身体其他部位相比,哺乳动物大脑的氨基酸代谢存在一些差异,如脑部的赖氨酸主要经过高脯氨酸途径而不是酵母氨酸途径降解[48],这些信息提示脑部氨基酸代谢具有一定的特殊性。
4.1 Glu
Glu可由α-KG在谷氨酸脱氢酶的催化下生成,是主要的兴奋型神经递质之一;Glu经谷氨酰胺合成酶(glutamine synthetase,GS)催化可代谢成谷氨酰胺(glutamine,Gln),Gln与Glu可以相互转化。当细胞所处的环境中Glu含量过高时,Glu会抑制半胱氨酸(cysteine,Cys)转运蛋白活性,降低胞内Cys而影响抗氧化剂谷胱甘肽(glutathione,GSH)的合成,最终使细胞内ROS急剧上升;GSH的耗竭引发了异常的细胞Ca2+内流,钙蛋白酶随之激活而导致截短型bid(truncated bid,tBid)的产生,最终激活凋亡蛋白B淋巴细胞瘤-2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax);同时,过多的ROS损伤了线粒体,触发了细胞凋亡因子(apoptosis factor,AIF)从线粒体膜上转位到细胞核,激活Caspase非依赖性细胞凋亡途径,由此共同导致了神经细胞的凋亡[49]。
人参皂苷Rg1可促进神经元Glu的释放,其作用机制与钙/钙调蛋白依赖性蛋白激酶II有关,当使用抑制剂阻断该蛋白激酶活性时,人参皂苷Rg1对海马神经元Glu释放的促进作用消失[50]。长期摄入人参皂苷Rg1可以上调小鼠海马体谷氨酸受体-1(glutamate receptor-1,GLT-1)的表达[51]。
人参皂苷Rb1和Rb3可以抑制Glu介导的神经传递而对神经细胞起到保护作用。在糖氧剥夺一段时间以后,人参皂苷Rb3可以延缓复氧后α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid receptor,AMPAR)和-甲基--天冬氨酸受体(-methyl--aspartic acid receptor,NMDAR)介导的群体峰电位(population spike potential,PS)瞬时恢复的出现,改善了AMPA-PS和NMDA-PS的恢复幅度;人参皂苷Rb1仅对复氧后的NMDA-PS具有较大幅度改善[52]。星形胶质细胞可以通过GLT-1从细胞外摄取Glu并通过GS生成Gln,从而降低胞外Glu的水平[32],人参皂苷Rb1可以提高癫痫小鼠大脑皮层、海马及星形胶质细胞中GLT-1和GS的表达,改善Glu-Gln循环从而避免细胞外Glu蓄积[53-54]。
4.2 GABA
GABA可由Glu在谷氨酸脱羧酶(glutamate decarboxylase,GAD)的作用下转化而来,是主要的抑制型神经递质之一,其主要作用机制是与GABA受体结合抑制突触后电位,从而抑制神经细胞的兴奋性[55]。GABA与焦虑、抑郁和癫痫等多种神经紊乱疾病有关,如GAD缺乏导致大脑GABA能神经激活紊乱而患抑郁症[56]。
Shao等[57]对Glu、GABA的含量进行监测发现,在人参皂苷Rg5或Rk1给药后,小鼠血清、海马体、下丘脑和大脑皮质中Glu的含量降低,而GABA的含量上升;与正常组相比,给药组生物样本中GABA/Glu显著增大,说明人参皂苷Rg5与Rk1可以促进小鼠机体内的Glu向GABA转化。人参皂苷CK可以促进细胞中肌质/内质网Ca2+的释放而提高突触末梢终端的Ca2+浓度,进而促进GABA的主动释放[58]。
研究表明人参皂苷Rg5和Rk1可以上调小鼠脑组织中γ-氨基丁酸A型受体A(gamma aminobutyric acid receptor A,GABAA)和γ-氨基丁酸B型受体B(gamma aminobutyric acid receptor B,GABAB)的表达[57]。Jiang等[59]在研究人参皂苷Rb3对神经细胞糖氧剥夺的保护作用时发现,人参皂苷Rb3恢复PS的幅度可被GABAA拮抗剂所降低,而无法被GABAA激动剂所增加,提示人参皂苷Rb3保护脑细胞的作用机制可能与促进GABA生成或与GABAA结合有关。
大脑中其他氨基酸的代谢也需要关注,如苯丙氨酸(Phe)在体内经苯丙氨酸羟化酶代谢生成酪氨酸(Tyr),是DA的重要前体物质[45]。人参其他化学成分如人参糖蛋白对氨基酸代谢也具有一定的调节作用[60]。
5 人参对乙酰胆碱代谢的调控作用
服用人参有利于维持胆碱能神经的正常生理功能[61]。人参皂苷Rg1可透过BBB并促进内侧前额叶皮层、海马体中ACh的释放,与脑脊液中Rg1的快速清除相比,内侧前额叶皮层、海马体能在较长时间内维持高水平的ACh[17,21]。人参皂苷Rg2、Rh1和Rb1可以提高阿尔茨海默病(Alzheimer’s disease,AD)模型小鼠海马体、前脑皮层中ACh的含量[62-64]。
人参提取物可提高大脑中胆碱乙酰转移酶(choline acetyltransferase,ChAT)的活性而抑制乙酰胆碱酯酶(acetylcholinesterase,AchE)的活性[65]。进一步研究表明,人参皂苷Re、Rd均可以促进Neuro-2a细胞中、囊泡乙酰胆碱转运蛋白(vesicular acetylcholine transporter,)基因的表达,同时上调高亲和力胆碱转运蛋白基因表达;人参皂苷Rg2、Re与Rd可上调小鼠大脑中和的表达水平,促进细胞对ACh的摄取[19,63]。Gintonin则通过作用于LPA受体而提高脑部ACh和ChAT的表达[66]。研究显示人参皂苷Rg1、Rg2、Rg5、Rb1和Rk1等对AchE具有抑制效果[63,67-69],分子对接结果提示人参皂苷Re对AchE具有潜在抑制活性[70],这些作用显示了人参有助于维持大脑中ACh活性。
6 人参对单胺类神经递质代谢的调控作用
人参可以改善脑部ACh及NE介导的神经传递过程而上调不同脑区的δ谱、θ谱功率,改善老年人的学习记忆能力及注意力等[71]。焦虑、压力等刺激会导致神经细胞的树突萎缩,进而对下丘脑-垂体-肾上腺素轴(hypothalamic-pituitary-adrenergic axis,HPA)及脑内单胺类神经递质的代谢产生影响[72]。
6.1 多巴胺
人参皂苷对多种因素造成的多巴胺能神经元损伤具有保护作用,其机制与提高氧自由基清除能力、抑制多巴胺神经元树突减少、防止炎症进展和抗神经细胞凋亡有关[73-76]。研究显示,人参皂苷原型可以上调衰老大鼠海马体及下丘脑中多巴胺的含量[77],其体内代谢产物(如CK)可以提升慢性不可预见性轻度应激(chronic unpredictable mild stress,CUMS)大鼠前额皮层和海马区中DA及其代谢产物的含量[23]。
人参皂苷Rg1、Re可以透过BBB并显著提升大鼠海马体、内侧前额叶皮层的DA水平[78]。人参皂苷Rg1提高DA能神经释放DA的机制可被雌激素受体拮抗剂所阻断,表明人参皂苷Rg1提高DA的机制与雌激素受体有关[79];近来学者发现人参皂苷Rg1提高脑部DA水平的作用机制还与增加细胞囊泡中DA含量,提高神经细胞胞吐频率有关[80]。Gintonin可以上调小鼠血清DA水平,促进PC12细胞释放DA,其机制与LPA受体激活引发细胞内钙瞬变,从而调节Ca2+依赖性离子通道和受体有关[81]。
6.2 肾上腺素
人参对肾上腺素能受体具有一定的抑制作用[82]。HPA过度激活时,机体促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)及其下游激素如皮质酮(corticosterone,CORT)等的分泌将显著增加,这会导致抑郁症等神经系统疾病,而人参皂苷Rg1可以抑制HPA过度激活,降低CUMS小鼠血清中ACTH和CORT的水平或大鼠血清中肾上腺素水平[83-84]。人参皂苷Rb1可以降低压力状态下小鼠小脑中肾上腺素的水平,从而缓解压力导致的神经损伤[72]。此外,人参皂苷代谢产物M4对肾上腺也有抑制作用,可减少由ACTH引起的皮质醇升高[28]。
6.3 NE
心力衰竭患者服用人参2周后,可降低24 h尿液中NE的水平[85]。人参皂苷可以提高大鼠海马体及下丘脑中NE的水平[77]。人参皂苷Rg1、Rb1可以提高CUMS小鼠前额叶皮质或海马体中NE的含量[83];而在压力或应激状态下,人参皂苷Rb1或Re可以降低小鼠前额皮质、纹状体和下丘脑中NE的水平[72,86],其作用机制与神经递质的分泌与单胺类受体的调节等有关[87]。
6.4 5-HT
色氨酸(tryptophan,Trp)经色氨酸羟化酶催化生成5-羟色氨酸(5-hydroxytryptophan,5-HTP),再经5-羟色氨酸脱羧酶催化成5-HT;5-HT在单胺氧化酶的作用下可生成5-羟色醛及5-羟基乙酸而排出体外。5-HT是抑制性神经递质。
中缝核包含大量的5-HT能神经元,其主要功能是产生5-HT。研究表明红参水提液可以抑制运动诱导的中缝核5-HTP的表达及5-HT的合成,从而提升大鼠的运动耐力[88]。人参总皂苷对脑内5-HT具有直接的调节作用而具有一定的抗应激效果[89]。与总提物相比,单体给药会进一步揭示人参调控5-HT代谢的机制。人参皂苷Rg1可通过降低脑部NE的含量而抑制蓝斑NE能神经元活性,以及提升中缝背核5-HT能神经元活性而增加总睡眠、快速眼动睡眠和非快速眼动睡眠时间,并延长慢波睡眠在总睡眠中的比例[90]。
人参皂苷Rg1也有利于维持正常的肠道菌群结构,通过对肠道中拟杆菌属细菌的丰度及其Trp代谢过程进行调控,可以影响肠菌来源的血清中Trp及其代谢产物5-HT的水平[91];同时,Rg1可以降低海马体中5-HT受体-1B(5-hydroxytryptamine receptor-1B,)和5-的mRNA表达[92]。人参皂苷Rb1可升高CUMS小鼠海马体中5-HT的含量,促进海马体中5-HTR-1A的表达[93]。人参皂苷Re可以显著降低水浸-束缚应激大鼠皮层、纹状体和下丘脑中5-HT和5-HIAA的含量[86],对5-HTR-1A激活过程具有一定的抑制作用[94]。
7 人参调节神经递质代谢的机制
临床研究表明,人参及其制剂可以改善心脏病患者的心排血量、射血分数[95],有利于保障CNS的血氧供应;可以降低抗阻训练后受试个体血清中皮质醇的含量,提高机体氧自由基清除能力,避免因高强度体力消耗所引起的HPA轴过度反应及潜在的神经细胞氧化损伤[96]。研究还显示红参对女性抑郁症患者的残留抑郁症状[97]、AD人群的认知能力下降具有显著的改善作用[98-100]。失眠患者服用人参总皂苷后,肢体交感神经皮肤反应的潜伏期显著延长,波幅显著降低;与服用人参前相比,该反应的异常率显著降低,反映了人参皂苷对失眠患者的自主神经功能障碍的治疗作用[101]。近年来的临床试验显示了人参对神经系统疾病的治疗潜力[102-103],学者为阐明人参调节神经递质代谢的作用机制开展了大量的实验研究(图2)。
7.1 保护神经细胞
临床观察显示人参的补气、益智功效有利于血管性痴呆、脑卒中等脑部疾病的防治,有利于维持神经细胞的正常功能,改善患者语言及思维能力[104-105]。人参可以通过改善心功能[2,106]、促进脑血管新生和提高血红细胞携氧能力[3,31,107]、调节能量代谢[18,36-37,40,42,108]等方式促进大脑的血液循环及物质交换,这为包括神经元在内的细胞新陈代谢提供良好的条件,如减少乳酸积聚、改善神经细胞微循环等作用。人参皂苷可抑制脑组织氧化应激和神经细胞凋亡、稳定神经细胞数量。例如,人参皂苷Re可提高帕金森病模型果蝇脑内超氧化物歧化酶(superoxide dismutase,SOD)含量,降低ROS、丙二醛(malondialdehyde,MDA)水平,从而提高脑组织抗氧化能力;人参皂苷Re还可能通过抑制Caspase-3信号通路激活而减轻鱼藤酮导致的DA神经元丢失现象[109]。
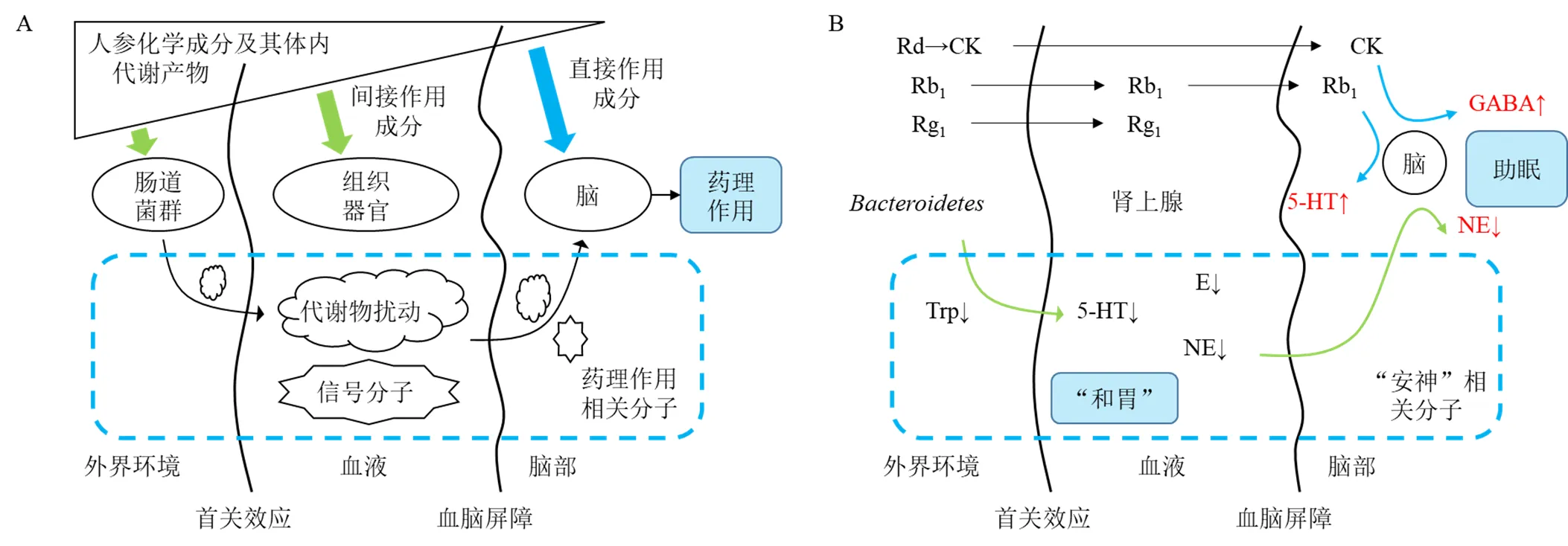
图2 人参调节神经递质代谢的潜在作用机制模式(A)及其示例(B)
人参皂苷可抑制脑组织炎症进展及致病物质的蓄积,降低神经细胞损伤。例如,人参皂苷Rg1抑制脑卒中后小胶质细胞向M1型(促炎型)转变,降低白细胞介素-6(interleukin-6,IL-6)、IL-1β及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎因子的表达;人参皂苷Rg1可以减轻帕金森症患者α-突触核蛋白的异常增加,促进小胶质细胞由M1型向M2型(抗炎型)转化,从而缓解炎症对神经细胞的损害[110];人参皂苷Rg1通过PPARγ/β-淀粉样蛋白裂解酶-1通路降低β-淀粉样蛋白质在脑内的沉积及Tau蛋白过度磷酸化[111-112]。
7.2 调节神经递质代谢酶的活性
神经递质是CNS行使功能的重要介质,也是研究人参及其制品治疗CNS相关疾病作用机制的重要组成部分[97]。GS、GAD和AchE等大量酶参与了神经递质的代谢过程,人参可通过调节代谢酶的活性,从而对神经递质的合成、降解产生调控作用。
三羧酸循环(tricarboxylic acid cycle,TCA)循环产物α-KG在谷氨酸脱氢酶的催化下可生成Glu,Glu经GS催化可代谢成Gln,Gln与Glu可以相互转化;Glu在GAD作用下又可转化成GABA。在“Gln-Glu-GABA”的体内转化体系中,Glu、GABA分别属于兴奋性和抑制性神经递质,而人参对二者均有一定的调控作用。人参常以方剂的形式运用到临床当中,1项纳入116例不寐证兼焦虑抑郁症患者的临床研究显示,归脾汤可以显著改善患者的睡眠质量、抑郁症负面情绪[113],其机制可能与降低脑内Glu浓度有关[114];开心散对老年焦虑症患者具有显著疗效,且配合化学药后效果更佳,其机制可能与调节脑内GABA、5-HT等神经递质有关[115]。人参皂苷Rg1可诱导GLT-1表达的上调,促进星形胶质细胞对胞外Glu的摄取[51];人参皂苷Rb1可提高小鼠皮层、海马体及星形胶质细胞GS的表达,催化Glu转化为Gln[53-54]。这提示在2种皂苷配伍给药或给予人参总皂苷的情况下,可以通过促进摄取、加快代谢的方式清除多余的Glu,从而避免神经细胞微环境Glu的过度蓄积及其带来的细胞损害[32]。另一方面,人参皂苷Rb3、Rg5或Rk1等可以促进Glu转化为GABA,提高脑组织中GABA相关受体的表达[57,59],从而抑制多种GABA能神经激活紊乱而导致的精神疾病。
神经细胞的ACh由胆碱、乙酰辅酶A(acetyl coenzyme A,CoA)在ChAT的催化下生成,并经由AchE降解而失活。ACh能神经在神经系统中分布广泛且与机体认知能力密切相关,因而常有研究者开发AchE靶向药物[116],如益智治呆方、益气聪明汤或灯盏生脉胶囊联合多奈哌齐可以在显著降低AD患者血清中AchE水平的基础上,降低中医症状积分、焦虑量表评分或提高认知能力评分,对CNS疾病进展起到了一定的缓解作用[117-119]。ACh的生成减少或降解异常均可引发疾病,药物可以调节脑组织内ACh水平,使其维持在适当的浓度范围内。对于ACh浓度低而导致疾病的机体而言,可以通过提高ChAT活性、抑制AchE活性等方式提高特定组织中ACh的水平,从而对疾病起到一定的治疗效果。研究表明,人参皂苷Rg2、Re、Rd和gintonin可上调小鼠大脑中ChAT的表达水平[19,63,66],人参皂苷Rg1、Rg2和Rb1等对AchE具有抑制效果[63,67-69],这说明人参能在提高ChAT活性的同时抑制AchE的活性[65]。人参皂苷既促进了ACh的生成,又延缓了ACh的代谢失活速率,有利于维持胆碱能神经的正常生理功能。
7.3 调节脑内神经递质的释放
突触前神经细胞产生的神经递质需要在特定条件下释放并作用于突触后细胞方能完成神经信号传递并产生一定的生理效应。人参可以通过多种机制促进神经递质的释放。一是调节第2信使,如人参皂苷CK可以通过调节神经细胞钙库来提高突触末端的Ca2+,诱导GABA的释放[58]。二是蛋白靶点相互作用,如人参皂苷Rg1与钙/钙调蛋白依赖性蛋白激酶II具有一定的相互作用,可促进海马神经元Glu的释放[50];gintonin可以通过LPA受体激活而促进PC12细胞释放DA[81]。此外人参皂苷Rg1还可增加细胞囊泡神经递质填充量,提升神经细胞胞吐频率而上调脑组织中DA神经元的活力[80]。
7.4 脑外作用途径
BBB是由大脑毛细血管内皮细胞、星形胶质细胞和周细胞组成的毛细血管水平的生物屏障结构,对内源性/外源性物质均具有一定的限制作用,从而维持大脑组织内环境的稳定性及特殊性。在“受体- 配体”作用模式指导下,对于人参而言,可以跨过BBB的化学成分更容易引起研究者的兴趣并被业界所认可,如可以透过BBB的人参皂苷Rg1、Re、Rd或其代谢产物CK、PPD等被认为是人参治疗CNS疾病的重要组分[19,21-25]。需要注意的是,因为循环系统及药物代谢过程的存在,跨过BBB的人参化学成分几乎都经历了组织分布的过程而接触到大脑以外的器官/组织,即可能作用于脑外靶点而产生其他有利于CNS的药理作用;同时,不能跨过BBB的化学成分不能简单地等同于没有CNS疗效,因为除了生命活动所必须的营养物质可以跨过BBB以外,一些神经递质或其前体物质(NE、Gln和Trp等)也可进入循环系统并跨越BBB而与神经细胞接触[120],而人参化学成分可作用于分泌或代谢这些物质的组织、器官甚至细菌[72,83,91]。
肾上腺皮质、肾上腺髓质分别分泌类固醇类激素和儿茶酚胺(肾上腺素、NE等),可调节CNS及外周神经系统的激活,同时也是人参类药物的靶组织之一,如红参可以提高抑郁症患者血清中脱氢表雄酮的含量[121]。肾上腺素能显著提升心脏收缩力,加快心跳与血液流动速度,常在机体兴奋、紧张时大量释放。HPA轴过度激活会对神经系统造成损害,人参皂苷Rb1、人参皂苷代谢物M4等可以抑制HPA的激活,降低外周及中枢神经系统中肾上腺素的水平而有利于机体静息态的形成与保持[28,72]。NE可弥漫性地分布于CNS,其对神经系统活动的影响具有双向调节作用,具体以作用部位中优势受体而定,如NE蓄积会导致机体出现狂躁、争斗,而NE缺乏则导致机体表现出抑郁等症状。有趣的是,人参皂苷Rg1、Rb1可以提高抑郁小鼠皮质中NE的水平[83],人参皂苷Rb1、Re又可以降低应激状态小鼠皮质和下丘脑中NE的水平[72,86]。这说明人参对脑外源性神经递质具有“双向调节”的药理作用。临床研究显示,归脾汤联合中医情志护理可以在舍曲林片的疗效基础上,进一步降低抑郁症患者血清中NE的水平且未见不良反应,联合治疗效果显著优于化学药单独治疗组[122]。
此外,肠道微生物群及其代谢产物也会对神经系统疾病如AD产生影响[123],口服是经典的中药给药形式,如独参汤、参苓白术散等,这意味着来源于人参的多种化学成分可与肠道菌群发生充分的接触,从而可能对肠道菌群的结构及丰度产生影响。有研究表明人参可以调节肠道微生物多样性[124],人参皂苷Rg1对Trp代谢相关的肠道菌群具有调控作用,从而影响循环系统中Trp水平并干预脑内Trp代谢及其产物5-HT的水平[91-92]。
8 人参的不良反应
对于药食同源中药人参[125],一般认为其具有较高的安全性[126]。但是过量服用或者配伍失当也会导致不良反应的发生[127],且常累及神经系统、心血管系统等,如过量服用人参导致大脑皮层及垂体-肾上腺皮质系统过度激活而引发头晕、烦躁和失眠等,也可诱发心悸、呼吸急促、胃肠道不适甚至消化道出血等较为严重的毒性作用[97,128-129]。
研究表明,大鼠在连续口服人参或红参3周以上时,会导致部分大鼠出现流鼻血、失眠、大便干燥(含水量显著低于正常组)的症状,同时伴有血压升高、心率加快[130]。服药期间,大鼠下丘脑中DA、NE长期处于较高水平;而血清中ACTH、促甲状腺激素、三碘甲状腺原氨酸的含量则显著降低。同时,长期服用人参还导致大鼠血清中IL-6、TNF-α含量升高以及SOD、谷胱甘肽过氧物酶(glutathione peroxidase,GSH-Px)水平下降,以上结果验证了人参的不良反应与机体内分泌系统紊乱、炎症和氧化损伤等有关。
此外,人参化学成分对细胞色素P450酶(cytochrome P450,CYP)和尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyl transferase,UGTs)等药物代谢酶的诱导作用也是人参及其制剂引起不良反应的重要原因之一。在I相代谢酶方面,发酵人参提取物对CYP2C8、CYP2D6和CYP2C9具有抑制作用,人参皂苷Rb1和人参皂苷CK对CYP2C9均有抑制作用,其中CK还对CYP3A4有较强的抑制作用[131];在II相代谢酶方面,人参皂苷Rb1、Rc、Rd和Rg3等可以抑制UGT1A9的活性,而人参皂苷Re、CK和PPD等则对UGT1A3具有较强的抑制作用,人参皂苷Re、Rf、Rg1、Rh1、CK还对UGT1A1有抑制作用[131-132]。鉴于人参对药物代谢酶广泛的调控作用,临床上药物联用时需要加以考虑,如可经CYP3A4代谢的抗癌药伊立替康与人参联用时,伊立替康的体内代谢过程受到一定程度的抑制,可能会导致不良反应的发生[133]。
9 结语
神经系统疾病常伴有神经递质代谢的紊乱,充足的血流、氧气供应可以给大脑提供丰富的养料及能量代谢基础,这有利于神经细胞各项生理功能的正常运行,如神经递质的合成及代谢物的清除等。人参含有皂苷、多糖和多肽等成分,部分成分可以直接吸收入血甚至透过BBB而作用于CNS,肠道菌群也参与了人参化学成分的代谢过程,人参皂苷与肠道菌群的相互作用会以神经递质或其前体的形式通过“肠道菌群-肠-脑”轴干预不同种类的神经而影响CNS功能。
尽管多种人参化学成分已经被证明可以对神经递质代谢产生不同程度的影响,但是对于人参化学成分之间的配伍药理作用及其机制研究较少,不同成分在神经递质调节方面的协同效应尚未得到完整的阐释,这给人参“安神益智”的功效物质基础研究带来挑战。在不同脑区的神经递质代谢研究方面,尚缺乏动态、连续的有效监测手段,难以统筹人参化学成分的脑内分布信息与神经递质代谢的相关性。综上所述,结合化学成分的体内过程及神经递质的代谢过程有利于加深对人参药效物质基础的认识,但是不同人参化学成分之间的配伍关系尚不明确,进一步结合分子探针、质谱成像等示踪技术将有助于揭示其内在关联性。在聚焦于记忆、睡眠和情绪反应等大脑功能的前提下,通过对几个或几类神经递质的体内代谢过程进行研究,或有利于更好地阐释人参的功效组分。
利益冲突 所有作者均声明不存在利益冲突
[1]中国药典[S]. 一部. 2020: 8-9.
[2]吴昱杰, 刘建勋. 益气活血中药改善慢性心衰心气虚证作用机制研究进展 [J]. 中药药理与临床, 2021, 37(1): 234-239.
[3]谢靖, 梁华峰, 祁鸣, 等. 人参皂苷RH2对MCAO大鼠血管新生的调节 [J]. 中国病理生理杂志, 2018, 34(1): 112-117.
[4]于晓风, 李茂微, 邹敬韬, 等. 5年生种植人参对成年大鼠心功能和血流动力学的影响 [J]. 人参研究, 2014, 26(1): 2-5.
[5]叶康, 顾嘉霖, 高俊杰, 等. 中药人参治疗慢性心力衰竭的研究进展 [J]. 中西医结合心脑血管病杂志, 2017, 15(5): 559-562.
[6]Kim D G, Jang M, Choi S H,. Gintonin, a ginseng-derived exogenous lysophosphatidic acid receptor ligand, enhances blood-brain barrier permeability and brain delivery [J]., 2018, 114: 1325-1337.
[7]黄鑫, 王一凯, 修洋, 等. 解吸电喷雾电离飞行时间质谱成像分析大鼠脑组织中小分子神经化学物质的分布 [J]. 分析化学, 2022, 50(10): 1533-1541.
[8]李帅坪, 黄鑫, 张勇, 等. 红参皂苷组分对大鼠血浆中神经化学物质的影响 [J]. 中草药, 2017, 48(14): 2918-2924.
[9]史帧婷, 刘丽鸽, 韩梅, 等. 代谢组学在人参研究中的应用进展 [J]. 上海中医药杂志, 2022, 56(11): 84-90.
[10]罗国安, 梁琼麟, 王义明. 中药指纹图谱—质量评价、质量控制与新药研发 [M]. 北京: 化学工业出版社, 2009: 281-303.
[11]罗国安, 王义明, 梁琼麟. 中医药系统生物学 [M]. 北京: 科学出版社, 2011.
[12]肖盛元, 罗国安. 红参加工过程中人参皂苷化学反应HPLC/MS/MS研究 [J]. 中草药, 2005, 36(1): 40-43.
[13]李平亚, 冯浩, 刘金平, 等. 以人参为基源的创新药物研究与开发: 人参皂苷综合技术开发方案 [J]. 中草药, 2021, 52(17): 5350-5357.
[14]肖雪, 李军山, 张博, 等. 近红外光谱快速测定红参提取过程中5种人参皂苷成分含量 [J]. 南开大学学报: 自然科学版, 2017, 50(3): 44-48.
[15]高健, 吕邵娃. 人参化学成分及药理作用研究进展 [J]. 中医药导报, 2021, 27(1): 127-130.
[16]Li L, Luo G A, Liang Q L,. Rapid qualitative and quantitative analyses of Asian ginseng in adulterated American ginseng preparations by UPLC/Q-TOF-MS [J]., 2010, 52(1): 66-72.
[17]Liu Y, Gao Y, Li K X,. Pharmacokinetics and acetylcholine releasing effects of ginsenoside Rg1in hippocampus of beta-amyloid model rats [J]., 2019, 21(8): 772-781.
[18]Chen X J, Li H, Yang Q,. Ginsenoside compound K ameliorates Alzheimer’s disease in HT22 cells by adjusting energy metabolism [J]., 2019, 46(5): 5323-5332.
[19]Kim M S, Yu J M, Kim H J,. Ginsenoside Re and rd enhance the expression of cholinergic markers and neuronal differentiation in neuro-2a cells [J]., 2014, 37(5): 826-833.
[20]王佩瑶, 陈曦, 孟宪生, 等. 基于UPLC/TOF-MS的双龙方大鼠体内药代动力学研究 [J]. 中成药, 2011, 33(11): 1889-1895.
[21]Xue W, Gao Y, Xie P P,. Plasma and intracerebral pharmacokinetics and pharmacodynamics modeling for the acetylcholine releasing effect of ginsenoside Rg1in mPFC of Aβ model rats [J]., 2021, 23(3): 294-306.
[22]Chen F Y, Li C, Cao H Y,. Identification of adenylate kinase 5 as a protein target of ginsenosides in brain tissues using mass spectrometry-based drug affinity responsive target stability (DARTS) and cellular thermal shift assay (CETSA) techniques [J]., 2022, 70(8): 2741-2751.
[23]Song W, Guo Y, Jiang S,. Antidepressant effects of the ginsenoside metabolite compound K, assessed by behavioral despair test and chronic unpredictable mild stress model [J]., 2018, 43(7): 1371-1382.
[24]Zhang H T, Chen F Y, Xu S Y,. Protective effect of 20(S)-protopanaxadiol on D-gal-induced cognitively impaired mice based on its target protein brain-type creatine kinase [J]., 2023, 71(7): 3484-3496.
[25]Chen C, Wang L S, Cao F R,. Formulation of 20(S)-protopanaxadiol nanocrystals to improve oral bioavailability and brain delivery [J]., 2016, 497(1/2): 239-247.
[26]Tachikawa E, Kudo K, Hasegawa H,.inhibition of adrenal catecholamine secretion by steroidal metabolites of ginseng saponins [J]., 2003, 66(11): 2213-2221.
[27]刘伟, 刘永博, 王梓, 等. 人参的化学成分与转化机理研究进展 [J/OL]. 吉林农业大学学报 (2022-11-14). https://kns.cnki.net/kcms/detail/22.1100.S.20221111.0938. 002.html.
[28]Hasegawa E, Nakagawa S, Miyate Y,. Inhibitory effect of protopanaxatriol ginseng metabolite M4 on the production of corticosteroids in ACTH-stimulated bovine adrenal fasciculata cells [J]., 2013, 92(12): 687-693.
[29]刘云霄, 黄英如, 石一峰, 等. 人参皂苷Rg1对大鼠坐骨神经冷冻保存后SCs活性及异体移植后神经再生的影响 [J]. 中国实验方剂学杂志, 2022, 28(13): 52-61.
[30]高彦宇, 沈芳玲, 李永鑫, 等. 人参皂苷基本成分对细胞保护作用研究进展 [J]. 辽宁中医药大学学报, 2020, 22(11): 57-60.
[31]Li D, Ren J W, Sun J Q,. Anti-hypoxia effects of ginseng (Ginseng C. A. Meyer) oligopeptides in mice [J]., 2022, 20(7): 1447-1454.
[32]Hertz L. Intercellular metabolic compartmentation in the brain: Past, present and future [J]., 2004, 45(2/3): 285-296.
[33]姚泰, 赵志奇, 朱大年. 人体生理学 [M]. 第4版. 北京: 人民卫生出版社, 2015: 214-224.
[34]Dienel G A. Brain glucose metabolism: Integration of energetics with function [J]., 2019, 99(1): 949-1045.
[35]Sharma V, Singh T G, mannan A S. Therapeutic implications of glucose transporters (GLUT) in cerebral ischemia [J]., 2022, 47(8): 2173-2186.
[36]Lee H M, Lee O H, Kim K J,. Ginsenoside Rg1promotes glucose uptake through activated AMPK pathway in insulin-resistant muscle cells [J]., 2012, 26(7): 1017-1022.
[37]Gao Y, Yang M F, Su Y P,. Ginsenoside Re reduces insulin resistance through activation of PPAR-γ pathway and inhibition of TNF-α production [J]., 2013, 147(2): 509-516.
[38]Yu Y G, Herman P, Rothman D L,. Evaluating the gray and white matter energy budgets of human brain function [J]., 2018, 38(8): 1339-1353.
[39]Błaszczyk J W. Energy metabolism decline in the aging brain—Pathogenesis of neurodegenerative disorders [J]., 2020, 10(11): 450.
[40]Huang Q X, Lou T T, Lu J,. Major ginsenosides frompromote aerobic cellular respiration and SIRT1-mediated mitochondrial biosynthesis in cardiomyocytes and neurons [J]., 2022, 46(6): 759-770.
[41]杨俊杰, 赵大庆, 张婉迎, 等. 人参多糖对一次性力竭游泳大鼠红细胞功能恢复的影响 [J]. 中草药, 2019, 50(23): 5778-5784.
[42]Liu M C, Bai X Y, Yu S T,. Ginsenoside Re inhibits ROS/ASK-1 dependent mitochondrial apoptosis pathway and activation of Nrf2-antioxidant response in beta-amyloid-challenged SH-SY5Y cells [J]., 2019, 24(15): 2687.
[43]Gietzen D W. Brain signaling of indispensable amino acid deficiency [J]., 2021, 11(1): 191.
[44]Aguilar A, Mattos H, Carnicero B,. Metabolomic profiling reveals changes in amino acid and energy metabolism pathways in liver, intestine and brain of zebrafish exposed to different thermal conditions [J]., 2022, 9: 835379.
[45]Huang X, Wang R, Wang Y K,. Investigation on property differences of ginseng and American ginseng by spatial metabolomics of neurochemicals with desorption electrospray ionization mass spectrometry imaging [J]., 2023, 303: 116006.
[46]Errasti-Murugarren E, Palacín M. Heteromeric amino acid transporters in brain: From physiology to pathology [J]., 2022, 47(1): 23-36.
[47]Taraskina A, Ignatyeva O, Lisovaya D,. Effects of traumatic brain injury on the gut microbiota composition and serum amino acid profile in rats [J]., 2022, 11(9): 1409.
[48]Hallen A. Amino acid metabolism in mammalian brain: discovery and characterisation of mammalian ketimine reductase [D]. Sydney: Macquarie University, 2022.
[49]Kim D H, Kim D W, Jung B H,. Ginsenoside Rb2suppresses the glutamate-mediated oxidative stress and neuronal cell death in HT22 cells [J]., 2019, 43(2): 326-334.
[50]Liu Z J, Zhao M, Zhang Y,. Ginsenoside Rg1promotes glutamate release via a calcium/calmodulin-dependent protein kinase II-dependent signaling pathway [J]., 2010, 1333: 1-8.
[51]Zhu G, Wang Y, Li J,. Chronic treatment with ginsenoside Rg1 promotes memory and hippocampal long-term potentiation in middle-aged mice [J]., 2015, 292: 81-89.
[52]Jiang S, Fang D F, Chen Y. Involvement of-methyl--aspartic acid receptor and DL-α-amino-3-hydroxy-5- methyl-4-isoxazole propionic acid receptor in ginsenosides Rb1 and Rb3 against oxygen-glucose deprivation-induced injury in hippocampal slices from rat [J]., 2018, 101(3/4): 133-139.
[53]李娟, 柳钰书, 刘滢, 等. 人参皂苷Rb1经鼻给药对戊四唑慢性点燃小鼠的抗癫痫作用 [J]. 中国实验方剂学杂志, 2022, 28(24): 65-74.
[54]陈雪, 张慧明, 马青, 等. 人参皂苷Rb1治疗性给药的抗癫痫作用及机制研究 [J]. 西北药学杂志, 2021, 36(5): 739-745.
[55]Spiering M J. The discovery of GABA in the brain [J]., 2018, 293(49): 19159-19160.
[56]Prévot T, Sibille E. Altered GABA-mediated information processing and cognitive dysfunctions in depression and other brain disorders [J]., 2021, 26(1): 151-167.
[57]Shao J J, Zheng X Y, Qu L L,. Ginsenoside Rg5/Rk1 ameliorated sleep via regulating the GABAergic/ serotoninergic signaling pathway in a rodent model [J]., 2020, 11(2): 1245-1257.
[58]Bae M Y, Cho J H, Choi I S,. Compound K, a metabolite of ginsenosides, facilitates spontaneous GABA release onto CA3 pyramidal neurons [J]., 2010, 114(4): 1085-1096.
[59]Jiang S, Miao B, Song X J,. Inactivation of GABAAreceptor reduces ginsenoside Rb3neuroprotection in mouse hippocampal slices after oxygen-glucose deprivation [J]., 2011, 133(2): 914-916.
[60]Wang Y, Zhu D F, Chen Y H,. Metabonomics study of ginseng glycoproteins on improving sleep quality in mice [J]., 2019, 2019: 1-9.
[61]Lee B, Park J, Kwon S,. Effect of wild ginseng on scopolamine‐induced acetylcholine depletion in the rat hippocampus [J]., 2010, 62(2): 263-71.
[62]毕云枫, 陶伟明, 王溪竹, 等. 人参皂苷Rh1对AD小鼠认知障碍的改善作用 [J]. 食品工业科技, 2019, 40(24): 300-304.
[63]商崇智, 赵明亮. 人参皂苷Rg2对东莨菪碱诱导阿尔茨海默病小鼠学习记忆的影响 [J]. 中华实用诊断与治疗杂志, 2017, 31(5): 444-447.
[64]Shergill A. Ginseng and memory [J]., 1998, 4(2): 2-5.
[65]Jang S, Ahn J, Jo B,. Double-processed ginseng berry extracts enhance learning and memory in an Aβ42-induced Alzheimer’s mouse model [J]., 2019, 51(2): 160-168.
[66]Kim H J, Jung S W, Kim S Y,.ginseng as an adjuvant treatment for Alzheimer’s disease [J]., 2018, 42(4): 401-411.
[67]李海涛, 黄曦漫, 李玉, 等. 人参单体皂苷对桃蚜取食、解毒酶及乙酰胆碱酯酶活性的影响 [J]. 中国农业科技导报, 2019, 21(11): 103-110.
[68]Jiang Y Y, Gao H W, Turdu G. Traditional Chinese medicinal herbs as potential AChE inhibitors for anti-Alzheimer’s disease: A review [J]., 2017, 75: 50-61.
[69]An K S, Choi Y O, Lee S M,. Ginsenosides Rg5and Rk1 enriched cultured wild ginseng root extract bioconversion ofHLJG0702: Effect on scopolamine-induced memory dysfunction in mice [J]., 2019, 11(5): 1120.
[70]Choi R J, Roy A, Jung H J,. BACE1 molecular docking and anti-Alzheimer’s disease activities of ginsenosides [J]., 2016, 190: 219-230.
[71]Dimpfel W, Mariage P A, Panossian A G. Effects of red and white ginseng preparations on electrical activity of the brain in elderly subjects: A randomized, double-blind, placebo-controlled, three-armed cross-over study [J]., 2021, 14(3): 182.
[72]Lee S H, Hur J Y, Lee E J H,. Ginsenoside Rb1 modulates level of monoamine neurotransmitters in mice frontal cortex and cerebellum in response to immobilization stress [J]., 2012, 20(5): 482-486.
[73]耿艺娟, 孙梦桢, 赵进东, 等. 人参皂苷Rb1对MPTP诱导的神经元损伤和小鼠行为学异常的作用研究 [J]. 天然产物研究与开发, 2022, 34(5): 842-847.
[74]赵文学, 赵雨, 王伟楠, 等. 人参皂苷Rg1对LRRK2突变致帕金森病果蝇的治疗作用探讨 [J]. 食品研究与开发, 2019, 40(13): 33-39.
[75]刘家岐, 楚世峰, 张大永. 人参皂苷Rg1在帕金森病中的研究进展 [J]. 神经药理学报, 2018, 8(6): 33.
[76]李玉娟, 王香明, 王丹巧. 人参皂苷Rg1干预线虫帕金森病模型分子机制研究 [J]. 中国药业, 2013, 22(19): 4-7.
[77]郑敏, 将裕芸, 周畅, 等. 人参皂苷对衰老大鼠学习记忆和脑单胺类神经递质的影响 [J]. 宜春学院学报, 2013, 35(6): 68-71.
[78]Shi J, Xue W, Zhao W J,. Pharmacokinetics and dopamine/acetylcholine releasing effects of ginsenoside Re in hippocampus and mPFC of freely moving rats [J]., 2013, 34(2): 214-220.
[79]徐丽, 刘黎星, 陈文芳. 人参皂苷Rg1对PD模型大鼠纹状体多巴胺含量的影响及其机制探讨 [J]. 中国中药杂志, 2008, 33(15): 1856-1859.
[80]Zhou J L, Zhang J, Cao L J,. Ginsenoside Rg1modulates vesicular dopamine storage and release during exocytosis revealed with single-vesicle electrochemistry [J]., 2023, 59(21): 3087-3090.
[81]Hwang S H, Lee B H, Choi S H,. Gintonin, a novel ginseng-derived lysophosphatidic acid receptor ligand, stimulates neurotransmitter release [J]., 2015, 584: 356-361.
[82]Kim S K, Chung J H, Lee B C,. Influence ofon alpha-adrenergic receptor of benign prostatic hyperplasia [J]., 2014, 18(4): 179-186.
[83]王艳芳, 朱茂晶, 李敏敏, 等. 人参皂苷Rg1对CUMS+LPS致小鼠抑郁行为的改善作用及其机制 [J]. 烟台大学学报: 自然科学与工程版, 2021, 34(3): 308-314.
[84]张艺红, 刘智. 人参皂苷Rg1对冠心病大鼠的影响研究 [J]. 中国临床药理学杂志, 2020, 36(2): 133-136.
[85]陈东浪, 邹培源, 林铭健. 人参对心力衰竭患者心功能、神经内分泌因子影响的研究 [J]. 中国医药科学, 2020, 10(23): 100-102.
[86]Xu F F, He W F, Lu J C,. Effects of ginsenoside Re on the levels of brain monoamines transmitters and serum corticosterone in water immersion-restraint rats [J]., 2009, 21(5): 752-756.
[87]Wang G L, Wang Y P, Zheng J Y,. Monoaminergic and aminoacidergic receptors are involved in the antidepressant-like effect of ginsenoside Rb1in mouse hippocampus (CA3) and prefrontal cortex [J]., 2018, 1699: 44-53.
[88]Min Y K, Chung S H, Lee J S,. Red ginseng inhibits exercise-induced increase in 5-hydroxytryptamine synthesis and tryptophan hydroxylase expression in dorsal raphe of rats [J]., 2003, 93(2): 218-221.
[89]严晴山, 邓洪斌, 刘天培. 人参总皂甙对应激小鼠脑内5-羟色胺和5-羟吲哚乙酸的影响 [J]. 南京医学院学报, 1988, 8(2): 161-162.
[90]Xu Y P, Cui X Y, Liu Y T,. Ginsenoside Rg1promotes sleep in rats by modulating the noradrenergic system in the locus coeruleus and serotonergic system in the dorsal raphe nucleus [J]., 2019, 116: 109009.
[91]O'Mahony S M, Clarke G, Borre Y E,. Serotonin, tryptophan metabolism and the brain-gut-microbiome axis [J]., 2015, 277: 32-48.
[92]Chen Z J, Lin Y B, Zhou Q C,. Ginsenoside Rg1mitigates morphine dependence via regulation of gut microbiota, tryptophan metabolism, and serotonergic system function [J]., 2022, 150: 112935.
[93]刘昊, 徐爱军, 秦丽娟, 等. 人参皂苷Rb1对抑郁症大鼠海马5-HT及5-HT1A受体表达的影响 [J]. 时珍国医国药, 2014, 25(11): 2565-2567.
[94]Shin E J, Jeong J H, Nguyen B T,. Ginsenoside Re attenuates 8-OH-DPAT-induced serotonergic behaviors in mice via interactive modulation betweengene and Nrf2 [J]., 2023, 46(2): 281-296.
[95]Liu Q X, Wu H Y, Wang J J,. Effects of Shenmai Injection on the values of CO, SV, and EF in patients undergoing off-pump coronary artery bypass graft [J]., 2018, 97(10): e0085.
[96]Flanagan S D, DuPont W H, Caldwell L K,. The effects of a Korean ginseng, GINST15, on hypo-pituitary-adrenal and oxidative activity induced by intense work stress [J]., 2018, 21(1): 104-112.
[97]Jeong H G, Ko Y H, Oh S Y,. Effect of Korean Red Ginseng as an adjuvant treatment for women with residual symptoms of major depression [J]., 2015, 7(3): 330-336.
[98]Heo J H, Lee S T, Chu K,. An open-label trial of Korean red ginseng as an adjuvant treatment for cognitive impairment in patients with Alzheimer’s disease [J]., 2008, 15(8): 865-868.
[99]Onaolapo A, Obelawo A Y, Onaolapo O. Brain ageing, cognition and diet: A review of the emerging roles of food-based nootropics in mitigating age-related memory decline [J]., 2019, 12: 2-14.
[100]Namgung E, Kim J, Jeong H,. Effects of Korean red ginseng on human gray matter volume and cognitive function: A voxel-based morphometry study [J]., 2021, 36(2): e2767.
[101]张余, 张金聪, 迟凯扬, 等. 人参总皂甙对失眠症患者的交感神经皮肤反应影响的临床研究 [J]. 中外医学研究, 2016, 14(10): 4-6.
[102]Chen W J, Yao P F, Vong C T,. Ginseng: A bibliometric analysis of 40-year journey of global clinical trials [J]., 2021, 34: 187-197.
[103]Fan S S, Zhang Z P, Su H,.clinical trials: Current status and future perspectives [J]., 2020, 132: 110832.
[104]马福慧. 益智汤治疗血管性痴呆18例 [J]. 中国中医药现代远程教育, 2010, 8(15): 37.
[105]江涛, 刘雨坤, 方应杰. 人参滴丸对于脑卒中患者的治疗与临床相关性效果研究进展 [J]. 现代医学与健康研究电子杂志, 2017, 1(5): 57.
[106]刘倩倩, 樊官伟. 人参皂苷Rg3现代药理作用及作用机制的研究进展 [J]. 中西医结合心脑血管病杂志, 2022, 20(13): 2375-2381.
[107]Chen L B, Yao H, Chen X B,. Ginsenoside Rg1decreases oxidative stress and down-regulates Akt/mTOR signalling to attenuate cognitive impairment in mice and senescence of neural stem cells induced by-galactose [J]., 2018, 43(2): 430-440.
[108]胡晶晶, 范雪梅, 孟宪生, 等. 应用基因表达谱芯片研究中药复方对心肌梗死的药效机制 [J]. 辽宁中医药大学学报, 2014, 16(7): 79-82.
[109]徐燕, 孟雪, 赵文学, 等. 人参皂苷Re对帕金森病果蝇模型的脑神经保护作用机制 [J]. 中国中药杂志, 2023, 48(7): 1927-1935.
[110]龙俊鹏, 孙洋, 刘莎莎, 等. 人参皂苷Rg1的神经保护作用研究进展 [J]. 药学学报, 2023, 58(1): 21-26.
[111]Quan Q K, Li X, Feng J J,. Ginsenoside Rg1reduces β‑amyloid levels by inhibiting CD5K‑induced PPARγ phosphorylation in a neuron model of Alzheimer’s disease [J]., 2020: 3277-3288.
[112]Li F L, Wu X Q, Li J,. Ginsenoside Rg1ameliorates hippocampal long-term potentiation and memory in an Alzheimer’s disease model [J]., 2016, 13(6): 4904-4910.
[113]蔡晓. 归脾汤加减用于不寐证合并焦虑抑郁患者的效果观察 [J]. 实用中医内科杂志, 2019, 33(10): 34-36.
[114]刘亚芹. 人参及其复方抗抑郁症作用机制研究进展 [J]. 成都大学学报: 自然科学版, 2023, 42(1): 6-10.
[115]温苹, 刘明, 范越. 开心散合用代力新治疗老年焦虑症的临床观察 [J]. 中医药学报, 2015, 43(1): 111-112.
[116]Abbas K, Abbas K, Abbas K,. Interaction of nootropic drugs with neurotransmitter enzyme acetylcholinesterase: An insilico approach: A review [J]., 2021, 3(2): 33-45.
[117]省格丽, 胡琴, 阿布都沙拉木, 等. 益智治呆方对阿尔茨海默病乙酰胆碱酯酶和过氧化氢酶浓度的影响 [J]. 中华中医药学刊, 2022, 40(1): 22-25.
[118]亢文生, 陈艳, 张美云. 益气聪明汤联合盐酸多奈哌齐片治疗阿尔茨海默病患者的效果 [J]. 中国民康医学, 2021, 33(5): 92-94.
[119]徐敏, 黄攀, 何晓英. 灯盏生脉胶囊联合盐酸多奈哌齐治疗阿尔茨海默病的临床研究 [J]. 卒中与神经疾病, 2020, 27(4): 479-483.
[120]钟凯龙, 洪浩. 血脑屏障转运体研究现状 [J]. 北方药学, 2015, 12(8): 83-85.
[121]Lee K J, Ji G E. The effect of fermented red ginseng on depression is mediated by lipids [J]., 2014, 17(1): 7-15.
[122]王晓歌, 周斌. 归脾汤联合中医情志护理对成人抑郁症患者血清5-羟色胺和去甲肾上腺素水平的影响 [J]. 河南中医, 2019, 39(8): 1213-1216.
[123]孙孟艳, 秦合伟, 王梦楠, 等. 基于肠道微生物群探讨阿尔茨海默病认知障碍的中医辨治 [J]. 中医学报, 2022, 37(11): 2337-2342.
[124]李昶, 雷天荣, 王思明, 等. 人参蛋白对阿尔茨海默病小鼠肠道菌群及BDNF/TrkB信号通路的影响 [J]. 中成药, 2023, 45(4): 1319-1323.
[125]缪冬瑞, 李家劼, 李丹阳, 等. 药食两用中药抗肝损伤作用及辨证施食规律分析 [J]. 中国医药导刊, 2021, 23(8): 569-573.
[126]杨明, 林贺, 陈声武, 等. 关于人参列入药食两用原料安全性毒理学评价 [DB/OL]. [2010-12-28]. https://kns. cnki.net/kcms2/article/abstract?v=IUBLoWpfHZF69yISSSqulF5Yl1MFzjAJcQYGyg6AWHQ2zKvnzy55GpXsCz5sgqden9QVdcvec06Sc07UfeX1UjhsLr6E_UflfRpkFpDuoU6_Qx9HC2WflAS_17iJqFSLoAE70nDfZRBskoaGUuk1iw==&uniplatform=NZKPT&language=CHS.
[127]马莹慧, 朱鹤云, 郭淑英, 等. 基于中药十八反理论的人参藜芦药对吸收转运研究 [J]. 时珍国医国药, 2020, 31(4): 809-812.
[128]府明棣, 叶进. 人参不良反应之探析 [J]. 辽宁中医杂志, 2015, 42(6): 1214-1215.
[129]吴宿慧, 郭璐璐, 李寒冰. 人参杀人无过大黄救人无功之初探 [J]. 中国中医药现代远程教育, 2022, 20(14): 65-67.
[130]Ran X K, Dou D Q, Chen H Y,. The correlations of adverse effect and tonifying effect of ginseng medicines [J]., 2022, 291: 115113.
[131]张雪, 杨长青. 人参活性成分对药物代谢酶和转运体的调控作用研究进展 [J]. 广东化工, 2022, 49(4): 105-108.
[132]刘新豫, 吕侠, 吴敬敬, 等. 胆红素代谢酶UGT1A1介导的中药不良反应研究进展 [J]. 药物评价研究, 2018, 41(5): 716-726.
[133]朱延焱, 冯炎林, 梅紫薇, 等. 伊立替康与人参的相互作用研究 [J]. 中国现代应用药学, 2021, 38(13): 1582-1587.
Research progress onin regulation of neurotransmitter metabolism
LU Zeng-hui1, ZHENG Qing-yan2, Cheung Suet1, HAN Qiang1, LIANG Qiong-lin1
1. Institute of Traditional Chinese Medicine-X, State Administration of Traditional Chinese Medicine Third-level Laboratory of Traditional Chinese Medicine Chemistry, Chinese Medicine Modernization Research Center, Tsinghua University, Beijing 100084, China 2. Ancient Han Group Traditional Chinese Medicine Co., Ltd., Hengyang 421003, China
Renshen (et) has the functions of invigorating primordial, tranquilization and intelligence-promoting, and its main pharmacodynamic constituents include triterpenoid saponins, polysaccharides, peptides, etc., which can be used in the treatment of central nervous system diseases. The chemical constituents and active metabolites ofethave a wide range of regulatory effects on the endogenous metabolism of neurotransmitters, such as amide acids, monoamines, acetylcholine, etc., including regulating the metabolic microenvironment in brain, directly acting on neurons by crossing the blood brain barrier and regulating the neuroendocrine network. Inspired by the theory of “tranquilization and intelligence-promoting”, this paper reviewed the main mechanism ofetregulating neurotransmitter metabolism in the brain by combining themetabolic process of the chemical compounds ofetand neurotransmitters, in order to provide a basis for further research onet.
et; neurotransmitter; endogenous metabolism; blood brain barrier; tranquilization and intelligence-promoting
R285
A
0253 - 2670(2023)21 - 7260 - 13
10.7501/j.issn.0253-2670.2023.21.034
2023-05-20
国家中医药管理局中医药创新团队及人才支持计划项目(ZYYCXTD-D-202208);国家重点研发计划项目(2017YFC0906902);国家重点研发计划项目(2022YFA1103403);国家自然科学基金青年科学基金项目(82204338)
卢增辉,研究实习员,从事中药药效物质基础及中药现代化研究。E-mail: lz0714@mail.tsinghua.edu.cn
通信作者:梁琼麟,教授,从事药物分析、药品质量与安全及中药现代化研究。E-mail: liangql@mail.tsinghua.edu.cn
[责任编辑 潘明佳]
