基于羊水脂质组学技术探索大黄对孕鼠生殖及胚胎发育影响*
2023-11-07李思颖房桦峰种莹徐建亚单进军
李思颖,房桦峰,种莹,徐建亚,单进军
(南京中医药大学中医儿科学研究所/江苏省儿童呼吸疾病(中医药)重点实验室 南京 210023)
大黄作为中药“四大金刚”之一,被广泛应用于内科、外科、儿科、皮肤科以及妇科等方面。但近年来,关于大黄各项毒性的报道层出不穷。学者们研究发现,大黄蒽醌类化合物(如大黄酸、大黄素)显示出了肝肾毒性以及生殖发育毒性[1-3];大黄水提物长期大剂量应用也会产生相关毒性[4]。何秋霞等[5-6]报道,大黄素对斑马鱼胚胎发育具有毒性作用;芦荟大黄素对未成熟斑马鱼胚胎具有致死作用。本课题组前期研究发现,重复给与大黄水提液(给药剂量为2 g·kg-1)14天,成年大鼠14天增重都有所降低,特别是雌性大鼠的14天增重及肾脏、子宫系数显著降低,给药组雄性大鼠精子数量明显减少;血清中谷草转氨酶(AST)、肌酸激酶(CK)显著降低。这些研究结果也提示,大黄可能会影响大鼠的生殖功能。大黄被列为妊娠禁忌中药中的慎用药,但目前对于妊娠禁忌中药界定还有很大争议,没有一个普遍认可的标准。鉴于中药是多成分复合体,每种成分的毒性不能完全代表中药整体的作用效果。基于高通量筛选平台的研究方法更适合中药安全性的综合评价,特别是代谢组学技术为发育毒性中药的筛查及机制的研究提供了新的手段。羊水能够反映胎儿的生理或病理状态,在胚胎发育的相关研究中具有优势;基于羊水的代谢组学可以更加精确地检测药物以及毒物等对胎儿的影响[7]。
关于大黄的毒性研究不少,但目前对大黄水提物的妊娠毒性及胚胎发育毒性的相关研究仍较少,其作用机制尚未明确。
基于此,本课题组通过拟羊水代谢组学的方法探索了大黄对大鼠的生殖发育的影响,讨论了孕期大黄用药的可行性以及大黄作为妊娠禁忌中药的依据。
1 材料与方法
1.1 动物
10周龄性成熟SD大鼠共30只,体质量300g左右;由南京市江宁区青龙山动物繁殖场提供,SPF级;实验动物合格证号:NO.201900840。饲养环境温度为(23±2)℃,湿度为(60%±10%),自由饮水进食。动物实验得到了南京中医药大学实验动物伦理委员会的批准,遵守实验动物福利及伦理(动物伦理批件号:201812A008)。
1.2 药物制备
生大黄饮片,购自江苏省中医院药房。
大黄水煎液的制备:大黄药材500 g,10倍水浸泡2 h,煮沸10 min,倒出药液;再加6倍水,煎煮10 min,合并药液,过滤,低温浓缩至浓度为0.2 g·L-1备用。
1.3 主要试剂与仪器
磷酸盐缓冲液(PBS):溶于超纯水中,定容1000 mL,用高压蒸汽灭菌器灭菌,氯化钠8.0 g,氯化钾0.2 g,磷酸氢二钠1.56 g,磷酸二氢钾0.1 g,在室温下冷却;甲基叔丁基醚(MTBE),购自美国ROE;内部标准:lysoPE(17:1)(批号:LM171LPE-11),SM(17:0)(批号:170SM-13),PE(17:0/17:0)(批号:LM170PE-19)从Avanti Polar Lipids公司购买;冰醋酸(批号:15080553613,纯度:99.5%)购自南京化学试剂有限公司。异丙醇、甲酸铵和乙酸铵均为99.8%的纯质谱,购自美国ROE公司;甲醇和乙腈为99.8%质谱,购自德国默克公司。
ALLegra64R高速冷冻离心机(Beckman,USA);Savant SPD1010真空离心浓缩器(Thermo Fisher Scientific,USA);U3000高效液相色谱仪(Dionex,USA);Q-Exactive四极杆-静电场Orbitrap高分辨率质谱仪(Thermo Fisher Scientific,USA);Xcalibur 2.1SP1数据处理系统(Thermo Fisher Scientific,USA)。
1.4 分组及给药
性成熟SD大鼠(雌性20只,雄性10只),适应性饲养1周后,每天20:00,雌、雄鼠(2:1)合笼交配,次日8:00,精子涂片,见精子者确定为已交配,定为妊娠0天(GD0)。确认交配的雌鼠随机分成空白对照组(CK组)和大黄水提物组(DH组),每组8只。大黄水提物组按每100 g体质量1 mL药液,于GD6-16天灌胃给药每日给药1次,剂量为2 g·kg-1体质量;空白组给予等体积饮用水。
1.5 观察指标及方法
1.5.1 一般状态观察
给药期间观察孕鼠的活动、有无阴道出血或者流产等现象。
1.5.2 指标检测
孕大鼠于GD17麻醉后取血,血清样本隔日送至南京市东南大学中大附属医院检测谷草转氨酶(AST)、谷丙转氨酶(ALT)、肌酸激酶(CK)、肌酐(Cr)以及尿素氮(BUN)的含量。解剖后采集母鼠的心脏、肝脏、肾脏、卵巢及胎盘用于病理检测,组织经10%福尔马林固定;48 h后送检,常规石蜡包埋,切片厚4-5 µm,HE染色,病理专业人员阅片,根据病变轻重程度,依次半定量为极轻度“±”、轻度“+”、中度“++”、重度“+++”而无病变组织标记为“-”。取羊水用于脂质组学检测;同时记录活胎数、吸收胎、早死胎(晚死胎),三者总和计数为胚胎植入数。采用诱导低温法处死活胎后,逐个测量体质量,鉴定外观畸形。实验结束后分别统计各组母体受孕率,胎仔活胎率、吸收胎率、早死胎率、平均活胎体质量以及外观畸形率。
1.5.3 羊水代谢组学检测
(1)羊水LC-MS前处理
500 µL羊水冻干后,用200 µL或160 µL纯净水复溶。复溶后羊水取80 µL于1.5 mL的离心管中,加入含内标[lyso PE(17:1),SM(17:0),PE(17:0/17:0)]的冰甲醇溶液225 µL,涡旋10 s,加入冰甲基叔丁基醚(MTBE)750 µL,涡旋10 s后于4℃震荡10 min后加入冰超纯水188 µL,涡旋20 s后于4℃,14000 r·min-1离心2 min,吸取上清液35 0µL至1.5 mL的离心管中(上层用于测脂质组);取下层水相110 µL至1.5 mL的离心管中(下层备用用于GC-MS法测极性物质);在离心浓缩仪中真空挥干,放置于-20℃待测。
(2)液相色谱质谱条件
液相色谱质谱条件参考相关文献[8]为了检测脂质,通过梯度洗脱将2 µL等份试样溶液注入维持在60℃的反相Waters Acquity UPLCCSHC18(100 mm×2.1 mm,1.7 m)上。流动相A为水:ACN(6:4),流动相B为异丙醇:ACN(9:1),均含有10 mmol·L-1甲酸铵和0.1%甲酸。流速为0.3 mL·min-1,洗脱梯度如下:0-4.0 min,15% B;4.0-5.0 min,15%-48% B;5.0-22.0 min,48%-82% B;22.0-23.0 min,82%-99% B;23.0-24.0 min,99% B;24.0-24.2 min,99%-15% B;24.2-30.0 min,15% B。施加的离子源和离子转移参数如下:喷雾电压3.5 kV(正)和3.0 kV(负)。对于这两种电离模式,鞘气、辅助气、毛细管温度和加热器温度分别保持在35、15(任意单位),325℃和300℃。
1.6 数据统计
数据采用SPSS 19.0统计软件进行处理分析。两组连续性计量数据采用独立样本T检验比较。Kruskal-Willis H(K)检验用于胎仔活胎率,吸收胎率、早死胎率及先天畸形率的分析。其中胎仔体质量的统计检验采用嵌套设计(胎仔嵌套于窝,窝嵌套于组)方差分析,即先计算每窝胎仔均数,再以窝均数计算每组均数。数据以均值±标准差(±s)表示,P<0.05表示有统计学差异。
脂质注释后,建立了一个小型数据库,其中包含脂质名称,保留时间(RT)和准确的质荷比(m/z)。使用ABF转换器(可从http://www.reifycs.com/AbfConverter访问)将从Xcalibur 2.2软件(Thermo Scientific)获得的原始数据文件转换为ABF格式。对于数据处理,使用了MS-DIAL(V.2.78)软件程序。在这项研究中,只有定义为m/z-RT对的脂质特征才能针对相同的脂质进行比对。生成的高质量时间校准检验脂质的输出数据表及其相应的RT,m/z和每个样品的峰面积均经过了进一步的统计分析[8]。
使用MetaboAnalyst 5.0(http://www.metaboanalyst.ca)进行多变量分析。使用基于R语言的LOESS(局部加权回归)归一化数据矩阵[9-10]。进行了无偏差主成分分析PCA和偏最小二乘法分析OPLS-DA,并使用置换策略进行了模型评估。通过U检验和FDR校准选择差异脂质,P<0.05,FDR<0.4。
2 结果
2.1 孕鼠一般情况
给药期间孕鼠的活动、行为无异常表现,未发现阴道出血、流产等现象;正常组的3只孕大鼠于GD17解剖前发现已经或者正在生产,可能是前期受孕日判断有误。
2.2 孕鼠血清生化指标
如表1所示,与对照组相比,大黄组孕大鼠ALT显著升高(P<0.01);其余各项生化指标与对照组均无显著性差异。
表1 孕大鼠血清生化结果(±s,n=8)
注:与CK组比较,**P<0.01。
组别CK组DH组剂量(g·kg-1)-2 ALT(IU·L-1)44.88±7.32 58.00±7.05**AST(IU·L-1)97.14±17.86 114.50±16.43 CK(IU·L-1)473.71±166.66 497.20±187.95 BUNmmol·L-1 4.71±0.87 4.83±0.94 Crµmol·L-1 26.13±2.23 23.63±3.02
2.3 孕鼠组织病理学结果
组织病理学检查结果表明,与对照组相比,大黄组孕大鼠心、肝、肾、卵巢无明显的与药物有因果关系的病理性损伤。但是大黄组两例胎盘有重度瘀血(图1),这两例对应于没有活胎,只有吸收胎和早死胎的两只孕大鼠。

图1 给药11天后孕鼠胎盘组织病理变化(200×)
2.4 对孕鼠妊娠及胚胎发育的影响
如表2所示,与CK组比较,DH组的活胎数率显著降低,吸收胎及早死胎率显著升高(P<0.05);DH组窝胎仔体质量也显著低于CK组(P<0.01);外观畸形率也低于CK组,但无显著差异。
表2 大黄水提物对大鼠妊娠及胚胎发育的影响(±s,n=8)

表2 大黄水提物对大鼠妊娠及胚胎发育的影响(±s,n=8)
注:与CK组比较,*P<0.05,**P<0.01。
组别CK DH-2 g·kg-1受孕率(%)100%100%着床数104 111活胎数/率(%)104(100%)71(64%)*吸收胎数/率(%)0(0)18(16.2%) *早死胎数/率(%)0(0)22(19.8%) *胎仔体质量(g)0.94±0.06 0.78±0.05**外观畸形率(%)0 5.6
2.5 羊水代谢组学结果
2.5.1 羊水中脂质成分的分析
对照组和大黄组的样品通过混合四极杆活性Orbitrap质谱(UHPLC-Q-Exactive Orbitrap MS)进行检测。样品以正离子和负离子模式随机分配。使用MS-DIAL软件和超过200000个MS/MS光谱的LipidBlast数据库分析了原始数据。图2A和图2B分别显示了在正离子模式和负离子模式下不同时间段的总离子流图(TIC)。与公共LipidBlast文库的准确质量数和MS/MS匹配用于脂质注释和鉴定。
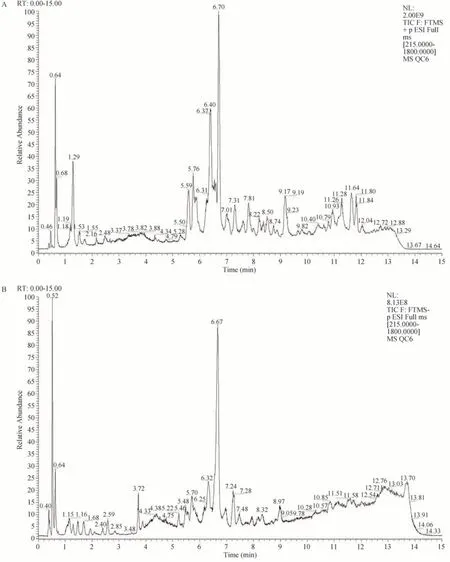
图2 MS-DIAL软件中大鼠羊水QC样品的典型脂质总离子流(TIC)
431种脂质分子以阳离子模式被包被,主要涉及以下类别:心磷脂(CAR);胆固醇酯(CE);神经酰胺(CER);二酰基甘油(DG);溶血磷脂酰胆碱(lysoPC);溶血磷脂酰乙醇胺(lysoPE),磷脂酰胆碱(PC)磷脂酰乙醇胺(PE);磷脂酰肌醇(PI);磷脂酰丝氨酸(PS);磷脂酰丝氨酸(PS);鞘磷脂(SM)和甘油三酸酯脂质,例如甘油三酸酯(TG)。
负离子模式覆盖了270种脂质,主要涉及以下类别:脂肪酸(FA)、溶血磷脂酰胆碱(lysoPC)、溶血磷脂酰乙醇胺(lysoPE)、磷脂酰胆碱(PC)磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)、磷脂酰丝氨酸(PS)和鞘磷脂(SM)脂质。
2.5.2 UHPLC-Q-Exactive Orbitrap MS方法验证
本实验使用3种方法来监控实验操作误差并研究仪器的稳定性:①进入实验样品之前使用先进的10针QC样品平衡系统;②监测所有样品中内标物的峰高,以计算相对标准偏差(RSD);③每10个实验样品后注入空白溶剂样品和QC样品。
为了评估系统稳定性和可重复性,使用了不同的归一化方法来计算羊水的QC样品的RSD值。在正模式下,PQN归一化后的RSD值最小,为10.04%,但与没有任何归一化方法的结果相似。在负模式下,线性归一化后的RSD值最小,为7.011%。归一化后,QC样品在正电离和负电离中都聚集在一起。这表明LC-MS系统的稳定性在整个分析过程中都很好。
2.5.3 非靶向脂质组学代谢分析
在羊水脂质组学研究中,以正离子和负离子模式比较了CK组和DH组之间的羊水脂质代谢产物。通过无偏PCA(图3A,3B)和OPLS-DA(图4A,4B)分析了正离子和负离子模式下每组的数据集。每个点代表一个样本。本研究发现,在正离子和负离子模式下的OPLS-DA模型在1000个排列后适应性良好(在正离子模式下R2Y=0.877,在负离子模式下R2Y=0.997)和良好的预测(在正离子模式下Q2=0.649,在负离子模式下Q2=0.794);但可能存在过拟合的风险(P>0.05)(图4C,4D)。初步的PCA模型和OPLS-DA模型均显示,在正电离和负电离下,CK组和DH组中羊水的总体脂质变化具有较一致的分离。这提示CK组和DH组的羊水有代谢差异。

图3 两组羊水脂质分布的PCA评分图

图4 两组羊水脂质谱的OPLS-DA评分图和模型验证
2.5.4 脂质差异代谢物分析
用U-检验和FDR校正法测定CK组和DH组羊水的脂质差异。选择差异脂质的基础是P<0.05,FDR<0.4和CK和CP组的峰高(FC)的倍数变化>1.5。在正离子和负离子模式下,分别获得了13和31种差异脂质(表3和表4)。其中,图5A显示了5种在正离子模式下FC>2.0的脂质,例如PC、TG和PI。图5B显示了8种在负离子模式下FC>2的脂质,即PC,LPC,PI、PE和SM等。通过分析羊水中不同脂质的相对种类和变化趋势,本课题组发现,CK组和DH组之间存在着显著差异(P<0.05或P<0.01)。

图5 羊水中脂质明显改变的归一化峰强度图

表3 羊水中差异代谢物(正离子模式)

表4 羊水中差异代谢物(负离子模式)
根据前25种差异脂质的峰高绘制热图(图6)。图中的每个正方形代表每组样品的相应强度,红色或蓝色分别代表浓度的增加或降低。颜色越深,代谢物浓度的增加/降低越强。差异脂质分别以正离子和负离子模式聚集。正离子模式下的差异脂质聚类,结果热图如图6A所示。从图中可以看出,CK组与DH组明显不同,被分为两个束。DH组羊水的代谢产物(LPC、TG、DG等)的水平显著高于对照组;而PC、CE、PI以及个别TG显著下调。负离子模式下的差异脂质聚类,结果热图如图6B所示。与正离子模式类似,以负离子模式分析的脂质进一步证明对照组和DH组之间存在显著差异,热图也分为两束。与CK组相比,DH组的多数PE呈下降趋势,而PC呈上升趋势。结果 提示,大黄给药后大鼠羊水中的脂质(如PI、PC、LPC、TG和PE等)可能代谢异常。

图6 羊水中鉴定出的前25种差异性脂质的热图
3 讨论与结论
本实验发现,大黄给药组活胎数明显减少,出现吸收胎、早死胎等不正常现象,表明妊娠期应用大黄,会造成孕鼠的的胚胎发育异常。与闫丽伟等[11]研究结果一致。本实验进一步采用LC-MS技术检测了羊水脂质组,共鉴定出701种脂质成分,正、负离子模式下分别有431、270种。差异分析显示,羊水脂质中主要有PI、PC、PE等磷脂及甘油三酯TG表现出代谢紊乱;大黄给药后胚胎发育的异常可能与这些脂质的代谢异常相关。
3.1 磷脂酰肌醇(PI)
PI是膜磷脂的重要组成,参与细胞膜的形成,脂质合成和细胞生长,在维持细胞形态和促进细胞分化中起到至关重要的作用[12]。细胞内肌醇衍生物主要分为磷脂酰肌醇(PI)、4-磷酸磷脂酰肌醇(PIP)和4,5-二磷酸脂酰肌醇(PIP2)[13],参与不同的生物代谢途径,行使其功能。发育中的中枢神经系统、骨骼肌和心肌中的高肌醇浓度强调了胚胎对这种营养素的高需求[14]。有研究发现PI(4,5)P2即4,5-二磷酸磷脂酰肌醇是神经系统发育的重要调节因子[15-17]。PI(4,5)P2通过产生脂质第二信使如二酰基甘油(DG)和1,4,5-三磷酸肌醇(IP3)[18]以及3,4,5-三磷酸磷脂酰肌醇,进一步调节细胞功能,参与肌动蛋白细胞骨架重组、膜运输、细胞黏附、离子转运蛋白及通道的活性和凋亡等过程,参与细胞生长、存活和凋亡[19],从而调节神经系统的发育。PI(4,5)P2局部浓度的高低,对不同的细胞通路及细胞功能至关重要[20-21]。在围孕期补充肌醇可能会降低胎儿受神经管缺陷(NTD)影响的复发风险,胚胎摄取肌醇对胚胎发育至关重要[22]。本研究发现,大黄干预后,羊水中PI浓度下降,可能大黄抑制了PI的合成和分泌,这可能是其引起胚胎吸收和早期死亡的重要原因。
3.2 磷脂酰胆碱(PC)
PC也是真核细胞膜磷脂的重要组成。PC是神经突起生长和神经元再生的重要分子[23],如果在体内的生物合成受影响,在胚胎后发育中表现出严重的生长缺陷[24]。PC分子具有多样性和复杂性,其中最丰富的磷脂种类是PC(16:0/16:0),也称为二棕榈酰卵磷脂(DPPC)。DPPC与多种疾病有关。DPPC可能通过掺入质膜并影响细胞膜的流动性来抑制由气道上皮细胞和细胞因子的产生[25]。有研究表明[26],循环PC水平与心血管事件呈正相关;含饱和脂肪酰链和单不饱和脂肪酰链的PC与心因死亡率高度正相关;而含有高度不饱和脂肪酰的PC具有心血管保护作用[27]。本实验中本课题组发现大黄干预后,羊水中循环PC包括含单不饱和脂肪酰链的PC如PC 32:1,PC 36:1等含量显著高于正常对照组;但高度不饱和的PC如PC 40:9含量反而下降。实验结果提示,大黄可能通过改变循环PC以及高度不饱和PC的水平,影响胚胎心血管系统的发育。
3.3 磷脂酰乙醇胺(PE)
PE是磷脂的一种,又称脑磷脂,可以改善记忆力并对肝硬化,或动脉粥样硬化等疾病有调控作用,主要组成成分为脂肪酸和乙醇胺[28]。有研究表明,脑磷脂合成主要器官是大脑,提示其在脑组织中含量丰富,其是脑细胞膜的重要组成部分,许多基本生命过程均与脑细胞膜有关[29]。在保健品中添加脑磷脂,可以改良大脑,智力也会得到一定程度的提升[30]。也有研究发现,脑磷脂的缺失可能会导致运动神经元疾病[31]。本实验中,大黄组磷脂酰乙醇胺PE下降,提示大黄可能通过改变PE水平,影响胚胎脑组织发育。
3.4 甘油三脂(TG)
TG体内储量最大,是产能最多的能源物质,也是胎儿生长的重要因素。怀孕早期,胎儿无法合成脂质。胎儿的脂肪生成始于妊娠足月的肝脏和脂肪组织[32]。有研究认为妊娠期母亲TG升高似乎会增加先兆子痫和早产的风险[33]。另有研究发现小于胎龄(SGA)新生儿的TG升高[34],可能是由低密度脂蛋白(LPL)活性受损和随后的胎儿脂肪团发育造成的。羊水中关于TG的研究很少,Rodie等[35]研究了怀有hemoglobin Bart’s diseases胎儿孕妇的羊水脂质组时发现,代谢物TG较对照组有明显变化,而且不饱和程度高的TG主要呈下调趋势而饱和程度高的TG主要呈上调趋势。本实验研究结果也类似,与对照组相比,大黄干预后孕大鼠羊水中大量的TG也发生代谢异常,主要表现为含高不饱和脂肪酸(5个以上双键)的TG主要呈下调趋势,而含有饱和脂肪酸或低不饱合脂肪酸(4个以下双键)的TG主要呈上调趋势(见表3)。大黄引起羊水中TG代谢的紊乱,但不同TG之间的差别以及对胚胎发育的影响等,有待进一步研究。
3.5 其他
以往有研究表明,许多细胞毒性和DNA损伤剂会导致鞘磷脂(SM)水平发生显著变化[36]。本研究中,羊水中两种氧化型的长链SM在大黄干预后显著上调。SM是细胞膜的结构成分,其代谢产物调节生理和病理过程的多种细胞功能[37],包括在细胞生长、细胞周期、细胞死亡、细胞衰老、炎症、免疫反应、代谢、对应激刺激和自噬的反应等。SM也是神经发育和神经变性的驱动因素[38],SM在组织内堆积,严重者影响中枢神经系统,甚至危及生命[39]。SM在皮肤的屏障功能中也具有重要的作用[40]。本实验结果提示大黄可能通过干扰SM的代谢,对胚胎神经系统的发育及皮肤屏障功能产生不利的影响。
此外,本实验中发现大黄组羊水中溶血磷脂酰胆碱LPC 20:3/0:0显著升高。有研究发现LPC 20:3/0:0与雄性后代的头围有关,可能影响大脑的发育[41]。
3.6 结论
综上所述,本研究建立了一种利用UHPLC-QExactive Orbitrap MS高分辨率质谱分析羊水脂质组学的方法。利用MS-DIAL软件和LipidBlast数据库,本课题组分别鉴定了431种正离子模式和270种负离子模式的脂质。其主要成分为磷脂、鞘磷脂、脂肪酸及甘油三酯等。通过对脂质的鉴定和分析,发现大黄干预后可能导致孕鼠羊水脂质(如PI、PC等)代谢紊乱。鉴于脂质在胚胎发育中具有重要作用,推测脂质代谢的紊乱可能影响大鼠胚胎的正常发育。但是本课题组的研究还有较大的局限性:本实验属于非靶标脂质组学实验,鉴定的脂质进行了相对定量而非绝对量化;此外,上述推论尚缺乏药理毒理实验研究的证实,将来需进一步分析生物样本中的发育毒性相关脂质,探讨在细胞功能和病理生理中的作用。
