复方益生菌粉提高小鼠免疫力的实验研究
2023-11-07刘柘君刘振权孙文燕
刘柘君,刘振权,孙文燕
(1. 北京中医药大学 中医学院,北京 100029;2. 北京中医药大学 中药学院,北京 100029)
益生菌是指一类对人体有益处的微生物有机体,通常在人体肠道黏膜中定植,发挥维持肠道生态平衡、增强机体免疫力等重要作用[1]。随着研究不断深入,益生菌用于消化系统肿瘤患者和手术患者预后的辅助用药[2]。中医学者则通常立足于脏象气血理论,认为人体“正气存内,邪不可干”,此处的“正气”即机体抵御病邪的能力,即西医中的免疫力一词,治法多着眼于扶正祛邪、补中益气[3]。本研究根据《保健食品检验与评价技术规范》中有关增强免疫力的检测方法,研究复方益生菌粉增强小鼠免疫力的效果。
1 材料与方法
1.1 受试材料
鼠李糖乳杆菌R9639(活菌数2000亿CFU/g)、干酪乳杆菌Zhang(活菌数2000亿CFU/g)及植物乳杆菌P9(活菌数2000亿CFU/g)(北京科拓恒通),按照质量比4:2:4比例混合。
1.2 实验动物及给药
SPF级ICR雌性小鼠200只,体重18~22 g(北京维通利华),适应性饲养7 d后,随机分为A、B、C、D和E 5个大组,每大组再随机分为阴性对照组、低、中、高剂量组各10只,具体分组及各组实验项目见表1。

表1 动物分组
用纯净水配制浓度为0.21,0.42,1.25 mg/(kg·d)复方益生菌粉,对低、中、高3个剂量组小鼠进行灌胃,阴性对照组灌胃给予同等体积纯净水。每日给药1次,连续灌胃30 d后各组对应实验项目进行检测。
1.3 主要试剂和仪器
RPMI1640培养基(批号:SH30809.01,Hyclone);四季青胎牛血清(批号:11011-8611,浙江天杭);CCK8试剂盒(批号:CA1210,北京百瑞极);刀豆蛋白A (Con A,批号:C8110),Hank’s液,琼脂糖(批号:A8530),台盼蓝染色液(批号:C0040-50),Giemsa染液(批号:G1015)(北京索莱宝),NP40(批号:N8030);绵羊红细胞(SRBC,批号:HQ80073),鸡红细胞(批号:HQ80071)(鸿泉生物);文奇氏试剂(批号:H1025,上海源叶);乳酸脱氢酶(LDH)测定试剂盒(批号:A020-2,南京建成生物工程研究所)。
CO2培养箱(松下健康医疗器械);96孔板(美国康宁costar);倒置显微镜(日本OLYMPUS);油镜(日本OLYMPUS);低速离心机(北京北利时代);酶标仪(BIO-TEK)。
1.4 实验方法
1.4.1 小鼠体重差值及脏器/体重比 取小鼠胸腺和脾脏称重,计算小鼠体重、胸腺/体重比值及脾脏/体重比值。
1.4.2 小鼠体液免疫功能影响
1.4.2.1 血清溶血素半数溶血值(HC50)测定 于第31天对B组小鼠腹腔注射0.2 ml 的2 %(V/V)SRBC,并于注射后第4 d摘眼球取血,置入离心管,离心1 h后收取上层血清。将血清稀释300倍后取50 μl置于96孔板,依次加入25 μl 10 %(V/V)SRBC和50 μl已制备好的补体,37 ℃恒温培养箱30 min后终止反应并再次离心取0.05 ml上清,加文奇氏试剂0.15 ml作为样品。同时设半数溶血孔,取12.5 μl 10 %(V/V)SRBC,加文奇氏试剂至0.2 ml,各组试剂充分混合,放置10 min后,于540 nm下测定各孔A值。溶血素具体数值以半数溶血值(HC50)表示,按式(1)计算。
1.4.2.2 抗体生成细胞检测 将1 ml 压积SRBC加至5 ml空白小鼠血清中,于4 ℃冰箱放置30 min,离心取上清,-70 ℃保存作为补体待用。并于第31天对B组小鼠腹腔注射0.2 ml 的2 %(V/V)SRBC,注射后第4天处死各组小鼠并取出脾脏于Hank’s液中保存,磨碎脾脏筛网过滤并离心制成细胞悬液,细胞浓度调整为5×106个/ml,待用。将表层培养基加热溶解后置于45 ℃水浴保温,与等体积 2倍浓度的Hank’s液混匀后,以每管0.5 ml的容量分装于试管中,再加入50 µl的10 %(V/V)SRBC和20 µl脾细胞悬液,迅速混合,倾倒于已刷琼脂糖薄层的玻璃片上,待琼脂糖凝固,将玻片水平扣放在片架上放入CO2培养箱中继续孵育1.5 h,再加入已制备好补体,置于玻片凹槽内,培养1.5 h后,计数溶血空斑数。
1.4.3 小鼠细胞免疫功能影响
1.4.3.1 迟发型变态反应(DTH)测定 于第31天对A组每只小鼠腹腔注射0.2 ml 的2 %(V/V)SRBC,经4 d免疫后,精确测量小鼠的左后足趾厚度,并在测量部位皮下注射20 μl 20 %(V/V)SRBC再次致敏,经24 h再次免疫后,观察并再次测量小鼠的左后足趾厚度,计算首次致敏后和再次致敏后小鼠左后足趾厚度的差值,即通过足趾肿胀度表征DTH的程度。
1.4.3.2 ConA诱导的淋巴细胞转化试验 于第31天对C组小鼠处死后浸于75 %乙醇中灭菌10 min,并在无菌条件下取出脾脏,制备无菌脾细胞悬液并用RPMI1640不完全培养基调整细胞浓度为3×106个/ml,按照CCK8法测定淋巴细胞增殖情况,将脾细胞分两孔加入培养板,每孔200 μl,一孔加入15 μl ConA液,另一孔对照,在CO2培养箱中培养72 h,培养结束前4 h每孔吸取上清0.7 ml,加入100 μl不含牛血清的RPMI 1640培养基和10 μl CCK8,继续培养4 h,结束时加入1 ml酸性异丙醇,混匀后于450 nm下测定A值,计算加入ConA和未加入ConA各孔的A差值,按式(2)计算。
1.4.4 小鼠单核-巨噬细胞功能影响
1.4.4.1 碳廓清实验 取稀释后浓度为10 ml/kg印度墨汁,于第31天尾静脉注射E组小鼠,注射后开始计时,于注射后第2 min和第10 min分别眼眶取血20 μl,并分别与2 ml 0.1 % Na2CO3溶液混合均匀。于600 nm波长处检测吸光度值(A),称量小鼠肝重及脾重,并按式(3)(4)计算吞噬指数α。式中:K代表廓清指数;α代表吞噬指数。
1.4.4.2 小鼠腹腔巨噬细胞吞噬实验 于第31天将D组小鼠腹腔注射20 % SRBC 1 ml,并于0.5 h后处死小鼠并使其呈仰卧位,注射生理盐水洗液2 ml至小鼠腹腔,按揉腹部1 min后吸出生理盐水洗液1 ml,分别均匀的滴于2片载玻片上,移至37 ℃孵箱中孵育30 min。然后用生理盐水漂洗载玻片后干燥。在甲醇溶液中固定1 min后,用4 %的Giemsa进行染色3 min,用蒸馏水漂洗晾干。通过40×显微镜观察巨噬细胞的形态并计数,按式(5)(6)进行计算。
1.4.5 NK细胞活性
1.4.5.1 乳酸脱氢法(LDH)测定NK细胞活性 于第30天将靶细胞YAC-1传代培养并调整细胞浓度为4×105个/ml,并于第31天对C组小鼠处死后置于75 %乙醇中灭菌后无菌取脾镊子磨碎后筛网过滤、离心弃上清液,向细胞浆中加入0.5 ml灭菌水20 s,再加入Hank’s液清洗3次并离心,用1 ml含小牛血清的RPMI1640完全培养液重悬,测定活细胞数量为95 %以上后,用RPMI1640 完全培养基制成脾的单细胞悬液作为效应细胞,并调整细胞浓度为2×107个/ml,靶细胞和效应细胞比例约为50:1。取靶细胞和效应细胞溶液各50 µl,加入U型96孔板中,其中靶细胞自然释放孔中分别加入靶细胞和培养液各100 µl,靶细胞最大释放孔分别加靶细胞和1 % NP40各100 µl,均设3个平行孔,37 ℃CO2培养箱中培养4 h后,离心5 min,吸取上清100 µl铺于新的96孔板中,加入LDH基质液100 µl,室温反应10 min后,加入盐酸溶液(1 mol/L)30 µl终止反应,采用酶标仪490 nm处测定A值。按式(7)进行计算。
1.5 数据分析
应用SPSS19.0软件对以上符合正态分布的计量数据资料进行单因素方差分析和组间LSD检验,若数据资料不符合正态分布,则采用非参数检验统计学处理。结果以平均值±标准差(±s)表示,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 小鼠体重差值及脏器/体重比
小鼠体重差值及脏器/体重比 结果见表2。由表2可见,实验期间各组小鼠生长发育良好,体重随给药时间延长而增加,各剂量组与阴性对照组比较显示差异无统计学意义(P>0.05)。由图1可见,各剂量组小鼠胸腺/体重比值及脾脏/体重比值与阴性对照组相比差异无统计学意义(P>0.05)。结果表明,不同剂量的复方益生菌粉对小鼠体重和淋巴器官影响较小。
表2 复方益生菌粉对小鼠体重的影响 (±s,n=10)
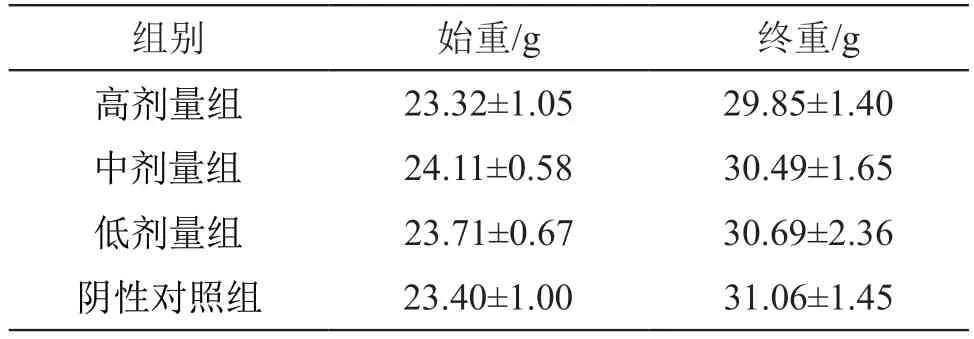
表2 复方益生菌粉对小鼠体重的影响 (±s,n=10)
组别 始重/g 终重/g高剂量组 23.32±1.05 29.85±1.40中剂量组 24.11±0.58 30.49±1.65低剂量组 23.71±0.67 30.69±2.36阴性对照组 23.40±1.00 31.06±1.45
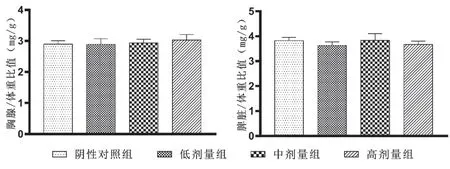
图1 复方益生菌对小鼠脏器/体重比值的影响
2.2 复方益生菌小鼠体液免疫功能影响
2.2.1 血清溶血素半数溶血值 结果见表3。由表3可见,低、中、高剂量组小鼠溶血素半数溶血值均高于阴性对照组,差异有统计学意义(P<0.01)。结果表明,复方益生菌能有效促进SRBC细胞发生溶血反应,提高产生溶血素的能力。
2.2.2 抗体生成细胞数 结果见表3。由表3可见,低、中、高剂量组小鼠的抗体生成细胞数均高于阴性对照组,差异有统计学意义(P<0.01)。结果表明,复方益生菌能有效增加小鼠抗体生成细胞的数量。
表3 复方益生菌粉对小鼠体液免疫的影响(±s,n=10)
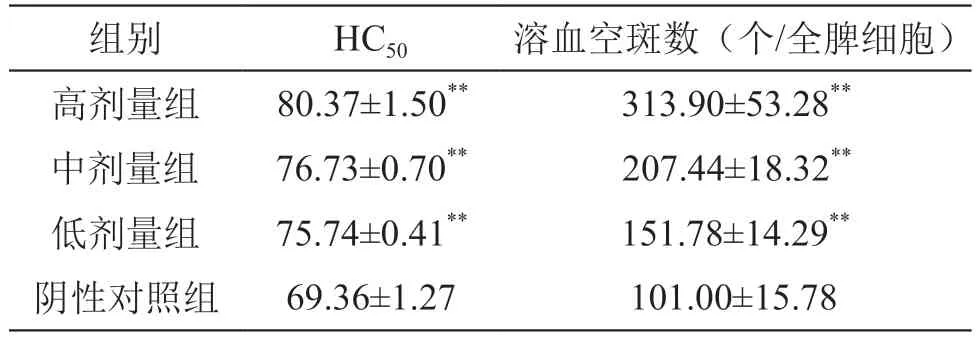
表3 复方益生菌粉对小鼠体液免疫的影响(±s,n=10)
注:**P<0.01 vs 阴性对照组
组别 HC50 溶血空斑数(个/全脾细胞)高剂量组 80.37±1.50** 313.90±53.28**中剂量组 76.73±0.70** 207.44±18.32**低剂量组 75.74±0.41** 151.78±14.29**阴性对照组 69.36±1.27 101.00±15.78
2.3 小鼠细胞免疫功能影响
2.3.1 迟发型变态反应 结果见表4。由表4可见,与阴性对照组相比低、中剂量组差异无统计学意义,而高剂量组小鼠的足趾肿胀程度差值显著性增大(P<0.01),因此可进一步猜测随着剂量再次增加,其淋巴细胞诱导的细胞免疫功能可能会一定程度的再次增强。
表4 复方益生菌粉对小鼠细胞免疫的影响(±s,n=10)
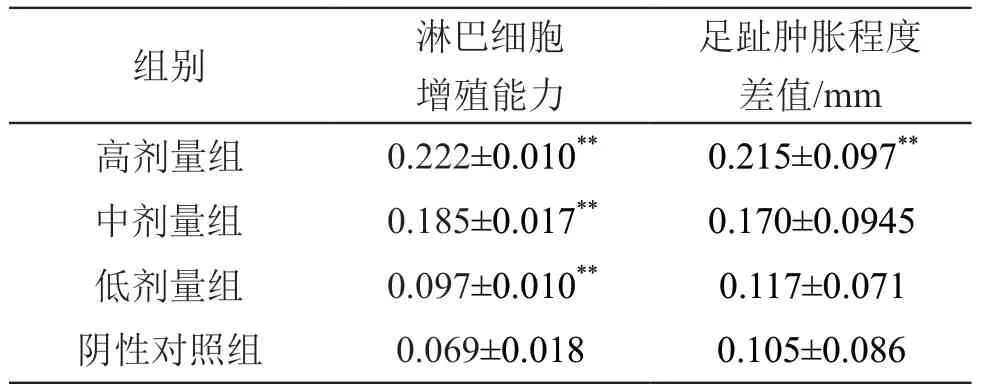
表4 复方益生菌粉对小鼠细胞免疫的影响(±s,n=10)
注:**P<0.01 vs 阴性对照组
足趾肿胀程度差值/mm高剂量组 0.222±0.010** 0.215±0.097**中剂量组 0.185±0.017** 0.170±0.0945低剂量组 0.097±0.010** 0.117±0.071阴性对照组 0.069±0.018 0.105±0.086组别 淋巴细胞增殖能力
2.3.2 淋巴细胞增殖能力 结果见表4。由表4可见,随着复方益生菌粉剂量的增加,低、中、高剂量组均能显著增加ConA诱导的小鼠淋巴细胞转化能力,促进淋巴细胞的增殖,低、中、高剂量组均高于阴性对照组,差异有统计学意义(P<0.01)。结果表明,复方益生菌能有效增强小鼠的淋巴细胞免疫功能。
2.4 复方益生菌小鼠单核-巨噬细胞功能影响
2.4.1 小鼠碳廓清功能 结果见表5。由表5可见,低、中、高剂量组小鼠吞噬指数均高于阴性对照组,差异有统计学意义(P<0.01)。结果表明,复方益生菌能针对小鼠的碳廓清功能有显著增强作用,提高小鼠单核-巨噬细胞吞噬能力。
表5 复方益生菌粉对小鼠单核-巨噬细胞功能的影响(±s,n=10)
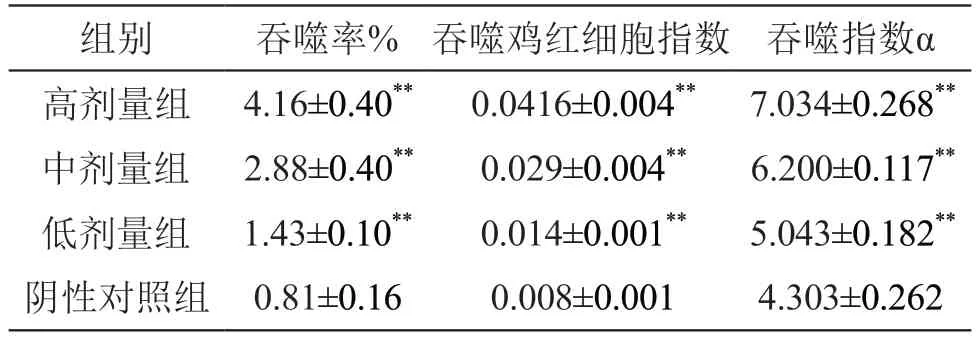
表5 复方益生菌粉对小鼠单核-巨噬细胞功能的影响(±s,n=10)
注:**P<0.01 vs 阴性对照组
组别 吞噬率% 吞噬鸡红细胞指数 吞噬指数α高剂量组 4.16±0.40** 0.0416±0.004** 7.034±0.268**中剂量组 2.88±0.40** 0.029±0.004** 6.200±0.117**低剂量组 1.43±0.10** 0.014±0.001** 5.043±0.182**阴性对照组 0.81±0.16 0.008±0.001 4.303±0.262
2.4.2 腹腔巨噬细胞吞噬鸡红细胞指数 结果见表5。由表5可见,低、中、高剂量组小鼠巨噬细胞的吞噬能力均高于阴性对照组,差异有统计学意义(P<0.01)。结果表明,复方益生菌能增强小鼠腹腔巨噬细胞的吞噬活性,提高小鼠单核-巨噬细胞的功能。
2.5 复方益生菌NK细胞活性
NK细胞活性结果见表6。由表6可见,低、中、高剂量组小鼠的NK细胞活性均高于阴性对照组,差异有显著性(P<0.01),复方益生菌能够增强小鼠的NK细胞活性,增强NK细胞功能。
表6 复方益生菌粉对小鼠NK细胞活性的影响(±s,n=10)

表6 复方益生菌粉对小鼠NK细胞活性的影响(±s,n=10)
注:**P<0.01 vs 阴性对照组
组别 细胞活性/%高剂量组 109.68±8.56**中剂量组 68.77±4.25**低剂量组 53.88±4.50**阴性对照组 34.94±4.28
3 结论与讨论
机体免疫功能的强弱与抗疾病能力的强弱及疾病的预后具有密不可分的联系[4-5]。单核-巨噬细胞和NK细胞主要参与非特异性免疫,T淋巴细胞主要参与细胞免疫,B淋巴细胞主要参与体液免疫,因此,以上细胞均在机体免疫反应过程中发挥重要作用[6],其变化与否及变化程度是评价益生菌对机体免疫调节作用的重要指标。本文根据《保健食品检验与评价技术规范》有关检测方法和判定标准,围绕单核-巨噬细胞功能、NK细胞活性、体液免疫和细胞免疫等方面,评价并验证复方益生菌粉对小鼠免疫功能的具体影响。
本文所用的复方益生菌粉由鼠李糖乳杆菌R9639、干酪乳杆菌Zhang和植物乳杆菌P9等3种益生菌菌株组成,菌株均为目前国内外重点开发的Lactobacillus属细菌,均能耐受酸性胃液、碱性肠液,进入肠道并成功黏附于肠黏膜,通过影响多种细胞因子的释放发挥抗炎等特性[7-9]。有研究表明,多种益生菌的复合搭配能更好地发挥益生菌本身的功能,促进CD8+T淋巴细胞和B淋巴细胞增殖转化,使前者发挥细胞毒作用释放穿孔素等细胞因子攻击病原微生物,使后者转化为浆细胞分泌sIgA使病原微生物失去黏附功能,发挥维护肠道平衡、增加肠道免疫功能的作用,从而加强机体先天性免疫反应和适应性免疫反应[10-12]。
本研究结果表明,各剂量复方益生菌对小鼠胸腺指数和脾脏指数无差异,初步明确了其安全性。体液免疫实验结果表明,低、中、高剂量的复方益生菌能使小鼠血清溶血素半数溶血值及抗体生成数显著增加;细胞免疫实验结果表明,高剂量复方益生菌能显著增强小鼠迟发型免疫反应和淋巴细胞增殖能力;单核-巨噬细胞免疫实验结果表明,低、中、高剂量复方益生菌能显著增强小鼠碳廓清功能和巨噬细胞吞噬活性;最后通过NK细胞实验表明,低、中、高剂量复方益生菌能显著增强小鼠NK细胞功能和活性。
综上所述,由3株益生菌组成的复合益生菌无明显毒性作用,对小鼠健康状态无显著负面影响,并能从体液免疫、细胞免疫、单核-腹腔巨噬细胞吞噬能力和NK细胞活性等4个方面起到增强免疫功能的作用,通过《保健食品检验与评价技术规范》中对增强免疫力实验结果判定标准的界定,认为该产品具有增强免疫力的作用,并为后续的开发和临床应用提供了新的理论依据。
