QuEChERS联用气相色谱法同时测定枸杞中21种拟除虫菊酯农药残留
2023-11-07李婷婷任兴权张诗琪杨雪芬孙姗姗
李婷婷 ,任兴权, 张诗琪 ,赵 俊,杨雪芬,史 蓉*,孙姗姗
(1. 酒泉市食品检验检测中心,甘肃 酒泉 735000;2. 中国食品药品检定研究院/国家市场监管重点实验室(食品质量与安全),北京 100050)
枸杞是一种食药同源的食材,每100 g干制品中总糖含量高于24.8 g、蛋白质含量高于10 g[1],且因含有铜、锌、铁、锰等微量元素[2-3]和枸杞多糖、甜菜碱、黄酮、类胡萝卜素等多种活性物质而具有较高的食用价值[4-5],在保健食品和新型食品开发方面表现突出[6-7]。枸杞作为甘肃省传统的道地药材,其种植面积逐年增长,产量提升明显,对当地经济发展起到了积极的促进作用[8]。
由于枸杞在栽培过程中易发生病虫害,拟除虫菊酯类农药因具有毒效较强、残效较短、广谱性高且对环境友好等特点,是其栽培过程中使用频率较高的一类杀虫剂[9]。近年,枸杞及其深加工产品中农药残留的暴露情况和膳食风险评估已引起较多关注[10-12]。虽然评估结果普遍表明,通过摄入枸杞中拟除虫菊酯类农药对人体产生的膳食风险目前处于可接受水平,但长期摄入农药残留量超标的枸杞给人体健康带来的危害仍不可忽视。在GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》[13]中,将鲜枸杞归类为浆果和其他小型类水果,规定了110余种农药及其代谢物的限量;将干枸杞归类为药用植物,规定了17种农药及其代谢物的限量;对以枸杞为主要原料的深加工产品中农药残留的限量暂无要求。在 NY/T 1051-2014《绿色食品 枸杞及枸杞制品》[14]中规定了枸杞鲜果、枸杞干果、枸杞原汁和枸杞原粉等绿色食品中15种农药的残留限量。
在已有报道中,枸杞及其制品中农药残留量的测定方法有固相萃取联用气相色谱法[15-16]、分散液液微萃取联用液相色谱法[17-18]、QuEChERS联用质谱法[19-20]、凝胶渗透色谱联用质谱法[21-22]和固相萃取联用质谱法[23-25],而QuEChERS联用气相色谱法测定枸杞及其制品中拟除虫菊酯类农药残留的报道较少。本文以鲜枸杞、干枸杞和枸杞原浆作为测试对象,建立QuEChERS联用气相色谱法测定21种拟除虫菊酯类农药残留量的方法,并对该方法中每种目标农药的基质效应进行评价。
1 仪器与试药
1.1 仪器
GC-2014C气相色谱仪(配有电子捕获检测器,日本岛津公司);TG16离心机(上海卢湘仪); MV5高通量平行浓缩仪(北京莱伯泰科);PL602E/02电子天平[梅特勒-托利多(上海)]。
1.2 试药
21种农药标准溶液(浓度均为100 μg/ml,溶剂均为正己烷,天津农业部环境保护科研检测所);正己烷和乙腈(色谱纯,德国Meker公司);乙二胺-N-丙基硅烷化硅胶(PSA,粒径40~60 μm)、十八烷基硅烷键合硅胶(C18,粒径40~60 μm)、石墨化碳黑(GCB,粒径40~120 μm)(上海麦克林);其余试剂均为国产分析纯;测试样品有鲜枸杞、干枸杞和枸杞原浆3类,均由酒泉市瓜州昊泰生物科技有限公司提供。样品粉碎混匀后,于-18 ℃冰箱中密封保存。
2 方法
2.1 色谱条件
色谱柱:DB-35毛细管色谱柱(30 m×0.32 mm,0.25 μm);进样口温度:280 ℃;进样方式:不分流进样;进样体积:1.0 μl;柱流量:1.2 ml/min;检测器温度:300 ℃;尾吹气流量为30 ml/min;柱温箱升温程序见表1。
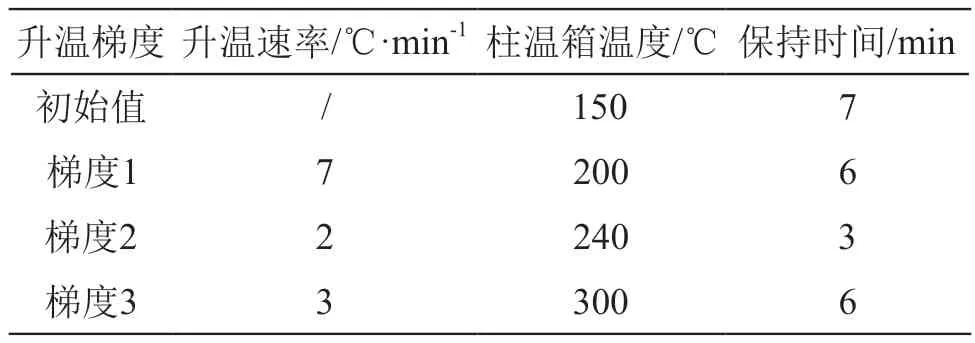
表1 柱温箱的升温程序
2.2 样品前处理方法及标准溶液配制
2.2.1 净化填料用量的选择 参照GB23200.113-2018《食品安全国家标准 植物源性食品中208种农药及其代谢物残留量的测定》[26]前处理方法中的QuEChERS净化技术,对PSA、C18和GCB的用量进行优化。分别向6.0 ml目标农药质量浓度均为0.05 μg/ml的样品提取溶液中加入方案1、方案2和方案3对应的填料净化,溶剂置换后上机分析。同时测定相同浓度的溶剂标液作为对照,通过比较目标农药的峰面积确定净化填料的用量。3种方案对应的净化填料用量见表2。
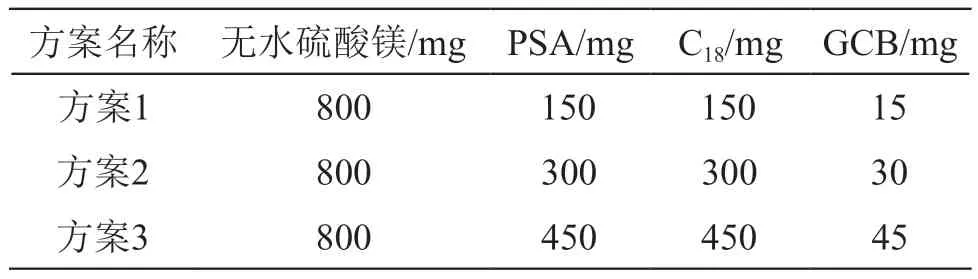
表2 3种方案的净化填料用量
2.2.2 样品前处理方法 准确称取5.00 g样品,置入50 ml离心管,干枸杞样品需加入10.0 ml水浸润30 min、鲜枸杞和枸杞浆不需要加水浸润,加入10.0 ml乙腈,2000 r/min涡旋提取5 min,加入1颗陶瓷均质子后再加入1.0 g柠檬酸钠、0.5 g柠檬酸氢二钠、6 g无水硫酸镁和1 g氯化钠,剧烈震荡1 min,4000 r/min离心5 min。于15 ml离心管中准确吸取上层有机相6.0 ml,并向其中加入800 mg无水硫酸镁、450 mg PSA、450 mg C18和45 mg GCB,2000 r/min涡旋1 min,8000 r/min离心5 min。取2.0 ml净化液置入试管,40 ℃下加氮气缓缓吹至近干后准确加入1.0 ml正己烷复溶,过0.22 μm有机滤膜,上机分析。
2.2.3 标准溶液配制 空白基质溶液:空白干枸杞样品经2.2.2项方法制得样品溶液,于4 ℃冰箱保存。
混合标准储备液:分别吸取α-六六六、五氯硝基苯、γ-六六六等21种拟除虫菊酯农药标准溶液各0.20 ml,用正己烷定容至10.0 ml,混匀,得到质量浓度为2.0 μg/ml的混合标准储备液,于-18 ℃冰箱中保存。
溶剂标准工作液:分别吸取0.025,0.125,0.25,1.25,2.50 ml混合标准储备液,用正己烷定容至5.0 ml,混匀,得到质量浓度分别为0.010,0.050,0.10,0.50,1.0 μg/ml的溶剂混标系列工作液(试剂标液),临用现配。
基质标准工作液:分别吸取0.025,0.125,0.25,1.25,2.50 ml混合标准储备液,用空白基质溶液定容至5.0 ml,混匀,得到质量浓度分别为0.010,0.050,0.10,0.50,1.0 μg/ml的溶剂混标系列工作液(基质标液),临用现配。
2.3 基质效应试验
在进行基质效应试验前,用空白基质溶液连续进样以饱和衬管上的活性位点,待连续进样时目标化合物的峰面积稳定后,依次在最优的仪器条件下进样试剂标液和基质标液。以目标农药的质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,通过比较基质匹配标准曲线和溶剂标准曲线的斜率来评价基质效应(ME)。
其中,km表示基质匹配标准曲线的斜率,ks质表示匹配标准曲线的斜率。
一般认为:当ME大于100 %,为基质增强效应;当ME小于100 %,为基质减弱效应;当ME位于-20 %~+20 %的范围内,基质效应不显著;当ME位于-50 %~-20 %或+20 %~+50 %的范围内,为较强基质效应,即基质效应显著;当ME大于+50 %或小于-50 %时,为强基质效应,即基质效应非常显著[28-29]。
2.4 加标回收试验
选取空白干枸杞作为测试样品,分别进行0.02,0.10和0.40 mg/kg 3个含量水平的加标回收试验。待测物的含量通过下式计算:
式中,X:待测物含量,mg/kg;C:样品测试溶液中待测物质量浓度,μg/ml;V1:提取溶剂体积,ml,V1=10.0 ml;V2:用于氮吹的净化液体积,ml,V2=2.0 ml;V3:样品测试溶液复溶体积,ml,V3=1.0 ml;m:称样质量,g;1000:单位换算系数;f:稀释倍数。
3 结果与讨论
3.1 柱温箱升温程序
通过降低柱温箱的升温速率和延长保持时间可使得性质相近的目标农药实现有效分离。在测定实际样品时,目标组分的保留时间与相应的标准物质的保留时间差应小于±0.05 min。21种拟除虫菊酯类农药标准物质的气相色谱图见图1。
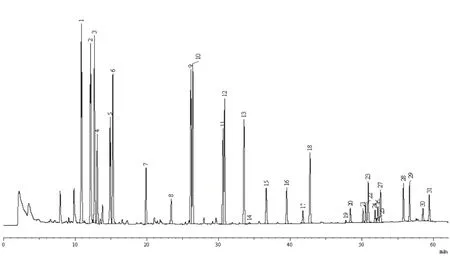
图1 标准物质的气相色谱图
3.2 净化填料用量
枸杞样品中糖、蛋白质等组分含量较高且样品提取溶液颜色较深,故应在前处理过程尽量降低样品测试溶液中基质的含量,进而消除基质效应对测定结果和分析仪器带来的不利影响。目标农药经3种净化方案和溶剂置换后的峰面积见图2。由图2可见,经不同净化方案得到的样品测试溶液中目标农药的峰面积与其相同质量浓度的试剂标液的峰面积比较呈不同的变化趋势。本文涉及的21种拟除虫菊酯农药中有15种目标农药经方案3净化后峰面积之比在80 %~120 %之间,有3种目标农药经方案3净化后的峰面积之比不在80 %~120 %范围内,其余3种目标农药经所有方案净化后的峰面积之比均不在80 %~120 %的范围内。因此,本实验选用方案3作为样品提取溶液净化的最佳选择,即当吸取的样品提取溶液体积为6.0 ml时,加入的PSA、C18和GCB的用量分别为450,450和45 mg。
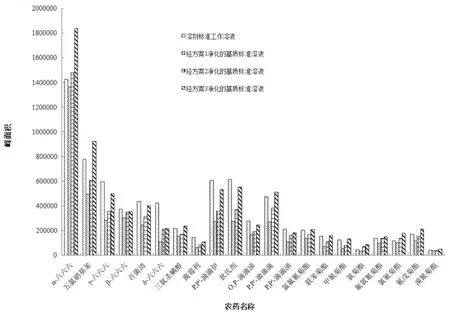
图2 3种净化方案对目标物峰面积的影响
3.3 样品前处理方法
本实验测定的样品包含鲜枸杞、干枸杞和枸杞原浆,其中干枸杞的含水量较低,直接用乙腈提取效果不佳,因此在提取过程中应考虑复水量的影响。根据GB 23200.10-2016《食品安全国家标准桑枝、金银花、枸杞子和荷叶中488种农药及相关化学品残留量的测定 气相色谱-质谱法》[30]和相关研究[20],当复水量为称样量的2~2.5倍时,可获得较高的提取效率。因此,在处理干枸杞样品时,称样后加入10 ml水浸泡30 min再加入乙腈提取。
较NY/T 761-2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》[31]的前处理方法而言,本文设计的前处理方法具备以下优势:(1)将50.00 g的称样量降至5.00 g,同时将乙腈的用量从50.00 ml调整为10.00 ml,为节约试剂、降低检测成本起到积极作用;(2)干制样品在复水后进行提取,使提取溶剂乙腈与样品组织充分接触,进而获得更高的提取效率;(3)在样品提取溶液净化时,采用QuEChERS技术代替了传统的固相萃取技术,在减小有机试剂用量和缩短样品净化时间方面表现更突出。
3.4 基质效应评价
在实际样品测定时,目标农药表现出的基质效应因其自身性质[32]和含量水平[33]、样品种类[34]及测试仪器[35]等因素而异。因此,明确目标农药在相应测试样品中的基质效应非常必要。本文涉及的21种拟除虫菊酯农药表现出不同的基质增强效应或基质减弱效应,结果见表3。对于强基质效应的目标农药,采用基质匹配的标准曲线定量是较常用的消除基质效应对测定结果不利影响的方法之一。因此,本实验在加标回收试验和实际样品测定时,均采用基质匹配的标准曲线定量。
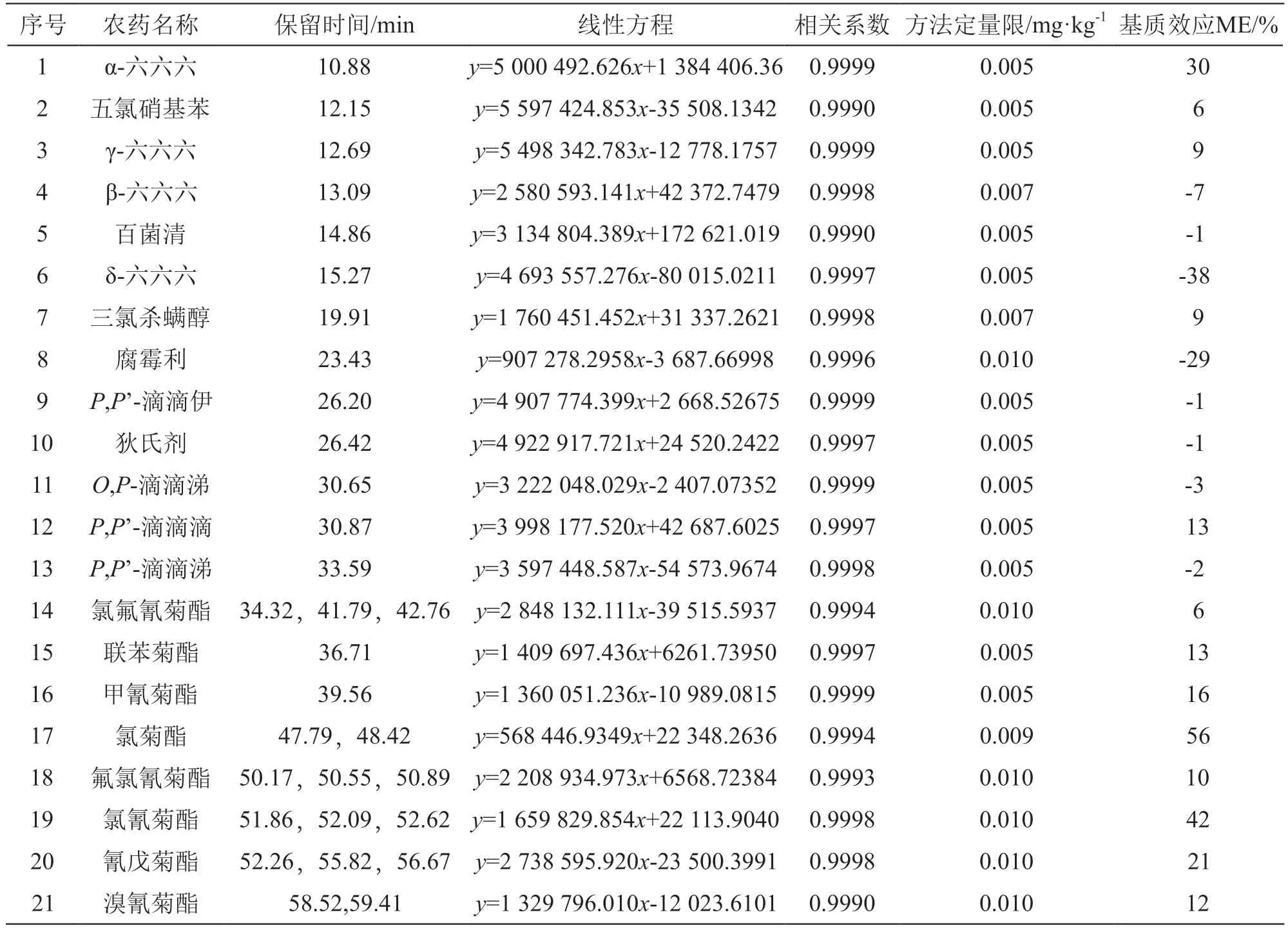
表3 目标农药的保留时间、线性方程、相关系数、方法定量限及基质效应
3.5 方法的分析特性
21种拟除虫菊酯农药在0.010~1.0 μg/ml的质量浓度范围内与对应峰面积呈线性关系,相关系数均大于0.9990。以10倍的信噪比作为仪器的定量限,将其作为样品测试溶液浓度,代入2.4项样品中目标物含量的计算公式即得到方法检出限。21种目标农药的方法检出限均在0.005~0.010 mg/kg之间,与GB 23200.113-2018《食品安全国家标准 植物源性食品中208种农药及其代谢物残留量的测定 气相色谱-质谱联用法》[26]给出的方法定量限处于同一水平。21种目标农药的保留时间、线性回归方程、相关系数和方法定量限见表3。
通过低、中、高3个浓度水平的加标回收试验验证方法的准确性和精密度,每个加标水平平行测定3次。3个加标水平下所有目标农药的加标回收率均在80.14 %~116.38 %之间,相对标准偏差均在0.38 %~8.76 %之间,符合GB/T 27404-2008《实验室质量控制规范 食品理化检测》[36]的要求。
3.6 实际样品测定
选取2份干枸杞、2份鲜枸杞和1份枸杞原浆作为实际样品,采用本文优化方法分析。在1份干枸杞中检出了氯氰菊酯和高效氯氰菊酯,含量为0.096 mg/kg,小于GB 2763-2021[13]中规定的枸杞(干)中氯氰菊酯和高效氯氰菊酯的最大残留限量2 mg/kg;其余4份样品中均未检出本文涉及的目标农药。
4 结论
本文建立了一种气相色谱法同时测定枸杞及枸杞制品中21种拟除虫菊酯类农药残留量的方法,优化了采用QuEChERS技术净化样品提取溶液时所用到的PSA、C18和GCB的用量,并明确了目标农药的基质效应。同时,通过加标回收试验考察此法的准确度和精密度,并测定实际样品。此法前处理简单,准确度高且灵敏度好,可满足枸杞中21种拟除虫菊酯类农药残留量的同时测定,可为枸杞及其制品中相关拟除虫菊酯类农药的阳性筛查和定量测定提供积极的帮助。
