酶解北芪菇蛋白抗氧化肽制备及其抗氧化活性研究
2023-11-07缪文玉程继安张娜郡
缪文玉,程继安,陈 超,张娜郡,秦 楠 *
(1. 太原城市职业技术学院管理工程系,山西 太原 030027;2. 内蒙古伊利实业集团股份有限公司奶粉事业部,湖北 宜昌 443000;3. 山西中医药大学中药与食品工程学院,山西 榆次 030619)
北芪菇是在平菇培养基中加入黄芪培育而成的一类新型食用菌类,产于山西省大同市浑源县[1]。北芪菇既具有普通食用菌无脂肪、无胆固醇的特点,还具备黄芪的药理作用,具有药食同源价值[2]。近年,安全、高效的功能活性肽成为研究热点[3]。来源于食源性蛋白质的抗氧化肽具有安全性高、活性高、功能性强等特点,能清除体内自由基,有效防止脂质氧化,并进一步延缓细胞衰老和死亡[4-8]。关于北芪菇的研究主要集中在成分研究及提取工艺[1-2,9-10],基于北芪菇抗氧化功能制备抗氧化肽的研究较少。本文以北芪菇蛋白为原料,以复合蛋白酶[11]高效酶解蛋白,研究制备北芪菇蛋白抗氧化性多肽的最佳工艺条件,为北芪菇蛋白的深加工和抗氧化肽的深入研究提供基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试药 北芪菇(浑源县泽青芪业开发有限公司);木瓜蛋白酶(6000 U/mg)、碱性蛋白酶(200 U/mg)、中性蛋白酶(60 U/mg)、胰蛋白酶(250 U/mg)、ABTS(北京索莱宝);1,1-二苯基-2-三硝基苯肼(DPPH·,东京化成工业);抗坏血酸、过硫酸钾、铁氰化钾(天津科密欧)。
1.1.2 仪器 LXJ-IIB离心机(上海安亭科学仪器厂);PHS-3C型pH计(上海盛磁);HH-4数显恒温水浴锅(金坛杰瑞尔);Ultra-3660紫外可见分光光度计(北京普源精电);AR223CN电子天平(奥豪斯仪器)。
1.2 方法
1.2.1 北芪菇蛋白肽的制备 北芪菇干粉按1:12加蒸馏水溶解,用0.5 mol/L氢氧化钠溶液调pH至8.0[12],2700 r/min离心5 min,取上清加盐酸调pH至4.5,5000 r/min离心15 min,取沉淀加蒸馏水配制为浓度为2 %的溶液,调节pH,加入蛋白酶,在最适温度下酶解,反应完成后,95 ℃水浴灭酶15 min,5000 r/min离心15 min,取上清,得到北芪菇蛋白肽。
1.2.2 复合蛋白酶选择
1.2.2.1 蛋白酶筛选 选取木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和胰蛋白酶,在最适温度和pH值下进行酶解,其他条件为底物浓度2 %,加酶量5000 U/g,酶解时间2 h,检测DPPH·清除率和水解度[13]。
1.2.2.2 加酶方式选择 选出两种最佳蛋白酶后,根据表1的加酶方式进行酶解[14],其他条件为底物浓度2 %,加酶量5000 U/g,酶解时间2 h,检测DPPH·清除率和水解度。

表1 加酶方式
1.2.2.3 加酶比例选择 确定加酶方式后,分别按两种酶比例1:1,1:2,1:3,2:1,3:1进行酶解,其他条件为底物浓度2 %,加酶量5000 U/g,酶解时间2 h,检测DPPH·清除率和水解度。
1.2.3 单因素试验 研究不同酶解时间(1,1.5,2,2.5,3 h),复合酶加酶量(3000,4000,5000,6000,7000 U/g),温度(30,35,40,45,50 ℃),pH(7,7.5,8,8.5,9)对北芪菇蛋白酶解的影响。固定研究因素底物浓度2 %,pH 7.5,加酶量5000 U/g,反应温度40 ℃,酶解时间2 h,检测DPPH·清除率及水解度[15]。
1.2.4 响应面设计 自变量为酶解时间、加酶量、酶解温度、pH值,响应值为DPPH·清除率,设计4因素3水平的响应面分析[10,14],具体设定见表2。结果采用Design-Expert.8.0.6.1软件进行分析。
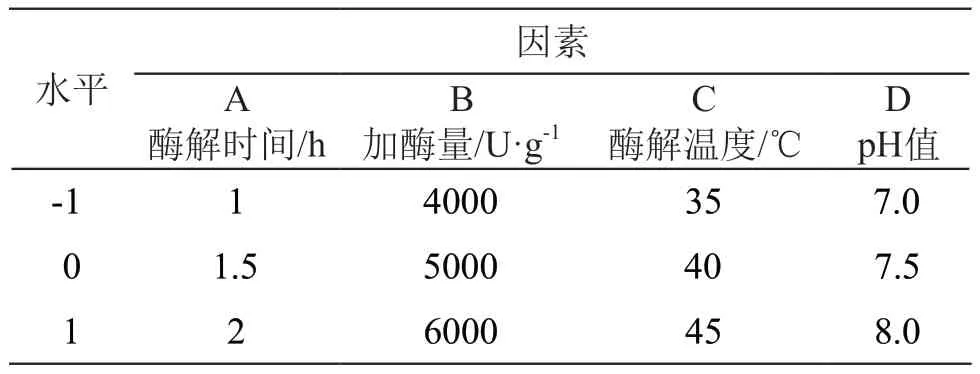
表2 响应面试验因素及水平
1.2.5 DPPH·清除率的测定 按表3加样,震荡,混匀后避光保存30 min,于517 nm处每3 min测一次吸光度(A),直至A值保持稳定。每一A值需进行3次重复试验以减小误差。计算公式[16]见式1。

表3 DPPH·清除率试验加样表
1.2.6 水解度测定 选用pH-stat滴定法[17],计算公式见式2。
式中,V(ml)=消耗碱的体积;C(mol/L)=消耗碱的浓度;m(g)=蛋白质总量;h=每克蛋白中肽键数(7.52 mmol/g)[18];α是α-氨基酸的平均解离度,α=10pH-pKa/(1+10pH-pKa),pH是反应初始的pH值,pKa=7.8+2400×(298-T)/298T,T=273.15+t,t为反应环境的温度。
1.2.7 抗氧化试验 ABTS·+清除率试验 采用ABTS法[19]测定北芪菇蛋白水解液的抗氧化性,以抗坏血酸作标准对照品进行比较。
用磷酸盐缓冲溶液制得7 mmol/LABTS溶液40 ml,加入2.45 mmol/L过硫酸钾溶液40 ml混匀,再用磷酸盐缓冲溶液稀释至734 nm处A为0.70±0.02,制成ABTS·+溶液。按表4加样,于734 nm处测定A值。计算公式见式3。

表4 ABTS加样表
1.2.8 抗氧化试验 总还原力试验 对北芪菇蛋白水解液进行总还原力的测定[20],以抗坏血酸作为标准对照品进行测定。
取2 ml待测液加2.5 ml pH为6.6的PBS缓冲液和2.5 ml 1%铁氰化钾溶液,混合后50 ℃水浴20 min,冷却后加入1 ml 10%的三氯乙酸溶液,5000 r/min离心10 min,取2.5 ml上清,加入2.5 ml蒸馏水和0.5 ml 0.1%三氯化铁溶液,混匀,放置10 min后在700 nm波长处测定A。以80 %的乙醇溶液作为空白组对照。
2 结果与分析
2.1 复合蛋白酶的选择
2.1.1 蛋白酶的筛选 由图1可见,中性蛋白酶和碱性蛋白酶对北芪菇蛋白的DPPH·清除率和水解能力均高于其他两种酶,所以选择中性蛋白酶和碱性蛋白酶复合进行后续试验。

图1 酶的种类对DPPH·清除率和水解度的影响
2.1.2 加酶方式的选择 由图2可见,在DPPH·清除率指标中,中性加碱性酶比碱性加中性酶要高,但是在水解度指标中,碱性加中性酶比中性加碱性酶高。综合考虑,选择复合酶在中性蛋白酶最适合的温度40 ℃和pH值7.5条件下水解。

图2 加酶方式对DPPH·清除率和水解度的影响
2.1.3 加酶比例的选择 由图3可见,加酶比例为1:1时DPPH·清除率比2:1略高,明显高于其他组,且水解度最高。因此,确定最适的加酶比例为中性蛋白酶:碱性蛋白酶=1:1。

图3 加酶比例对DPPH·清除率和水解度的影响
2.2 单因素试验结果
2.2.1 酶解时间对DPPH·清除率和水解度的影响 由图4可见,随反应时间的延长,DPPH·清除率先上升后缓慢下降,在反应1.5 h处达到最大值,1.5 h以后DPPH·清除率逐渐降低可能是抗氧化性多肽又进一步被分解为氨基酸或者小分子多肽[21]。水解度先增加后保持不变,在反应2 h处达到峰值并稳定,可能是因为底物与蛋白酶充分反应。因此,选择1.5 h为合适的酶解时间。
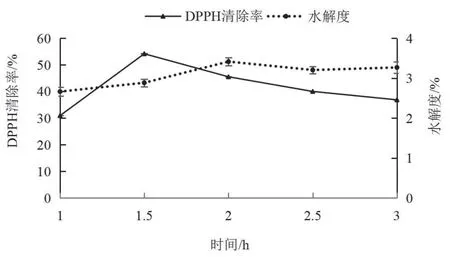
图4 时间对DPPH·清除率和水解度的影响
2.2.2 加酶量对DPPH·清除率和水解度的影响 由图5可见,DPPH·清除率先上升后下降,在加酶量5000 U/g处达到峰值,可能是北芪菇蛋白在酶量刚开始增加时先被水解成具有抗氧化性的多肽[22],随着酶量的逐渐增加,抗氧化性的多肽又进一步被水解为氨基酸和小分子肽。随着酶用量的增加,水解度先增大后基本保持稳定,添加量在4000 U/g时达到最大值,可能是因为底物与蛋白酶已经充分反应。综合考虑,选择5000 U/g为合适的加酶量。

图5 加酶量对DPPH·清除率和水解度的影响
2.2.3 温度对DPPH·清除率和水解度的影响 由图6可见,随着温度的升高,DPPH·清除率和水解度先增大后减小,在温度达到40 ℃时,DPPH·清除率和水解度均达到峰值。原因可能是温度过低时酶活性较低,随着温度的升高,酶促反应加快,水解度增大,得到更多的抗氧化性多肽,超过最适温度后,酶活性会降低,甚至会失活,导致水解度减小,抗氧化性多肽数量减少[23]。综合考虑,选择40 ℃为合适的酶解温度。

图6 温度对DPPH·清除率和水解度的影响
2.2.4 pH对DPPH·清除率和水解度的影响 由图7可见,随pH值的增大,DPPH·清除率和水解度先增大后降低。pH为7.5时,DPPH·清除率达到最大值,pH值为8时,水解度达到最大值。原因可能是蛋白酶有最适pH值,远离最适pH值会降低水解能力,水解蛋白的数量减少,得到的抗氧化性多肽数量也会减少,因而导致DPPH·清除率降低[24]。综合考虑,选择7.5为最适pH。

图7 pH对DPPH·清除率和水解度的影响
2.3 响应面结果分析
2.3.1 响应面试验结果与方差分析 根据单因素试验结果,以酶解时间、加酶量、酶解温度、pH值为自变量,DPPH·清除率为响应值进行响应面分析,结果见表5。

表5 响应面分析实验结果
采用Design-Expert.8.0.6.1软件对表4数据进行二次多元回归拟合,得回归方程:DPPH·清除率(%)Y=57.20-2.49A+1.88B-4.49C-0.83D-3.38AB+5.25AC+0.35AD+1.22BC-1.55BD+1.80CD-8.06A2-13.85B2-17.69C2-13.40D2。
对上述回归模型进行方差分析,结果见表6。一次项A、B、C,二次项A2、B2、C2、D2和交互项AB、AC对DPPH·清除率具有极显著影响。此回归模型P<0.0001,失拟项P>0.05,表明该模型可靠。R2=0.9944,表明拟合值与试验数据具有高度拟合性。R2Adj=0.9887,表明该模型能解释98.87%的响应值变化。因此,用此模型优化酶解北芪菇蛋白制备抗氧化肽的工艺是可行的。

表6 回归模型方差分析结果
2.3.2 响应曲面图结果 各因素之间的交互作用对响应值的影响见图8。AC的响应面曲线较陡,且等高线图更偏椭圆形,因此AC的交互作用对DPPH·清除率的影响最为显著。其中,温度对DPPH·清除率的影响大,表现为响应曲面的梯度较陡峭,等高线较密度较大;时间对DPPH·清除率的影响较小,表现为响应曲面的梯度较平,等高线密度较小[25]。交互作用对DPPH·清除率的影响大小顺序为:AC>AB>CD>BD>BC>AD。

图8 各因素对DPPH·清除率影响的响应面图和等高线图
2.3.3 验证试验 运用Design-Expert.8.0.6.1软件分析由模型预测可见,在时间1.39 h,加酶量5091 U/g,温度39.2 ℃,pH 7.47的条件下酶解,DPPH·清除率可达57.95 %。考虑到试验条件和现实情况,确定最优实验条件为时间1.5 h,5100 U/g,温度40 ℃,pH 7.5。进行3次平行试验,DPPH·清除率为58.20 %±0.23 %,与预测值相差较小,结果可靠。
2.4 抗氧化试验结果
抗氧化试验结果见表7,表明北芪菇蛋白水解液所得的多肽具有抗氧化性。
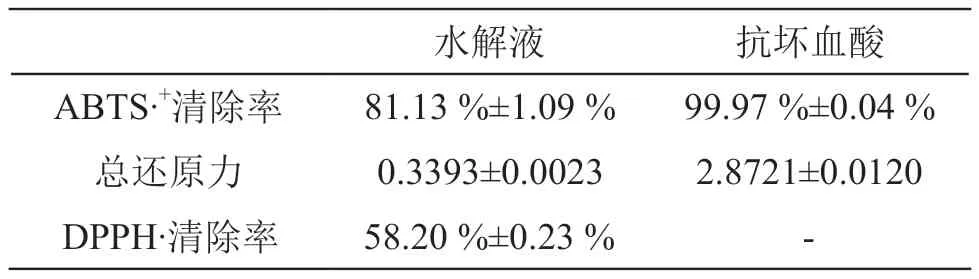
表7 抗氧化指标
3 结论
本文采用复合酶解的方式,研究制备北芪菇蛋白抗氧化性多肽的最佳工艺条件,并验证所得多肽抗氧化活性。确定制备北芪菇蛋白抗氧化肽的最佳工艺参数为:酶解时间1.5 h,复合酶添加量5100 U/g,酶解温度40 ℃,pH 7.5。在此条件下,得到的抗氧化性多肽的DPPH·清除率为58.20 % ±0.23 %,ABTS·+清除率为81.13 %±1.09 %,总还原力为0.3393±0.0023,可以说明北芪菇蛋白水解液所得的多肽具有抗氧化性。
本研究为酶法制备北芪菇蛋白抗氧化肽提供最佳工艺条件,为进一步研究其抗氧化性提供理论基础。之后可以就北芪菇抗氧化肽在体内抗氧化作用及作用机制进行深入研究,为北芪菇的深加工以及抗氧化肽的发展提供技术和理论支持。
