伽师瓜幼苗响应盐胁迫的生理特性及耐盐性评价
2023-11-07谢志明马刘峰方志刚
谢志明,宋 刚,马刘峰,陈 芸,方志刚
(1.喀什大学生命与地理科学学院 新疆喀什 844006; 2.新疆帕米尔高原生物资源与生态重点实验室新疆喀什 844006; 3.江苏农林职业技术学院茶与食品科技学院 江苏句容 212400)
盐胁迫是一种典型的非生物胁迫,一般而言,土壤中盐含量高于0.3% 会严重抑制植株生长,降低作物产量和品质。土壤中盐分来源除自身因素外,全球气候变化、不合理灌溉及施肥,也导致土壤盐渍化加剧[1]。目前,我国土壤盐渍化总面积达3.69×107hm2,主要分布在东北、西北、华北及滨海地区,合理利用盐渍化土地迫在眉睫,其中筛选和培育耐盐的作物品种是盐渍化土地开发利用的有效方式[2]。
幼苗期是植株对盐胁迫十分敏感的阶段,根系首先与土壤中的Na+接触,当盐分达到一定含量时,会导致土壤水势下降,影响水分代谢、渗透调节、离子吸收等生理过程,使根系吸收水分及矿质元素的能力降低,引发植株产生氧化胁迫[3-4]。高盐胁迫下,植物体内会积累大量的Na+,扰乱质膜上离子通道功能,影响K+、Ca2+及Mg2+等无机离子的吸收[5]。植物在一定条件下可启动抗氧化酶系统、离子选择性吸收及Na+外排等机制来应对盐胁迫带来的伤害[6-7]。此外,液泡膜Na+/H+逆向转运蛋白基因CmN‐HX1在根中高表达,具有将Na+转运至液泡的功能,可以抵御盐胁迫带来的伤害[8]。
研究表明,不同作物品种耐盐性存在较大差异。耐盐型的燕麦品种,叶片中Na+含量较低,K+含量较高,使叶片中K+/Na+比值下降幅度较小[9]。也有研究表明,较耐盐的植物可能会将较多的Na+区隔在液泡中,应对盐胁迫所带来的伤害[10]。盐胁迫会导致甜瓜叶片的光合速率下降,降低光合作用,影响果实发育[11]。甜瓜在盐胁迫下,叶片O2-产生速率及H2O2含量急剧上升,导致细胞膜受损[12]。有研究表明,甜瓜品种繁多,耐盐性存在较大差异,而厚皮甜瓜的耐盐性相对较强[13]。伽师瓜属厚皮甜瓜的一种,是中国地理标志产品,果肉风味独特,耐贮运,广受市场好评。伽师瓜主栽区在新疆喀什地区的伽师、疏勒、麦盖提等县的16 个乡镇,该地区受到土壤盐渍化的危害,影响其种植面积进一步扩大。尽管在甜瓜耐盐性研究方面前人已经做了较多工作,但针对伽师瓜响应盐胁迫的生理特性及耐盐性评价却鲜有报道。基于此,笔者利用前期筛选的100 mmol·L-1NaCl 开展盆钵模拟盐胁迫试验,进一步探究盐胁迫对不同伽师瓜幼苗生理特性的影响,并评价伽师瓜的耐盐性,为伽师瓜耐盐性生理机制解析及品种选育提供理论依据。
1 材料与方法
1.1 材料
选择本地区主栽的常规伽师瓜、杂交伽师瓜和绿肉伽师瓜作为试验材料,其中常规伽师瓜和杂交伽师瓜由新疆西域种业股份有限公司培育,绿肉伽师瓜由新疆吉丰种业有限公司培育,种子均购置于喀什农博城。各品种主要性状见表1。

表1 伽师瓜品种主要性状Table 1 Main traits of different Jiashi melon
1.2 方法
1.2.1 试验设计 试验于2022 年3—6 月在喀什大学植物逆境生物学研究室进行。选取籽粒饱满、大小均匀的伽师瓜种子,用5% 次氯酸钠消毒5 min,去离子水洗涤3 次,25°C 避光浸泡12 h,播于装有基质营养土的塑料花盆中(底部直径16 cm,高18 cm),每盆播种8 粒种子。当幼苗子叶展平后,每盆留苗4 株。在幼苗第2 片真叶展平时,用Hoa‐gland’s 营养液浇灌一次。待长至3 叶1 心时,用100 mmol·L-1NaCl 模 拟 盐 胁 迫,对 照(CK)使 用去离子水浇灌,试验采用完全随机区组设计,各处理均4 次重复,共24 盆。植物材料培养期间,保持昼夜温度30 ℃/25 ℃,湿度为40%~45%,光照度为350 μmol·m-2·s-1,光周期12 h(L)/12 h(D)。处理7 d 后,选取生长部位相同的叶片,用于指标测定,各样本处理均重复测定3 次。
1.2.2 测定指标与方法 盐胁迫7 d 后,记录株高和茎粗及鲜质量,于105 °C 杀青15 min,80 °C 烘干至恒质量,记录地上部干质量。另从基质土中取整株幼苗,洗净后,分别取根、茎、叶烘干至恒质量后用于Na+、K+含量的测定。叶面积采用纸样称质量法测定,计算公式:叶面积/cm2=m2×21×29.7/m1(其中m1为纸张质量,m2为剪下叶片的纸张质量)[14]。
Na+、K+含量(w,后同)采用原子吸收光谱法测定[15];超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性的测定方法参照南京建成试剂盒说明书;丙二醛(MDA)含量(b,后同)测定采用硫代巴比妥酸法,脯氨酸(Pro)含量(w,后同)采用磺基水杨酸法,可溶性蛋白(SP)含量(w)采用考马斯亮蓝G250 染色法测定,过氧化物酶活性(POD)采用愈创木酚法测定[16];细胞膜相对透性采用DDS-307 电导率仪测定,计算公式:相对膜透性=R1/R2×100%(其中R1 为初始电导率,R2 为沸水浴加热10 min 后的电导率);光合色素含量(w,后同)采用95% 乙醇浸提法测定[9],过氧化氢(H2O2)含量(b,后同)用硫酸钛法测定[17]。
为明确不同伽师瓜品种的耐盐性差异,采用隶属函数法及主成分分析法进行综合评价。参考刘炳响等[18]的方法进行主成分分析,公式如下:
式(1)中:Ai代表某一指标的特征向量(指标系数),λ 代表特征值,Bi代表各指标的载荷矩阵。
式(2)中:Fj代表某一品种的综合得分值,αi代表某一品种中各指标的标准值。
式(3)中:Xj代表某一品种的综合指标得分值,Xmax代表某一品种综合指标得分值中的最大值,Xmin代表某一品种综合指标得分值的最小值。
式(4)中:Wi表示第i个主成分在所有成分中的重要程度即综合指标权重,Pi为各品种第i个主成分的贡献率
式(5)中:D值代表不同品种间综合指标评价值,D值越大,耐盐性越强。
1.3 数据分析
采用Microsoft Excel 2016 整理数据及绘图,利用SPSS 20.0 对数据进行单因素方差分析、Duncan’s多重比对法分析以及主成分分析。
2 结果与分析
2.1 盐胁迫对伽师瓜幼苗生长及生理指标的影响
2.1.1 盐胁迫对伽师瓜幼苗生长的影响 由表2可以看出,常规伽师瓜、杂交伽师瓜及绿肉伽师瓜的株高、茎粗、叶面积及地上部鲜质量,在盐胁迫处理前无显著差异。
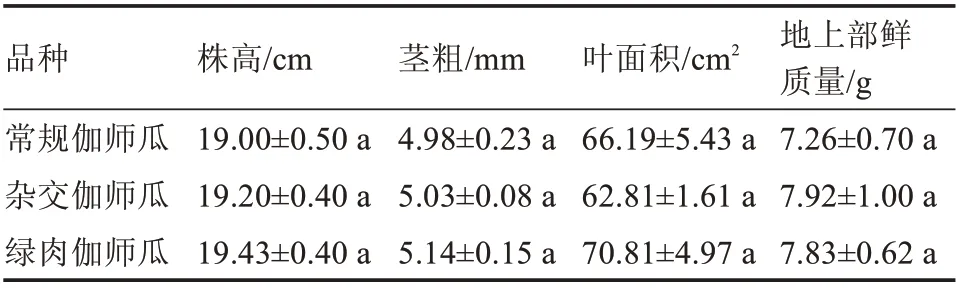
表2 不同伽师瓜盐胁迫处理前的主要农艺性状Table 2 Main agronomic traits of different Jiashi melon before salt stress
与CK 相比,100 mmol·L-1NaCl 胁迫均显著降低常规伽师瓜、杂交伽师瓜及绿肉伽师瓜幼苗的株高及地上部鲜质量(图1-A、1-D),株高分别降低17.40%、18.99%、28.12%,地上部鲜质量分别降低38.62%、41.95%、57.37%。盐胁迫导致常规伽师瓜和绿肉伽师瓜茎粗显著降低10.92% 和15.53%(图1-B);仅绿肉伽师瓜叶面积在盐胁迫下显著降低19.68%(图1-C)。盐胁迫下,不同伽师瓜品种地上部干质量与其CK 相比均无显著差异(图1-E)。上述结果表明,100 mmol·L-1盐胁迫能抑制伽师瓜幼苗生长,尤以绿肉伽师瓜最为突出。
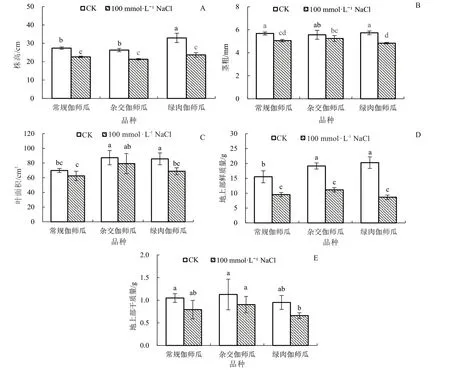
图1 盐胁迫对伽师瓜幼苗生长的影响Fig.1 Effects of salt stress on growth of Jiashi melon seedlings
2.1.2 盐胁迫对伽师瓜叶片抗氧化酶活性的影响从图2 可以看出,与CK 相比,100 mmol·L-1NaCl 胁迫未显著影响伽师瓜叶片SOD 活性;杂交伽师瓜POD 活性显著下降45.41%,CAT 活性显著升高8.59%,APX 活性显著升高167.85%。这表明盐胁迫下不同伽师瓜品种叶片的抗氧化酶活性表现出较大差异。
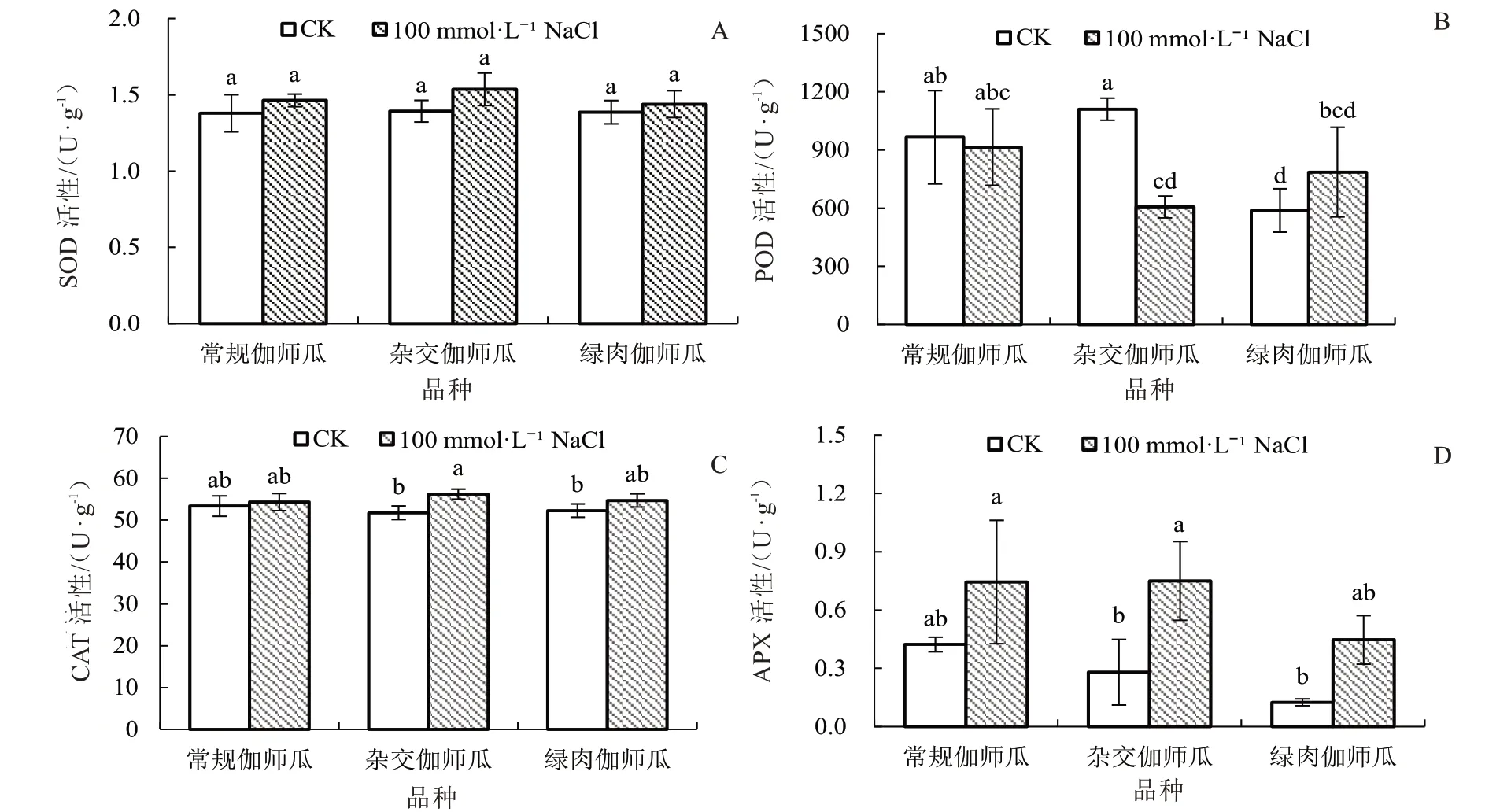
图2 盐胁迫对伽师瓜幼苗抗氧化酶活性的影响Fig.2 Effects of salt stress on antioxidant enzyme activities of Jiashi melon seedlings
2.1.3 盐胁迫对伽师瓜叶片渗透调节物质的影响图3 表明,100 mmol·L-1NaCl 处理使常规伽师瓜叶片脯氨酸含量较CK 显著升高172.89%;绿肉伽师瓜叶片中可溶性蛋白含量显著升高26.78%,其余2个品种无显著变化。
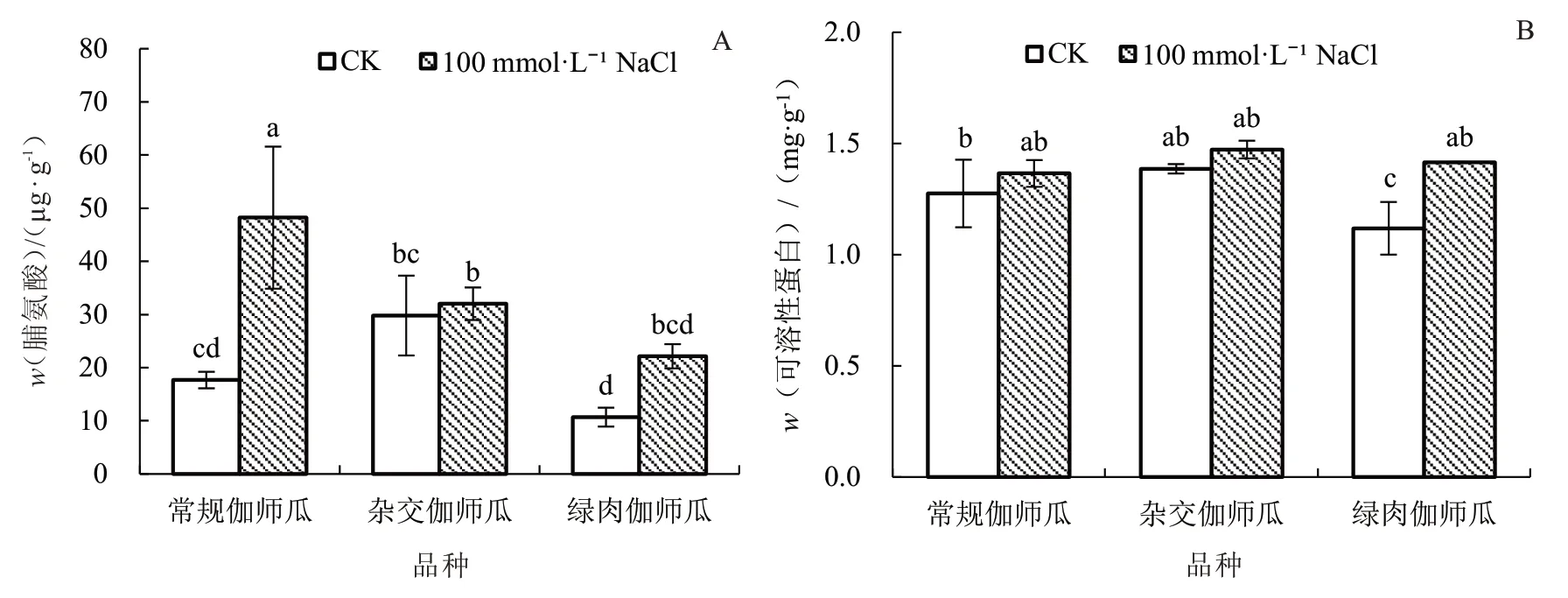
图3 盐胁迫对伽师瓜幼苗渗透调节物质含量的影响Fig.3 Effects of salt stress on osmotic adjustment substances content of Jiashi melon seedlings
2.1.4 盐胁迫对伽师瓜叶片过氧化氢含量、丙二醛含量及相对膜透性的影响 由图4 可知,和CK相比,100 mmol·L-1NaCl 处理显著提高了常规伽师瓜、杂交伽师瓜及绿肉伽师瓜叶片相对膜透性和H2O2含量,叶片相对膜透性分别提高10.61%、15.20%、42.13%,H2O2含 量 分 别 提 高 15.25%、35.22%、21.28%;盐胁迫使绿肉伽师瓜叶片MDA含量显著升高57.07%,其余2 个品种无显著变化。
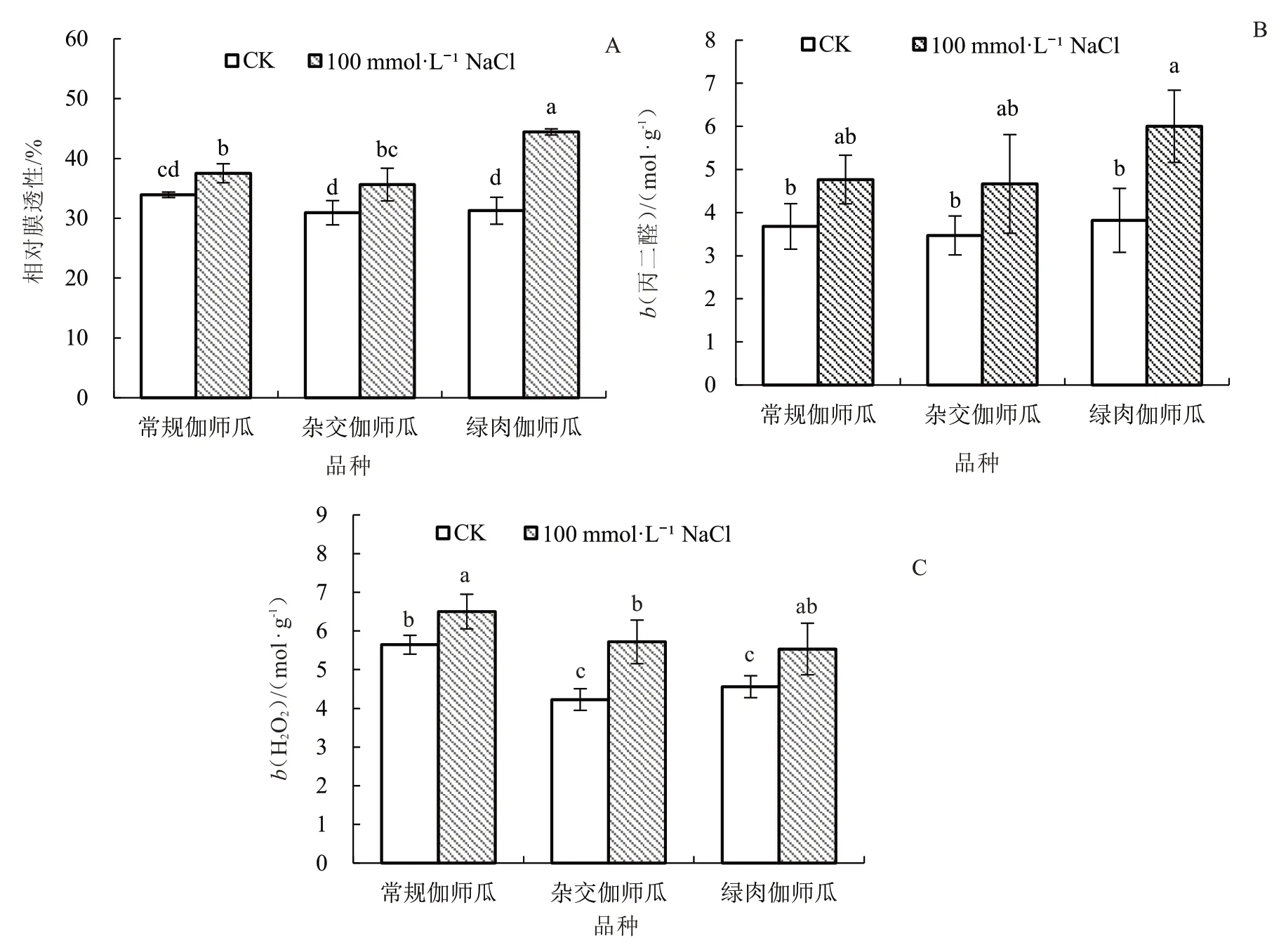
图4 盐胁迫对伽师瓜叶片膜相对透性、过氧化氢和丙二醛含量的影响Fig.4 Effects of salt stress on relative permeability of cell membrane,H2O2 and MDA content of Jiashi melon leaf
2.1.5 盐胁迫对伽师瓜幼苗光合色素含量的影响由图5 可知,100 mmol·L-1NaCl 能够影响伽师瓜叶片光合色素含量。与CK 相比,盐胁迫处理使绿肉伽师瓜叶绿素a、叶绿素b 及总叶绿素含量显著下降,分别降低33.03%、48.00%、35.82%;常规伽师瓜、杂交伽师瓜及绿肉伽师瓜叶片中类胡萝卜素含量分别显著下降20.00%、21.74%、28.57%。
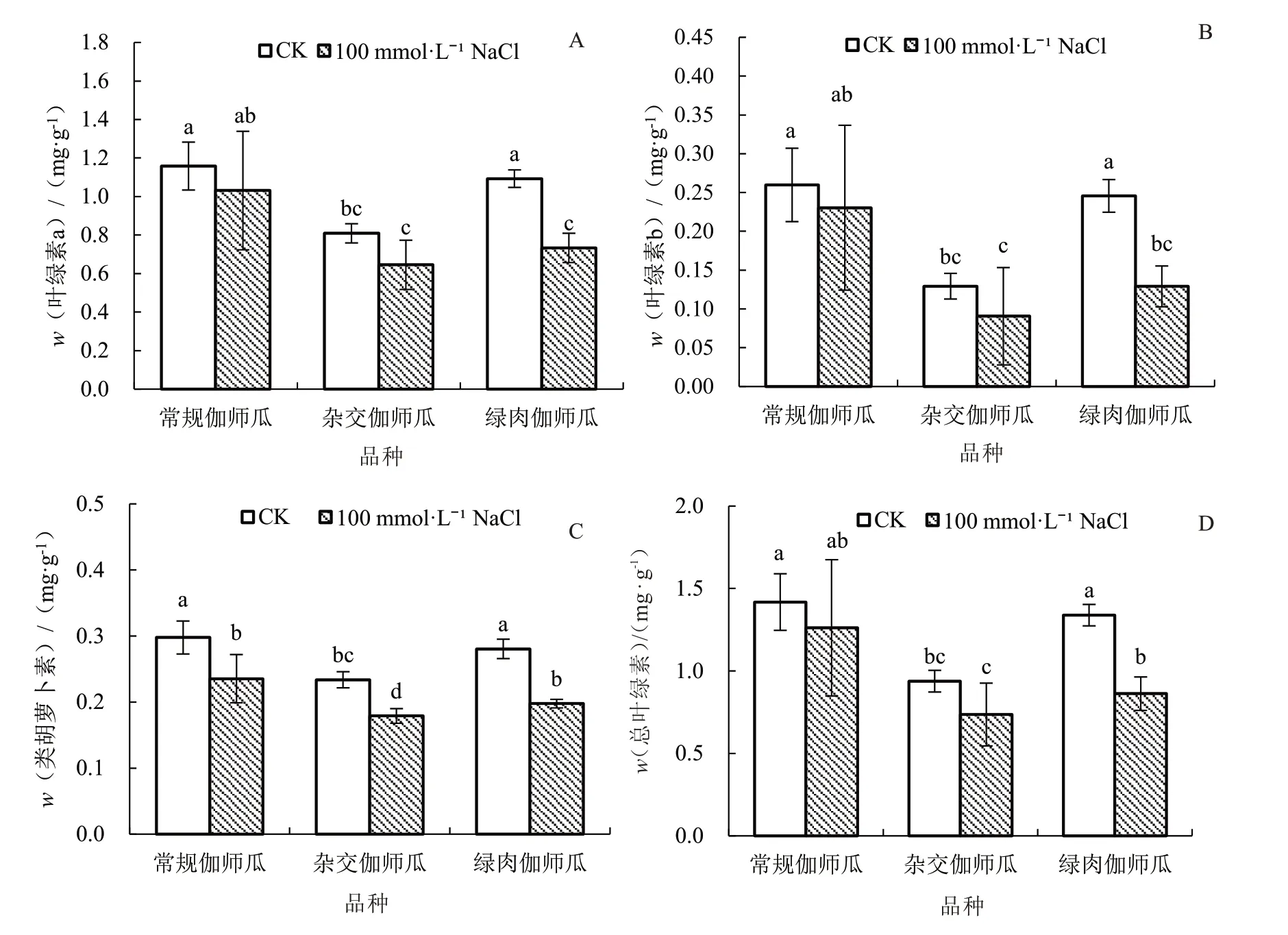
图5 盐胁迫对伽师瓜幼苗光合色素含量的影响Fig.5 Effects of salt stress on photosynthetic pigment content of Jiashi melon seedlings
2.1.6 盐胁迫对伽师瓜根系活力的影响 由图6可知,100 mmol·L-1NaCl 处理能抑制伽师瓜幼苗的根系活力。与CK 相比,常规伽师瓜根系活力无明显下降,但杂交伽师瓜和绿肉伽师瓜根系活力分别显著下降50.44% 和73.43%,说明盐胁迫下不同品种的根系活力存在较大差异。

图6 盐胁迫对伽师瓜幼苗根系活力的影响Fig.6 Effects of salt stress on root activity of Jiashi melon seedlings
2.1.7 盐胁迫对伽师瓜根、茎、叶Na+、K+含量的影响由图7 可以看出,与CK 相比,100 mmol·L-1NaCl 处理使常规伽师瓜和绿肉伽师瓜叶片中Na+含量显著升高,分别升高了46.85%和194.05%;3 个品种叶片中K+含量均未发生显著变化;常规伽师瓜和绿肉伽师瓜叶片中K+/Na+分别显著降低了29.72% 和68.56%。与CK 相比,盐胁迫导致绿肉伽师瓜茎中Na+含量显著升高5.29%;常规伽师瓜、杂交伽师瓜及绿肉伽师瓜茎中K+含量分别显著下降5.65%、8.79%、13.26%;3 个品种茎中K+/Na+分别显著降低6.00%、8.65%、16.98%。与CK 相比,杂交伽师瓜在盐胁迫下根中Na+含量显著升高43.62%,其余2个品种未发生显著变化;不同伽师瓜根中K+及K+/Na+在盐胁迫下也均未发生显著变化。
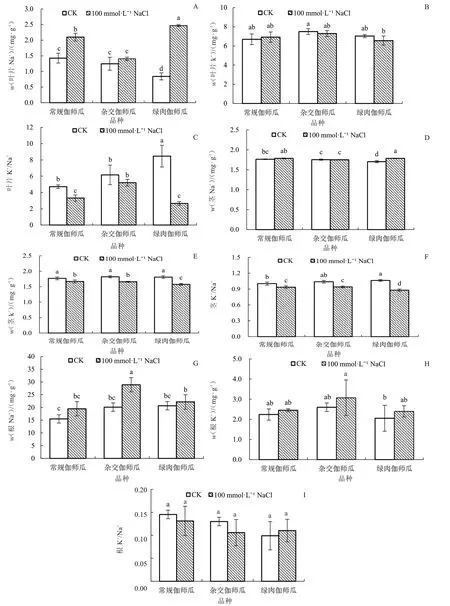
图7 盐胁迫对伽师瓜幼苗根、茎、叶Na+、K+含量的影响Fig.7 Effects of salt stress on Na+,K+content of root,stem and leave of Jiashi melon seedlings
2.2 伽师瓜耐盐性综合评价
2.2.1 主成分分析 对28 个生理指标进行主成分分析,以特征值大于1 为提取标准,最终提取到2 个主成分,特征值分别为21.378 和6.622,贡献率分别为76.351% 和23.649%,累积贡献率达100%,说明这2 个主成分涵盖了伽师瓜耐盐性的大部分信息(表3)。28 个生理指标的主成分因子载荷矩阵分析表明,第1 主成分主要由株高、地上部鲜质量、叶面积、茎K+/Na+、类胡萝卜素含量、叶片K+/Na+决定,第2 主成分主要由脯氨酸含量和根系活力决定。上述指标可作为评价伽师瓜耐盐性的综合指标。
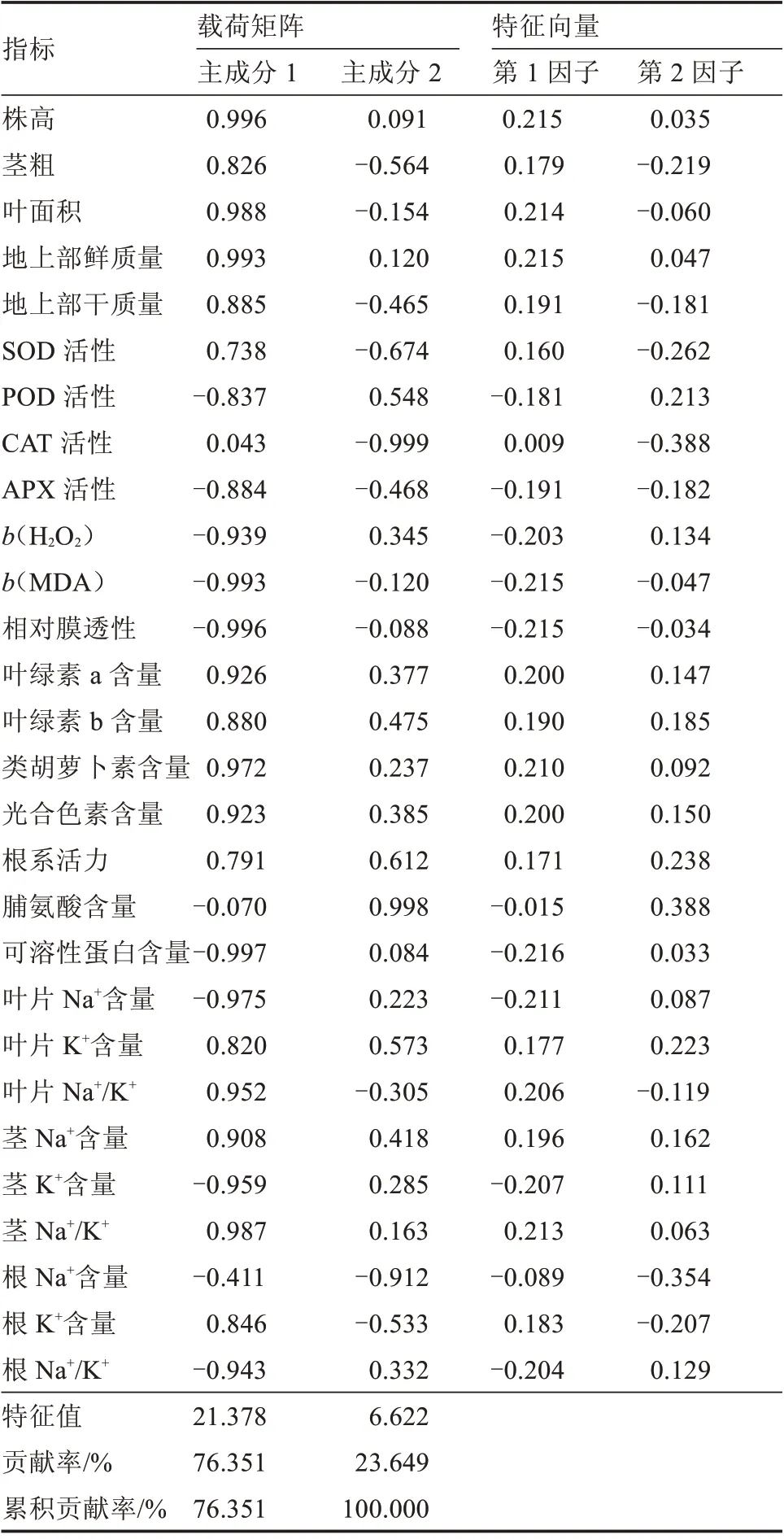
表3 盐胁迫下主成分在各指标上的载荷矩阵和特征向量Table 3 Load matrix and eigenvector of principal component in each index under salt stress
2.2.3 不同伽师瓜品种耐盐性综合评价 表3 中每个指标的特征向量即为各主成分的指标系数,将单项指标进行z-score 标准化,由式(2)可得各品种的2 个综合指标值(表4),根据式(3)可计算出每个伽师瓜品种所有综合指标的隶属函数值,根据综合指标贡献率的大小,利用式(4)计算出2 个综合指标值的权重,采用式(5)对伽师瓜品种进行耐盐性综合评价。根据D 值排序,3 个伽师瓜品种耐盐能力强弱依次为常规伽师瓜、杂交伽师瓜、绿肉伽师瓜。
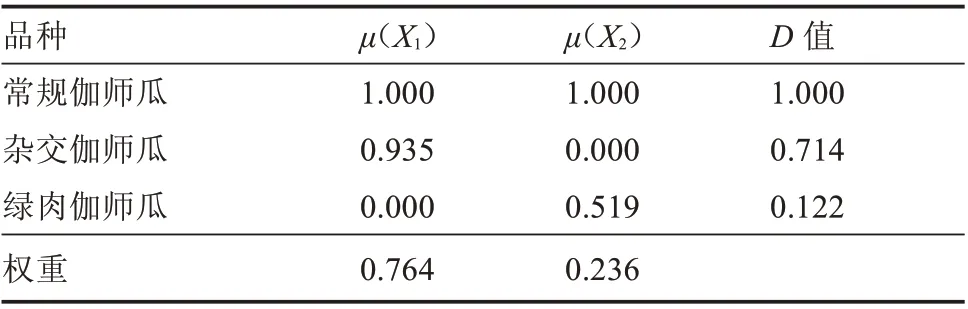
表4 盐胁迫下3 种伽师瓜的隶属函数值及综合评价D 值Table 4 Membership function value and D value of comprehensive evaluation of 3 varieties of Jiashi melon under salt stress
3 讨 论
3.1 盐胁迫对伽师瓜生理特性的影响
植物幼苗对盐胁迫较敏感,基质中盐分达到一定浓度会抑制植物的生长发育,造成生理代谢紊乱,外部形态表现出叶面积减小、植株矮小等[19-20]。笔者的研究中,3 种伽师瓜株高、茎粗、叶面积、地上部鲜质量及干质量在100 mmol·L-1NaCl 胁迫下均呈下降趋势,盐胁迫下苦荞的株高、茎粗、鲜质量及干质量也表现出同样的趋势[21]。这可能与植物在应对盐胁迫合成渗透调节物质、启动抗氧化防御系统过程中,蛋白质折叠需要能量耗费及光合产物积累减少有关[22]。
光合产物的积累主要与叶绿体类囊体膜上色素分子的光反应效率及叶绿体基质中碳同化酶活性有关,但盐胁迫能破坏叶绿体结构,抑制叶绿素合成,使光合速率降低[23]。笔者的试验中,100 mmol·L-1NaCl 处理使3 种伽师瓜叶绿素和类胡萝卜素含量减少,在油莎豆响应盐碱胁迫的试验研究中也有与笔者研究类似的结果[24],这可能是由于盐胁迫损伤叶绿体结构,光合色素合成受阻,并使光合作用碳同化过程中的关键酶RUBP 羧化酶活性降低,导致光合产物积累能力下降[25]。有关盐胁迫下,与伽师瓜叶绿素合成有关的细胞结构及光合作用关键酶活性的变化有待进一步验证。
笔者的研究中,盐胁迫下常规伽师瓜叶片中积累大量的脯氨酸,熊韬等[26]也发现盐胁迫下,甜瓜幼苗叶片积累更多的脯氨酸,这可能是因为脯氨酸作为渗透物质,调节细胞内外水势,保护蛋白质、核酸等大分子物质结构,从而应对盐胁迫的伤害[27]。植物受到盐胁迫时,在组织内会积累活性氧自由基如H2O2、O2-及OH-等物质,同时积累膜脂过氧化产物丙二醛,启动膜脂过氧化,使细胞膜受损,为维持磷脂分子层的良好结构,植物会启动抗氧化酶系统用于清除活性氧,其中,SOD 可将O2-歧化为H2O2和H2O,CAT、APX 及POD 等可将组织中过量的H2O2转变成H2O 和O2,维持活性氧的产生与清除的动态平衡,进而缓解盐胁迫带来的伤害[28-29]。笔者在研究中发现,100 mmol·L-1NaCl 处理的伽师瓜幼苗,不同品种叶片中SOD 活性未显著升高,仅杂交伽师瓜叶片CAT 和APX 活性显著升高,这表明伽师瓜应对盐胁迫启动抗氧化防御的效率存在品种差异,可能导致抗氧化酶系统防御失效,造成不可逆的氧化胁迫伤害。类似的结果在水稻品种应对盐胁迫时也被发现[30]。颜志明等[31]研究发现盐胁迫降低了甜瓜幼苗根、茎和叶中的K+含量,茎中降低幅度最大,这与笔者研究结果类似。在笔者的试验条件下,绿肉伽师瓜下降幅度最大,可能是绿肉伽师瓜茎中Na+积累过多,与K+存在竞争关系,影响了K+的吸收[31]。此外,笔者的研究还发现,100 mmol·L-1NaCl处理伽师瓜幼苗根系吸收的Na+被大量转运到绿肉伽师瓜叶片中,导致叶肉细胞中可能积累过量的Na+,破坏细胞内的离子平衡,也可能诱发氧化胁迫。但也有研究表明,根系吸收的Na+在植物细胞中积累后,除破坏离子平衡外,还能够引起植物水分代谢失衡,造成渗透胁迫及离子毒害的双重效应[32]。
3.2 不同伽师瓜品种耐盐性差异
在100 mmol·L-1NaCl 胁迫处理下,常规伽师瓜、杂交伽师瓜及绿肉伽师瓜苗期的耐盐性存在一定的差异,可能是不同品种对盐胁迫做出的响应机制不同[33]。盐胁迫下,尽管杂交伽师瓜根中Na+含量最高,但叶片中绿肉伽师瓜中积累的Na+含量显著高于其余2 个品种,这表明绿肉伽师瓜具有高效的Na+转运效率,其茎中较高的Na+含量可以部分证明。盐胁迫下,八棱海棠株系和中山杉主要将Na+区隔于根部,减少Na+向茎和叶运输[32,34],也有研究表明,黄瓜根系吸收的Na+主要分布于叶和茎中[35],这表明Na+在植物中的分布存在差异。由于绿肉伽师瓜叶片中积累较多的Na+,可能引起叶肉细胞内离子失衡,并积累较多的MDA 和H2O2,且绿肉伽师瓜叶片抗氧化酶(SOD、POD、APX)活性在盐胁迫下未发生显著变化,推测该品种叶片的抗氧化系统已无法起到清除活性氧的作用,说明盐胁迫对绿肉伽师瓜造成了不可逆伤害。绿肉伽师瓜在受到盐胁迫下根系活力在3 个品种中最低,相对膜透性最高,叶片及茎中K+/Na+比值降幅最大,植株在外部形态如株高、叶面积、地上部鲜质量降幅最大,说明绿肉伽师瓜对盐胁迫较为敏感。盐胁迫下,常规伽师瓜根系活力未显著下降,经根系吸收的Na+转运至叶片中的含量显著低于绿肉伽师瓜,说明常规伽师瓜对Na+的转运效率较低,部分Na+可能截留在根中,再分配到茎、叶中,进而减轻Na+的毒害作用。此外,常规伽师瓜在盐胁迫下,脯氨酸含量增幅远高于杂交伽师瓜和绿肉伽师瓜,说明伽师瓜可能通过积累渗透物质调节水分代谢。盐胁迫下,杂交伽师瓜叶片较高的CAT 和APX 活性有助于清除组织内积累过量的H2O2,从而减少盐胁迫引发的氧化胁迫伤害。
3.3 不同伽师瓜品种耐盐性评价
植物的耐盐性是复杂的数量性状,将植物表型与生理生化指标结合起来,评价作物的耐盐性,具有合理性。然而,不同作物品种的同一指标在盐胁迫下的变异较大,无法用某项指标来衡量品种间的耐盐性差异。单一采用隶属函数法评价植物的耐盐性,由于分析指标多,可能存在变异大的现象,易导致结果不准确。笔者的研究认为,伽师瓜耐盐性是综合性状的体现,为避免28 个指标间的信息重叠,用主成分分析法将多指标转换成较少的综合指标,结合隶属函数法,可有效确定主要指标在耐盐胁迫中的贡献率[36]。应用主成分分析法及隶属函数法评价水稻和越橘品种的耐盐性均得到认可[37-38]。李世玉等[12]选用26 份甜瓜材料,测定7 个指标,利用隶属函数法进行综合评价甜瓜耐盐性,筛选出耐盐及敏感的甜瓜材料,这与笔者研究结果不同,主要是由指标数量和试验材料存在差异所致。笔者应用主成分分析结合隶属函数的方法进行综合分析,提取到2 个主成分,通过载荷矩阵分析,获得8个指标作为评价伽师瓜的主要指标,并消除各指标之间的相关影响,再用隶属函数法量化不同伽师瓜品种的耐盐能力,能够较为科学合理地评价伽师瓜的耐盐性。
4 结 论
100 mmol·L-1NaCl 处理使伽师瓜叶片中积累过多MDA 和H2O2,常规伽师瓜通过积累更多的脯氨酸,并维持较高的光合色素含量和根系活力;杂交伽师瓜通过根部积累较多的Na+,叶片启动抗氧化酶清除活性氧。盐胁迫下,绿肉伽师瓜叶片中积累Na+和MDA 含量最高,根系活力最低,质膜受到不可逆的伤害,导致株高、叶面积、地上部鲜质量降幅最大。采用主成分分析结合隶属函数法,量化了不同伽师瓜耐盐性,结果表明常规伽师瓜为耐盐品种,绿肉伽师瓜为盐敏感品种。
