柚皮纤维调节高脂饮食小鼠血脂与肥胖及其与肠道菌群的关系
2023-11-07张倩倩王雪儿王学强张涵鸣莫开菊
张倩倩,袁 林,王雪儿,韩 婕,王学强,张 睿,张涵鸣,莫开菊,*
(1.湖北民族大学生物与食品工程学院,湖北 恩施 445000;2.湖北民族大学 风湿性疾病发生与干预湖北省重点实验室,湖北 恩施 445000)
2021年《中国肥胖防控倡议书》中提出,中国超过50%的成年人和近20%的儿童、青少年存在超重和肥胖问题[1]。肥胖使人患心脑血管[2]、动脉粥样硬化[3]等慢性疾病的危险系数升高。超重使青年人、老年人寿命分别缩短8.4、0.9 年[4]。肠道是维持免疫系统正常的主要器官,其稳态与肥胖的发生密切相关[5]。研究显示,膳食纤维可改变宿主肠道菌群多样性[6],提升拟杆菌门等益生菌丰度[7],其可溶性部分发酵产生的短链脂肪酸可改善机体代谢异常,减少肠道对脂肪物质的吸收,有望成为控制体质量、治疗肥胖药物的替代品。
中国是全球柚子产量较高的国家,柚皮湿质量约占全果质量的50%,含有丰富的膳食纤维,但大多作为果蔬垃圾废弃,不仅浪费资源,也给环境带来了较大的压力[8]。本研究旨在探究柚皮纤维对预防肥胖的效果,并分析肠道菌群与肥胖的关联性,以期为提升柚皮资源利用率、减少环境污染提供参考。
1 材料与方法
1.1 动物、材料与试剂
实验动物:SPF级C57BL/6雄性黑鼠(体质量15~18 g)购于辽宁长生生物技术股份有限公司,生产许可证号:SCXK(辽)2020-0001。
大小鼠维持饲料(生产许可证号:SCXK(辽)2015-0003)购于辽宁长生生物技术股份有限公司;D12492型高脂饲料(生产许可证号:SCXK(京)2018-0006)购于小黍有泰(北京)生物科技有限公司。干预饲料:将D12492型高脂饲料粉碎,分别与占总质量2.5%的果胶、不溶性膳食纤维、原料(未经提取纯化的柚皮纤维)混合均匀,制备果胶饲料、不溶性膳食纤维饲料、原料饲料粉,经挤压成型为直径约1.2 cm的紧实棒状饲料。
恩施白柚购于湖北恩施本地某超市。柚皮原料粉:新鲜柚皮去除黄皮,将白瓤成分清洗干净后脱水粉碎,过80 目筛。柚皮果胶、柚皮不溶性膳食纤维为本实验室自制,过程如下:柚皮原料粉→0.1 mol/L磷酸(料液比1∶20)→在超声频率60 kHz、超声功率640 W、超声温度80 ℃条件下超声1 h→离心(8 000 r/min、15 min)→上清液经80%(体积分数,下同)乙醇反复沉淀,40 ℃下烘干至恒质量,粉碎过80 目筛得可溶性膳食纤维,经傅里叶变换红外光谱鉴定为果胶;沉淀反复用去离子水清洗,40 ℃烘干至恒质量,粉碎过80 目筛得不溶性膳食纤维[9-13]。
血清甘油三酯(triglyceride,TG)、血清总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒 潍坊三维生物工程集团有限公司;肝素钠一次性真空采血管 江苏宇力医疗器械有限公司;10%多聚甲醛 上海源叶生物科技有限公司;DP712 DNA提取试剂盒 天根生化科技(北京)有限公司;Phusion®High-Fidelity PCR Master Mix with GC Buffer、高效高保真酶 美国New England Biolabs公司。
1.2 仪器与设备
BS224S型电子天平 赛多利斯科学仪器(北京)有限公司;TG16-WS离心机 湖南湘仪实验室仪器开发有限公司;DW-HL1010-86 ℃超低温冷冻储存箱 中科美菱低温科技股份有限公司;TMS-1024i全自动生化分析仪 东莞美生实业有限公司;组织包埋机、切片机武汉俊杰电子有限公司;SW-CJ-2FD超净工作台 上海博迅医疗生物仪器股份有限公司;Nova Seq 6000测序仪美国Illumina公司。
1.3 方法
1.3.1 实验分组与流程
健康C57BL/6雄性小鼠75 只,适应性饲养1 周后随机分为正常对照组(normal control group,NCG)、肥胖对照组(obesity control group,OCG)、果胶组(soluble dietary fiber group,SDF)、不溶性膳食纤维组(insoluble dietary fiber group,IDF)、原料组(raw material group,RMG),每组15 只。NCG组饲喂维持饲料,OCG组饲喂D12492高脂饲料,SDF、IDF、RMG组分别饲喂相应干预饲料。实验期67 d,小鼠自由摄食饮水,OCG组小鼠体质量超过NCG组20%时即为实验性肥胖鼠。试验结束后,对小鼠禁食约12 h(不禁水),将小鼠称质量后麻醉解剖,眼球取血后脱臼处死,取肝、脾、肾、附睾脂肪分别称质量,随后将其脏器置于福尔马林溶液中保存备用,脂肪置于专用固定液贮存,小鼠解剖后立即在超净工作台中取肠道内容物于1.5 mL EP管中,置于-86 ℃冰箱中保存,采用干冰运输。血液用一次性真空采血管收集,待全血充分静置后4 ℃、4 000 r/min离心10 min,取血清于离心管中并置于-86 ℃冰箱中备用。
1.3.2 小鼠日均摄食量测定
各组小鼠每日定量添加日粮至(100±2)g,定时回收并称当日余粮质量,计算当日每组小鼠食物摄取量,并据此计算每只小鼠日均摄食量。
1.3.3 体质量及Lee’s指数测定
体质量与Lee’s指数参照涂杜[14]、王静[15]等的方法稍作修改,实验过程中每3 d测一次小鼠体质量,观察各组小鼠的体质量增长规律。在最后一次喂食前测定小鼠的体长(鼻到肛门的距离)与体质量,根据公式(1)计算Lee’s指数。
1.3.4 脏器指数测定
参照廉明[16]的方法,实验结束后称取小鼠肝、脾、肾质量,计算脏器指数(公式(2))与附睾脂肪系数(公式(3))。
1.3.5 血脂生化指标检测
待实验结束,根据宋海昭[17]的方法稍作变动,对小鼠进行眼球取血。按照试剂盒说明书使用TMS-1024i全自动生化分析仪检测小鼠血清中TG、TC、LDL-C、HDL-C浓度。
1.3.6 组织病理切片分析
实验结束后取各组动物的肝脏组织,用10%甲醛固定,石蜡包埋、切片、脱水、固定,用苏木精-伊红染色,显微镜下进行组织病理切片分析。
1.3.7 测序和数据分析
测序采用16SrRNA高通量测序技术,测序区间为16S(V3~V4),引物为341F(5’-CCTACGGGNGGCWGCAG-3’)、806R(3’-GGACTACHVGGGTATCTAAT-5’),采用溴化十六烷基三甲胺(cetyltrimethyl ammonium bromide,CTAB)法提取样品基因组DNA,用2%琼脂糖凝胶电泳检测所提DNA纯度和浓度;随后取适量DNA于离心管中,并用无菌水稀释至1 ng/μL。以稀释后的基因组DNA为模板,根据扩增区域选择使用带编码的特异性引物、Phusion®High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行聚合酶链式反应(polymerase chain reaction,PCR)。PCR产物用2%琼脂糖凝胶电泳进行检测,采用NEBNext®Ultra™ IIDNA Library Prep Kit建库,将构建好的文库进行Qubit和实时荧光定量PCR(quantitative realtime PCR,qPCR)检测;文库检测合格后,使用Nova Seq 6000测序仪的PE250模式进行上机测序。
1.4 数据统计与分析
理化检测结果采用SPSS 21软件进行单因素方差分析及偏相关分析,采用Origin 8.0软件绘图。高通量测序分析采用Nova Seq 6000测序仪的PE250模式处理,采用FLASH软件对样本序列进行拼接;采用fastp软件进行质控;采用Usearch软件去除高质量序列的嵌合体以获得有效序列;采用QIIME2软件中DADA2算法对有效序列进行降噪[18],采用classify-sklearn算法对扩增子序列变异(amplicon sequence varian,ASV)物种进行注释[19];采用R软件中的ade4和ggplot2进行主坐标分析(principal co-ordinates analysis,PCoA)[20];采用adonis和anosim函数分析组间群落结构差异显著性;采用LEfSe软件完成组间显著差异性物种分析。
2 结果与分析
2.1 SDF、IDF、RMG小鼠摄食量分析
如图1所示,5 组小鼠中NCG小鼠摄食量远高于各高脂膳食组,主要是因为D12492饲料含有60%脂肪,能量较高;RMG小鼠摄食量高于OCG、SDF、IDF 3 组,但高脂饮食的4 组小鼠间摄食量无明显差异。表明膳食纤维添加量为2.5%的条件下,其对小鼠摄食量和饱腹感的影响不明显,与向沁雪[21]的实验结果相似。
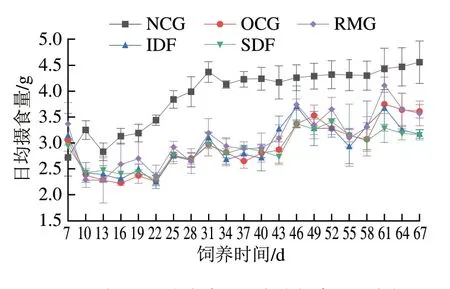
图1 不同组别小鼠实验过程中摄食量的变化Fig.1 Changes in food intake of mice from different groups during the experiment
2.2 SDF、IDF、RMG小鼠体质量分析
如图2所示,NCG小鼠饲养期分为生长期与平稳期,前31 d为生长期,体质量由18 g左右增至22.5 g,此后由生长期进入平稳期,至实验结束,其体质量稳定于24.0 g左右。在整个实验周期内,OCG小鼠与3 个膳食纤维干预组小鼠体质量均快速增加,未见平稳期。至第40天,OCG与RMG小鼠体质量分别比NCG高20.0%、20.9%,RMG小鼠体质量比OCG高1.3%,成为肥胖鼠,但两组小鼠体质量无明显差异;IDF与SDF小鼠体质量较低,两组间无明显差异,分别比NCG高13.2%、13.4%,比OCG低6.3%、6.2%。至实验结束(第67天),OCG、RMG小鼠体质量分别比NCG高28.0%、33.5%;IDF、SDF小鼠体质量分别比NCG高22.1%、21.5%,比OCG低4.9%、5.1%;IDF、SDF两组小鼠体质量与OCG差异明显。结果表明柚皮不溶性膳食纤维和果胶可以有效预防高脂饮食所导致的小鼠体质量增加。
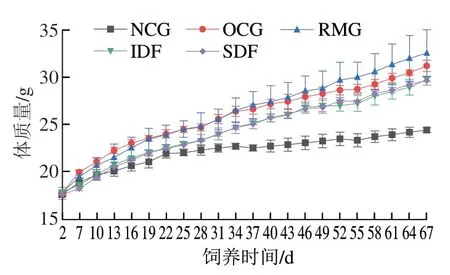
图2 不同组别小鼠体质量变化Fig.2 Changes in body mass of mice from different groups
2.3 SDF、IDF、RMG小鼠脏器指数及Lee’s指数分析
肥胖与肝脏、肾脏、附睾脂肪及体长密切相关,由表1可知,各组小鼠脏器质量间差异显著程度高于脏器指数,因此脏器质量比脏器指数更能反映小鼠的肥胖程度。表征肥胖灵敏度的指标主要有肝质量、肾质量、附睾脂肪质量及Lee’s指数。NCG小鼠肝质量比OCG、RMG降低0.8%~1.1%,比IDF、SDF高8.6%~10.2%;脾质量、肾质量、附睾脂肪质量及Lee’s指数分别比各高脂组低15.4%~20.5%、4.7%~12.1%、47.6%~71.3%、2.8%~12.64%。OCG小鼠肝质量、肾质量、附睾脂肪质量、附睾脂肪系数、Lee’s指数分别比IDF、SDF小鼠高10.4%~11.4%、5.6%~11.8%、24.3%~26.1%、0.44%~0.60%、2.47%~2.54%;RMG小鼠以上指标分别比IDF、SDF小鼠高10.4%~11.4%、8.3%~14.7%、81.4%~84.1%、1.4%~1.56%、3.74%~3.81%。RMG小鼠附睾脂肪系数、Lee’s指数分别比OCG组高0.96%、1.27%,脾质量与IDF、SDF无显著差异。以上结果表明,高脂饮食使脏器及附睾脂肪质量显著增加,柚皮不溶性膳食纤维和果胶可有效控制小鼠脏器及附睾脂肪质量,进而控制体质量,与文献[22]结果相似。各脏器质量及Lee’s指数表征肥胖的灵敏度顺序为附睾脂肪质量>肝质量>肾质量>Lee’s指数。此外,本研究发现RMG小鼠附睾脂肪质量等指标均高于其余各组,该现象值得进行深入研究。

表1 各组小鼠脏器指数及Lee’s指数Table 1 Visceral and Lee’s indexes of mice from different groups
2.4 SDF、IDF、RMG小鼠血脂生化指标分析
血脂生化指标是反映机体肥胖与血脂健康程度的重要指标。由图3可知,TC、TG浓度可以比LDL-C、HDL-C浓度更灵敏地展示各组间的差异。根据TC、TG浓度的显著性分析,可将小鼠分为3 类,即NCG为一类,IDF、SDF为一类,OCG、RMG为一类,同一类中这2 个指标均无显著性差异,但各类间均存在不同程度的差异。NCG小鼠各指标均显著低于其余4 组,其中TC浓度比其余4 组低39.9%~49.8%,TG浓度低13.5%~23.0%,HDL-C浓度低47.7%~50.4%,LDL-C浓度低0~26.7%。IDF与SDF小鼠TC浓度分别比OCG低8.3%、11.4%,LDL-C浓度分别比OCG低14.29%、21.21%,RMG小鼠TC、LDL-C、HDL-C浓度分别比OCG小鼠高7.4%、12.5%、5.44%。这与Kim等[23]的实验结果相似。以上结果说明,高脂饮食对血脂健康十分不利,TC、TG、LDL-C、HDL-C浓度是与血脂健康相关的重要指标,柚皮不溶性膳食纤维和果胶可有效控制血脂,但未经提取纯化的柚皮纤维未显示出控制血脂的益处。
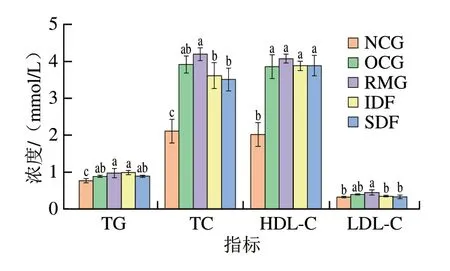
图3 不同处理组小鼠的血脂生化指标Fig.3 Biochemical indexes of blood lipids in mice from different groups
2.5 SDF、IDF、RMG小鼠肝脏组织观察
肝脏是脂肪合成的主要场所,各组小鼠肝脏病理切片见图4。NCG小鼠肝脏中脂肪滴数量明显低于其余各组。OCG小鼠比其余各组多出大量脂肪泡,表明该组小鼠脂肪代谢异常,结合2.3节结果可知该异常导致了肝质量改变。SDF、IDF小鼠脂肪滴数量介于NCG与OCG之间,明显低于OCG,表明柚皮不溶性膳食纤维和果胶干预减少了肝脏脂质堆积。RMG小鼠脂肪滴数量介于IDF、SDF与OCG之间,表明未经提取纯化的柚皮纤维减少肝脏脂肪堆积效果较柚皮不溶性膳食纤维和果胶差。
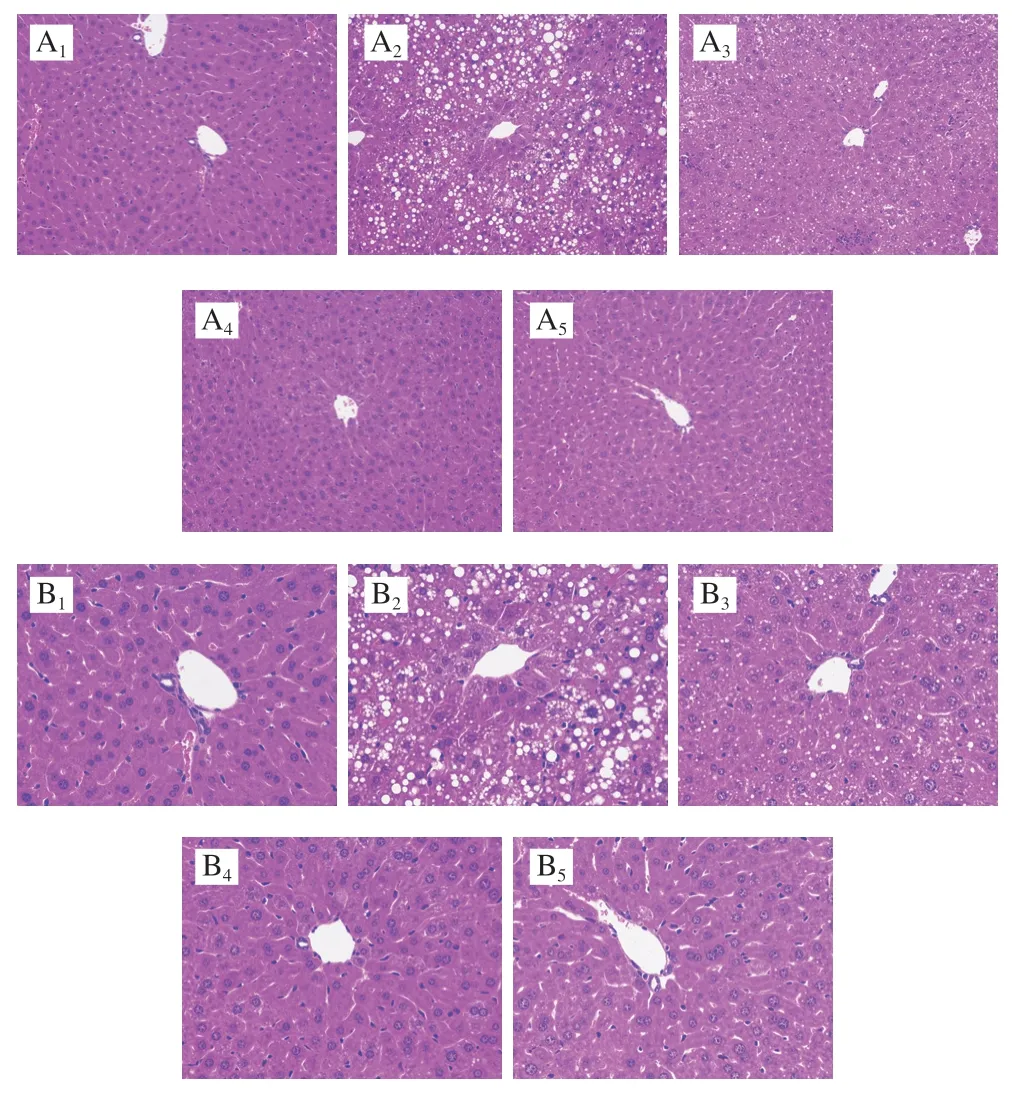
图4 不同处理组小鼠肝脏组织切片组织学变化Fig.4 Histological changes in liver tissue of mice from different groups
2.6 小鼠肠道微生物Alpha多样性分析
由表2可知,各组操作单元分类(oper ational taxonomic units,OTU)覆盖率均超过99.9%,说明测序结果可以较好地展现各组小鼠肠道微生物多样性。Chao1指数越大,Shannon、Simpson指数越高,说明样品中细菌物种总数越多,物种均匀度越好、丰富度越高,其变化趋势与OTU一致。5 组小鼠肠道微生物物种总数由高到底依次为SDF、RMG、IDF、NCG、OCG。SDF、IDF、RMG小鼠物种总数高于OCG小鼠,表明柚皮不溶性膳食纤维、果胶和未经提取纯化的柚皮纤维可不同程度地改善高脂饮食所致肥胖小鼠肠道菌群总数减少的现象。
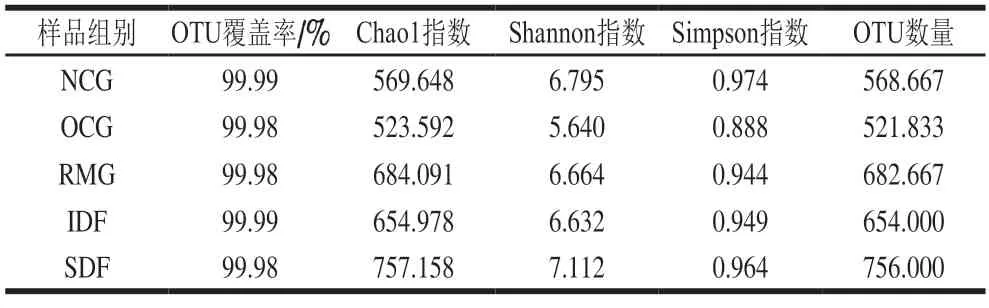
表2 小鼠肠道微生物Alpha多样性指数分析Table 2 Statistic analysis of alpha-diversity indexes of intestinal microbes in mice
2.7 小鼠肠道微生物Beta多样性分析
2.7.1 PCoA
由图5可知,主成分1(PC1)和主成分2(PC2)对区分各组差异的贡献度分别为59.72%、12.51%,总贡献率为72.23%,能较好地体现5 组小鼠肠道群落间分布差异。NCG集中于第3象限,SDF主要集中于第1象限,OCG、RMG、IDF跨越第1、2、4象限,表明NCG、SDF与其余各组群落组成和结构差异较大。RMG、OCG距离较近,分布情况相似,说明两组小鼠肠道群落存在相似的组成结构;IDF分布范围与SDF接近,表明两组小鼠肠道群落存在相似之处,且与RMG、OCG存在差异。
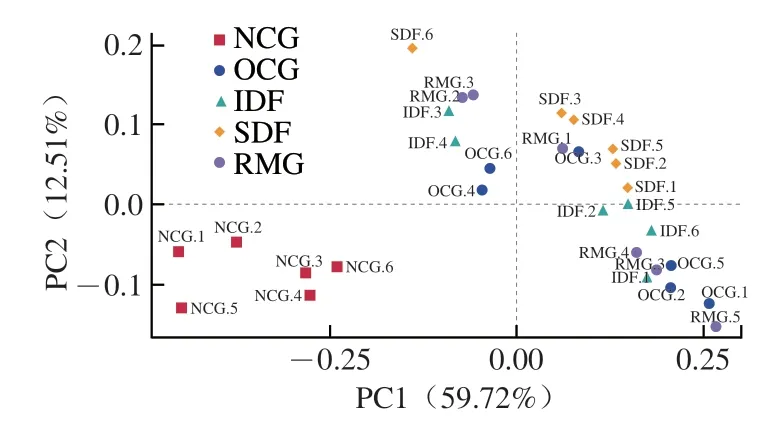
图5 小鼠肠道微生物Beta多样性的PCoAFig.5 PCoA plot of beta-diversity of intestinal microbes in mice
2.7.2 细菌群落差异分析
2.7.2.1 门水平细菌群落差异分析
门水平相对丰度排名前10 位的菌群分别为拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、脱硫菌门(Desulfobacterota)、环孢菌门(Campilobacterota)、螺旋体门(Spirochaetota)、脱铁杆菌(Deferribacterota)、Patescibacteria、变形菌门(Proteobacteria)、广古菌门(Euryarchaeota)与放线菌门(Actinobacteriota)(表3)。
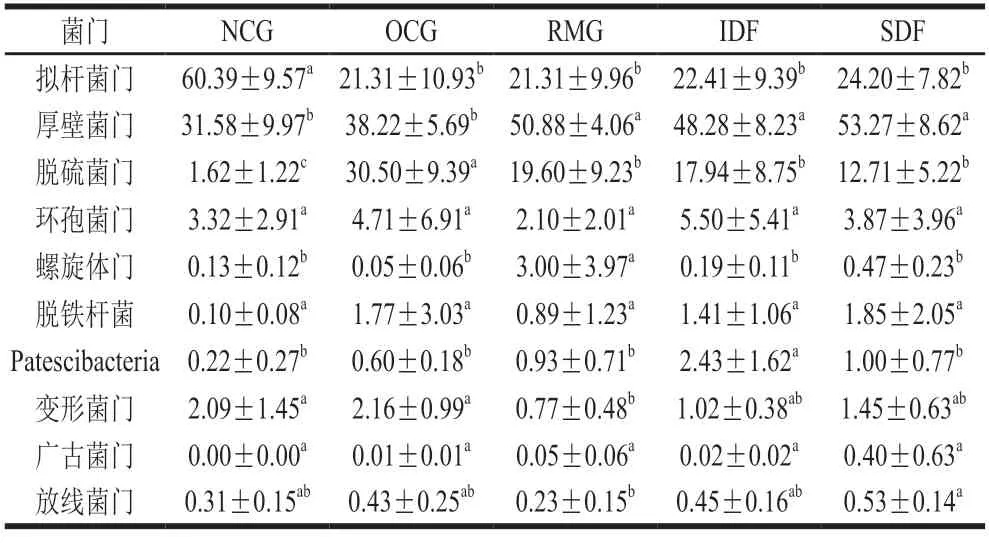
表3 门水平相对丰度排名前10 位的菌群Table 3 Relative abundance of top 10 most abundant bacterial groups at the phylum level%
NCG小鼠拟杆菌门相对丰度显著高于其他各高脂组,厚壁菌门、脱硫菌门、脱铁杆菌相对丰度低于其他各高脂组。与OCG小鼠相比,各膳食纤维干预组厚壁菌门、Patescibacteria、螺旋体门相对丰度均升高。RMG与IDF、SDF小鼠在门水平肠道菌群组成上存在差异。
2.7.2.2 属水平细菌群落差异分析
属水平相对丰度排名前10 位的菌群为Muribaculaceae、拟杆菌属(Bacteroides)、幽门螺杆菌属(Helicobacter)、毛螺菌属(Lachnospiraceae_NK4A136_group)、Dubosiella、粪杆菌属(Faecalibaculum)、罗氏菌属(Roseburia)、链球菌属(Streptococcus)、布劳特氏菌属(Blautia)与Mucispirillum(表4)。

表4 属水平相对丰度排名前10 位的菌群Table 4 Relative abundance of top 10 most abundant bacterial groups at the genus level%
NCG小鼠Muribaculaceae相对丰度显著高于各高脂组,粪杆菌属、罗氏菌属、布劳特氏菌属、Mucispirillum低于各高脂组。与OCG小鼠相比,各膳食纤维干预组小鼠毛螺菌属、Dubosiella及链球菌属相对丰度均升高,罗氏菌属相对丰度降低。RMG小鼠与IDF、SDF肠道菌群在属水平组成上存在一定差别。
2.8 生理指标与菌群组成间的相关性分析
2.8.1 小鼠生理指标与门水平肠道菌群相关性分析
由图6可知,拟杆菌门相对丰度对控制体质量及肥胖(附睾脂肪质量、附睾脂肪系数)显著有益,但与血脂的各项指标均呈负相关,有的达到极显著负相关,因此其对于健康的利弊不明确。厚壁菌门和脱硫菌门相对丰度与体质量、肥胖和血脂指标有相似的相关性,二者与体质量均呈正相关,与附睾脂肪质量、TC及HDL-C浓度呈显著或极显著正相关,但与肝脏指数呈负相关。螺旋体门相对丰度与体质量、附睾脂肪质量、附睾脂肪系数、LDL-C浓度呈显著正相关。

图6 小鼠生理指标与相对丰度排名前10 位的门水平肠道菌群间相关性分析Fig.6 Correlation analysis between physiological indexes in mice and top 10 most abundant intestinal bacteria at the phylum level
如图7所示,拟杆菌门相对丰度与肝脏质量呈显著正相关,与HDL-C浓度呈极显著负相关,与LDL-C浓度呈显著正相关,其相对丰度的升高不利于血脂健康;螺旋体门相对丰度与HDL-C浓度呈显著负相关,其相对丰度的升高可能不利于血脂健康;厚壁菌门相对丰度与HDL-C浓度呈极显著正相关,与LDL-C浓度呈显著负相关,其相对丰度的升高有利于血脂健康。此外,脱铁杆菌相对丰度的升高可能有利于血脂健康。而脱硫菌门、Patescibacteria相对丰度分别对肾脏质量及指数、肝脏质量及肝脏指数有显著影响,但是其对于健康的利弊及机理有待后续探讨。
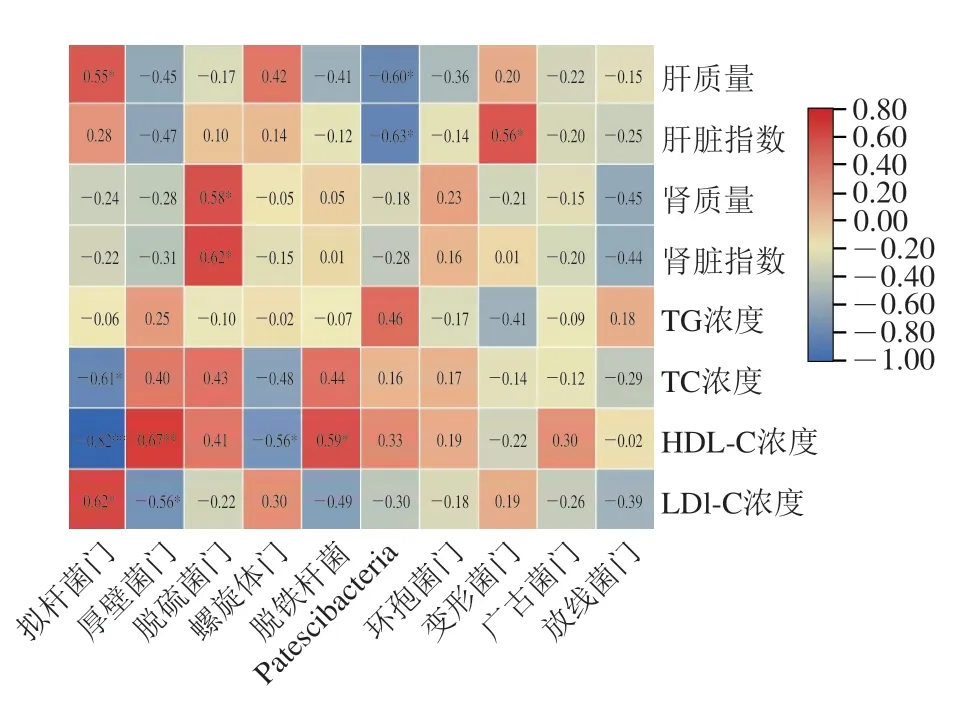
图7 控制体质量变量时小鼠生理指标与相对丰度排名前10 位的门水平肠道菌群间偏相关性分析Fig.7 Analysis of partial correlation between physiological indexes in mice and top 10 most abundant intestinal flora at phylum level when controlling body mass
2.8.2 小鼠生理指标与属水平肠道菌群相关性分析
由图8、9可知,绒毛杆菌属(属拟杆菌门)相对丰度与体质量、附睾脂肪质量及TG、TC、HDL-C浓度呈负相关,控制体质量变量时与肝质量、LDL-C浓度呈正相关,拟杆菌属(属拟杆菌门)相对丰度与肾质量呈负相关,表明拟杆菌门中利于控制体质量的菌属包括绒毛杆菌属和拟杆菌属,而绒毛杆菌属可对血脂产生不利影响。从属于厚壁菌门的毛螺菌属相对丰度与附睾脂肪质量呈正相关,Dubosiella相对丰度与肾质量呈负相关,链球菌属相对丰度与TG、HDL-C浓度正相关,与LDL-C浓度呈负相关,表明厚壁菌门中毛螺菌属可对附睾脂肪相关指标产生负面影响,而Dubosiella与链球菌属则分别有利于控制脏器质量与改善血脂健康。Mucispirillum(脱铁杆菌)相对丰度与HDL-C浓度呈正相关,与LDL-C浓度呈负相关,其相对丰度的升高有利于血脂健康。

图8 小鼠生理指标与相对丰度排名前10 位的属水平肠道菌群间相关性分析Fig.8 Correlation analysis between physiological indexes in mice and top 10 most abundant intestinal bacteria at the genus level
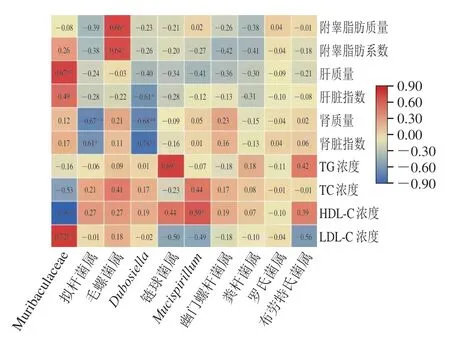
图9 控制体质量变量时小鼠生理指标与相对丰度排名前10 位的属水平肠道菌群间偏相关性分析Fig.9 Analysis of partial correlation between physiological indexes in mice and top 10 most abundant intestinal flora at the genus level when controlling body mass
综上,肠道菌群对肥胖及血脂健康影响微妙且深远,即使其相对丰度的升高使小鼠体质量增加,但不一定对血脂健康有不良影响,同一菌群可能对体质量、脏器和血脂相关指标的影响并不同步,因此肠道菌群与肥胖及血脂健康的关联需要进行更细致和深入的探究。
3 讨论
肠道菌群与肥胖的关联是探究肥胖发生机理及拓宽预防新思路的关键所在。血脂相关指标常伴随机体肥胖发生变化,是研究肥胖的重要指标。研究表明,补充膳食纤维可改变肠道菌群的群落结构,从而改善脂代谢平衡,调控肥胖及血脂变化。
人体实验中,Thompson等[24]证明补充可溶性膳食纤维可降低受试者0.41%(质量分数,下同)的体脂,使受试者体质量平均降低2.52 kg。Ye等[25]发现食用40~48 g/d全谷物膳食纤维可分别使LDL-C和TC浓度降低0.83 mmol/L和0.72 mmol/L。Mayengbam等[26]对53 名肥胖患者进行膳食纤维干预实验,发现膳食纤维干预组患者体质量显著降低,肠道中毛螺菌群丰度显著增加。动物实验中,Andersson等[27]对C57BL/6小鼠饲喂含27%燕麦麸的饲料4 周,小鼠TC含量降低19%。Antonin等[28]对大鼠饲喂含10%豆渣的饲料,发现大鼠体质量周增量降低3 g,TC质量浓度降低14 mg/dL。Wang Haiyuan等[29]给高脂饮食小鼠喂食可溶性膳食纤维,发现小鼠脂肪质量降低,肠道中拟杆菌门丰度增加。
本研究结果表明,NCG小鼠血脂指标、体质量均显著低于高脂饮食组,IDF、SDF小鼠上述指标介于NCG与OCG之间,各组小鼠细菌微生物组成也存在明显差异,表明所造模型合理,补充膳食纤维有助于调控肥胖。16S rRAN高通量测序技术分析结果显示,拟杆菌门及厚壁菌门为肠道优势菌群,且高脂饮食组小鼠拟杆菌门菌相对丰度降低,厚壁菌门相对丰度升高,这与Zhong Yadong[30]、Riva[31]等学者的结论一致。本研究发现厚壁菌门、拟杆菌门对体质量和血脂相关指标的影响并不同步,厚壁菌门相对丰度的升高有利于血脂健康却不利于控制体质量,拟杆菌门的效果与之相反,与文献[32]的结果相似,如从属于拟杆菌门的绒毛杆菌属有利于控制体质量但不利于血脂健康,从属于厚壁菌门的链球菌属、Dubosiella不利于控制体质量但对维持血脂健康有益。此外,本研究结果显示各高脂组小鼠脱铁杆菌、脱硫菌门的相对丰度增加,其中脱铁杆菌主要由Mucispirillum属组成,与文献[33]的结果相似,这两个菌门可能是引起肥胖的重要菌群[34]。
分析小鼠理化指标结果及其与肠道菌群之间的关联性,总结柚皮膳食纤维对预防肥胖及调节肠道菌群影响的结果如下:
补充柚皮膳食纤维对预防肥胖有效,其机理并不全是通过增加饱腹感以抑制摄食量,与前人研究结果相似,其主要是通过影响肠道微生物丰度从而影响宿主的生理健康。本研究中柚皮不溶性膳食纤维、果胶可控制体质量,与OCG小鼠相比,SDF和IDF小鼠体质量分别降低5.1%、4.9%。而未经提取纯化的柚皮纤维却导致小鼠体质量增加。但RMG小鼠摄食量与IDF、SDF相比略高,体质量明显增加,甚至高于OCG,未经提取纯化的柚皮纤维导致体质量增加的原因值得深入研究。
补充柚皮膳食纤维可有效降低肥胖小鼠脏器质量,减少附睾脂肪堆积并维持血脂健康。与OCG小鼠相比,IDF、SDF小鼠脏器指数、脏器质量、附睾脂肪质量、Lee’s指数、TC浓度、LDL-C浓度降低,HDL-C浓度升高,说明补充柚皮不溶性膳食纤维、果胶可有效控制血脂,而未经提取纯化的柚皮纤维却未显示出控制血脂的益处。
补充柚皮膳食纤维可有效改善肥胖小鼠肠道菌群物种多样性。SDF、IDF小鼠拟杆菌门及厚壁菌门中毛螺菌属相对丰度增加,从而抵抗宿主肥胖,这与朱宏斌等[35]发现肥胖宿主体内拟杆菌门丰度显著降低,厚壁菌门、脱铁杆菌丰度显著升高,毛螺菌属可显著抵抗肥胖,及Chen Tingting[36]、Petia[37]等发现柚皮不溶性膳食纤维、可溶性膳食纤维显著增加猪肠道中拟杆菌门丰度的结论一致。补充柚皮不溶性膳食纤维、果胶可降低可能导致肥胖的脱硫菌门、脱铁杆菌及厚壁菌门的相对丰度,这与Fleissner等[38]发现肥胖小鼠体内拟杆菌们含量降低,厚壁菌门含量升高的现象一致。
肠道菌群对体质量、脏器质量及血脂相关指标的调控并不同步。拟杆菌门及其从属菌相对丰度的升高利于控制小鼠体质量,但不利于控制血脂;厚壁菌门相对丰度的变化对小鼠体质量影响不明显,但其相对丰度的升高有利于降低血脂;脱硫菌门、脱铁杆菌相对丰度的升高不利于控制体质量,但对血脂具有正面影响;脱铁杆菌调控血脂相关指标的能力可能与Mucispirillum具有抵御沙门氏菌引发的肠道炎症相关[33]。
综上,本研究证实补充柚皮膳食纤维可有效预防肥胖且改善小鼠肠道菌群稳态,同时揭示了部分肠道菌群相对丰度与血脂、肥胖间的关联性,尤其补充柚皮不溶性膳食纤维、果胶效果较好,这使靶向预防肥胖成为可能,但其代谢通路、作用机制及有效剂量仍需深入研究。
