Ru 负载复合半导体光热催化H2O 还原CO2
2023-11-06杨舜苨梅晋豪洪佳楠黎昌棋许辰宇张彦威
杨舜苨,梅晋豪,洪佳楠,黎昌棋,许辰宇,张彦威
(浙江大学 能源高效清洁利用全国重点实验室, 浙江 杭州 310027)
0 引 言
利用太阳能光热催化CO2制备太阳能燃料是如今以及未来应对能源与环境问题的重要手段。自1972 年藤岛昭和本多健一使用TiO2作为光催化反应的催化剂以来,TiO2在太阳能光转换和CO2还原等领域广泛应用,已成为极具应用潜力的光催化剂。但TiO2对太阳能光谱利用率低,仅利用占全光谱5%的紫外光。因此,将TiO2光谱响应范围由紫外光区向可见光区扩展已成为目前的研究方向之一[1]。
研究表明,通过半导体复合的方式对TiO2进行改性,可以显著提高催化效率;混合性能优良的光热协同半导体材料可以提高CO2转化反应的碳选择性。而Ru-Al2O3被认为是CO2转化极具潜力的催化剂[2],Ru-Al2O3的贵金属中心与Al2O3之间形成一种协同机制,这种机制能防止催化剂的形貌和晶体结构发生变化[3],提高其稳定性和可再生性,继而可以提高催化剂材料的热稳定性和反应的碳转化性[4]。
本文采用构建复合半导体和负载等离激元金属的改性手段,通过混合TiO2、Al2O3、CuAl2O4三种氧化物并改变铜钛比与Ru 负载的方式,制备了一系列兼具光热响应的催化剂。在模拟太阳光源照射下进行 CO2和 H2O 催化转化实验,并通过一系列实验表征手段初步探究了铜钛比和Ru金属纳米颗粒负载对光热催化性能的影响。
1 实验
1.1 催化剂的制备
该研究采用液相水解法,对TiO2进行半导体复合改性得到具有p-n 异质结的TiO2、Al2O3、CuAl2O4的复合纳米光热催化剂(简称CuAT),并且由Ru 金属纳米粒子负载得到光利用率和甲烷选择性更好的催化材料,实现催化材料对光热协同转化CO2更优的催化效果。所用到的催化剂内不同元素的配比见表1,负载质量分数为1%的Ru。制备催化剂所用到的化学试剂均由国药集团化学试剂有限公司提供。催化剂表征需要用到能谱仪(Energy Dispersive Spectrometer, EDS)、透 射 电 镜(Transmission Electron Microscope,TEM)、X 射 线 衍 射 仪(X-ray Diffraction,XRD)、紫外可见漫反射光谱法(Ultraviolet-visible Diffuse Refelction Spectroscopy, UV-vis DRS)、光致荧光光谱法(Photoluminescence Spectroscopy,PL)。

表1 催化剂材料内元素配比
Ru 负载异质结半导体催化剂样品制备过程(以Ru/CuAT-20 为例):称取13.5 g 硝酸铝粉末以及0.72 g 硝酸铜,加入45 ml 无水乙醇搅拌15 min。称取5.13 g 钛酸四丁酯,逐滴加入上述的溶液,60 ℃恒温搅拌。搅拌15 min 后,加入3.46 g 柠檬酸,恒温80 ℃加热1 h。将所得的溶液100 ℃干燥4 h 后,900 ℃煅烧2 h,取出研磨过筛。称取0.105 g 的十二羰基三钌,分散在无水乙醇中形成悬浊液,加入0.5 g 煅烧后的样品粉末,70 ℃干燥20 min。干燥后的样品在300 ℃下热处理2 h,取出研磨过筛。
1.2 催化剂性能检测
光热协同催化CO2转化反应系统如图1 所示,主要由光源系统、进气系统、反应系统、检测系统组成。
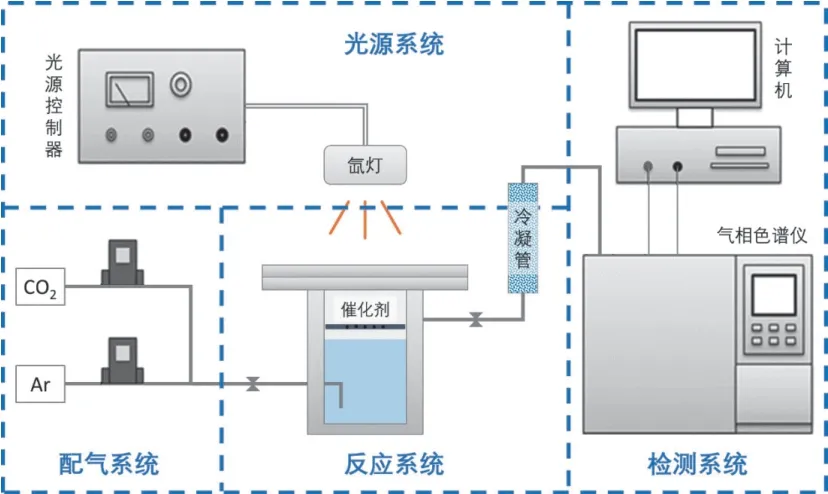
图1 光热协同催化转化CO2 和H2O 实验系统
具体操作步骤为:对催化剂样品进行预处理,称取20 mg 的Ru/CuAT 样品,加入适量的去离子水,利用超声震荡仪使样品在水相中呈悬浊液的状态。待其均匀分散后,尽快将样品均匀地滴在石英纤维滤膜的中心位置,放入烘箱中充分干燥(烘箱温度为80 ℃)。干燥完成后,放入上文所述的反应器,密封后,通入CO2,将反应器内的气氛完全置换后,维持CO2流量为4 ml/min 开始光照,反应生成的气体由氩气带入气相色谱仪。每隔20 min 对反应器内的气体使用气相色谱进行检测。
2 结果与讨论
2.1 催化剂性能评价
采用CuAT-5、CuAT-10、CuAT-20、Ru/CuAT-5、Ru/CuAT-10、Ru/CuAT-20 六组样品进行光热协同催化CO2转化实验,反应开始后,在30 min内气体产率将会达到一个稳定值。稳定后的产率结果如图2 所示,其中碳选择性和气体产率的计算公式如下:
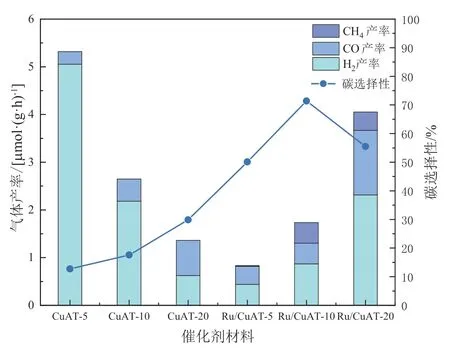
图2 光热协同催化转化CO2 和H2O 反应的气体产率及碳选择性
结果表明:随着铜钛比的升高,反应的碳选择性提高,但H2的产率显著下降,这是由于铜钛比的增加会抑制析氢反应(Hydrogen Evolution Reaction,HER)。而当Ru 负载后,碳的选择性进一步提高,且随着铜钛比的增加,气体产率明显升高。这是由于Ru 可能成为TiO2电子和CuAl2O4空穴的复合中心,三者可能形成Z 型异质结,异质结结构示意图如图3。因此,铜钛比增加,异质结数量增多,气体产率升高。
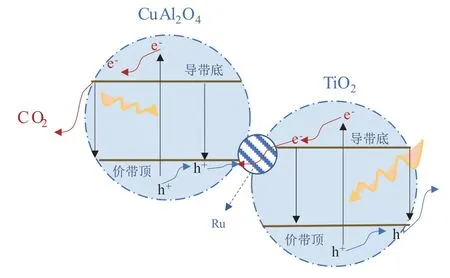
图3 Ru、CuAl2O4 和TiO2 三者构成的Z 型异质结示意图
由下述表征可发现:Ru 负载后材料的光响应能力和光热转化能力有明显提升,但气体总产率无显著增加,反而降低。这是由于在生成CH4的过程中需要转移8 个电子,而生成H2只需转移2个电子,转化为CH4反应难度大。Ru 负载后反应倾向于生成更不易产生的CH4和CO。因此,氢气的产率无显著增加,反而降低,这导致了气体总产率无明显提高,而碳选择性则大幅度提高。
Ru 负载后碳选择性大幅度提升,是由于Ru的负载可以促进CO2还原反应(Carbon Dioxide Reduction Reaction,CRR)。Ru 金属能作为CO2分子的吸附和活性位点以及电子陷阱,促进CO2在催化剂表面的吸附,当CO2分子与活性位点接触时,中心金属Ru 可提供电子促使CO2发生还原反应生成CH4,且能有效地促进电子的迁移,抑制由于形成肖特基势垒而产生的光生电子-空穴对的复合[5],有利于CO2的多电子还原反应。且Al2O3与Ru 之间由相互作用力产生的表面协同效应进一步增强反应活性,促进CO2向CH4的转化。
2.2 形貌与晶格结构
Ru/CuAT-5、Ru/CuAT-10、Ru/CuAT-20 的TEM 和EDS 图谱分别如图4、图5 所示。

图4 Ru/CuAT-5、Ru/CuAT-10 和Ru/CuAT-20 的TEM 图
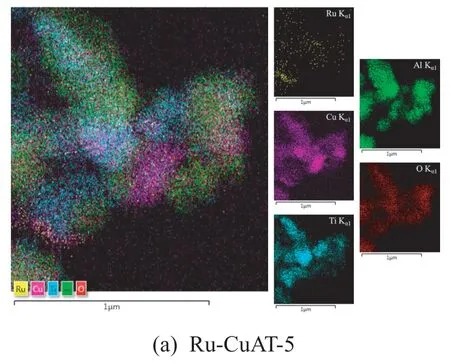
图5 Ru/CuAT-5、Ru/CuAT-10 和Ru/CuAT-20 的EDS 图
EDS 分层图像表征出三种样品对应位置均含有Ru 元素。在Ru/CuAT-5 和Ru/CuAT-20 中Cu、Al 和O 的高密集区基本相似,而与Ti 的密集区有一定的差别。Ru/CuAT-10 中,从其密集的程度来看,Al 和O 元素的分布较为一致。通过对比Ru 和Ti、Cu、Al 的密集区位置可以发现,Ru与Al 的分布相对均匀,而Ti 总体分布不均,因此可判断Ru 主要负载于Al2O3。
而结合TEM 和EDS 的图像可知,Cu、Al 和O 这三种元素的密集区基本一致,但Ti 元素的分布并未与Cu、Al 很好地结合在一起。
对样品继续进行XRD 表征,分析结果如图6。催化剂主要是由CuAl2O4、Al2O3和TiO2混合而成。根据其衍射峰的面积可以估算Cu、Ti 的摩尔比基本符合预期,具体数据可见表2。

图6 Ru/CuAT-5、Ru/CuAT-10 和Ru/CuAT-20 的XRD 图

表2 三种材料在催化剂中的质量分数
2.3 光学吸收性质
紫外可见吸收光谱(UV-vis DRS)是分子外层电子吸收辐射后发生电子跃迁而形成的反映材料光学性能的表征手段之一。六个样品的UV-vis DRS 如图7 所示,负载Ru 后CuAT 在可见光和近红外波段吸光能力有明显提升。并且,随着铜钛比的升高,材料在可见光和近红外波段吸光度总体呈递增趋势,在紫外波段吸光度下降。
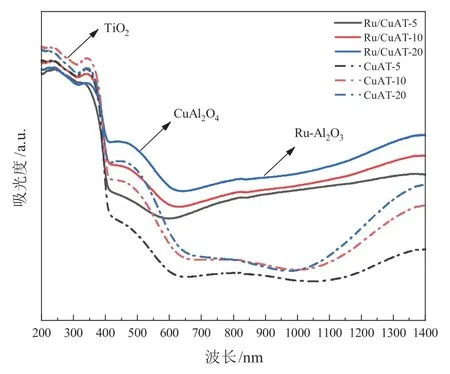
图7 六种催化剂材料的紫外可见吸收光谱
由于TiO2对紫外光利用率高,在紫外波段决定催化剂吸光度的主要为TiO2,因此当铜钛比增加,钛的相对含量减少,在紫外波段的吸光度下降。而在可见光波段(400~640 nm),通过对比催化剂材料和CuAl2O4的UV-vis 图谱[6],可发现在此波段影响材料吸光度的主要是CuAl2O4。在可见光(640 nm 以上)和近红外波段,Ru 金属纳米粒子的局域表面等离子共振(LSPR)效应有效提高了材料的光响应[7]。并且,对比图11 材料的温升曲线可知,Ru 负载后材料的光热性能显著提高,光热效应明显,因此Ru 负载后在可见光波段和近红外波段材料的吸光度显著提高。
根据以上UV-vis DRS 的结果,计算出CuAT和Ru/CuAT 的具体带隙(分别见图8、9)。结果表明:复合纳米催化剂中CuAl2O4和TiO2可能构成了异质结,且随着铜钛比的升高,半导体的带隙不断变窄。
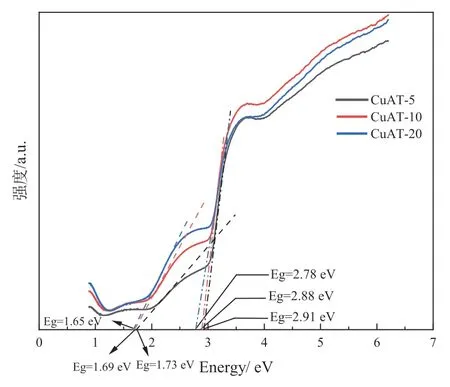
图8 不同铜钛比的CuAT 带隙

图9 不同铜钛比的Ru/CuAT 带隙
由图8、9 可知,催化剂中含有TiO2和CuAl2O4两种半导体,其中TiO2属于n 型半导体,带隙宽度一般为3.2 eV[1],而CuAl2O4属于p 型半导体,带隙宽度为1.80 eV[8]。因此,当铜钛比上升时,催化剂的带隙会逐渐向CuAl2O4接近。此外,当这两种半导体掺杂在一起时,会构建p-n异质结,在构建的过程中,由于TiO2本身的费米能级高于CuAl2O4,电子会从TiO2流向CuAl2O4直到两者拥有统一的费米能级。这种推动有利于光生电子和空穴的形成,提高催化剂的整体活性[9]。
从Ru 负载前后的带隙可发现,Ru 负载后,复合催化剂材料的带隙减小,当纳米 Ru 颗粒受可见光照射时,其局域表面会产生很强的电磁场,在电磁场的影响下 Ru 颗粒的近场自由电子被激发为热电子,热电子越过能垒到达CuAT 表面参与还原反应形成光致氧空位,这提高了材料在可见光波段的吸收能力,扩展了材料可利用的光谱[6]。
2.4 载流子分离性能分析(PL)
太阳能光热协同催化的首步为材料吸收太阳光能,超过带隙能量的光激发价带电子跃迁到导带,而后发生光生电子空穴对分离与复合,最后剩余迁移到表面的电子与空穴参与表面氧空位的形成或直接与表面吸附的基团反应。PL 可用于表征光生电子空穴对的辐射复合率,其结果如图10所示。

图10 六种催化剂材料的光致发光光谱
由图10 可看出:6 个样品均在波长420 nm到480 nm 之间出现峰,Ru 未负载的峰高明显高于Ru 负载CuAT 的峰高。当未负载Ru 时,CuAT-10 的光致发光强度远强于其他两个铜钛比的材料。从三种催化剂的升温曲线(见图11)可知,CuAT-20 的温度远高于CuAT-5 和CuAT-10,由此推测,CuAT-20 的非辐射复合的比例可能大于CuAT-5 和CuAT-10,这样的结果导致了CuAT-20 的光热转化性能优于前两者。
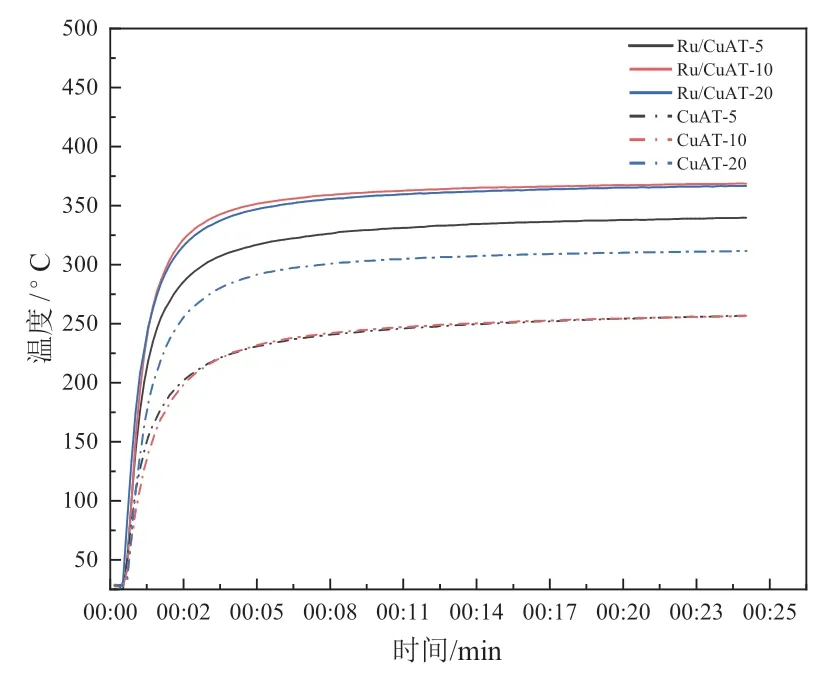
图11 六种催化剂材料的温升曲线
负载了Ru 纳米颗粒后,材料的光致发光强度显著降低,这说明了Ru 能有效抑制光生电子与空穴的复合,促进了光生电子与空穴的分离,使得更多的光生电子能够参与进CO2的转化反应。
2.5 光热转化性能分析
将催化剂均匀地镀在石英器皿上,后将其放进反应器内密封,在干燥的环境下通入氩气,待反应器内气氛置换完全后,打开氙灯光照(氙灯以最大工作电流22 A 照射),得到催化剂表面的温升曲线(如图11)。
结果表明:负载了Ru 后,材料最终稳定的温度明显提升,由此可见其光热转化性能有明显提升。由于Ru 的纳米颗粒在负载之后拥有集体光热效应,即等离子体纳米催化剂最重要的光学特性不是单个吸收截面,而是整个样品的吸收。纳米颗粒温度的升高是在整个样品中传播的,并且是连续的,没有纳米级的特征。换而言之,样品在受到光照温度升高除了自身的影响外,还受到Ru 纳米颗粒的影响,能有效地提高整个样品的热效应[10]。
Ru 未负载时,铜钛比升高,材料的热效应增强。由图7 可知,铜钛比升高,材料在可见光和近红外波段吸光能力增强,从而总体对光的利用能力增强;因此铜钛比升高, CuAl2O4的含量增加,光热转化性能提高。
3 结论
在前期研究的基础上,采用液相水解法制备了以复合半导体为载体,负载了Ru 金属纳米颗粒的催化剂。在模拟太阳光源照射下进行CO2和H2O 催化转化实验,实现了H2、CO、CH4等产物的合成。结果表明:改性后的材料光热催化性能有明显的提高,可实现光热催化H2O 还原CO2制备气体燃料,反应过程中的碳选择性提高到原来的1.86~4.06 倍。
负载Ru 金属纳米颗粒的催化剂的光响应性能提升极为明显,材料在太阳光全波段,尤其是可见光近红外波段的吸收度有很大的提升。并且,由于Ru 金属能作为CO2分子的吸附和活性位点,促进CO2在催化剂表面的吸附,促进了CO2还原反应(CRR),Ru-Al2O3的存在提高了CO2转化反应中的碳选择性。且由于Ru 的纳米颗粒在负载之后拥有集体光热效应,Ru 负载后材料的光热转化性能也明显提升。但因为反应倾向于生成不易产生的CH4和CO,气体总产率无明显升高,甚至下降,而碳选择性大幅度提高。
合适的铜钛比可改变产物的选择性。由于TiO2与CuAl2O4复合,合适的铜钛比有利于两者构建p-n 异质结,从而利于光生电子和空穴的分离和迁移,提高催化剂的整体活性。且随着铜钛比增加,材料的带隙越接近于CuAl2O4,即带隙降低,可利用的波长范围增加,对太阳光的利用效率提高。
