生物可吸收血管内支架的现状
2023-11-06武玙璠汤超杰
武玙璠,汤超杰,王 武
经皮冠状动脉介入治疗术(percutaneou scoronary inter vention,PCI)作为治疗血管类疾病的有效手段,自诞生来历经四次技术革新(图1)。1977年瑞士的Andreas Gruntzig 率先行球囊成形术治疗人严重的冠脉狭窄,从此拉开PCI 的帷幕。1986 年金属裸支架(bare metal stent,BMS)首次成功植入人冠状动脉,一定程度上克服了球囊成形术导致的血管急性闭塞和再狭窄等不良事件,被视为PCI 的第二次革新[1]。1999 年诞生的药物洗脱金属支架(drug-eluting stent,DES)能有效地抑制新生内膜的增生,明显降低了支架内再狭窄的发生率,成为PCI的第三次革新;但长期随访发现存在支架内皮化不完全与支架段血管异常的舒缩反应等现象,同时由于金属支架固有的不可吸收性引起的慢性炎症,最终可导致晚期和极晚期支架内血栓形成,以及血管的再狭窄甚至闭塞[2-4]。近些年来,随着科学技术和材料学的发展,以聚合物和(或)金属为原料制备的生物可吸收支架(bioresorbable stent,BRS)有望克服远期的再狭窄等不良事件,理论上来讲其有助于恢复血管重塑,可使血管恢复至天然生理结构与功能,因此被视为PCI 的第四次技术革新。
1 生物可吸收聚合物支架
作为最具前景的生物可吸收聚合物支架,其制造材料包括乳酸(lactide)、乙醇酸(glycolide)和己内酯(caprolactone)家族合成的聚合物(polymer)和共聚物(copolymer),例如聚L-乳酸(poly-L-lactic acid,PLLA)、聚D-乳酸(poly-D-lactic acid,PDLA)、聚D、L-乳酸(poly-D,L-lactic acid,PDLLA)、聚ε-己内酯(PCL)和酪氨酸聚碳酸酯聚合物(PTD-PC)等[5]。其中PLLA 和PCL 是最基本也是最常用的生物可吸收材料,其生物相容性良好,通过水解的方式以可控的速率在机体降解吸收,终产物无毒无害。生物可降解聚合物支架的载药与传统金属支架相同——抗增殖类免疫抑制剂及其衍生药物:西罗莫司、诺维莫司、依维莫司、紫杉醇和雷帕霉素相关衍生药物等,大量试验证实了其可以显著抑制新生内膜增殖并降低荷支架段再狭窄的发生率。该类支架的药物洗脱过程取决于载药的种类、数量及载药方式,例如支架表面刻槽,填入内含药物的聚合物小分子,亦或将一定比例的聚合物与药物混合物通过浸涂或喷涂法等涂布于支架表面,因此聚合物支架既是携带药物的载体,又是药物释放的平台。生物可降解聚合物支架历经数年不断研发与改进,终于2011年雅培公司研发的ABSORB 支架[6]横空出世,正式拉开了可吸收聚合物支架的帷幕,见表1。

表1 代表性生物可吸收聚合物支架概况
1.1 ABSORB BVS 支架
ABSORB BVS 支架是目前唯一开展了全球临床研究的球囊扩张式生物可吸收药物洗脱支架。早期ABSORB 支架为桥接式失相锯齿形环箍,改进后的ABSORB 支架主要有以下优势:①桥接式同相锯齿形环箍,提供了更均匀的血管壁支撑力和药物输送。②改进的制造工艺导致聚合物的体内吸收速度降低,从而在更长时间周期内保持支架的机械完整性,有利于病变血管的正向重塑[7-8]。动物实验发现体内支架质量随着时间而减少:12 个月时减少了30%,18 个月时减少了60%,在24 个月时支架完全吸收,整个吸收过程从乳酸单元间的酯键水解开始,使PLLA 和PDLLA 中的长链逐渐缩短,乳酸在乳酸脱氢酶的作用下转变成丙酮酸,进入线粒体通过Krebs 循环,最后生成二氧化碳和水[9]。
自2008 年起开展的前瞻性、开放性的ABSORB Cohort A 试验和多中心单臂ABSORB Cohort B 试验均取得了良好的临床效果,于是ABSORB 支架在2011 年取得CE 认证,进入欧洲市场。2015 年在ABSORB Ⅲ试验后,取得美国食品和药品管理局(Food and Drug Administration,FDA)批准,广泛应用于临床[23]。然而为期3 年的ABSORBⅡ试验发现ABSORB BVS 组的器械导向复合型终点(包括心源性死亡、靶血管心肌梗死和临床指征的靶病变血运重建)发生概率显著高于DES 组,且晚期管腔狭窄发生率高[24]。2017 年的Meta 分析收集了7 项ABSORB 支架临床试验,数据分析表明,在过去2年的随访中相比于传统药物洗脱支架,该款支架后期临床并发症过高[25]。虽然随后的ABSORB Ⅳ试验[26]改进了支架释放方式,但经评估后,该支架仍存在一定的安全问题,于2017 年撤出全球市场。
1.2 DESolve 支架
DESolve 支架是继ABSORB BVS 支架之后,第二款获得CE 认证上市型生物可吸收聚合物支架。与上述ABSORB BVS 支架相比,该支架的吸收时间更短(<2 年)且安全压力阈值更高,具有自身独特的“自我矫正”特性,可避免支架错位或贴壁不良等现象[27]。2015 年开展的为期2 年的DESolve Nx 试验表明,该支架能有效地抑制新生内膜增生和高效的内皮覆盖率[10]。目前最新一代DESolve 支架提高了可视化程度,预安装在专用球囊(TRASFORMTM)上,可避免植入过程中血管边缘剥离和过度损伤,围绕该款支架正在开展多中心DESolve NXT BRS临床试验[12]。
1.3 Fantom 支架
Fantom 支架是一款含碘的可视化可吸收血管支架,该款支架可通过CT(computed tomography)等非侵入性手段对支架在体内动态降解吸收过程进行定期追踪随访监测。主干材料包括低分子量的碘化双酚和聚乳酸低聚物,其径向压缩强度可达0.22 N/mm,血管急性回缩发生率极低。为期6 个月的FantomⅡ试验[5]证实了其良好的临床疗效与安全性。该支架以高度可视化为亮点,于2017 年取得CE 认证,在欧洲临床应用。
1.4 MeRes 100 支架
MeRes 100 支架是最新一代取得CE 认证的目前市场上最薄的生物可吸收支架,厚度仅为100 μm,2~3 年内完全吸收。该款支架有着独特的杂合式网孔设计(开、闭环相结合)[12]。先后进行了MeRes-1和MeRes-1 Extend 试验[15],充分证实了MeRes 100支架的临床可靠性和安全性。
1.5 NeoVasTM 支架
NeoVasTM是我国自主研发的一款生物可吸收支架,鉴于首次人体试验(first-in-man,FIM)取得了不错的试验结果,随后的随机对照试验(randomized controlled trial,RCT)试验[21]证实该支架有着与传统钴铬合金依维莫司药物洗脱支架(CoCr-EES)相似的临床效果,于2019 年成为国内首个国家食品药品监督管理总局批准的医用可吸收支架。
1.6 XINSORB 支架
XINSORB 是我国首个自主研发的生物可吸收支架。2012 年开展的临床前试验,结果表明该支架性能与DES 无显著差异[12]。随后长达5 年的临床随访中,主要终点靶病变失败率(target lesion failure,TLF)为13.3%,主要不良心血管事件发生率(major adverse cardiovascular,MACE)为16.7%[22],证实了XINSORB 支架长期良好预后。
对于生物可吸收聚合物支架来讲,即便使用了相同的材料,但不同的制作工艺生产出不同分子量聚合物材料,最终的性能也千差万别。正如,Onuma等[8]发现高分子质量(321 kDa)PLLA 涂层支架在体内耐受性更好,局部释放药物效能更高,而低分子质量(≈80 kDa)PLLA 涂层支架更易诱发剧烈的炎性内膜反应。目前来看,市场上可吸收聚合物支架具有诸多优势,但也存在一些不可忽视的缺点:①吸收过程中产生代谢性酸性物质,易引起机体局部炎症反应;②绝大多数可吸收支架可视化程度不高,不利于手术植入定位和后期无创性随访。目前市场中Reva,ReZolve,ReZolve 2 和Fantom 支架中混合碘元素,不仅在植入过程中可实时观察支架扩张状态,也实现了对支架吸收行为的动态检测;③机械性能远不及金属支架,如PLLA 等材料的拉伸强度在45~70 MPa 之间,而钴铬合金可达到1 499 MPa,因此聚合物支架径向强度较弱,同时后期支架逐渐吸收,导致晚期支架回缩十分明显,可能导致血管内再狭窄,影响血管正向重塑。与此同时,可媲美传统金属支架的可吸收金属支架逐渐崭露头角,其优越的“表面吸收”模式,避免了聚合物支架的“整体吸收”模式导致的血管基质再生不良、血管再狭窄等问题。
2 生物可吸收金属支架
可吸收金属作为医学植入物相关记载可追溯至17 世纪,但直到21 世纪初才开始应用于心血管疾病的治疗。纯铁是首个进行试验的材料,到如今镁基、铁基和锌基合金支架层出不穷,大量动物和临床试验有效地证明了可吸收金属支架在体内的生物安全性和良好的临床疗效。目前主要使用铁、镁、锌以及它们和稀有元素构成的合金作为可吸收金属支架材料,见表2。
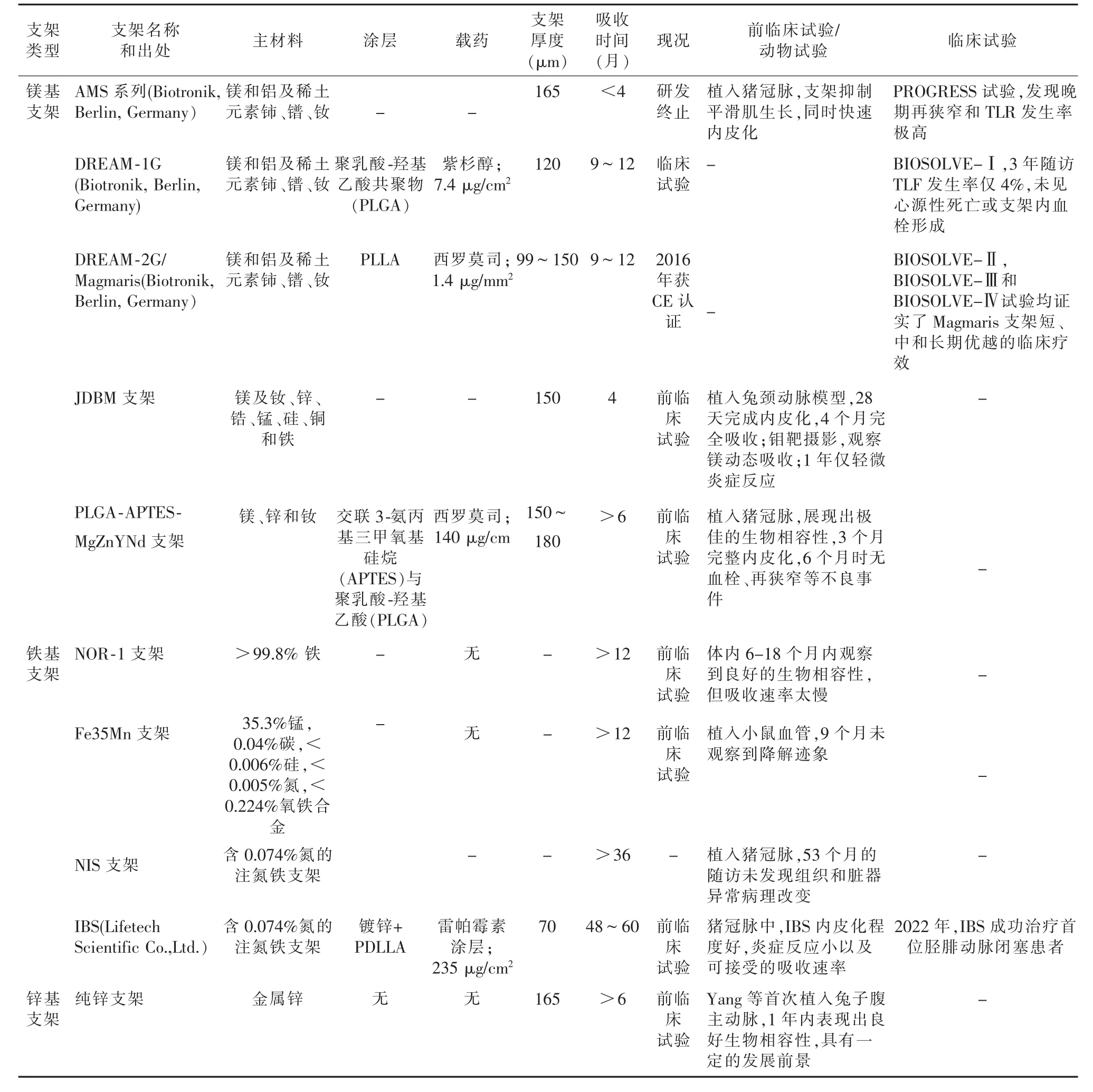
表2 可吸收金属支架的概况
2.1 铁基合金支架
铁作为人体内必须的微量元素,是参与体内新陈代谢最重要的辅因子,也是大脑中含量最丰富的过渡金属元素。与镁、锌等金属元素相比,纯铁有着优越的柔韧性和延展性,但体内降解吸收速度十分缓慢,带来一定困扰[28]。2003 年,Peuster 等[29]首次将NOR-1(>99.8% 铁)支架植入兔降主动脉,术后6~18 个月的随访证实了纯铁支架植入体内的安全性和可行性,但纯铁支架存在吸收周期过长、低清除率和大量吸收产物体内堆积等局限性。尽管随后研制出Fe35Mn 支架和NIS 支架(含0.074%氮的注氮铁支架)分别改善了支架的磁化率和径向支撑力,但铁基支架吸收速率缓慢仍是一大难题。目前,IBS 支架是全球首个商业化的生物可吸收铁基支架,IBS 支架由三层结构组成:载药层、纳米金属锌颗粒和注氮铁平台,亮点是超薄的支架设计(70 μm)。Zheng 等[30]将IBS 与传统钴铬合金依维莫司药物洗脱支架(CoCr-EES)植入猪冠脉中,进行了长达7 年的随访,证实了IBS 及其降解产物的长期安全性,同时说明降解产物似乎通过淋巴系统排出体外。临床应用方面,Sun 等[31]将IBS 用于治疗1 例80 岁患有胫腓动脉(TA)闭塞的患者。这是IBS 植入胫后-腓动脉首例报道,为未来下肢血管疾病的治疗提供了新思路。目前关于铁基合金支架体内试验报道过少,其临床价值尚待进一步证实。
2.2 镁基合金支架
镁离子作为人体内第四大最常见的阳离子,参与体内300 多种酶的合成,是体内不可或缺的重要成分。基于金属镁的抗凝作用,并能够抑制内皮素-1 诱导的血管舒缩运动和促进内皮细胞增殖及抑制平滑肌细胞增殖的特性,2003 年Cockerill 等[32]首次对镁合金支架AE21 开展体内外试验,发现该支架良好的生物相容性,但存在吸收速度过快和血管内膜过度增生等缺陷。
AMS-1 是第一代生物可吸收金属镁支架,2007年开展的PROGRESS AMS 试验[33]充分肯定了该支架的安全性,及有助于恢复病变部位血管正常舒缩功能等优势,但其吸收速率过快容易导致再狭窄。随后调整各金属成分比例、支架的结构和表面涂层抗增殖药物等相继研发出AMS 系列、DREAM-1G、DREAM-2G 和DREAM-3G 支架。其中DREAM-2G(又称Magmaris 支架)于2016 年成为首个获得CE 认证的生物可吸收金属支架[34-36]。通过系列BIOSOLVE试验充分证明了DREAM-2G 长期可靠的生物安全性[34]。最新一代DREAM-3G 在载药和支架设计方面不断改进,支架更薄,仅99~150 μm,12 个月内完全吸收,目前正在进行临床试验中[37]。
近些年来,国内镁基可吸收支架的研究也取得不错的进展,例如上海交通大学丁文江院士团队自主研发的交大镁合金支架(JDBM),植入正常兔颈动脉,进行长达20 个月的随访研究发现JDBM 支架在28 d内迅速完成内皮化,这项长期的结果进一步肯定了JDBM 支架作为可吸收金属支架的生物安全性和可行性[38];同时改良的JDBM 覆膜支架进行兔侧壁动脉瘤的治疗,取得了令人满意的效果[39]。Liu 等[40]研发了PLGA-APTES-MgZnYNd[poly(lactic-co-glycolic acid)-(3-aminopropyl)trimethoxysilane-MgZnYNd]支架,为期6 个月的试验发现内皮化达到75%,支架机械强度完整性维持超过6 个月,充分证实了该支架良好的生物相容性和安全性。
2.3 锌基合金支架
金属锌作为人体必需的微量元素参与调节许多生理活动,相关研究表明,锌具有抗动脉粥样硬化的潜在作用,通过介导凋亡相关信号通路,维持血管内皮的完整性。Bowen 等[41]首次对金属锌体内吸收过程进行研究,其结果显示锌吸收速率可达到10~20 μm/y,几乎接近于理想的生物可吸收材料的标准(20 μm/y)。Yang 等[42]将纯锌支架植入兔子腹主动脉,为期12 个月的动物试验发现纯锌支架前6 个月可以保持机械支撑的完整性,12 个月时支架吸收过半,未出现炎症反应和明显的内膜增生,说了锌在体内良好的吸收行为和可靠的生物相容性。有研究者将不同比例的锌铁合金材料植入大鼠的皮下和股骨组织中,结果发现该合金在体内表现出均匀地吸收模式,有利于维持机械完整性,可显著提高内皮细胞的生存率和抑制平滑肌细胞,进而促进血管重塑。目前,锌作为第三代可吸收金属支架材料,基于其理想的体内降解吸收行为,可调控的机械强度和令人满意的生物相容性,有望成为未来可吸收金属支架的主力材料。
3 理想的BRS
3.1 BRS 与血管重塑
支架植入后的血管修复过程,涉及血栓形成、炎症、细胞增殖和迁移等一系列生理反应。支架内皮化延迟或不完全都会引起支架内血栓形成和荷支架段再狭窄(in-stent restenosis,ISR)甚至闭塞,而邻近病变部位内皮细胞的迁移、增殖和内皮祖细胞归巢黏附和定向分化是荷支架段血管内皮化的关键。此处不得不提到“ 血管重塑(vascular remodeling)”这一适应性生理反应,即当血管受到微环境如血流量和剪切应力等变化后,针对其结构和功能进行相应调整,以尽可能维持正常的剪切应力、壁张力和血流量。而支架植入后的血管重塑,尤其是负性重塑与血管内再狭窄的发生密不可分[43]。重塑类型通常用重构指数(remodeling ratio,RR)来判断,即病变处血管的外管壁面积与邻近正常血管的外管壁面积比值。若RR>1.05,称为正性重塑(positive remodeling);RR <0.95,为负性重塑(negative remodeling)[44]。其中血管中膜血管平滑肌细胞(VSMCs)异常增殖、迁移和复杂的表型转换是血管负性重塑的主要原因。
支架植入后血管重塑的时间周期是有规律可循的,前3 个月属于血管组织结构重建时期,第1个月进行血管正性重塑,3~6 个月属于血管恢复期,存在正负性重塑,决定远期预后;术后12 个月血管重塑完成。对于BRS 而言,至少前6 个月维持其机械完整性,以提供足够的径向支撑力,6~12 个月期间,最好第9 个月开始以非常缓慢的速度在体内降解吸收,最终在12~24 个月时完全吸收(见图2)。目前市场上支架载药均为雷帕霉素及其衍生物,抑制平滑肌细胞的增殖,进而抑制内膜增生,预防ISR;但同时抑制了内皮细胞,这是血管内皮修复延迟的主要原因,再者过早完全地释放药物也极易出现晚期支架内血栓(late stent thrombosis,LST)的形成。数十年来很多学者积极探索既能抑制平滑肌细胞增殖,又能促进内皮细胞的支架载药,联合载药和/或纳米材料技术近些年来取得了一些成果[45],但仍局限于动物试验。而我国中药提倡内外平衡,如三七总皂苷[46]具有修复和促进内皮细胞,抑制平滑肌细胞增殖及抗炎反应等功效,无疑为新型支架的载药提供新的思路。
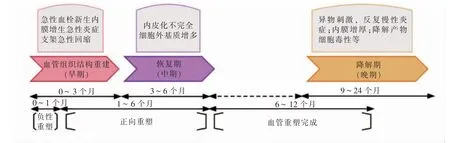
图2 支架术后血管重塑过程示意图
3.2 理想的BRS 相关因素
理想的BRS 主要与以下8 个因素密切相关(见图3)。首先BRS 材料的生物相容性尤为重要,包括体外实验评估BRS 材料本身和吸收产物的细胞毒性、血液相容性、诱变/致癌及细胞生物功能等。其次是BRS 的机械强度,必须满足正常血管的舒缩功能,其结构设计同样重要,不同的血管路径需要匹配不同结构的BRS。再者就是BRS 释放方式,自膨式相对于球囊扩张式而言,靶血管的损伤小,进而引起负性重塑的概率降低。目前所有BRS 的材料需要表面修饰促进早期内皮化,早期内皮化程度高可以避免内膜过度增生和再狭窄等问题。支架表面修饰改性目前常见的有金属支架药物涂层、表面覆载药生物薄膜及支架定向凹槽内填充药物,但无论何种技术,均存在药物释放过快过早这一难题,因此支架药物的释放是值得进一步研究的课题。当然BRS 的吸收过程需要与血管重塑相匹配,至少6~12 个月开始吸收,24 个月完成吸收。最后BRS 的可视化也不可忽视,绝大多数可吸收支架可视化程度不高,不利于手术植入定位和无创性随访,尤其是磁共振成像随访。

图3 理想BRS 的基本要素
3.3 BRS 的发展
BRS 最突出的优势在于具有恢复血管正常结构和生理功能的潜力,在完成预防血管负性重构和释放药物等功能后自动吸收消失。与金属支架相比,可吸收聚合物支架顺应性更高,潜在消除慢性炎症反应,帮助血管正性重塑。再者,BRS 可以钝化易损斑块,同时预防新发动脉粥样硬化[47]。BRS 也有利于后续治疗,有望缩短患者“双抗”治疗周期。但是,BRS 仍存在一些亟待解决的难题,譬如与金属支架相比较,其厚度较大,干扰血流动力学平衡,不利于植入和早期内皮化进程。可喜的是越来越多的新型和改良后的生物可吸收支架不断涌现,包括采用新颖的制造技术、全新吸收材料和优化的表面修饰,如3D 打印(three dimensional printing)生物可吸收支架,其优点在于个性化快速定制相应的血管支架,一次成型,极大地节约了材料和时间[48-49]。相信在不久的将来,随着科学技术的改进和提高,3D 打印生物可吸收支架有望成为临床血管内支架的主力军。
