光谱CT多参数定量评估胃腺癌病理分化程度及Lauren分型
2023-11-06叶露李之珺高绪杰李绪斌刘海威叶兆祥
叶露,李之珺,高绪杰,李绪斌,刘海威,叶兆祥*
1.天津医科大学肿瘤医院放射科,国家恶性肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心,天津 300060;2.飞利浦(中国)投资有限公司,北京 100600;*通信作者 叶兆祥 yezhaoxiang@163.com
胃癌是我国最常见的消化道恶性肿瘤,发病和死亡人数均高于大多数发达国家[1],手术和化疗是最有效的治疗手段。影响胃癌治疗、预后的相关因素包括病变大小、浸润深度、病理分型、淋巴结转移、分化程度与Lauren分型等[2]。目前胃癌确诊主要依靠有创检查如胃镜活检或术后病理,但由于取材位置和数量有一定局限性,容易出现误差,治疗前提供无创、有效、定量的影像诊断,对指导临床决策具有重要意义。目前关于胃癌组织学分化的影像学研究多依据肿瘤在传统CT的形态学特征及相关参数。光谱CT不仅成像快速、辐射剂量低,还可通过后处理提供虚拟单能级图像、碘密度(iodine concentration,IC)及有效原子序数(effective atomic number,Z-eff)等多种光谱参数进行定量分析[3],在肿瘤术前诊断中具有广泛的应用前景,但目前对于40 keV低能级和Z-eff评估胃癌分化程度及Lauren分型的研究较少,特别是利用Z-eff评估Lauren分型的研究少见。本研究拟通过对胃腺癌光谱CT图像中各光谱参数进行测定,评估、探讨其对于病理分化程度及Lauren分型的诊断价值,以期为临床选择治疗方案和评估预后提供更有价值的参考信息。
1 资料与方法
1.1 研究对象 回顾性分析2019年10月—2021年12月天津医科大学肿瘤医院经手术病理证实的134例胃癌的临床及影像资料。男97例,女37例;年龄30~82岁,平均(60.94±9.80)岁。纳入标准:①检查前未行任何放疗、化疗、靶向及免疫治疗等;②检查后1周内行手术治疗并获得病理分型、分期及分化程度;③病理诊断为T2~T4期;④图像质量符合诊断要求。排除标准:①病灶过小或显示不清导致无法测量;②CT增强检查禁忌证。本研究经本院伦理委员会审批(Ek2020125),豁免患者知情同意。
1.2 检查方法 使用双层探测器光谱CT(IQon Spectral CT,Philips)行上腹平扫及增强检查。检查前禁食8 h,饮水800~1 000 ml。患者取仰卧位,扫描范围从膈顶至左肾下极水平或盆腔,扫描参数:准直器宽度64 mm×0.625 mm,管电压120 kV,管电流采用自动智能mAs调控技术(78~145 mAs),X线管转速0.5 s/周,螺距0.969,层厚、重建厚度均为1.5 mm,层间距0.5 mm。经肘前静脉注射碘海醇(300 mg/ml),剂量1.5 ml/kg,速度2.8~3.0 ml/s,注射后25~30 s、50~60 s、120 s行动脉期(arterial phase,AP)、静脉期(portal venous phase,PP)与平衡期扫描。
1.3 光谱参数定量分析方法 扫描后在Philips IntelliSpace Portal v6.5星云光谱工作站对AP和PP光谱基图像进行后处理,生成单能级图像、IC图像及Z-eff图像。由2名具有3年及5年以上经验的放射科初级及中级医师阅片,选取肿瘤显示最大层面勾画感兴趣区(ROI),软件自动生成40 keV低能级CT值(CT40keV)、IC、Z-eff值,所有测量重复3次取平均值。为减少因对比剂注射及扫描参数产生的误差及循环时间、血容量引起的个体差异,在IC测量时选取肿瘤同层面腹主动脉的IC为标准参考值,计算病变IC值/主动脉IC值,得到标准化碘浓度(normalized iodine concentration,nIC)。所有ROI直径>病灶厚度1/2,面积20~30 mm2,避开血管、坏死、囊变及周围脂肪。
1.4 病理分析
1.4.1 分化程度 ①高分化腺癌:恶性程度低,多排列成柱状,细胞异型性不明显,核分裂少见,腺管及腺泡结构清晰;②低分化腺癌:恶性程度高,成片状或实质状排列,仅存在灶性腺样结构或黏液分泌,细胞异型性明显,核分裂多见;③中分化腺癌:病理表现介于以上两者之间。根据术后病理结果将中分化及高分化胃癌分为中高分化组46例,低分化组胃癌88例。
1.4.2 Lauren分型[4]①肠型:肿瘤病灶内可见腺管样结构,癌细胞成柱状,可见肠上皮化生;②弥漫型:病灶内无腺管结构,癌细胞散在呈弥漫性生长;③混合型:肿瘤病灶内可见腺管结构及弥漫分布的癌细胞,各成分所占比例≥5%。
1.5 统计学分析 应用SPSS 22.0软件。符合正态分布的计量资料以±s表示,两组比较采用独立样本t检验,3组比较采用单因素方差分析,两两比较采用LSD检验;不符合正态分布者以M(Q1,Q3)表示,两组比较采用Mann-Whitney U检验,多组比较采用Kruskal-Wallis H秩和检验,两两比较采用Nemenyi检验。将差异有统计学意义的参数绘制受试者工作特征(ROC)曲线,采用Medcalc 15.6.1软件计算曲线下面积(AUC),评价诊断效能,确定最佳诊断阈值,使用Delong检验比较AUC的差异,再进行二元Logistic回归分析,得到低分化胃癌和Lauren分型弥漫型胃癌的独立预测因子。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌分化程度
2.1.1 低分化组与中高分化组比较 低分化组胃癌动、静脉期各光谱参数值均高于中高分化组,差异有统计学意义(P<0.05),见表1及图1、2。

表1 低分化组与中高分化组胃癌动、静脉期光谱参数比较

图1 男,64岁,胃癌。胃窦及胃体下部胃壁增厚并明显强化,动脉期测量病灶CT40 keVAP 150.0 Hu(A)、ICAP 1.23 mg/ml、nICAP 0.18(B)、Z-effAP 8.03(C);静脉期测量病灶CT40 keVPP 259.4 Hu(D)、ICPP 2.53 mg/ml、nICPP 0.47(E)、Z-effPP 8.61(F);术后病理(G)为中分化腺癌,Lauren分型为肠型(HE,×100)

图2 男,42岁,胃癌。胃小弯侧胃壁增厚并明显强化,动脉期测量病灶CT40 keVAP 202.8 Hu(A)、ICAP 1.95 mg/ml、nICAP 0.25(B)、Z-effAP 8.35(C);静脉期测量病灶CT40 keVPP 394.9 Hu(D)、ICPP 4.15 mg/ml、nICPP 0.87(E)、Z-effPP 9.26(F);工线术后病理(G)为低分化腺癌,Lauren分型为弥漫型(HE,×100)
2.1.2 ROC曲线及Logistic回归分析 对差异有统计学意义的参数绘制ROC曲线(图3),各参数AUC及诊断阈值见表2。nICPP的AUC最大为0.786,与CT40keVPP及Z-effPP比较差异有统计学意义(Z=2.071、2.257,P<0.05);与其余参数差异无统计学意义(P≥0.05)。当诊断阈值为0.52时,诊断低分化胃癌的敏感度为62.5%,特异度为80.4%。nICPP为诊断低分化胃癌的独立预测因子(OR=0.005,95% CI 0.000~0.469,P=0.022)。

表2 各光谱参数诊断低分化胃癌的AUC及诊断阈值
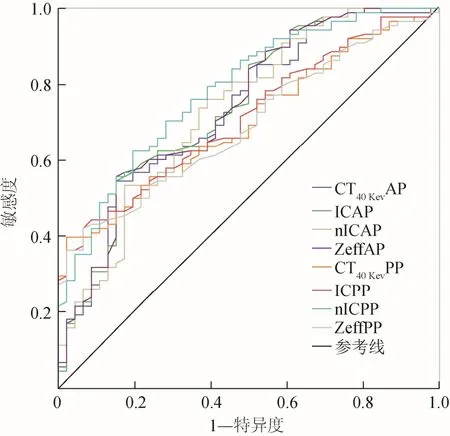
图3 各光谱参数诊断低分化胃癌的ROC曲线
2.2 胃癌Lauren分型
2.2.1 不同Lauren分型组间比较 根据术后Lauren分型结果分组,弥漫型43例(32.09%),其中低分化型41例(95.35%)、中高分化型2例(4.65%);混合型45例(33.58%),其中低分化型27例(60.00%)、中高分化型18例(40.00%);肠型46例(34.33%),其中低分化型20例(43.48%)、中高分化型26例(56.52%)。
动脉期弥漫型、肠型和混合型胃癌的各光谱参数值依次减小,差异无统计学意义(P≥0.05);静脉期弥漫型、混合型和肠型胃癌的各光谱参数值依次减小,差异有统计学意义(P<0.05)。肠型和混合型胃癌间各光谱参数差异均无统计学意义(P≥0.05),混合型及弥漫型胃癌仅nICPP差异有统计学意义,肠型及弥漫型胃癌静脉期各光谱参数值差异均有统计学意义(P<0.05),见表3及图1、2。
2.2.2 ROC曲线分析评估相关参数的诊断效能 对组间比较差异有统计学意义的参数绘制ROC曲线(图4),各参数AUC及诊断阈值见表4。nICPP的AUC最大为0.704,与其余参数的AUC差异无统计学意义(P≥0.05),当诊断阈值为0.55时,诊断弥漫型胃癌的敏感度为69.8%,特异度为71.4%。nICPP为诊断弥漫型胃癌的独立预测因子(OR=0.041,95% CI 0.002~0.903,P=0.043)。
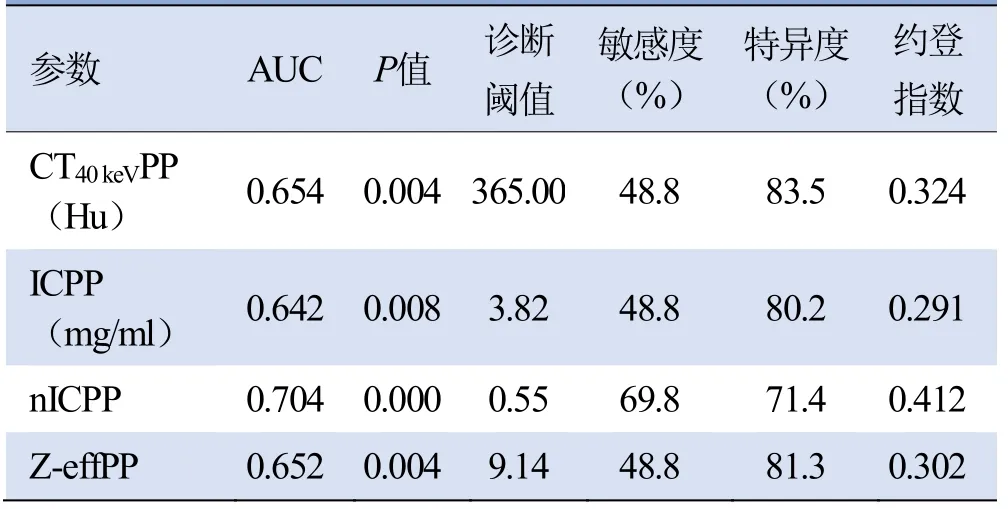
表4 各光谱参数诊断弥漫型胃癌的AUC及诊断阈值
3 讨论
胃腺癌是一种上皮组织来源的恶性肿瘤,其病理分化程度及分型不同导致形态学结构和生物学行为不同,手术方式选择、化疗疗效和预后也存在明显差异。目前已证实组织分化程度是影响胃癌预后的独立危险因子,且与淋巴结转移密切相关,而淋巴结转移也是影响预后的重要因素[5]。最新研究表明Lauren分型也是影响胃癌患者预后的独立危险因素[6],其中弥漫型预后最差,总生存期最短[7],对化疗反应率最低[8]。本研究使用Spectral CT View软件导入光谱基图像数据,勾画一次ROI可以同时直观得到CT40keV、IC、Z-eff值,可重复性及可行性更高,通过测量和计算比较其在不同分化程度及Lauren分型胃癌中的差异,选择具有诊断意义的参数,可更好地在术前协助临床诊断。
3.1 光谱CT评估胃癌分化程度 本研究显示,低分化组胃癌在动、静脉期的CT40keV、IC、nIC、Z-eff均显著高于中高分化组,表明光谱CT参数可以有效地反映胃癌病理学分化程度。胃癌的构成包含排列紧密而丰富的毛细血管网,肿瘤组织分化程度越低,肿瘤细胞生长越活跃、迅速;且分化程度低的肿瘤组织血管生长因子的分泌明显增加,直接或间接诱导新生血管形成,导致微血管密度增高,肿瘤血供更加丰富。肿瘤新生血管不同于人体成熟的毛细血管,无基底膜或基底膜不连续,管壁通透性较正常血管高,导致血容量进一步增加[9],增强检查注射对比剂后对碘的摄取速度提高且总量增多[10]。王学东等[11]证实能谱CT IC及nIC可以客观反映组织的强化情况,从而了解肿瘤微循环的状态。吉玉刚等[12]研究表明,肿瘤分化程度和碘含量呈负相关,可以通过碘含量确定肿瘤分化。Li等[13]通过对胃癌的分化程度与能谱CT参数相关性的研究,认为分化程度越低,IC及nIC值越高。本研究结果显示,肿瘤分化程度越低,碘摄取越明显,IC及nIC越高,与既往研究结果一致。
3.2 光谱CT评估胃癌Lauren分型 本研究中弥漫型胃癌在动、静脉期各光谱参数值均高于肠型及混合型胃癌,可能由于弥漫型胃癌恶性程度高,较肠型及混合型胃癌组织分化差,低分化腺癌、印戒细胞癌所占比例较高[14],本组弥漫型胃癌中低分化型占95.35%,与既往研究相符。Lauren分型3组胃癌仅静脉期各光谱参数有显著差异,这可能与血流动力学机制有关,由于动脉期成像过早,碘造影剂尚未完全进入肿瘤,导致血管密度差异不明显,而静脉期肿瘤新生血管摄碘更充分,更能反映弥漫型胃癌微血管密度。弥漫型与肠型胃癌在静脉期各光谱参数有显著差异,弥漫型胃癌新生血管丰富,血管通透性、血容量及血流量更高,碘摄取更多。张梦梅等[15]研究显示弥漫型胃癌nIC、IC和能谱曲线斜率大于肠型胃癌,与本研究结果一致。而混合型与弥漫型仅nICPP有显著差异;肠型和混合型各光谱参数无显著差异,可能因为混合型胃癌兼具弥漫型及肠型胃癌特点,但更接近肠型[16]。
3.3 光谱CT各参数的诊断价值 虚拟单能级图像是通过高低能量数据集计算得到的相当于单一能量射线下的CT图像。既往对食管、直肠及胰腺的研究[17]表明,光谱CT在40 keV具有最大诊断效能,软组织分辨率、对比噪声比和信噪比较好[18],因此本研究采用40 keV能级图像进行分析。随着能级降低,碘对比剂等高原子序数物质的CT值明显增高,增加了异常强化病灶与正常背景组织的对比度,可以显示更微弱的造影剂强化,提高病灶的检出。Z-eff是某种元素与物质的X线吸收衰减系数一致时,该元素的原子序数[19],可以通过色彩量化的方式,直观呈现为彩色编码图,目前在胃癌诊断应用较少。Z-eff与物质的组成成分和比例有关,碘元素比人体内大部分物质的Z-eff高,碘元素摄取升高时,Z-eff随之增高。因此利用40 keV、Z-eff测量病变对碘元素的摄取,同样具有较高的精确性和可靠性[20]。
本研究以碘摄取后肿瘤微循环为基础,分化程度较差的肿瘤血管已建立完善,虽然对碘剂的摄取增多,但同时也要考虑肿瘤病灶供血与微循环的关系,包括对比剂的流出、外渗及进入细胞间隙滞留。ICPP不仅可以评价肿瘤血管对造影剂的摄取,还可以反映造影剂在组织间隙的浓度,可以更好地评价肿瘤血管生成后的血供平衡状态[21]。碘浓度受对比剂总量、个体循环等影响,选用同层面主动脉做参考可减少个体差异,计算nIC结果更加准确。本研究中,nICPP诊断低分化型胃癌及Lauren弥漫型胃癌的AUC均最高(0.786、0.704),诊断效能最优,且均为其独立预测因子。
3.4 本研究的局限性 ①中、高分化胃癌病例数相对较少,可能存在选择偏倚。②人为设置ROI,主观干扰较大,且ROI选取位置与术后病理取材位置未逐一对应。③目前关于Z-eff的胃癌诊断研究较少,有待进一步研究,相互佐证。后续研究需要进一步扩大样本量,探讨胃癌分化程度及Lauren分型与更多光谱参数的相关性,为其术前诊断提供更多支持与帮助。
总之,双层探测器光谱CT对于胃癌分化程度及Lauren各分型的鉴别诊断具有一定的价值,能提供多种定量参数如40 keV低能级CT值、IC、nIC、Z-eff值等,其中nICPP鉴别诊断效能最高,具有一定的临床应用价值。
