3D打印的PU支架复合CA以及PRF促进软骨再生的研究
2023-11-06杨梦琪全雅琦曾子瑜王忠山
杨梦琪 全雅琦 曾子瑜 王忠山
长期以来,外耳廓缺损的主要临床修复方法包括外科整形手术和赝复体修复。 外科手术主要是切取患者自体肋软骨后进行雕刻后移植,不仅造成患者供区损伤,而且临床技术敏感性高,难以推广。赝复体修复则存在材料老化变色、固位困难等问题[1]。
近年来,组织工程耳廓软骨成为替代传统耳廓重建方法的选择。如Cao等[2]和Jia等[3]应用聚乳酸、聚羟基乙酸、聚己内酯等可完全降解的生物材料制成人耳廓支架,将支架与软骨细胞复合后进行体外研究和动物实验,最终构建出人耳廓形态软骨。但是过量的酸性降解产物蓄积后易引起局部炎症反应,而且支架不规律降解后难以长期精确维持耳廓软骨形态。李生杰等[4]曾选择生物相容性好、不可降解的医用聚氨酯(polyurethane,PU),通过熔融沉积技术快速成型出一种外形逼真、机械强度可调的皮下植入式人耳廓支架,在一定程度上解决了支架难以长期维持耳廓精确形貌的难题,但是后续实验证实软骨细胞在单纯的PU材料表面粘附性差、死亡率高,且形成的软骨组织与材料结合性差,易于撕脱[5]。
因此,本研究拟利用软骨细胞聚集体(chondrocyte aggregates,CA)结合富血小板纤维蛋白(platelet rich fibrin,PRF),改善PU支架表面微环境,提高软骨细胞接种后的成活率、增殖速率以及维持软骨表型。其中CA技术是将软骨细胞在富含抗坏血酸的高糖培养液中进行复层诱导,在体外形成一种由大量细胞外基质严密包裹软骨细胞的膜状结构。在软骨细胞接种至生物材料表面时,CA技术可以有效地保持交联的细胞连接状态和成软骨微环境, 从而减少移植时的细胞流失,提高细胞存活率[6]。PRF凝胶是一种具有三维纤维蛋白网络结构的富含血小板的全血提取物。纤维蛋白附着于PU支架后,可提高细胞在材料表面的黏附能力,其降解吸收后的产物又可对CA起到营养和支持的作用[7]。PRF中富含的血小板可缓释多种生长因子,如血小板衍生生长因子(platelet derived growth factor,PDGF)、转化生长因子β(TGF-β)等,约为全血的3~8 倍之多,根据文献报道,PRF对软骨细胞的生长、迁移、软骨基质形成均有不同程度的促进作用[8]。
该研究拟利用3D打印的PU多孔支架长期维持重建软骨形态,通过CA和PRF技术改善细胞接种至PU孔隙时的成软骨微环境,从而改善PU多孔支架的成软骨效果,为今后特定形态的软骨缺损再生提供一种新型的组织工程解决方案。
1 材料与方法
1.1 实验动物
实验在获得空军军医大学第三附属医院伦理委员会批准(批号: 2022kq012),于空军军医大学第三附属医院动物中心完成。1 月龄雄性新西兰大白兔3只,体重1.2~1.4 kg,用于获取原代兔耳廓软骨细胞;6 月龄健康新西兰大白兔10 只,雌雄不限,体重2.4~3.2 kg,用于由耳中央动脉提取PRF;2.5 月龄雄性免疫缺陷鼠16 只(北京维通利华实验动物技术有限公司),用于PU/CA/PRF复合体异位移植实验。
1.2 实验试剂及仪器
PU(Alberdingk Boley,德国);3D 打印机(北京殷华);H-DMEM高糖培养基、胎牛血清、PBS(Hyclone, 美国);CCK-8试剂盒(江苏碧云天);0.25%胰蛋白酶(北京雷根);进口分装 ELISA 试剂盒(R&D 公司,美国);抗兔COL-II抗体(Santa Cruz Biotechnology,美国); DAB标记II抗(北京中杉金桥);细胞孵箱(Thermo SCIENTIFIC,美国);反转录PCR仪、实时定量分析仪、实时定量分析软件(Bio-Rad 公司,美国);Synergy HT酶标仪(BioTek,美国);超净工作台(苏州AIRTECH);扫描电镜(S-4800;Hitachi 公司,日本)。
1.3 PU支架的制备
利用计算机辅助设计(computer aided design,CAD)软件设计PU支架试件,材料设置为15 mm×15 mm×5 mm的长方体,孔径为400 μm, 孔隙率控制在60%。将设计对象转换成STL格式,输入3D打印机。调整3D打印机相关属性参数(喷头直径400 μm,扫描速度30 mm/s,成形室温度为50 ℃)进行打印。本实验采用熔融沉积技术(fused deposition modeling,FDM) 共打印PU试件50 枚,γ射线消毒后备用[4]。随机抽取3 枚试件,干燥、喷金后,扫描电镜(scanning electron microscopy,SEM)下观察表面超微结构。
1.4 新西兰大白兔耳廓软骨细胞的培养
无菌切取1月龄新西兰大白兔双侧耳廓软骨,剪成1 mm3的组织块,用含双抗PBS冲洗3 遍,加入约5 倍体积的0.2%Ⅱ型胶原酶,37 ℃恒温水浴振荡器内消化5 h,1 500 r/min离心5 min,弃上清, PBS冲洗2 遍。加入H-DMEM培养液(含10%FBS,青、链霉素各100 U/mL)重悬细胞,调整细胞密度至1×105/mL后接种于10 cm dish培养。每隔48 h换液,继续培养细胞至90%汇合,标记为原代,常规胰酶消化传代。
1.5 软骨细胞聚集体的制备以及鉴定
将第3代软骨细胞以5×104个/孔的密度接种至6 孔板,生长至90%左右汇合时,加入CA诱导液(含50 μg/mL抗坏血酸和15%FBS的H-DMEM培养液),连续培养10 d,待生长至边缘卷曲,肉眼观察成为白色半透明膜时,即为成熟的CA。用钝头镊子将CA细心剥离后,石蜡包埋,HE染色。分别提取CA、P3代软骨细胞总RNA,q-PCR检测Aggrecan、Collagen II、Sox9基因的相对表达量。由GenBank查找引物设计与合成的基因序列,使用软件Primer Express 2.0进行引物设计,引物序列由上海生工生物技术公司合成。
1.6 PRF制备
用10 mL注射器于6 月龄新西兰大白兔耳中央动脉抽取10 mL血液,迅速转移至不加抗凝剂的10 mL玻璃离心管,以3 000 r/min的速度离心12 min;4 ℃静置5 min,可见管中的血液出现明显的分层现象,上层为少量透明的缺乏血小板的血浆层;中间层为淡黄色半透明的PRF凝胶;下层为体积约占40%~50%的红细胞层。弃去血浆层,用眼科剪将纤维蛋白凝块底部的红血细胞层分离,此时注意保留凝胶以下约1 mm厚度的红细胞层,白细胞和血小板在此交界区域的浓度较高[7]。
1.7 SEM观察PRF以及连续7 d生长因子的缓释

1.8 PRF对软骨细胞增殖和分化的影响
将10 mL血液制备的一整张PRF膜沿其长轴纵向均分,大小分别为1/2 PRF、1/4 PRF、1/8 PRF。将P3代软骨细胞以3×104/孔的密度分别接种于24 孔培养板,每孔滴加2 mL含10% FBS的完全培养液,孵育12 h(细胞贴壁完成)后,向实验组中分别加入1/8、 1/4、 1/2 PRF,对照组不加PRF,各组分别设置4重复孔。常规培养,每隔3 d换液。采用细胞计数法检测各组加入PRF第1、3、5天时细胞增殖数量。具体步骤为:以组为单位,去除培养液及 PRF,常规0.25%胰酶消化,将收集的细胞重悬于3 mL培养液中,混匀;取20 μL,采用红血球计数板行细胞计数,计算细胞总数;以组为单位,每吸取细胞悬液100 μL转移至96 孔培养板1 孔,每孔滴加10 μL CCK-8试剂,标准环境中孵育2 h,采用多功能酶标仪测定波长为450 nm处A值,计算平均数(n=5),绘制生长曲线。
将P3代软骨细胞以3×104/孔的密度分别接种于6 孔培养板,每孔滴加2 mL含10%FBS的完全培养液,孵育12 h(细胞贴壁完成)后,向实验组中1/2 PRF,对照组不加PRF,各组分别设置4重复孔。培养72 h后,提取RNA,Real-time PCR检测Aggrecan、Collagen II、Sox9基因表达。
1.9 裸鼠皮下支架移植
实验组:用无菌吸管将诱导成熟的CA反复吹打成小于0.2 mm3大小碎片;将PRF用眼科剪剪成小于0.2 mm3的碎屑,1∶1混合均匀后形成可注射的CA/PRF混合物,将其注满PU内部孔隙与表面,然后将CA/PRF/PU复合体植入裸鼠皮下(n=10)。对照组:将5 个10 cm dish长满的P3代软骨细胞用0.25%胰酶消化,等量含10%胎牛血清的H-DMEM培养基中和胰酶,1 200 r/min离心,弃上清,用新鲜培养基调整细胞的密度至5.0×107/mL,无菌环境下将软骨细胞悬液滴满PU支架内部孔隙和表面,孵箱内静置2 h,使细胞初步黏附于支架,然后裸鼠皮下移植(n=10)。异位移植时将裸鼠以氯胺酮麻醉,在裸鼠背部两侧做约2 cm纵行切口,潜行分离后,每只裸鼠背部皮下分别植入两组移植物。移植物距离切口至少2 cm,严密缝合手术切口。
8 周后解剖分离标本,甲基丙烯酸甲酯包埋后进行硬组织切片,分别行甲苯胺蓝、番红-O、Collagen II免疫组化染色,观察新生软骨的组织学结构。Collagen II免疫组化染色结果观察使用Olympus正置显微镜,图像采集使用PRECiVTM软件,染色结果定量分析使用Image J 1.53r软件。采用相同参数获取免疫组化图像,将图像用Image J软件转换为8 位图像,测量Collagen II染色强度同时测量并减去背景参数,统计数值来自不同图像的平均值(n=3)。
1.10 统计学分析

2 结 果
2.1 PU支架形态
3D打印的PU复合支架为15 mm×15 mm×5 mm的长方体试件, 呈淡黄色, 表面较光滑, 质均匀,支架成品的尺寸与3D打印设计的几何模型尺寸基本一致。扫描电镜下可见支架表面光滑,内部布满丰富的微孔,微孔直径分布在(420±72) μm之间,孔隙之间存在约70%的交通率(图1)。

图1 PU支架SEM观察Fig 1 Observation of PU scaffold by SEM
2.2 CA形态及鉴定
倒置显微镜观察显示:第3天时细胞已长满培养皿底部(图2A);此后开始大量形成细胞外基质,随着基质成分的增加,细胞排列更为紧密,10 d后CA成熟,表面均匀、平整、无破溃,边缘卷曲;可用钝头镊子将其从边缘完整揭起,分离后的CA在培养液中逐渐挛缩成不规则形态(图2B)。HE切片结果显示:CA包含较多层细胞(3~6 层),细胞连接紧密,且被分泌的软骨细胞外基质严密包裹(图2C)。免疫组化染色显示:CA强阳性表达Collagen II,该蛋白是软骨细胞外基质的主要组分。qPCR分析结果发现:与P3代软骨细胞相比, 诱导为细胞聚集体后以下基因呈现高水平表达(图3):Aggrecan基因相对表达量约为P3代软骨细胞的3.28 倍,Collagen II基因约为5.57 倍,Sox9基因约为3.18 倍,以上3 种基因表达量与单纯的P3代软骨细胞相比均明显上升(P<0.05)。

图2 CA的观察结果Fig 2 Observation of CA
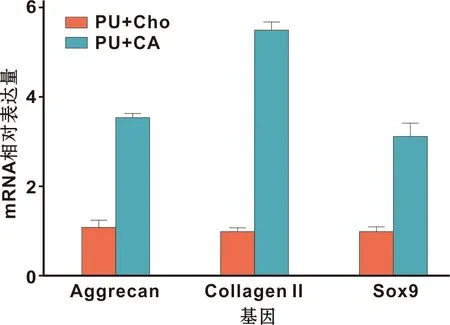
图3 两组标本的软骨相关基因表达情况Fig 3 Expression of cartilage-related genes in the 2 groups of specimens
2.3 PRF的形态
如图4A,采用一次性离心法制备PRF纤维蛋白凝胶。大体观察发现:PRF膜中上部结构简单,呈黄色;下部呈红色。SEM观察结果显示,PRF的支架结构主要包含粗大的纤维蛋白束和一些直径较小的纤维蛋白束夹杂其中,形成一种三维立体结构(图4B)。PRF的上部黄色区域表现出不含细胞的简洁的外观,而PRF的下部红色区域含有密集的血小板,一些红细胞和白细胞嵌入在由纤维蛋白构成的三维的网络结构之中(图4B)。
2.4 ELISA法检测 PRF中主要生长因子的缓释特点
采用酶联免疫吸附法测定一张完整的PRF膜在7 d内5 种主要的生长因子的缓释情况。结果表明,各种生长因子的释放特点呈现时间依赖效应,随时间延长,其释放量呈现递减的规律。此外,生长因子的释放量呈现前3天突释,之后释放量递减的特点(表1)。

表1 1 张完整PRF膜中7 d内释放的5 种生长因子量Tab 1 Amount of the growth factors released from a intact PRF film in 7 days
2.5 PRF对软骨细胞增殖、分化的影响
采用细胞计数法以及CCK8法测定不同浓度的PRF 对软骨细胞增殖的影响(图5A~B),结果发现:与对照组相比,1/8、 1/4、 1/2 PRF组均不同程度地促进了软骨细胞的增殖(P<0.05)。且PRF在不同剂量之间的影响无明显统计学差异(P>0.05)。

图5 PRF对软骨细胞增殖以及基因表达的影响Fig 5 The effects of PRF on chondrocyte proliferation and gene expression
通过q-PCR分析发现:与P3代软骨细胞相比, 六孔板内每孔软骨细胞与1/2 PRF共培养后表现出以下基因的高水平表达(图5C):Aggrecan基因相对表达量约为P3代软骨细胞的2.18 倍,Col-II基因约为6.07 倍,Sox9基因约为3.39 倍(P<0.05),而且Col-II基因的相对表达量上调最明显。
2.6 硬组织切片及染色观察
两组标本在设定硬组织切片厚度为20~100 μm后进行切片染色观察。番红-O染色结果显示软骨细胞基质呈红色(图6A、B),甲苯胺蓝染色结果显示新生软骨细胞基质呈紫红色(图6C、D)。PU/Cho组新生软骨组织呈岛状,散在分布于PU支架周围,软骨陷窝结构较少见,取而代之形成大量的结缔组织(图6A、C、E)。PU/CA/PRF组可见大量新生软骨组织呈团状包裹、镶嵌于PU支架周围,软骨陷窝结构明显增多,形成的软骨样组织嵌入支架内部孔隙结构(图6B、D、F)。实验组免疫组化结果显示:II型胶原蛋白的染色呈阳性,胶原蛋白纤维广泛分布在软骨基质中(图6F)。 II型胶原免疫组化染色定量结果显示:PU/CA/PRF组II型胶原蛋白的染色强度约为PU/Cho组的1.44 倍,具有统计学差异(P<0.05)(图7)。

图6 两组标本的硬组织切片染色结果Fig 6 Staining results of hard tissue sections of the 2 groups of specimens
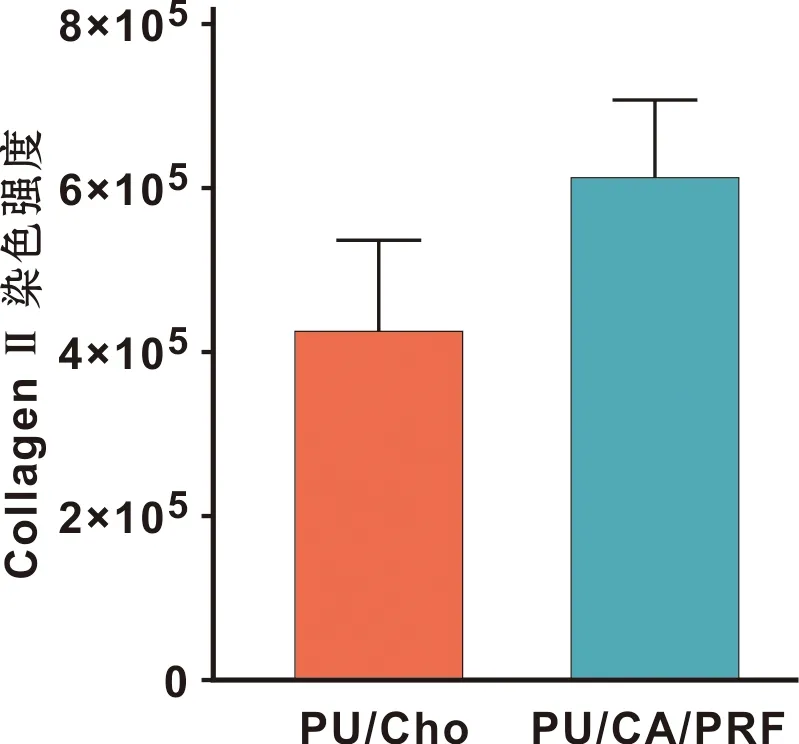
图7 两组标本II型胶原表达Fig 7 The expression of type II collagen the 2 groups of specimens
3 讨 论
国内外多个课题组曾使用生物安全性好、不可降解的PU材料,用于制作软骨再生支架。然而本课题组前期研究发现,单纯的PU支架与软骨细胞结合能力差、细胞粘附困难、死亡率高,因此形成的新生软骨组织数量少且容易撕脱[5-6]。本研究应用熔融沉积技术(FDM)快速成型为特定形态的PU多孔支架,多孔形态特征增加了支架表面积,为软骨细胞向支架内部生长打开通道,形成镶嵌结构,从而增加两者结合的稳固性。同时,为了增加软骨细胞接种后的存活率、增殖速度、以及细胞外基质的分泌,本研究尝试运用软骨细胞聚集体(CA)技术结合富血小板纤维蛋白(PRF)以改善软骨细胞生长微环境,促进软骨细胞增殖以及软骨细胞表型的维持,以改善软骨细胞在PU支架内新生软骨的质量。
对于构建不规则形状的软骨,3D打印技术可以生产具有三维复杂内部多孔结构和不同层不同结构的软骨支架,为细胞提供附着、增殖和营养运输的场所。熔融沉积方法涉及的硬件和材料容易获得,成本相对较低,是一种经济可行的个性化定制植入物的技术。并且其对设计参数的控制较灵活,对于材料、孔隙率以及几何形状都可改进,灵活调整细胞粘附、渗透以及生长[4,9]。本研究中所设计的PU支架具有出色的形状记忆功能,以及接近软骨的弹性和拉伸强度,从而能长期维持人外耳廓精确形态,维持美观和功能[4,10]。该支架孔隙率为60%,具有更大的表面积,为新生软骨的生长提供空间。微孔直径分布在(420±72) μm之间,前期研究结果证实300~1 200 μm之间的孔径有利于细胞和纤维蛋白的快速附着和生长[11]。
软骨细胞移植前的一个重要挑战,是对软骨细胞的质量进行控制。单纯扩增的离散软骨细胞,丧失了正常的成软骨细胞微环境,接种于PU支架上存活率低,增殖速度慢,而且极易发生软骨细胞“去分化”(chondrocyte dedifferentiation)现象。即已经分化成熟的软骨细胞在体外环境进行培养和扩增后,失去自己的成熟功能表型,转变为一种纤维软骨细胞[12]。虽然从离体初始细胞失去功能表型,到仍可在适宜条件刺激下(如三维培养)恢复功能;但是当去分化持续的时间过长,软骨细胞将没有这种恢复的潜能[11]。本研究采用的CA技术能够保证在体外细胞培养时形成基质严密包裹软骨细胞的多层细胞的膜状结构,类似于“三维培养”,从而有利于软骨细胞表型的维持[13]。本研究结果证实:软骨细胞聚集体含有3~6 层细胞结构,细胞间紧密有序排列。同时,与单个的软骨细胞相比,在CA中出现了软骨细胞表型相关基因的高水平表达,如Aggrecan、Col-II以及Sox9基因均出现不同程度的表达升高(P<0.05)。不仅如此,CA技术为移植后软骨细胞的生长提供初步的适宜微环境,有效地保护和促进软骨细胞间物质交换,减少移植过程的细胞流失,提高细胞存活率和增殖速率。
文献报道,PRF对软骨细胞的生长、迁移、软骨基质形成均有不同程度的促进作用[7]。PRF可缓释多种生长因子,约为全血的3~8 倍之多,本研究中ELISA实验进一步证实此结论。其中血小板衍生生长因子AB,表皮生长因子等,已被证明通过相互作用促进了软骨细胞的增殖以及细胞外基质的分泌。本研究也证实了不同浓度的PRF均有促进软骨细胞的增殖的作用,但不同浓度组之间未发现明显统计学差异,此结论与前期研究结果一致。PRF中富含的转化生长因子(TGF-β)、血管内皮生长因子则在软骨分化和软骨组织成熟中发挥重要的作用,IGF-1与TGF-β发挥协同作用后,可实现其累加效应[14]。同时,PRF对于软骨细胞的表型基因Aggrecan、Col-II以及Sox9,同样具有不同程度的促进作用(P<0.05),对Col-II基因表达的促进作用最明显,揭示了PRF加入后也有利于软骨细胞表型的维持。值得一提的是,PRF膜可以长期缓慢释放各种生长因子持续作用于软骨细胞,因而发挥更加稳定持久的促进作用[15]。
动物实验再次证实了在3D打印的PU支架上,相比于单纯的软骨细胞,CA与PRF复合后显示了更为出色的促软骨再生的功能。3 种不同的染色方法显示:PU与CA、PRF复合组可见大量成熟的软骨陷窝样结构形成,与支架紧密结合,II型胶原表达处于较高水平。而单纯PU与软骨细胞复合组形成的软骨陷窝样结构较少,更多可见大量的纤维结缔组织形成。其原因可能是,CA与PRF提高了种子细胞接种支架的成活率,以及粘附、增殖速率,能够长期维持成熟的软骨细胞的表型,从而为PU与软骨细胞的生长结合提供了新的可能。
4 结 论
本研究以3D打印的PU支架、结合CA以及PRF移植于裸鼠皮下成功形成了长期维持特定形貌的新生软骨组织。CA以及PRF的联合应用改善了PU支架内成软骨的微环境,有利于软骨细胞的增殖和软骨表型维持,为生物材料与种子细胞的结合以及构建具有精确三维形态的人外耳廓软骨提供了新的解决方案。
