浸泡型青梅酒中氨基甲酸乙酯的变化规律研究
2023-11-06刘涛涛熊晓通刘胜华黄智安
刘涛涛,蔡 凯,熊晓通,刘胜华,黄智安,王 喆*,肖 梦
(劲牌有限公司 劲牌研究院,湖北 黄石 435100)
中国是青梅的发源地,栽培历史已有三千多年,青梅酒也成为我国最古老的果酒之一[1]。青梅酒具有清酸的独特风味以及较高的保健功效和营养价值[2-3],受众广泛。随着人们健康意识的提高,饮酒安全越来越受到重视,青梅酒具有易污染氨基甲酸乙酯(ethyl carbamate,EC)的特点[4],这使其安全性受到了一定程度的质疑,不利于青梅产业的健康发展。EC天然产生于发酵食品和酒精饮料中,对人体具有潜在遗传毒性和致癌性,于2007年被世卫组织列为2A类致癌物[5-8]。人类膳食摄入EC的主要来源是酒精饮料[9],香港特区食物安全中心根据市民食物消费量调查结果进行风险评估后认为[10]:对于长期饮用大量酒精饮料的消费者,不能排除因摄入较高分量的EC而可能对健康构成风险。
我国青梅产量占世界总产量的70%[11],由于鲜果酸度高,不适合鲜食,广受欢迎的各类青梅加工品便应运而生,青梅酒便是其中之一。目前市售青梅酒有发酵型青梅酒、浸泡型青梅酒、发酵型勾兑浸泡型青梅酒[12],相关研究主要针对青梅酒感官优化工艺技术,如口感优化、香气优化、降酸、脱苦、澄清、护色、催陈等[12-14],而对其安全研究主要在于EC污染监测、降低氰化物含量方法、EC检测技术等[4,15-16],少见对降低青梅酒EC含量的工艺方法研究。除了商业化青梅酒,青梅酒爱好者的家庭自制青梅酒在我国也很常见,浸泡工艺是其目前广泛使用的生产方法[14],但家庭自制时往往过于粗放,如不去核甚至有意划破表皮、基酒酒精度高低不一、浸泡和陈放时间长、环境温度波动大等,产生和过量摄入EC的潜在风险较高。因此,本实验系统研究了多种因素对家庭自制浸泡型青梅酒中EC含量的影响规律,明确了有效减控EC含量的工艺参数,用以弥补家庭自制时缺乏针对安全性的工艺优化指导且难以进行安全指标监控的先天不足,为家庭自制青梅酒爱好者科学制作和安全饮用浸泡型青梅酒提供技术支持。
1 材料与方法
1.1 材料与试剂
青梅鲜果(七至八成熟):福建省诏安县;96%vol伏特加(特级):安徽安特食品股份有限公司;60%vol清香型、55%vol米香型、54%vol酱香型和66%vol浓香型白酒原酒(优级):劲牌有限公司;冰糖(单晶):广东南字科技股份有限公司。
氨基甲酸乙酯标准品(99.50%)、氨基甲酸乙酯-d5标准品(纯度>98%):德国DR EHRENSTORFER公司;甲醇、甲酸、乙腈(均为色谱纯):美国Sigma公司;氰化物(cyanide,CN)标准溶液(50 μg/L):中国计量科学研究院;氢氧化钠、酒石酸、磷酸二氢钾、氯胺T、1,3-二甲基巴比妥酸、异烟酸(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
E2695-TQ Detector型液质联用仪:美国Waters公司;Flex2型纯水/超纯水一体系统:威立雅水处理技术(上海)有限公司;AB135-S型分析天平:梅特勒托利多科技(中国)有限公司;FF-QHWL08型全自动酒类氰化物快速测定仪:北京吉天仪器有限公司;iCAP RQ型电感耦合等离子体质谱仪:赛默飞世尔科技有限公司。
1.3 方法
1.3.1 青梅酒制作工艺流程及操作要点
操作要点:
分选:挑选大小均匀(横向直径2.0~2.5 cm)、果肉硬实、色泽较青、表皮完好的新鲜青梅。
去蒂、清洗:用镊子轻挑去蒂,避免破皮;清洗时同样应避免破皮,且末道水使用纯净水,沥干。
切削:分离果肉和果核。刀具和托盘用前洗净。切削时应避免破坏果核外壳,允许果核外部残留少许因黏连而分离困难的果肉。流出的且未被污染的汁液尽量回收并归为果肉。
装瓶:选择密封良好的2.5 L规格玻璃瓶,洗净、沥干后分别装入青梅果肉或果核或整果。
加冰糖:青梅装瓶后尽快添加冰糖,在顶层青梅处一次性添加。
加浆降度:按目标酒精度在高度伏特加或白酒中添加相应量纯净水,混匀即为基酒。纯净水用量根据质量守恒原理计算。
加基酒:一次性添加所需基酒,密封后静置3 d,此过程中冰糖将缓慢溶化,青梅将逐步上浮,以致部分未溶化的冰糖沉底,此时摇瓶助溶。若未加糖,亦在静置3 d后进行同等程度的摇瓶。静置15 d后摇瓶混匀一次,之后仅在取样检测前进行摇瓶混匀。
静置:即陈化过程,陈化时避光,且储存温度需始终控制在≤25 ℃。
1.3.2 不同因素对酒中EC含量的影响
设置不同的工艺参数制作浸泡型青梅酒,考察不同因素对酒中EC含量的影响,具体参数设置见表1。

表1 浸泡型青梅酒制备参数Table 1 Preparation parameters of steeped type greengage wine
(1)原料对EC含量的影响
针对青梅果核、基酒酒精度、冰糖、基酒种类因素,设置实验参数见表1的1#~18#,每组均设置3个平行样。
(2)酒、果分离和加糖方式对EC含量的影响
以青梅整果为实验样品,设置3个平行样,按表1的19#参数添加青梅和伏特加基酒,不加冰糖,密封;浸泡30 d后分离果渣与酒液;合并3个平行样的酒液,混匀后均分为3份(即19#、20#、21#),其中第1份不加冰糖,第2份按对应青梅鲜果∶冰糖=1∶0.60的质量比添加冰糖并摇瓶溶糖,第3份与此前分离出的1/3青梅果渣混合且不加冰糖,每份设置3个平行样。
(3)环境温度对EC含量的影响
选取表1中已浸泡150 d的15#样品为实验对象,分离酒液和果渣,合并3个平行样的酒液,混匀后分装至125 mL规格玻璃瓶,密封;分别置于温度为1 ℃、12 ℃、20 ℃、37 ℃、50 ℃的避光环境中存储30 d,每个温度条件下设置3个平行样。
1.3.3 氨基甲酸乙酯检测方法
参考熊晓通等[17]的方法,采用液质法对青梅酒中氨基甲酸乙酯含量进行测定。
样品前处理:准确吸取样品0.95 mL于1.5 mL离心管中,加50 μL氨基甲酸乙酯-d5内标使用液,涡旋混匀,置于80~90 ℃烘箱中脱乙醇,待离心管中液面挥至0.4~0.5 mL时取出,冷却;使用虹吸管加水定容至1 mL,混匀,经0.45 μm水系过滤膜过滤后,待上机检测EC含量。
液相色谱条件:Xselect HSS T3色谱柱(3.5 μm,2.1 mm×100 mm);柱温40 ℃;进样量10 μL;洗脱方式为梯度洗脱,流速0.3 mL/min,具体程序见表2。

表2 梯度洗脱程序Table 2 Gradient elution procedure
质谱条件:电喷雾离子源(electron sprayionization,ESI);扫描模式为正离子模式;雾化器温度400 ℃;离子源温度150 ℃;雾化气流速800 L/h;毛细管电压3 kV;锥孔气体流速100 L/h;碰撞气流速0.17 mL/min。多反应监测采集条件见表3。
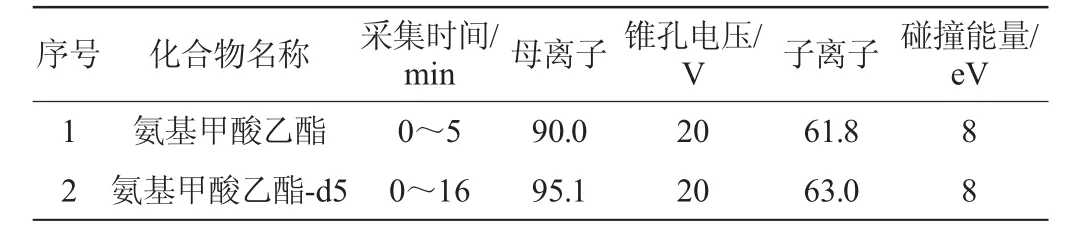
表3 多反应监测采集条件Table 3 Acquisition conditions for multiple reaction monitoring
1.3.4 氰化物含量测定
采用流动注射检测方法,取50 μL试样于5 mL容量瓶中,用氢氧化钠溶液(1.0 g/L)定容至刻度混匀,将样品溶液倒入进样管中,放到自动进样器上进样,测定氰化物含量。
蠕动泵梯度设置:泵速20 r/min;到达阀时间300 s;注射时间80 s;样品周期220 s;进样时间140 s;清洗时间30 s;进样针清洗时间10 s;加热模块1温度118 ℃;加热模块2温度85 ℃;前端采集增益100 K。
1.3.5 酒精度和铜含量检测
酒精度采用GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》中第二法测定;铜含量采用GB 5009.13—2017《食品安全国家标准食品中铜的测定》中第三法测定。
1.3.6 数据分析
采用Excel 2016软件进行数据统计、图表制作,采用Origin 9.0软件进行单因素方差分析。
2 结果与分析
2.1 果核对浸泡型青梅酒中EC的影响
由图1a可知,果核酒和整果酒中EC含量均随着浸泡时间的增加而持续极显著地增加(P<0.01),果肉酒中则先增后减,且三者在≥30 d后的相同时间点的差异均极显著(P<0.01):果肉酒中EC增速极其缓慢(≤7.58 μg/L)且远低于果核部位的3 033.89 μg/L,整果酒的EC含量309.96 μg/L则介于果核酒和果肉酒之间。表明浸泡型青梅酒中的EC主要源于青梅果核,且果核的暴露程度越小越有利于减缓EC的增长。

图1 果核对浸泡型青梅酒中氨基甲酸乙酯(a)及氰化物(b)含量的影响Fig.1 Effect of kernels on ethyl carbamate (a) and cyanide (b)contents in steeped greengage wine
青梅果核中含有苦杏仁甙,苦杏仁甙在酸性条件下易水解为氢氰酸[18],而氰化物是酒精饮料中EC的主要前体物质之一[7,19-20]。由图1b可知,果核酒中氰化物含量高且增速快,30 d即达峰值17 968.60 μg/L,而果肉酒中则含量极低(≤29.55 μg/L)且未持续增长,二者在不同时间点相差约534~1 583倍,这与EC在果核酒、果肉酒中的含量高低表现一致。文献亦报道通过去果核的方式减少果酒中氰化物的含量,可控制EC的形成[21],与实验结论一致。
2.2 基酒酒精度对浸泡型青梅酒中EC的影响
由图2可知,各酒样中EC含量总体上随着基酒酒精度的提高而极显著地升高(P<0.01,仅在60%vol且90 d时P<0.05),亦随着浸泡时间的延长而极显著地升高(P<0.01);其中,浸泡150 d后,基酒酒精度为60%vol时酒样的酒精度为29.9%vol,EC含量高达964.39 μg/L,约是20%vol基酒时(酒样酒精度为10.2%vol)的4.2倍,约是其自身在浸泡30 d时的4.7倍。这是由于EC是由其前体物质与乙醇反应生成[22],更高的乙醇含量可提高反应物分子在单位时间内的碰撞几率,更容易发生转化反应,符合化学反应碰撞理论[23],因此降低体系酒精度可显著降低浸泡型青梅酒中的EC累积。
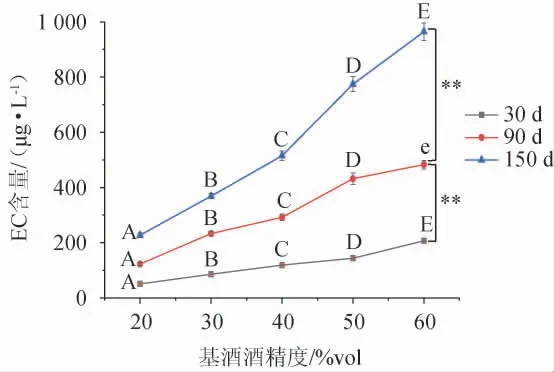
图2 基酒酒精度对浸泡型青梅酒中氨基甲酸乙酯含量的影响Fig.2 Effect of alcohol content of base liquor on ethyl carbamate contents in steeped greengage wine
2.3 冰糖用量对浸泡型青梅酒中EC的影响
由图3可知,当青梅与冰糖比例从1∶0上升至1∶0.15时,各酒样中EC含量均有增长且≥90 d时增幅显著,150 d时达到368.55 μg/L,这是由于冰糖溶解后提高了溶液的渗透压,高渗环境促使果核中EC前体物质加速渗出,继而转化出更多的EC。继续提高冰糖比例,EC含量总体呈显著或极显著下降趋势(P<0.05或P<0.01),但这种下降是冰糖用量不断增大引起体积增大后EC被稀释所导致。此外,青梅酸度极高,浸泡型青梅酒需要辅以较多的冰糖才具适口性,综合考量青梅与冰糖的比例介于1∶0.45~1∶0.60为宜。
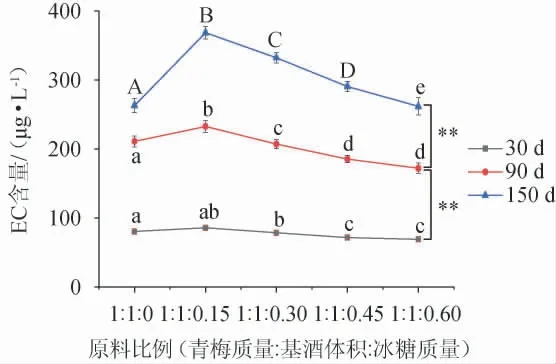
图3 冰糖用量对浸泡型青梅酒中氨基甲酸乙酯含量的影响Fig.3 Effect of crystal sugar addition on ethyl carbamate contents in steeped greengage wine
2.4 基酒种类对浸泡型青梅酒中EC的影响
由图4可知,伏特加、清香型白酒、米香型白酒、酱香型白酒、浓香型白酒作为基酒的青梅酒中EC含量均随着储存时间的延长而极显著地增长(P<0.01)。浸泡150 d后的EC净增量分别为368.55 μg/L、244.32 μg/L、243.05 μg/L、233.71 μg/L、236.32 μg/L,其中清香型、米香型、酱香型和浓香型白酒作为基酒的酒样中EC净增量相近,差异不显著(P>0.05);伏特加基酒中虽未检出EC,但对应酒样中的EC净增量却明显高于白酒基酒,对比差异极显著(P<0.01),可能是因为白酒中某些微量成分具有一定的减缓浸泡型青梅酒中EC转化速率的作用,相关机理有待进一步研究。此外,浓香型白酒、酱香型白酒酒香浓郁,与青梅酒清爽的香气调性匹配度弱于清香型白酒、米香型白酒。综合考虑,浸泡型青梅酒基酒选择优质清香型或米香型白酒为宜。
图4 不同基酒种类对浸泡型青梅酒中氨基甲酸乙酯含量的影响Fig.4 Effect of different types of base liquor on ethyl carbamate contents in steeped greengage wine
2.5 酒、果分离和加糖方式对浸泡型青梅酒中EC的影响
由图5可知,酒、果分离后,EC含量虽仍随着浸泡时间的延长而增长,但明显慢于不分离的酒样,且是否添加冰糖对EC含量的增速差异在180 d时极显著(P<0.01),分离后添加冰糖条件下,180 d时的EC含量(247.61 μg/L)高达酒、果分离初始时(59.67 μg/L)的4.2倍,分离后不添加冰糖条件下则仅约2.1倍;4种酒样的EC含量在180 d时两两之间差异均显著或极显著(P<0.05或P<0.01)。不分离且不加糖酒样的EC含量在≤150 d时高于或接近不分离且0 d时就加糖酒样,这是由于本组实验青梅与冰糖的比例为1∶0.6,加糖与否的体积相差较大所导致。总之,冰糖对浸泡型青梅酒中EC累积起到的作用不限于前述的促进EC前体物质渗出,还叠加促进了前体物质向EC的转化,对冰糖与伏特加的铜含量进行测定,结果表明冰糖的含铜量(0.019 2 mg/kg)远高于伏特加基酒(未检出),且铜离子是氰酸盐向EC转化的重要催化剂[22]。因此及时进行酒、果分离以及推迟冰糖添加时间点对减缓EC增速均有积极作用。

图5 酒、果分离和加糖方式对浸泡型青梅酒中氨基甲酸乙酯含量的影响Fig.5 Effect of separation of wine and fruit and method of adding sugar on ethyl carbamate contents in steeped greengage wine
2.6 温度对浸泡型青梅酒中EC的影响
由图6可知,与初始值相比,EC含量随着存储温度的上升而非匀速增长,且在≤12 ℃的低温条件下增速缓慢,差异不显著(P>0.05);20~37 ℃时增速明显加快,差异极显著(P<0.01);50 ℃的高温条件下增速更快,差异极显著(P<0.01)。这与黄酒[24]、白酒[25]、葡萄酒[26]、发酵型青梅酒[27]等酒精饮料体系中温度对EC转化的正相关影响规律一致。因此,降低环境温度至20 ℃以下可有效减缓浸泡型青梅酒中EC的累积。

图6 存储温度对浸泡型青梅酒中氨基甲酸乙酯含量的影响Fig.6 Effect of storage temperature on ethyl carbamate contents in steeped greengage wine
此外,综合前文实验现象可发现,非冷藏条件下,EC的上升趋势在实验周期内均未见终止,说明在前体物质转化完毕或达到某种平衡前,EC的上升可能会持续较长时间,因此即使采取了各种工艺优化措施,亦不宜在常温条件下长时间陈放不去核工艺的浸泡型青梅酒。
2.7 家庭自制浸泡型青梅酒EC污染风险评估及防控建议
2.7.1 EC污染风险评估
我国尚未制定饮料酒的EC限量标准,参考韩国对青梅酒400 μg/L的EC限量标准[4]进行污染风险评估。由图1~图6可知,1#去核酒样的EC超标风险极小,可忽略不计;其他工艺条件的酒样随着时间的延长,均存在EC超标风险或趋势。其中,19#和20#酒样,由于适时进行了酒、果分离,阻断了果核持续释放EC前体物质的源头,实验周期内EC虽仍呈上升趋势,但速度相对最慢且未超标;酒精度的负面影响最明显,当基酒酒精度≥40%vol时,EC累积速度明显快于基酒酒精度≤30%vol酒样,前者在90~150 d内超标;若加严参考加拿大等国对蒸馏酒150 μg/L的EC限量标准[28-29],除了1#去核酒样,其他酒样在浸泡30~150 d内均超标。
2.7.2 EC污染防控建议
相较于商业化青梅酒,家庭自制浸泡型青梅酒更易发生EC偏高问题,与实际调查结果一致[16]。为控制EC生成和减少摄入量,2种浸泡型青梅酒家庭自制工艺和饮用方法推荐见表4,可为自制浸泡型青梅酒提供参考。

表4 浸泡型青梅酒家庭自制工艺和饮用方法推荐Table 4 Suggestions on the process and drinking methods of homemade steeped greengage wine
3 结论
本研究探讨了不同因素作用下浸泡型青梅酒中EC的变化规律,发现浸泡型青梅酒易污染EC且增速较快,其前体物质主要来源于果核。果核暴露程度、酒精度、冰糖添加方式、浸泡及陈放时间、环境温度均是影响EC累积的显著因素;清香型、米香型、酱香型和浓香型白酒作为基酒时的EC新增污染程度相差无几,但极显著低于伏特加基酒(P<0.01)。可见,以当前主流家庭自制工艺制作的浸泡型青梅酒具有应当引起人们重视的食品安全风险,去核工艺可一劳永逸的消除该风险,否则应降低基酒酒精度、推迟加糖时间点、减少浸泡和陈放时间、降低存储温度,以达到降低EC含量的目的。
