头颅磁敏感加权成像联合血清血管内皮生长因子、微小RNA-127、微小RNA-320在小动脉闭塞性脑梗死患者预后评估中应用
2023-11-06韩伟华龙美跃
王 虹, 韩伟华, 龙美跃, 黄 维
1.保定市第一中心医院 神经内一科,河北 保定 071000;2.保定市第二医院 肿瘤外科,河北 保定 071000
脑血管疾病是危害中老年生命安全的重要疾病之一,位居各类致死疾病的第2位,根据急性卒中治疗低分子肝素试验分型,小动脉闭塞性脑梗死(small-artery occlusion,SAO)发生率较高,约占脑卒中疾病的30%[1]。SAO多由直径<0.1 mm的脑小深动脉病变导致,降低患者致残、致死率,快速再通供血动脉,是治疗的首要目标[2]。因此,早期准确客观评估对于治疗方案的选择,以及预后的评估具有重要意义。脑微出血(cerebral microbleeds,CMBs)是脑梗死患者出血性转化发生的重要危险因素[3],磁敏感加权成像(susceptibilitu weighted imaging,SWI)基于人体组织磁敏感差异,对于血液、静脉血管、钙化等敏感性均较强,信噪比高、空间分辨率高,病灶检测敏感度也较高[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)具有刺激血管内皮生长和血管再生、促进侧枝循环建立的作用。微小RNA(microRNA,miRNA)是一类高度保守的非编码小RNA,在缺氧性脑病进展中发挥重要作用。有研究报道,多种miRNA参与影响新生血管生成,靶向促进或抑制VEGF的表达水平[5]。本研究旨在探讨头颅SWI联合血清VEGF、miRNA-127、miRNA-320在SAO治疗后转归中的预测评估价值,为临床改善患者预后提供参考。现报道如下。
1 对象与方法
1.1 研究对象 选取自2021年7月至2022年4月保定市第一中心医院收治的126例SAO患者为研究对象。其中,男性66例,女性60例;年龄51~80岁,平均年龄(73.16±4.93)岁;合并症:高血压83例,糖尿病30例,高血脂21例,心房颤动18例。纳入标准:(1)符合《缺血性脑卒中诊治指南》[6]脑梗死腔隙综合征,直径<1.5 cm;(2)首次发病;(3)于本院接受治疗。排除标准:(1)既往卒中史;(2)颅内大动脉狭窄;(3)心源性栓塞;(4)合并脑肿瘤、脑外伤、动脉瘤、脑血管畸形等;(5)不能耐受磁共振成像(magnetic resonance imaging,MRI)检查,如心脏起搏器、空间幽闭症等。本研究经医院伦理委员会批准。所有患者或家属均知情同意。
1.2 研究方法
1.2.1 影像学检测方法 所有患者入院后,均采用超导核磁共振仪(Philips,Achieva 1.5T)检测,头部置8通道相控阵线圈,听眦线作为扫描基线,T1WI序列:TR、TE分别为371.0 ms、9.8 ms;T2WI采用快速自旋回波序列:TR、TE分别为5 000 ms、89 ms;T2FLAIR序列:TR、TE分别为8 000 ms、840 ms;DWI采用SE/EPI序列,TR、TE分别为7 500 ms、106 ms,扩散敏感系数0 s/mm2、1 000 s/mm2。SWI采用3D扰相梯度回波序列,TR、TE分别为49 ms、40 ms,FOV:24 cm×24 cm,层厚2.0 mm,矩阵256×256。扫描后数据导入MR Systems Achieva Release 2.6.3.6工作站,由两位经验丰富的放射医师盲法分析,评估出血部位、数目、出血灶形态等。
1.2.2 血清VEGF、miRNA-127、miRNA-320检测 所有患者入院后取空腹静脉血4 ml抗凝处理,离心(4 000 r/min、10 min),分离血清,水浴处理(37℃、2 min),Trizol试剂提取RNA(美国,Invitrogen公司),Nano Drop分光光度计检测纯度及浓度。合成cDNA(Takara逆转录试剂盒),逆转录聚合酶链反应法扩增miRNA-127、miRNA-320目标片段,反应体系(20 μl),条件:94℃(3 min),94℃(30 s),57℃(30 s),74℃(29 s),35个循环后,74℃(10 min),以β-action为内参,2-ΔΔct法计算血清miRNA-127、miRNA-320相对表达水平,引物合成由南京擎科生物进行,荧光定量聚合酶链反应为美国罗氏Cobas Lightcycle480z。血清VEGF含量检测采用酶联免疫吸附法,试剂盒均购自美国R&D公司。
1.3 CMBs影像学表现 SWI检测图像上孤立点状低信号,2~5 mm,界限清晰且周围无水肿,区别于血管间隙、脑出血、脑内钙化灶等。根据CMBs数量进行分级[7]:无为0级,1~3个为1级,4~6个为2级,7~9个为3级,9个以上为4级。
1.4 预后评估 对患者随访3个月,随访的方式包括电话、门诊等多种形式。采用改良Rankin量表(modified Rankin scale,mRS)评估短期预后状态[8],评分标准:0分为正常,未表现出相关症状;1分为未表现出明显功能障碍,症状较为轻微,疾病前能够完成的正常活动均可完成;2分为轻微功能障碍,虽可实现自我照顾,但存在病前正常活动不能全部顺利完成的情况;3分为存在中度残疾,患者虽可自主行走,但其他活动需借助其他力量;4分为存在中重度残疾,生活起居不能实现自理,需在他人的帮助下完成;5分为存在重度残疾,患者只能卧床,甚至出现大小便失禁;6分为死亡。以治疗3个月后mRS评分<2分为预后良好,mRS评分≥2分为预后不良。
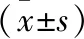
2 结果
2.1 MRI不同序列检测CMBs分布及数目 SWI共检测出CMBs病灶256个,其中,位于基底核区129个、脑干15个、丘脑43个、小脑19个、大脑皮质及皮质下50个。T1WI序列共检出CMBs病灶40个,其中,位于基底核区18个、脑干3个、丘脑8个、小脑2个、大脑皮质及皮质下9个。T2WI序列共检出CMBs病灶65个,其中,位于基底核区19个、脑干8个、丘脑17个、小脑6个、大脑皮质及皮质下15个。T2FLAIR序列共检出CMBs病灶81个,其中,位于基底核区23个、脑干11个、丘脑18个、小脑8个、大脑皮质及皮质下21个。DWI序列共检出CMBs病灶39个,其中,位于基底核区14个、脑干6个、丘脑11个、小脑2个、大脑皮质及皮质下6个。SWI检测出的CMBs病灶数多于MRI扫描中T1WI、T2WI、T2FLAIR、DWI扫描序列检测出的病灶数,且病灶主要分布在基底核区,其次在丘脑、大脑皮质及皮质下,位于脑干、小脑的较少。
2.2 预后良好与预后不良患者SWI检测CMBs分级比较 根据治疗后3个月的mRS评分将0~1分者纳入预后良好组(n=91),2~6分者纳入预后不良组(n=35)。预后良好组SWI检测CMBs分级程度为0级的比例高于预后不良组,分级程度为1~4级的比例均低于预后不良组,差异有统计学意义(P<0.05)。见表1。
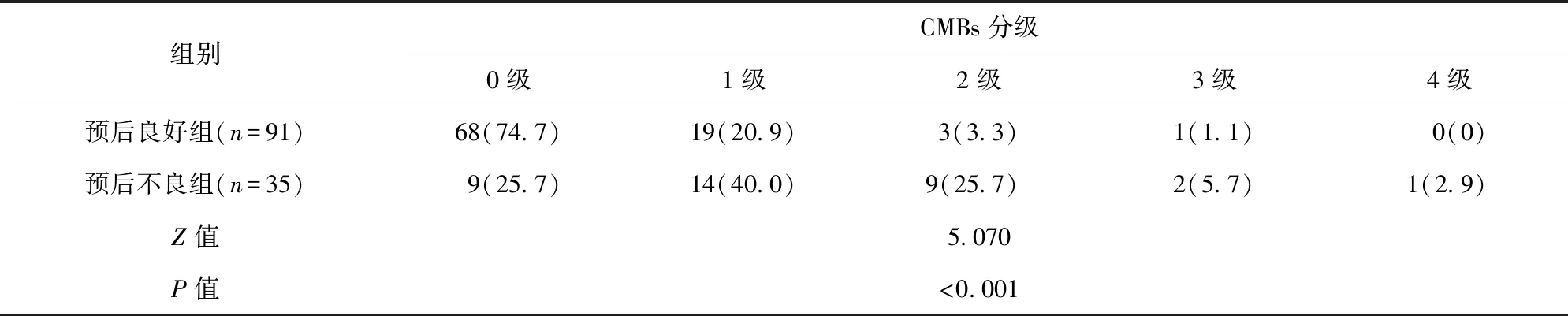
表1 预后良好与预后不良患者SWI检测CMBs分级比较/例(百分率/%)
2.3 预后良好与预后不良患者血清VEGF、miRNA-127、miRNA-320水平比较 预后良好组血清VEGF水平高于预后不良组,miRNA-127、miRNA-320水平低于预后不良组,差异均有统计学意义(P<0.05)。见表2。
表2 预后良好组与预后不良组患者血清VEGF、miRNA-127、miRNA-320水平比较
2.4 SWI序列联合血清VEGF、miRNA-127、miRNA-320对SAO患者预后的评估效能 SWI序列检测CMBs分级联合血清VEGF、miRNA-127、miRNA-320评估SAO患者预后ROC曲线下面积为0.886,高于各项指标单独检测的0.772、0.700、0.695、0.678(P<0.05)。见表3、图1。
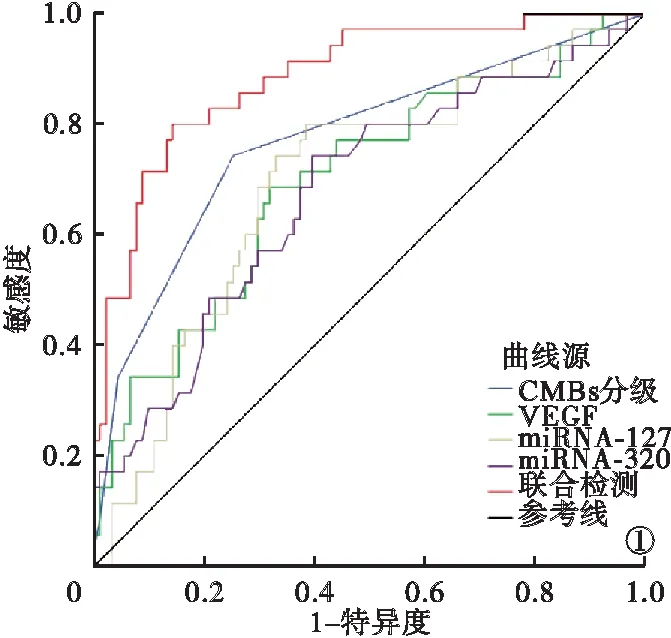
图1 SWI序列检测CMBs分级联合血清VEGF、miRNA-127、miRNA-320对SAO患者预后评估ROC曲线
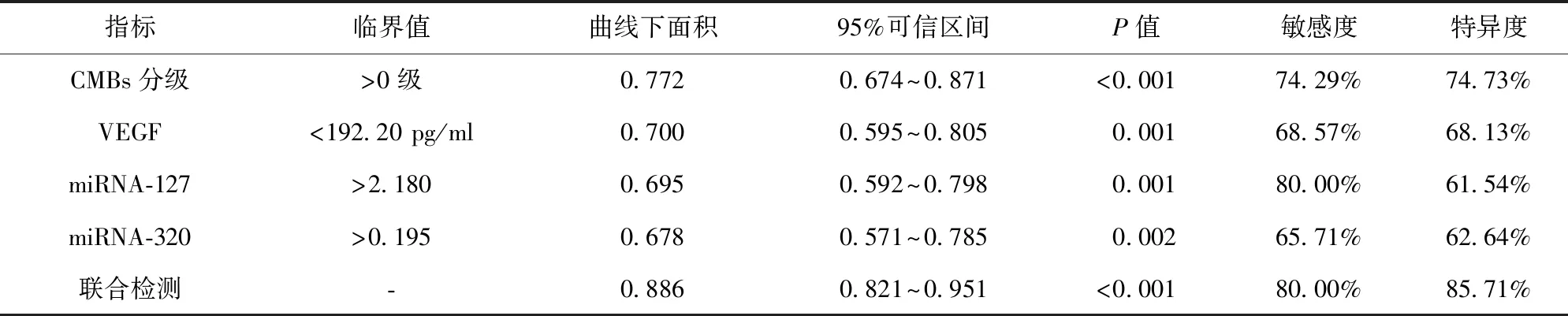
表3 SWI序列联合VEGF、miRNA-127、miRNA-320对SAO患者预后的评估价值
3 讨论
通常情况下,脑穿支动脉直径约为100~200 μm,易因血液涡流而处于高压状态,长期高压状态易对穿支动脉造成损伤,使得内皮细胞玻璃样变性,同时出现内膜胶原纤维、弹性纤维等增生,致使血管正常管壁结构消失,形成微粥样硬化斑,这也是SAO形成的病理基础[9]。CMBs主要特点在于微小量出血,指脑内微小血管管壁受损时,血管中血液外渗,预示患者康复过程中,出血倾向更高,严重微小血管病变发生的风险更大,甚至可能增加脑梗死患者病死率[10-11]。
SWI利用组织磁性成像检测组织磁场属性,脑实质出血吸收后,出血位置残留有顺磁性物质铁血黄素,影响磁场均匀相性,SWI序列上出血灶呈现低信号[12]。本研究结果显示,SWI共检测出CMBs病灶数高于其他MRI常规序列,检测出SAO伴CMBs 77例共256个病灶。SWI可同时得到磁距图像、相位图像,出血灶中铁血黄素、去氧血红蛋白等可引起磁场不均匀,即使该种差异较小,也能引起病灶与周围组织的相位差异,因此,病灶检出率较高[13]。史冬梅等[14]研究报道,CMBs为脑梗死患者神经功能恶化的独立危险因素,脑梗死患者不良预后与CMBs数目有关。本研究结果显示,SWI序列检测CMBs分级对SAO患者预后的评估价值的ROC曲线下面积为0.772,提示CMBs分级可在一定程度上反映患者不良预后状态。
VEGF作为促有丝分裂原与趋化因子,机体正常状态下,血管内皮细胞不表达VEGF,然而,缺血缺氧环境下可出现细胞内VEGF mRNA表达增加,脑组织和血液中VEGF 表达上调。本研究结果显示,预后良好组患者反而血清VEGF浓度更高,这可能是由于本研究纳入的均为SAO患者,疾病程度较低,VEGF 水平升高有利于脑血管再生、侧支循环形成,促进神经细胞生长存活,发挥血管保护作用,有利于患者预后。Auler等[15]研究发现,颈动脉粥样斑块中,miRNA-127呈现高表达,且其表达水平与斑块内巨噬细胞浸润和出血风险呈正相关。本研究中,预后良好组血清miRNA-127水平低于预后不良组。miRNA-127参与斑块形成、进展及稳定性调控,可促进巨噬细胞增殖,促进细胞内总胆固醇表达,加重巨噬细胞泡沫化程度,阻断不饱和脂肪酸合成,使胆固醇含量升高,促进SAO患者病情进展,导致不良预后。功能性分析结果显示,miRNA-320参与调节的通路主要包括凋亡、转化生长因子-β信号通路、细胞因子及其受体间的相互作用等,也是动脉粥样硬化、缺血性脑病预测的可靠指标[165]。本研究比较了SAO患者预后良好与预后不良组血清miRNA-320表达的差异,结果显示,预后良好组血清miRNA-320表达水平低于预后不良组。循环miRNA-320参与细胞间粘附分子-1表达调节,在血栓形成中发挥重要作用。本研究血清VEGF、miRNA-127、miRNA-320评估SAO患者预后ROC曲线下面积分别为0.700、0.695、0.678,低于SWI序列检测CMBs分级评估的0.772,但仍可在一定程度上反映患者不良预后,且3项血清指标联合SWI序列检测CMBs分级可进一步提高SAO患者预后评估价值,ROC曲线下面积达到0.886,高于各项指标单独评估。
综上所述,头颅SWI序列检测SAO患者的CMBs病灶数高于MRI常规序列;与SAO预后不良者比较,预后良好者血清VEGF呈现高表达,miRNA-127、miRNA-320呈现低表达;头颅SWI序列检测CMBs分级联合血清VEGF、miRNA-127、miRNA-320检测,可在一定程度上反映SAO患者的预后状态。
