温度与光照强度对蝴蝶兰光合生理与花序发育的影响
2023-11-05许申平袁秀云蒋素华牛苏燕
许申平,袁秀云,张 燕,梁 芳,蒋素华,牛苏燕,崔 波
(郑州师范学院 生物工程研究中心,河南 郑州450044)
蝴蝶兰(Phalaenopsis)为兰科蝴蝶兰属单轴茎兰花,在其生长的过程中每节至少有2个未分化的芽原基以休眠的状态存在[1]。当环境条件适宜的时候,从上往下第3~4片叶腋内的休眠芽从叶鞘内抽出形成花序,花序顶端向两边不断生出小花原基和芽原基[2]。小花原基经过大约3个月的时间,从花序轴的第5~6节开放。芽原基以休眠的状态位于蝴蝶兰花序轴的1~5节间,该休眠芽是目前进行组织培养获取种苗的主要材料[3]。在蝴蝶兰家庭养护中,花朵凋谢后从花序轴基部往上第4~5节处剪去上部开败的花朵,花序轴腋芽即可萌发为1个完整的花序,进行2次开花。由此可见,蝴蝶兰花序轴腋芽可能属于未分化分生组织,与主茎叶腋内的休眠芽具有相似特性,对其进行研究可避免破坏植株,研究结果对蝴蝶兰花期调控也具有重要理论价值。另外,蝴蝶兰品种多样,其花序类型因品种不同有很大差异。大花类型蝴蝶兰花序轴常无分枝,表现为总状花序;小花类型蝴蝶兰的花序轴多分枝,变现为复总状花序。在蝴蝶兰的工厂化栽培中,花序类型的不可调控性严重影响了蝴蝶兰的观赏品质,花序轴腋芽是否萌发是影响蝴蝶兰花序类型的关键,但是关于蝴蝶兰花序轴腋芽与环境因子的研究目前还未见报道。
蝴蝶兰属于多年生热带附生景天酸代谢途径(crassulacean acid metabolism, CAM)植物[4],必须经过一段时间的营养生长才能接受环境刺激而抽梗开花,自然花期一般在每年的3月前后。蝴蝶兰典型的年宵花特性使其花期调控成为研究的热点。经过多年研究,目前已发现温度是影响蝴蝶兰开花的首要环境因素[5-6]。环境温度持续高于29 ℃会抑制蝴蝶兰花芽的形成[7-8],蝴蝶兰栽培中常通过提高环境温度来延长蝴蝶兰的营养生长阶段,从而获取高质量开花株[8-9]。与持续高温相反,昼夜温差(如25 ℃/20 ℃,或20 ℃/15 ℃)可以促进蝴蝶兰的生殖生长[10-11],栽培中常采用人工调控温度的方式使其按需开花[12]。但长期的人工控温极大地降低了蝴蝶兰的利润空间[11]。随着研究的深入,光照在蝴蝶兰花期调控过程中的作用也得到印证[13-14],其中光照强度是影响蝴蝶兰花芽诱导成功的主要因子之一[15]。较低的光照强度利于蝴蝶兰进行营养生长,较高的光照强度则利于蝴蝶兰进行生殖生长。与150 μmol·m-2·s-1的光通量密度相比,20 μmol·m-2·s-1会推迟蝴蝶兰的花芽分化[16]。
到目前为止,虽然温度与光照在蝴蝶兰花期调控中的研究较多,但仅限于单一因素对蝴蝶兰花芽诱导的影响,关于温度与光照强度互作的研究并未见报道。本研究以蝴蝶兰品种大辣椒开花株为试验材料,通过调控温度与光照强度对蝴蝶兰光合作用、生理、花序轴腋芽发育形态和解剖结构进行研究,以期为蝴蝶兰生产提供理论依据和技术支撑。
1 材料与方法
1.1 材料
试验以蝴蝶兰大辣椒(Phalaenopsis‘Big Chili’)开花株为材料,从下往上留1个花序轴腋芽,剪除上部花序,把只有1个蝴蝶兰花序轴腋芽的植株放入人工气候箱里进行处理。
1.2 试验方法
1.2.1 试验设计
共4个处理:(1)低温强光(昼夜温度24 ℃/18 ℃,光通量密度为200 μmol·m-2·s-1);(2)低温弱光(昼夜温度24 ℃/18 ℃,光通量密度为30 μmol·m-2·s-1);(3)高温强光(昼夜温度30 ℃/28 ℃,光通量密度为200 μmol·m-2·s-1);(4)高温弱光(昼夜温度30 ℃/28 ℃,光通量密度为30 μmol·m-2·s-1)。每个处理均选取长势一致的蝴蝶兰100株。
试验于2021年8月在郑州师范学院兰花工程研究中心的人工气候培养箱(Percival LT-36VL,美国)中进行,培养箱相对湿度75%,光照时间为12 h。用花多多1号提供肥料供给,稀释3 000倍,每株施用200 mL,每周用1次。在处理7、14、21、28、35 d时,选取上部完全展开的功能叶(从上到下第2片叶,下同)中部进行气体交换参数的测定,并于相应的处理阶段采集叶片组织,用液氮速冻后于-80 ℃保存,用于生理生化指标的测定。
1.2.2 光合参数测定
于22:00—24:00,利用便携式光合作用测定仪Li-6400(美国LI-COR公司),在各自处理的环境条件下测定蝴蝶兰叶片的净CO2吸收速率和气孔导度(stomatal conductance,Gs)。每个发育阶段测定5个植株,每个叶片重复3次。
1.2.3 生理参数测定
利用80%丙酮测定叶绿素含量[17];用蒽酮比色法测定蝴蝶兰叶片的总可溶性糖含量[18];淀粉含量的测定参照Zapata等[19]的方法;叶片可溶性蛋白含量的测定参考Bradford[20]的方法。
1.2.4 花序轴腋芽形态与解剖结构观察
在试验处理的第35天,取蝴蝶兰花序轴腋芽的芽点,用去离子水冲洗,剥去苞片,用50% FAA固定液(50%乙醇450 mL+冰醋酸25 mL+40%甲醛25 mL)固定。采用常规石蜡制片法,用LEICA_ASP200S全密封式组织脱水机脱水,用LEICA_EG1160组织包埋机包埋,用Leica RM2245旋转切片机切片,切片厚度8 μm,用番红固绿二重染色,用加拿大树胶封片,在凤凰PH100-3B41L-IPL显微镜下观察并拍照。
1.3 数据处理
采用SPSS v15.0软件分析数据差异显著性,使用SigmaPlot 11.0和Excel 2010软件绘制图片。
2 结果与分析
2.1 温度与光照对蝴蝶兰叶片净CO2吸收速率和Gs的影响
在蝴蝶兰花序轴腋芽发育过程中,温度与光照对蝴蝶兰叶片的净CO2吸收速率和Gs都有显著影响(图1)。在2个温度条件下,强光条件下蝴蝶兰叶片的净CO2吸收速率均高于弱光条件下。温度对净CO2吸收速率的影响因光照强度不同而有显著差异,在相同的光照条件下,高温利于蝴蝶兰叶片进行CO2气体的吸收。随着试验的进行,蝴蝶兰叶片净CO2吸收速率始终保持高温强光>低温强光>高温弱光>低温弱光的趋势。
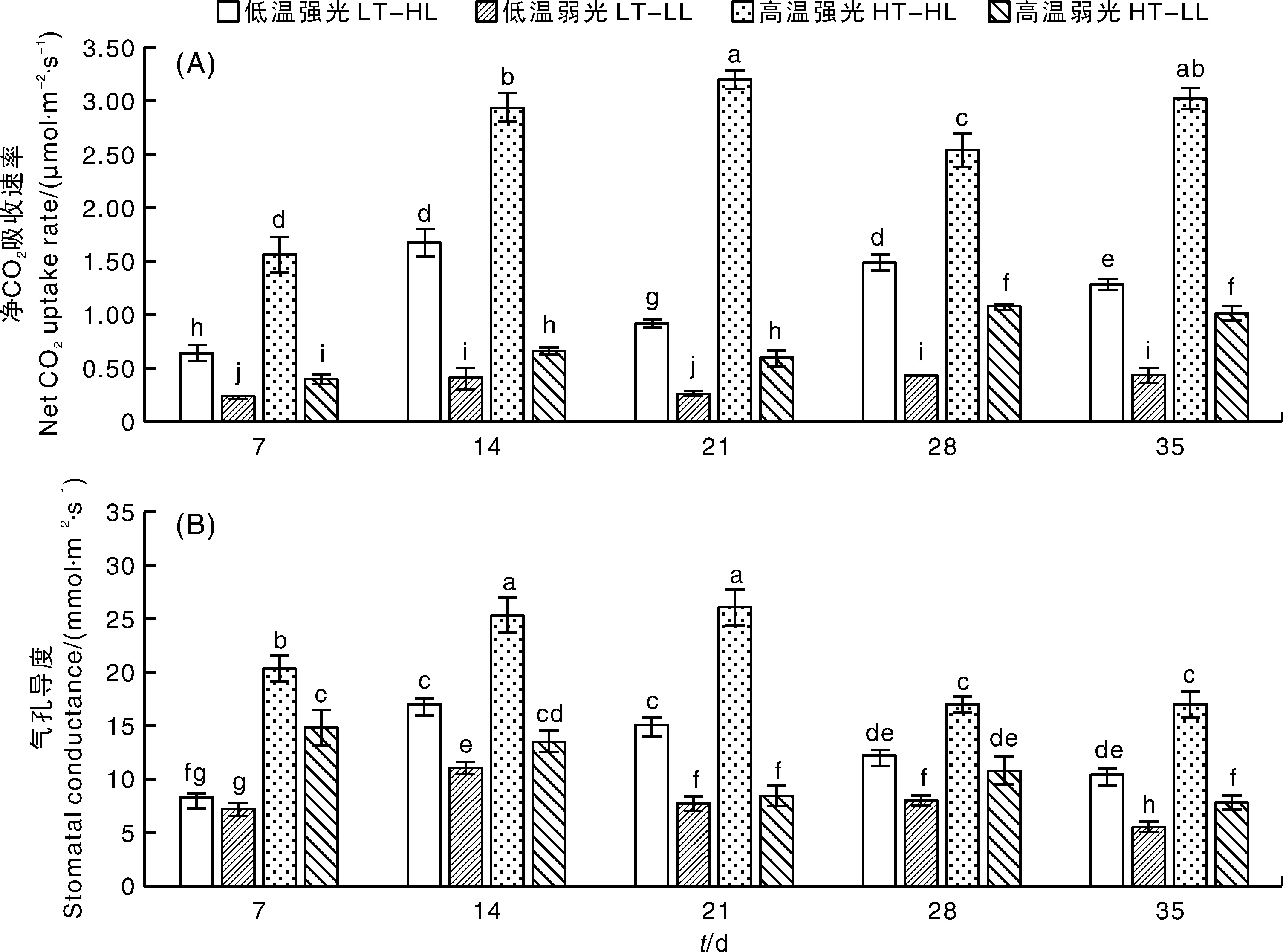
LT-HL,低温强光处理;LT-LL,低温弱光处理;HT-HL,高温强光处理;HT-LL,高温弱光处理。无相同小写字母表示各处理间差异显著(P<0.05)。下同。LT-HL, Low temperature with high light intensity treatment; LT-LL, Low temperature with low light intensity treatment; HT-HL, High temperature and high light intensity treatment; HT-LL, High temperature with low light intensity treatment. Data marked without the same lowercase letter indicated significant differences among treatments at P<0.05. The same as below.图1 温度与光照对蝴蝶兰大辣椒叶片净CO2吸收速率和气孔导度的影响Fig.1 Effects of temperature and light intensity on net CO2 absorption rate and stomatal conductance in Phalaenopsis ‘Big Chili’ leaves
气孔是空气中CO2进入植物体内和植物体内水分蒸发的主要通道,对植物来说有着至关重要的作用。温度与光照对蝴蝶兰叶片的Gs也有显著影响,在试验处理的初期,高温条件下叶片的Gs显著高于低温条件,随着试验处理的进行,蝴蝶兰叶片的Gs和净CO2吸收速率呈现相似的变化趋势,高温强光条件下的Gs显著大于低温强光条件,但低温弱光和高温强光条件下则没有显著差异。
2.2 温度与光照对蝴蝶兰叶片叶绿素含量的变化
叶绿素是植物进行光合作用的主要光合色素。温度和光照强度对蝴蝶兰叶绿素含量有不同的影响,如图2所示,在低温条件下,强光可促进叶绿素含量的积累,在高温条件下,弱光则促进叶绿素含量的积累。在强光条件下,叶绿素含量在高温和低温之间的差异不显著,在弱光条件下,高温促进了叶绿素含量的积累。在整个试验处理的过程中,高温弱光条件下的叶绿素含量都高于其他处理组。
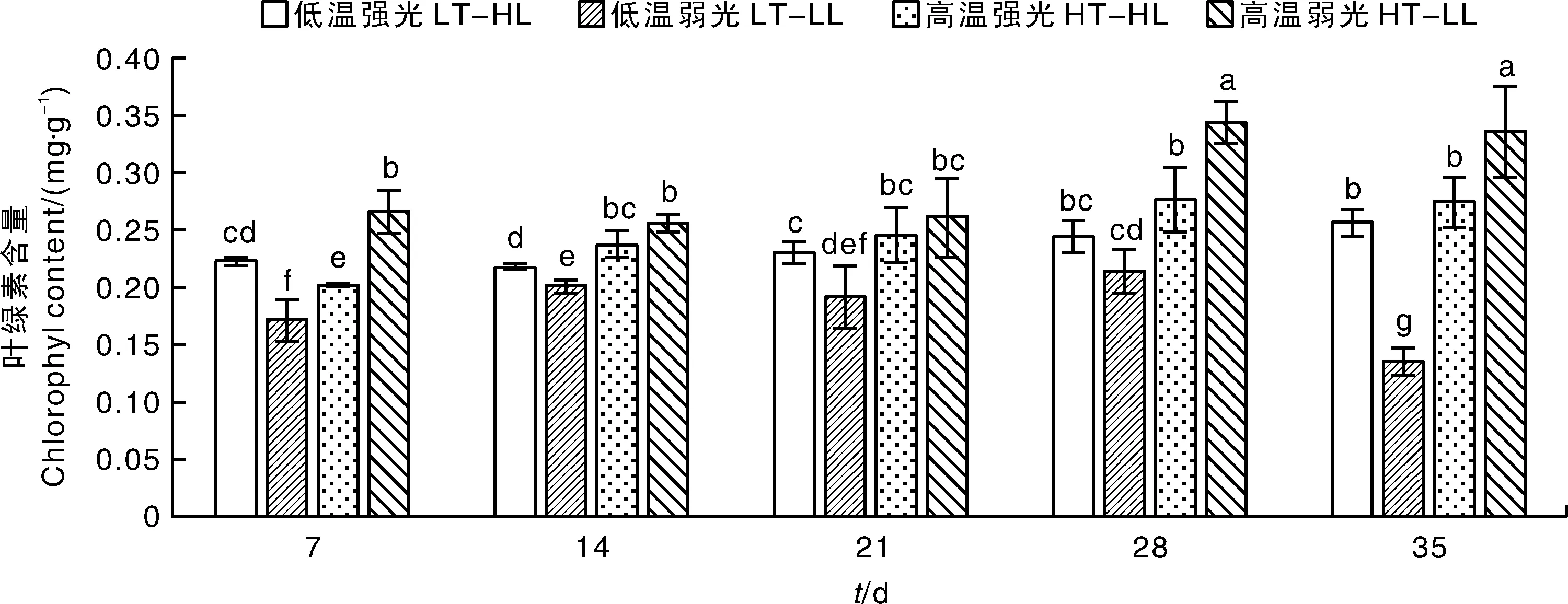
数据以鲜重计。下同。Data was detected based on fresh weight. The same as below.图2 温度与光照强度对蝴蝶兰大辣椒叶片叶绿素含量的影响Fig.2 Effects of temperature and light intensity on chlorophyl content in Phalaenopsis ‘Big Chili’ leaves
2.3 温度与光照对蝴蝶兰叶片碳水化合物含量的影响
碳水化合物是植物光合作用的重要产物,也是植物进行营养生长与生殖生长的重要调控信号。如图3所示,蝴蝶兰叶片的碳水化合物含量在不同处理条件下具有一定的差异,强光条件可以促进蝴蝶兰叶片碳水化合物含量的积累。对于可溶性糖含量来说,在处理的第7天,4个处理的可溶性糖含量都较低,在随后的处理中,强光促进了蝴蝶兰叶片可溶性糖含量的积累,其中低温强光处理下的可溶性糖含量最大,平均为15.49 mg·g-1,高温强光下的可溶性糖含量平均为11.04 mg·g-1;弱光条件下可溶性糖含量为3~9 mg·g-1,显著低于强光处理。对于淀粉含量来说,强光处理下蝴蝶兰叶片淀粉含量显著高于弱光处理。在整个试验处理过程中,高温强光条件下的淀粉含量一直维持较大值,平均含量为17.54 mg·g-1,其次为低温强光条件,平均含量为14.60 mg·g-1。
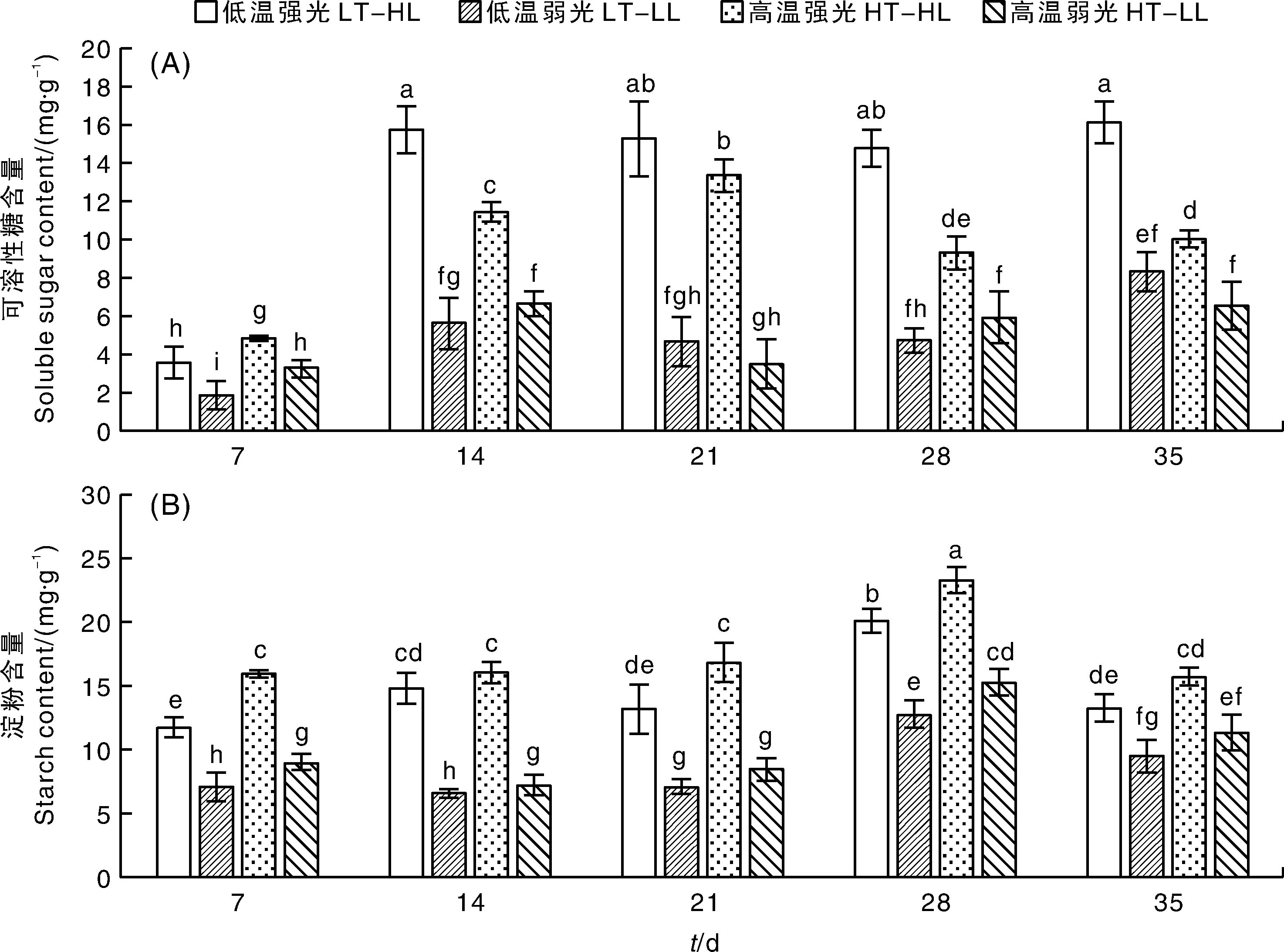
图3 温度与光照对蝴蝶兰大辣椒叶片碳水化合物含量的影响Fig.3 Effects of temperature and light intensity on the carbohydrate contents in Phalaenopsis ‘Big Chili’ leaves
2.4 温度与光照对蝴蝶兰叶片可溶性蛋白含量的影响
在不同温度和光照条件下,蝴蝶兰大辣椒叶片的可溶性蛋白含量有显著差异。与碳水化合物的变化趋势一样,强光可以促进蝴蝶兰叶片可溶性蛋白含量的积累。在试验处理的过程中,蝴蝶兰叶片的可溶性蛋白含量变化呈现高温强光>低温强光>高温弱光>低温弱光的趋势。在处理的第28天和第35天,高温强光条件下蝴蝶兰叶片的可溶性蛋白含量显著高于其他处理,比低温弱光条件下分别高96%和156%(图4)。
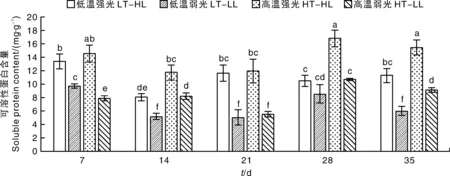
图4 温度与光照强度对蝴蝶兰大辣椒叶片可溶性蛋白含量的影响Fig.4 Effects of temperature and light intensity on the soluble protein content in Phalaenopsis ‘Big Chili’ leaves
2.5 蝴蝶兰花序轴腋芽的发育形态与解剖结构特征
蝴蝶兰花序打顶之后,花序轴腋芽开始萌发。在不同的温度和光照条件下,花序轴腋芽发育的形态有显著差异(图5)。在低温强光条件下,蝴蝶兰花序轴腋芽萌动伸长,逐渐露出节间,先端有鳞片包裹,颜色呈现褐红色(图5-A1)。观察显微结构发现,该处理下腋芽发育为完整的花序,顶端的花序分生组织饱满圆润,向两侧分化圆球状小突起,即为花序的侧花原基,侧花原基进一步变宽增大,继而从边缘分化出突起,即为花萼原基(图5-A2);在花序的最下面,有2个圆柱形的休眠芽,倘若条件合适,可发育为次生花序。在处理的第35天,低温强光下蝴蝶兰花序轴腋芽发育为具有次生花序的完整花序,发育进程位于花萼原基分化期。

A,低温强光;B,低温弱光;C,高温强光;D,高温弱光。IM,花序分生组织;FM,花分生组织;SE,花萼分生组织;PE,花瓣分生组织;DB,休眠芽;CO,合蕊柱原基;VC,生长锥;YL,幼叶。A, Low temperature and high light intensity; B, Low temperature and low light intensity; C, High temperature and high light intensity; D, High temperature and low light intensity. IM, Inflorenscence meristem; FM, Floral meristem; SE, Sepal meristem; PE, Petal meristem; DB, Dormant bud; CO, Column primordium; VC, Vegetative cone; YL, Young leaf.图5 温度与光照对蝴蝶兰大辣椒花序轴腋芽发育的影响Fig.5 Effects of temperature and light intensity on the axillary bud development of flower stalk in Phalaenopsis ‘Big Chili’
在低温弱光处理条件下,蝴蝶兰花序轴腋芽生长较慢,外观形态与低温强光条件下相似,但是生长较低温强光条件下慢,且颜色呈绿色(图5-B1)。观察显微结构发现,该处理诱导的腋芽仍发育为花芽,发育过程和低温强光相似,但下部节间分生组织没有形成典型的休眠芽,而且进程晚于低温强光,腋芽仅发育到花原基分化期(图5-B2)。
在高温强光处理下,蝴蝶兰花序轴腋芽生长较快,在处理的第35天,外观已能看到分化的节间和花蕾,外观颜色呈现褐红色(图5-C1)。显微结构观察发现,腋芽发育顶端仍在进行花原基、花萼原基和花瓣原基的分化,对可见花蕾进行解剖发现,花蕾已进入蕊柱和花粉块的分化期(图5-C2)。
在高温弱光处理下,腋芽的发育与其余3个处理明显不同。该处理下腋芽发育非常缓慢,在处理的第35天,仅表现为芽体膨大(图5-D1),当继续在该条件下处理2个月,可发育为幼苗(图5-D3)。显微结构下可观察到腋芽为典型的叶芽,芽体中央有一个芽轴,其顶端染色较深的地方为生长锥,紧邻生长锥的下方周围有叶原基,远离生长锥的叶原基已经发育长大为幼叶包围着生长锥(图5-D2)。
3 结论与讨论
CAM植物占高等植物的6%~7%[21],因夜间气孔打开固定CO2的特殊方式,而导致其光合生理的研究相对较少。蝴蝶兰为典型的CAM植物[4,22],夜间吸收CO2,还原为苹果酸储存于细胞的液泡中;白天,液泡里的苹果酸脱羧释放CO2进入卡尔文循环。白天的脱羧反应属于光依赖反应[23],光照不足导致的脱羧不完全,会抑制夜间气孔的开放,从而影响蝴蝶兰的净CO2吸收速率。本研究中,弱光条件下蝴蝶兰叶片的净CO2吸收速率显著低于相应的强光处理,该结果与C3植物中发现的光照强度降低会导致光合速率的下降[24-25]的结果一致。温度对CAM植物净CO2吸收速率的影响因品种不同而有显著差异,一般认为,凉爽的夜温(15~20 ℃)和昼夜温差有利于CAM植物苹果酸的夜间积累[26];但本研究却发现,高温(昼夜:30 ℃/28 ℃)条件下蝴蝶兰叶片的净CO2吸收速率显著高于低温(昼夜:24 ℃/18 ℃)条件,相似的研究结果在蝴蝶兰满天红的研究中也得到证实,28 ℃条件下植株叶片CO2吸收速率显著高于17 ℃条件下[27],目前对于这一现象的主要原因还不清楚,可能主要是由于蝴蝶兰原产于热带和亚热带地区,28 ℃的夜温仍属于适宜生长的温度。
叶片是蝴蝶兰感受低温的主要器官,把去掉叶片的蝴蝶兰植物放在低温环境下处理并不能诱导产生花芽[28]。因此,蝴蝶兰叶片光合产物的含量与其花芽的发育具有紧密的关系。碳水化合物既是光合作用的主要产物,又是蝴蝶兰由营养生长向生殖生长转化的重要能量物质[29-30]。对蝴蝶兰大辣椒来说,强光显著促进了光合产物的积累,这与叶片的净CO2吸收速率的研究结果一致。但在温度与光照强度互作条件下,蝴蝶兰叶片的碳水化合物含量变化趋势与净CO2吸收速率并不一致,高温强光下蝴蝶兰叶片的净CO2吸收速率显著高于其他处理,而低温强光下蝴蝶兰叶片具有较高的可溶性糖含量和淀粉含量。在成花过程中,叶片作为“源”是干物质积累的主要器官,花芽作为“库”是能量消耗的主要器官,植株通过改变体内的“能量分配”关系来平衡“源-库”的关系,改变同化物质在各器官的供应[31]。在蝴蝶兰花芽发育过程中,花芽的碳水化合物含量显著高于叶片[30,32]。本研究中,高温强光下蝴蝶兰花序轴腋芽发育进程较快,光合作用形成的产物可能大多分配到花芽中;而且,叶片中碳水化合物的不足会增强叶片的光合能力,这与高温强光下蝴蝶兰叶片的净CO2吸收速率较高相一致。
前期研究结果表明,蝴蝶兰花序轴腋芽在花序形态建成初期就已形成[32]。花序轴腋芽的萌发与品种的遗传特性紧密相关,大花型蝴蝶兰的花序轴腋芽在成花过程中以休眠的状态存在,小花型蝴蝶兰花序轴腋芽常发育为次生花序。此外,芽原基的发育也受到环境因素的调控。CO2浓度升高会增加蝴蝶兰花序的侧枝[33],尤其是CO2浓度升高与强光照互作[34],但高温会降低花序的分枝[35]。本研究与已有的研究结果有显著差异,以剪除花序的方式来抑制顶端优势以促进花序轴腋芽萌发。在本研究的4个处理下,花序轴腋芽均能正常萌发生长,但不同的环境条件下腋芽发育的机制和进程完全不同:在高温弱光处理下,蝴蝶兰腋芽进行营养生长,发育为植株幼苗;在其他3个处理中,虽然发育进程有所差异,但从发育形态和解剖结构来看,腋芽皆进行生殖生长,发育为花序进行二次开花。大部分研究已证明,温度和光照是影响蝴蝶兰营养生长与生殖生长的主要环境因子[7,16,27,36],本研究也进一步印证了这一结论。本研究中,高温强光条件下,蝴蝶兰花序轴腋芽仍进行生殖生长,并能够形成完整的花部形态,这与以往的研究结果并不一致[7-8]。An等[7]认为,白天持续12 h的高温(29 ℃)能充分促进蝴蝶兰的营养生长,完全防止花序的发生;Newton等[8]认为,持续高温(>29 ℃)8 h就能阻止部分蝴蝶兰品种开花。这一结论相违背的主要原因可能有2种情况:一是,本研究以蝴蝶兰花序轴腋芽为试验材料,该腋芽属于花序的附属器官,在花序形成的过程中有可能已经完成了生殖诱导,在条件适宜的情况下就萌发生长,但在高温弱光的条件下,发生了发芽逆转的情况;二是,本研究中的高温条件下设置了每天12 h 200 μmol·m-2·s-1的光通量密度,在温度与光照强度共存的条件下,较强的光照强度有可能优先促进蝴蝶兰花序轴腋芽完成花芽诱导,以进行正常的生殖生长。蝴蝶兰花芽逆转的研究发现,28 ℃的环境温度会导致早期分化(长度<5 cm)的蝴蝶兰花芽发生逆转的现象,但花芽分化后期(长度>10 cm),28℃的环境温度并不会影响蝴蝶兰的生殖发育,而且会加速花芽的生长而提早开花[2,13,37]。蝴蝶兰品种丰富,每个品种之间具有一定的特性差异,为探索高温强光对蝴蝶兰成花诱导的具体影响机制,在后期的研究中,可以选用成熟的蝴蝶兰植株为试验材料,以排除花序轴腋芽有可能早期发育的情况。倘若较强的光照强度能够减弱高温对蝴蝶兰成花的抑制作用,将对以后蝴蝶兰的生产具有重要的经济意义。
目前,以花序轴腋芽为试验材料进行蝴蝶兰成花诱导的研究还处于初级阶段,该发育机制与成熟植株的研究结果是否一致,还需要进行更广泛和深入的研究。如果能够以花序轴腋芽的发育来阐述蝴蝶兰的花芽诱导机制,将改变早期花芽分化对蝴蝶兰植物破坏性损伤的现状,为蝴蝶兰花期调控提供丰富的经济有效的试验材料。
