不同月龄新西兰兔肝中差异蛋白质鉴定与验证
2023-11-05刘方程毕冬琳杨东亮杨晓莉柏家林李琼毅
刘方程,王 峰,毕冬琳,杨东亮,杨晓莉,柏家林,李琼毅,*
(西北民族大学 a. 生物医学研究中心,生物工程与技术国家民委重点实验室;b. 生命科学与工程学院,甘肃 兰州 730030)
兔出血症病毒(Rabbithaemorrhagicdiseasevirus, RHDV)是兔出血症(rabbit haemorrhagic disease, RHD)的病原体,又名兔瘟。1984年,我国首次报道了兔出血症的流行,在之后的12个月内中国约有1.4亿只家兔因兔出血症死亡[1]。该疾病在短时间内传播到约50万km2的区域,并且在接下来的10年里,该病毒在全球范围内传播,严重威胁世界范围内养兔业的发展[2-6]。
成熟RHDV为单股正链RNA病毒,呈球形,直径约32~35 nm,无包膜,表面有典型的杯状凹陷[7]。RHDV基因组全长约7.5 kb,含有2个重叠的开放阅读框(ORF),ORF1编码病毒主要结构蛋白VP60和7个非结构蛋白[p16、p23、解旋酶、p29、VPg、蛋白酶和RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase, RdRp)][8];ORF2则编码次级结构蛋白VP10[9]。根据VP60基因组序列,RHDV可分为GⅠ和GⅡ两个基因群:GⅠ包括GⅠ.1~GⅠ.4共4种基因型,其中GⅠ.1(RHDV1)和GⅠ.2(RHDV2)是兔感染RHD的主要病原体,GⅠ.3和GⅠ.4无致病性;GⅡ包括欧洲棕兔综合征病毒(EBHSV)和与EBHSV相关的非致病性兔杯状病毒(Harecalicivirus, HaCV)[10]。
成年兔对GⅠ.1型RHDV易感,死亡率达90%以上;但2月龄幼兔感染后发病率较低,3周龄幼兔不发病[1]。幼兔对RHDV的易感性随年龄的增加而增加,直到9周龄其发病率、死亡率与成年兔一样[11-12]。幼兔对GⅠ.1型RHDV的天然抗病机制尚不明确,但可能与幼兔和成年兔肝结构功能不同[12-13]及固有免疫应答差异相关[14-16]。目前,由于没有适宜体外复制增殖的细胞系,RHDV致病机制等相关研究进展缓慢。正因为幼兔对其存在天然抵抗性,故寻找并分析关键的差异蛋白质对RHDV易感性的影响将为其致病机制研究和疫苗研发带来新突破。本文运用串联质谱标记(tadem mass tags, TMT)定量蛋白质组学技术和生物信息学分析对2周龄幼年兔和6月龄成年兔肝中差异蛋白质进行分析,旨在从蛋白质水平阐明成年兔和幼年兔对RHDV易感性差异的分子机制,为研究RHDV易感染宿主细胞的潜在靶点和RHDV体外扩增细胞系的构建提供新的思路和方法。
1 材料与方法
1.1 试验材料
未接种RHDV疫苗的2周龄幼年和6月龄成年新西兰兔各3只,购自甘肃省水思圆智能科技工程有限公司。将兔用空气栓塞法处死,解剖采集肝组织,切成1 cm×1 cm×1 cm大小方块,用锡箔纸包裹,于-80 ℃保存备用。兔肾细胞系RK-13购自武汉大学中国典型培养物保藏中心(CCTCC);TMT分子标记试剂盒、BCA蛋白质定量试剂盒、乙醇、甲酸、乙腈、丙酮、纳升级肽段分析柱(75 μm×250 mm)和HSPA9兔单克隆抗体均购自美国赛默飞世尔科技公司;4-羟乙基哌嗪乙磺酸(HEPES)、十二烷基硫酸钠(SDS)、三氟乙酸(TFA)和甲酸铵均购自西格玛奥德里奇(上海)贸易有限公司;乙二胺四乙酸(EDTA)、蛋白酶抑制剂(PMSF)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)和测序级胰蛋白酶(Trypsin)购自上海普洛麦格生物产品有限公司;三乙基碳酸氢铵(TEAB)和25%氨水购自上海圣克鲁斯生物技术有限公司;Sep-Pak C18除盐柱(100 mg)和高pH反相色谱柱均购自上海沃特世有限公司;尿素购自美国英杰生物技术有限公司;KRT8鼠单克隆抗体、KRT18鼠单克隆抗体、ACAT1兔单克隆抗体、ALDH1A1兔单克隆抗体和GAPDH鼠单克隆抗体均购自Abcam公司;SLBP兔单克隆抗体、山羊抗鼠IgG-HRP和山羊抗兔IgG-HRP购自上海睿铂赛生物科技有限公司;Hyper Signal高敏ECL发光底物购自北京四正柏生物科技有限公司;磷酸缓冲盐液(PBS,pH值7.2~7.4)、10×电转液、RIPA裂解液和TBST缓冲液购自北京索莱宝科技有限公司。
1.2 蛋白质提取、酶解
将-80 ℃保存的肝组织研磨后加入1.0 mL裂解液,放于冰上超声破碎10 min,4 ℃、20 000×g离心30 min,取上清液,使用BCA蛋白质测定试剂盒对蛋白质进行定量检测。吸取100 μg蛋白质溶液,添加1 mol·L-1三乙基碳酸氢铵(TEAB)至100 μL,加入二硫苏糖醇(dithiothreitol, DTT)至终浓度为0.1 mol·L-1,56 ℃还原1 h,加入碘乙酰胺(IAA)至终浓度0.55 mol·L-1,室温避光孵育1 h;加入预冷丙酮沉淀蛋白质,离心收集沉淀;加入1 mL 50%丙酮、50%乙醇溶液混悬沉淀,-20 ℃沉淀3 h以上;离心、收集沉淀,加入100 μL 1 mol·L-1TEAB溶液复溶沉淀,加入胰蛋白酶37 ℃反应12 h,酶解蛋白质悬浮液。
1.3 肽段标记
根据TMT分子标记试剂盒说明书对每个样品肽段进行标记,将TMT试剂溶于150 μL异丙醇,取100 μg样品肽段,加入已溶解的TMT试剂,于室温下反应2 h后,加入100 μL超纯水终止反应;随后将样品离心,真空冷冻干燥。
1.4 标记肽段除盐
将标记后的干燥样品溶于400 μL 0.1% TFA、0.5%乙腈溶液,使用200 μL 0.1% TFA、60%乙腈活化除盐柱,加入400~600 μL 0.1% TFA、1%乙腈溶液平衡除盐柱,将重溶样品加入除盐柱内,使样品缓慢流过除盐柱,标记肽段被除盐柱捕集,盐和其他非疏水性小分子流出、舍弃。再添加200 μL 0.1% TFA、0.5%乙腈溶液清洗除盐柱,洗去残留盐类。添加300 μL 0.1% TFA、60%乙腈溶液,使液体缓慢流过除盐柱,将肽段洗脱下来,使用新EP管收集洗脱溶液。最后将洗脱溶液冷冻干燥,去除乙腈。
1.5 反相色谱分离与质谱
用Waters公司的H-Class超高效液相色谱系统进行分离,高pH流动相A为pH值10.0的0.1 mol·L-1甲酸铵,高pH流动相B为pH值10.0的0.1 mol·L-1甲酸铵、90%乙腈,色谱柱为超高效色谱柱(BEH C18 1.7 μm, 2.1 mm×150 mm),上样量50 μL,流速250 μL·min-1,215 nm紫外光谱检测。结束色谱分离后,用Q Exative质谱分析肽段。离子源喷雾电压为2.0 kV,Q Exative质谱仪加热毛细管设定温度为320 ℃,采用数据依赖模式自动在MS和MS/MS间切换采集。条件设置:最大进样时间50 ms,全扫描分辨率17 500 FWHM,MS/MS分辨率50 000 FWHM,母离子扫描范围110~2 000 m/z,碰撞能量30 eV。
1.6 蛋白质鉴定和定量检测
将质谱数据输入到Proteome Discoverer(PD)软件(version 1.4.0.288, Thermo Fisher Scientific)后,软件先对质谱图进行筛选。PD软件提取后的谱图用Mascot(version 2.3.2, Matrix Science)进行搜索,搜索结束后PD软件根据Mascot搜索结果和质谱图进行定量分析。蛋白质组学原始数据库已通过iProX存储库存入国际蛋白质组学共享联盟(ProteomeXchange),项目ID号为IPX0005504001。
1.7 生物信息学分析
1.7.1 GO功能注释
使用NCBI BLAST+软件和Gene Ontology数据库(http://www.geneontology.org/)对筛选出的差异蛋白质进行搜索,然后利用GO进行定位和注释。
1.7.2 KEGG通路注释
将筛选出的差异蛋白质在京都基因与基因组百科全书Pathway数据库(KEGG)(www.kegg.jp/kegg/pathway.html)进行对比,对目标蛋白质进行KO归类,并获取目标蛋白质序列参与的通路信息。
1.7.3 蛋白质互作网络(protein-protein interaction networks, PPI)分析
利用IntAct(http://www.ebi.ac.uk/intact/main.xhtml)和STRING(http://string-db.org/)数据库查找差异蛋白质之间的直接和间接相互作用关系。使用Cytoscape 3.2.1软件进一步分析功能性蛋白质相互作用网络,并计算每种蛋白质的丰度以评估蛋白质在网络中的重要性,构建差异蛋白质的网络互作图。
1.8 差异蛋白质Western blot验证
收集生长状态良好的RK-13细胞、成年家兔和幼年家兔肝组织,用RIPA(含1%蛋白酶抑制剂PMSF)裂解液裂解,制备好的蛋白质样品分别加入SDS-PAGE胶上样孔中,每孔上样量为10 μg;设置恒压80 V电泳120 min,电泳完成后,用伯乐半干转膜仪10 V、1 A条件下转膜30 min,转印至PVDF膜。用脱脂奶粉封闭1 h后加入差异蛋白质单克隆抗体,4 ℃孵育过夜,用TBST洗膜5次,加入HRP标记的二抗,室温孵育1 h,用TBST洗膜5次,用电泳凝胶成像分析系统显色。
1.9 数据分析
对筛选得到的差异蛋白质进行Western blot检测,检测结果采用ImageJ(v1.8.0)软件进行灰度分析,其余数据均使用Graphpad Prism 8.0.1软件进行多组间单因素方差分析(one-way analysis of variance)分析。
2 结果与分析
2.1 差异蛋白质的筛选与鉴定
本试验共鉴定了4 353个蛋白质,筛选出821个具有统计学意义的差异蛋白质。相对于幼年兔,成年兔肝中显著上调表达蛋白质294个,显著下调表达蛋白质527个,差异蛋白质表达火山图和热图如图1所示。根据2种月龄兔肝中蛋白质定量比值将筛选出的差异蛋白质进行排序,筛选出了比值最大的6个差异蛋白质,其中醇脱氢酶(aldehyde dehydrogenase 1A1, ALDH1A1)、角蛋白8(keratin 8, KRT8)、角蛋白18(keratin 18, KRT18)和组蛋白结合蛋白1(histone binding protein 1, SLBP1)共4个蛋白质的表达显著上调,胆固醇酰基转移酶1(cholesterol acyltransferase 1, ACAT1)和热休克蛋白9(heat shock protein family A member 9,HSPA9)的表达显著下调(表1)。
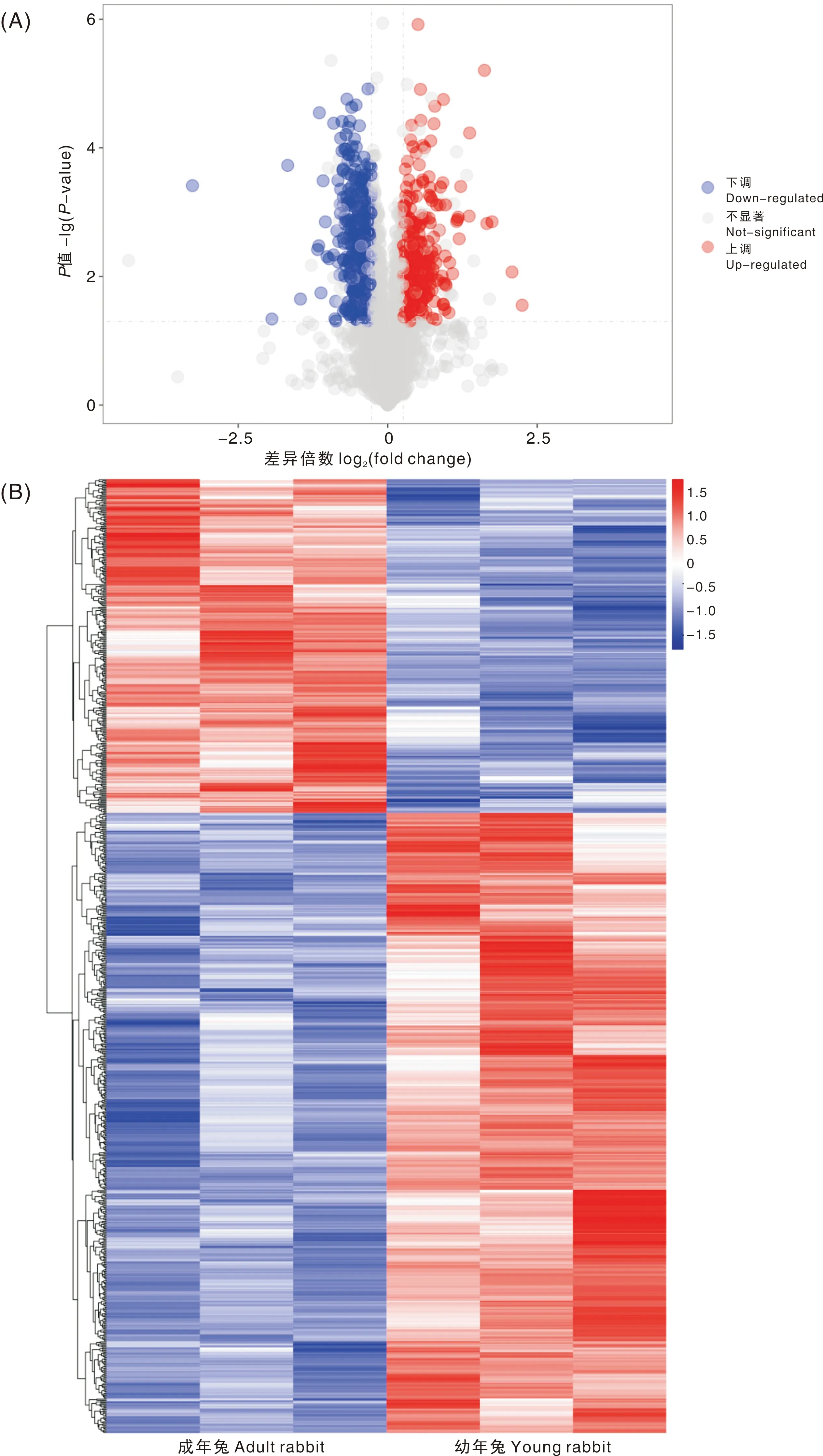
A,差异蛋白火山图;B,差异蛋白聚类热图。A, Volcano plot of differential proteins; B, Clustering heat map of differential proteins.图1 差异蛋白质的筛选与鉴定Fig.1 Screening and identification of differential proteins
2.2 差异蛋白质GO富集分析
GO富集分析结果显示,821种差异蛋白质主要富集到生物学过程(biological process, BP)、细胞组分(cellular component, CC)和分子功能(molecular function, MF)3大类(图2-A)。BP中小分子代谢(small molecule metabolic process)蛋白质145个、氧化还原过程(oxidation-reduction process)蛋白质111个、代谢过程(metabolic process)蛋白质478个;CC中细胞外成分(intracellular-part)蛋白质528个、线粒体(mitochondrion)蛋白质139个、细胞质(cytoplasmic part)蛋白质366个;MF中催化活性(catalytic activity)蛋白质342个、氧化还原活性(oxidoreductase activity)蛋白质93个、辅酶结合(coenzyme binding)蛋白质50个(图2-B)。
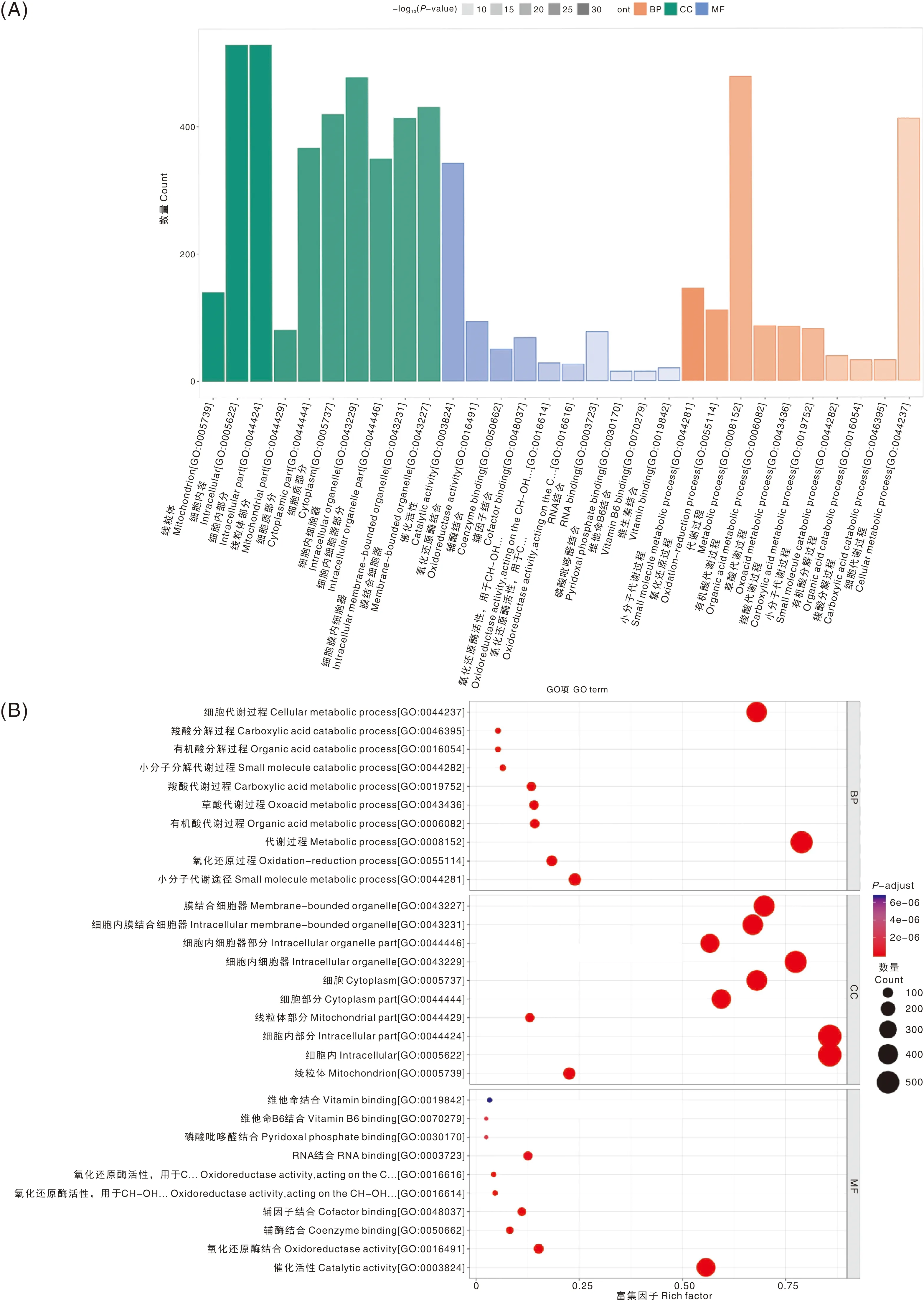
A,差异蛋白质GO富集分析分类直方图;B,差异蛋白质GO富集分析分类气泡图。BP,生物学过程;CC,细胞组分;MF,分子功能。A, Classification histogram of differential proteins by GO enrichment analysis; B, Classification bubble diagram of differential proteins by GO enrichment analysis. BP, Biological process; CC, Cellular component; MF, Molecular function.图2 差异蛋白质GO富集分析结果Fig.2 The results of GO enrichment analysis of differential proteins
2.3 KEGG信号通路注释结果
对成年兔和幼年兔肝中的821个差异蛋白质进行通路富集分析,结果共注释到47条KEGG信号通路,排名前10的通路如表2所示。其中,代谢途径(metabolic pathways)通路中富集的蛋白质差异极显著(P<0.01),且富集的蛋白质数量较多,剩余通路主要包括糖代谢(carbon metabolism)、氧化磷酸化(oxidative phosphorylation)、剪切小体(spliceosome)等。
2.4 差异蛋白的PPI构建分析
由成年兔和幼年兔肝中差异蛋白质相互作用网络结构图和柱形图(图3-A、3-B)可看出,关联度排名前10位的差异蛋白质分别是线粒体核糖体蛋白S15(mitochondrial ribosomal protein S15, MRPS15)、人核糖体蛋白L26(ribosomal protein L26, RPL26)、线粒体核糖体蛋白L11(mitochondrial ribosomal protein L11, MRPL11)、核糖体蛋白L11(ribosomal protein L11, RPL11)、泛醌氧化还原酶亚单位AB1(ubiquinone oxidoreductase subunit AB1, NDUFAB1)、线粒体核糖体蛋白L15(mitochondrial ribosomal protein L15, MRPL15)、小核糖核蛋白多肽F(small nuclear ribonucleo protein polypeptide F, SNRPF)、60S核糖体蛋白L27(60S ribosomal protein L27, LOC100356974)、线粒体核糖体蛋白L17(mitochondrial ribosomal protein L17, MRPL17)、线粒体核糖体蛋白L3(mitochondrial ribosomal protein L3, MRPL3),关联度最高的是MRPS15。以上蛋白质均为核糖体蛋白质,其功能聚类于细胞功能调控方面。
2.5 差异蛋白质的验证
根据蛋白质组学分析结果,用成年兔、幼年兔肝组织和5周龄幼兔肾细胞系(RK-13)作为样品,对筛选获得的6个差异蛋白质(ALDH1A1、KRT8、KRT18、ACAT1、SLBP和HSPA9)进行蛋白质表达水平验证。Western blot结果表明:幼年兔组和RK-13组的ALDH1A1、SLBP蛋白表达水平均极显著(P<0.001)低于成年兔组,且RK-13组的ALDH1A1、SLBP蛋白表达水平极显著(P<0.001)低于幼年兔组(图4A、4-B、图4-I、4-J);幼年兔组和RK-13组的KRT8蛋白表达水平极显著低于成年兔组,且RK-13组显著(P<0.05)低于幼年兔组(图4-C、4-D);幼年兔组和成年兔组的KRT18蛋白表达水平均极显著(P<0.001)低于RK-13组,幼年兔组KRT18蛋白表达水平极显著(P<0.001)低于成年兔组(图4-E、4-F);成年兔组、RK-13组的ACAT1蛋白表达水平极显著(P<0.001)低于幼年兔组,RK-13组的ACAT1蛋白表达水平极显著降低于成年兔组(P<0.001)(图4-G、4-H);幼年兔组和RK-13组的HSPA9蛋白表达水极显著(P<0.001)高于成年兔组,但RK-13组与幼年兔组间HSPA9蛋白表达水平无显著差异(P>0.05)(图4-K、4-L)。
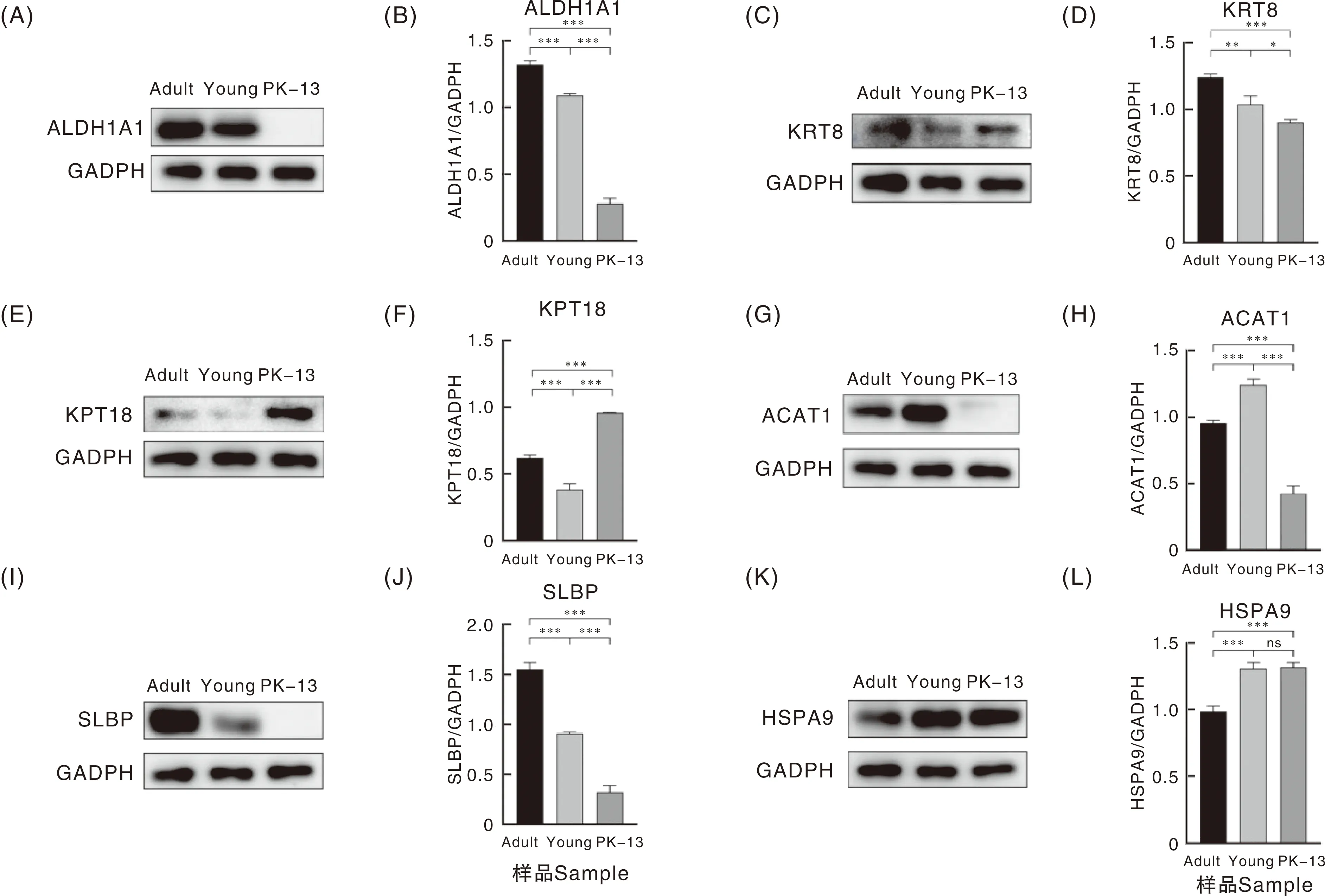
ALDH1A1,醇脱氢酶;KRT8,角蛋白8;KRT18,角蛋白18;ACAT1,胆固醇酰基转移酶1;SLBP,组蛋白结合蛋白1;HSPA9,热休克蛋白9;Adult,成年兔;Young,幼年兔。*、**、***分别表示在P<0.05、P<0.01和P<0.001水平差异显著。ALDH1A1, Aldehyde dehydrogenase 1A1; KRT8, Keratin 8; KRT18, Keratin 18; ACAT1, Cholesterol acyltransferase 1; SLBP, Histone binding protein 1; HSPA9, Heat shock protein family A member 9; Adult, Adult rabbit; Young, Young rabbit. *, ** and *** meant significa differences at the levels of P<0.05, P<0.01 and P<0.001, respectively.图4 成年兔和幼年兔肝、5周龄幼兔肾组织细胞系(RK-13)的差异蛋白表达水平Fig.4 Differential protein expression levels in livers of adult and young rabbits, and kidney cell lines (RK-13) of 5-week-old rabbits
3 结论与讨论
RHDV是一种在全球范围传播的兔急性、高度致死性传染病,对家兔养殖业造成了巨大经济损失[17-18]。疫苗是预防兔出血症的主要手段,但目前为止,仍尚未构建出允许体外培养RHDV毒株的细胞系[19-20]。因此,深入研究RHDV感染后的体液和细胞免疫机制,比较幼年兔和成年兔感染RHDV的机制,可为合理开发RHD疫苗提供基础理论依据。
病毒感染是一个极为复杂的过程,涉及基因、蛋白质、代谢物等物质的相互作用,蛋白质组学可较全面地揭示生物系统中差异蛋白质对病毒感染的影响[21]。目前基于质谱技术的蛋白质组学定量方法有同位素标记相对和绝对定量蛋白质组学(isobaric tags for relative and absolute quantitation, iTRAQ)、多重反应监测技术(multiple reaction monitoring, MRM)、TMT和平行反应监测(parallel reaction monitoring, PRM)等[22],其中TMT是赛默飞世尔科技(Thermo Scientific)公司推出的一种基于体外同位素标记的相对与绝对定量蛋白质组学技术,即利用同位素试剂标记蛋白质酶解后产生的多肽,可同时分析多达16种样品间的蛋白质表达量,具有不依赖抗体、可同时测定多样品多目标,易形成标准化操作等优点,应用最为广泛[22]。本研究采用TMT技术对成年兔和幼年兔肝中的差异蛋白质进行了筛选和分析,共鉴定出4 353个蛋白质,筛选出821个具有统计学意义的差异蛋白质,其中294个显著上调,527个显著下调。差异蛋白质GO功能注释生物学过程中主要富集到小分子代谢、氧化还原过程和代谢过程;细胞组分中主要富集到细胞外成分、线粒体和细胞质;分子功能中主要富集到催化活性、氧化还原活性和辅酶结合。KEGG通路数据库分类注释到47条KEGG信号通路,主要涉及代谢途径、糖代谢、氧化磷酸化、帕金森氏症、剪接体、阿兹海默病和丙酸代谢等通路。结合文献报道,本课题组对角蛋白8、角蛋白18、热休克蛋白9、胆固醇酰基转移酶1、醇脱氢酶和组蛋白结合蛋白进行后续验证。
热休克蛋白9属于热休克蛋白家族,参与细胞增殖、细胞器蛋白稳定、凋亡、蛋白质的囊泡运输和神经退行性疾病等多个生理病理过程[23]。已有研究表明,热休克蛋白家族作为一种细胞外的免疫原,可引起主要组织相容性复合体(major histocompatibility complex, MHC)交叉呈递抗原[24]。Neave等[16]研究发现,感染RHDV GI.2株后,幼年家兔肝中的杀伤细胞受到激活,相关功能基因(PTPN22、VaV1和ARRB2)表达下调,推测幼年家兔肝内HSPA9上调后,虽然会活化杀伤细胞,但由于相关基因被下调,不会诱导过强的炎症反应来阻碍RHDV GI.2株感染。本研究中幼年兔肝内HSPA9表达上调,推测感染RHDV GI.1株后,幼年兔可同时活化CD4+T细胞、CD8+T细胞和自然杀伤细胞,激活特异性细胞免疫进而阻碍病毒感染[25]。此外,也有研究表明,HSPA9是坦布苏病毒(TMUV)在鸡成纤维细胞(DF-1)上的病毒受体,推测HSPA9可能与病毒进入细胞有关[26]。
线粒体核糖体蛋白S15(MRPS15)是存在于真核细胞线粒体内的一种核糖体,与线粒体蛋白的翻译相关[27]。研究表明,线粒体核糖体蛋白可以与MAVS结合,促进MAVS活化,并且可以从线粒体转运到细胞质并促进RIG-I/MDA5的K63连接泛素化[28]。Neave等[16]对先天免疫因子基因的表达分析表明,幼年家兔和成年家兔在感染RHDV GI.1株或GI.2株后不同的抵抗效应正是基于这些早期免疫调节过程。本研究中根据PPI分析,MRPS15关联度最高,推测由于幼年兔肝中MRPS15表达较高,当受到RHDV刺激后,可能通过MRPS15与MAVS的互作,进一步促进MAVS的活化,激活天然免疫并拮抗病毒感染。在幼年兔对RHDV GI.1株的应答中,MHCⅠ型和干扰素诱导的基因上调,导致CD4+T和自然杀伤细胞的激活活性增强,这些结果可能与幼年兔对RHDV GI.1株不具有感染性相关。相反,在感染RHDV GI.2株后,幼年家兔肝中MHCⅠ型和干扰素诱导的基因下调,这可能与幼年家兔对RHDV GI.2株具有感染性有关[26]。
角蛋白8(KRT8)属于角蛋白家族,是消化系统中最大的中间丝蛋白和细胞骨架的主要组成部分[29]。李文静等[30]研究发现,丙型肝炎病毒(HCV)感染可导致角蛋白8表达上调,从而反过来促进HCV自身的复制,并且下调角蛋白8具有抗HCV作用,并增强抗HCV药物的抗病毒作用。Ye等[23]研究发现,角蛋白8突变体在慢性乙型肝炎病毒(CHBV)感染后表达上调,其突变体可能阻止细胞骨架的组装,并增加人体对急性肝衰竭的易感性。胆固醇酰基转移酶1(也称为甾醇-O-酰基转移酶,ACAT1)主要功能是催化胆固醇酯的形成并在体内发挥多种功能,包括调节胆固醇的储存和细胞胆固醇的内稳态[31];Pokhrel等[32]研究发现,胆固醇酰基转移酶1抑制剂可抑制诺如病毒(NV)复制,说明胆固醇酰基转移酶1和NV复制相关。组蛋白结合蛋白(SLBP)是一种新的RNA结合蛋白,参与转录翻译和mRNA降解,复制依赖性组蛋白mRNA是其唯一已知的靶点[33]。Li等[34]研究发现,HIV-1感染者的血浆中TNF-α水平与组蛋白结合蛋白水平呈负相关,说明组蛋白结合蛋白是HIV-1潜在的重要细胞调节因子。Albright等[35]研究发现,HCMV能够利用组蛋白结合蛋白作为另一种途径来协助病毒粒子的产生。这些差异蛋白质目前没有与RHDV感染机制相关的报道,我们将在后续的实验中进行逐一探索。
本文采用TMT标记定量蛋白质组学筛选鉴定出了成年兔和幼年兔肝中的差异蛋白质,并对其进行了相应的生物学分析,有助于进一步了解差异蛋白质在RHDV感染中的作用,为RHDV体外扩增细胞系构建提供新的研究思路。差异蛋白质筛选仅仅迈出了第一步,后续还需在细胞水平上进行差异蛋白质对病毒感染影响的验证。
