镉胁迫对不同品种羊肚菌镉富集规律与抗氧化系统的影响
2023-11-05范丽莹范婷婷仝宗军梁立韵赵志勇周昌艳赵晓燕
范丽莹,范婷婷,仝宗军,梁立韵,赵志勇,陈 辉,周昌艳,赵晓燕,*
(1.上海理工大学 健康科学与工程学院,上海 200093; 2.上海市农业科学院 农产品质量标准与检测技术研究所,上海 201403; 3.上海市农业科学院 食用菌研究所,上海 201403)
羊肚菌(Morchellaspp.)隶属于子囊菌门(Ascomycota)盘菌纲(Pezizomycetes)盘菌目(Pezizales)羊肚菌科(Morchellaceae)[1-2],因其鲜美的口感、独特的外观和较高的经济价值受到人们的广泛关注[3]。Rotzoll等[4]发现,羊肚菌具有抗肿瘤、抗菌、抗氧化、促消化、化痰、滋补肠胃、提高免疫力、神经保护等功效[5-9]。自2011年我国羊肚菌首次实现人工栽培以来,随着优良菌种的选育和外源营养袋技术的创新,羊肚菌栽培面积和产量不断增加,加之国家产业精准扶贫的大力推进,作为高附加值食用菌品种的羊肚菌在全国范围内栽培规模迅速扩大,截至2020年我国羊肚菌栽培面积达到1.1万hm2[10]。目前我国羊肚菌商业化栽培的品种主要是六妹羊肚菌(M.sextelata)和梯棱羊肚菌(M.importuna),约占产业的80%~90%[11]。
食用菌栽培方式由其品种决定,羊肚菌、双孢蘑菇、竹荪、大球盖菇等为覆土栽培食用菌,木耳、猴头菇、平菇、金针菇等则不需要土壤即可出菇。对于需要覆土栽培的食用菌而言,土壤是食用菌中重金属的主要来源[12]。宋伟等[13]根据138个典型耕地土壤重金属数据库计算出全国耕地土壤重金属污染率达16.67%,镉(Cadmium, Cd)污染占25.20%,远超其他几种重金属元素。土壤中的重金属能够通过食物链间接地威胁人体健康。与植物相比,食用菌体内会富集更多的重金属,且对Cd富集能力最强[14]。Cd易在机体内产生生物蓄积和生物放大作用,已被美国毒物管理委员会ATSDR列为第六位危及人体健康的有毒物质[15]。食用菌重金属富集最早是从蘑菇属(Agarices)Cd高水平积累中发现的[16]。谢宝贵等[17]对不同食用菌重金属的累积性能进行对比,发现姬松茸对Cd和铅(Pb)的富集能力最强,其次是灵芝,金福菇富集能力最弱。饶书恺等[18]对贵州人工栽培羊肚菌的Cd含量进行筛查,发现超标率达33.9%。食用菌栽培初期,生长基质中的重金属和其他微量元素易被菌丝体吸收,导致采后的食用菌存在一定比例重金属超标现象[19]。郭璟等[20]对青海省5种野生羊肚菌Cd含量进行测定,发现Cd含量超出食品中污染物限量标准的1.15~11.21倍。Liu等[21]对云南省野生食用菌进行重金属含量测定,其中检测到的羊肚菌属包括4个黑脉羊肚菌、1个尖顶羊肚菌和1个高羊肚菌,Cd的质量浓度范围为0.44~2.11 mg·kg-1,均高于国家食品中污染物限量标准值(Cd为0.2 mg·kg-1)。
非生物胁迫会使生物体发生氧化应激反应,积累大量活性氧(ROS)。为了避免ROS对细胞生长、代谢和发育造成损害,生物体必须在胞内控制其产生与清除间的平衡,平衡过程具体包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽还原酶(glutathione reductase, GR)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和抗坏血酸过氧化物酶(ascorbate peroxidase, APX)等酶促抗氧化剂,以及谷胱甘肽(reduced glutathione, GSH)和抗坏血酸(ascorbic acid, AsA)等非酶抗氧化物质[22,23]。小海绵羊肚菌(Morchellaspongiola)通过诱导产生抗氧化系统中的抗氧化酶和抗氧化活性物质来削弱重金属Cd的毒性,辅助细胞消除ROS对菌丝造成的伤害[24]。刘朋虎等[25]发现,Cd诱导姬松茸抗氧化防御系统,导致不同品种姬松茸菌丝酶活性总体呈先上升后下降趋势,Cd胁迫对J85菌丝酶活性影响比J77菌丝更强,J85菌丝细胞受损更严重[26]。
目前,关于羊肚菌重金属方面的研究主要集中在Cd的污染溯源、分布特征和安全评价等,关于Cd对不同品种羊肚菌菌株生理生化、Cd富集规律和抗氧化系统的影响差异方面尚未见报道。基于此,本研究拟利用六妹羊肚菌M25菌株和梯棱羊肚菌I15菌株为试验材料,探讨羊肚菌菌株Cd富集规律,以及不同Cd质量浓度对抗氧化系统典型酶活性及其产物变化的影响,阐明不同品种羊肚菌菌株在生理生化、Cd富集规律和抗氧化系统的差异和响应机制,以便更深入了解Cd对羊肚菌的损伤机制,为羊肚菌Cd抗性菌株筛选、安全栽培和真菌生物修复提供相关基础数据。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
六妹羊肚菌(M.sextelata)M25菌株和梯棱羊肚菌(M.importuna)I15菌株均由上海市农业科学院食用菌研究所菌种保藏中心提供。菌株生长条件:保藏温度4 ℃,培养温度20 ℃。
1.1.2 培养基与试剂
试剂:硝酸和高氯酸购于国药集团化学试剂有限公司;氯化镉购于上海西格玛奥德里奇贸易有限公司;超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、谷胱甘肽还原酶(GR)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、抗坏血酸过氧化物酶(APX)试剂盒、丙二醛(MDA)含量试剂盒、还原型谷胱甘肽(GSH)含量试剂盒和还原型抗坏血酸(AsA)含量试剂盒购于苏州科铭生物技术有限公司。
PDA培养基来自美国BD公司,PDB培养基来自安琪酵母股份有限公司。
Cd母液配制方法:取0.1 g CdCl2,用超纯水定容至50 mL容量瓶,配制成2 g·L-1CdCl2母液。
1.2 试验方法
1.2.1 菌丝培养
固体培养基(平板)培养:按照培养基使用说明(39 g·L-1)进行配制,加入配制好的CdCl2母液,使其终质量浓度分别为0、0.25、0.50、0.75、1.00、1.25、1.50、2.00 mg·L-1,用透气膜封口,121 ℃灭菌15 min。在超净工作台内倒培养基至培养皿中,培养基凝固后在中心分别转接活化后直径5 mm的M25和I15菌块,于20 ℃恒温培养箱中培养。每个菌株每个CdCl2质量浓度处理设置3个重复。
液体培养基(摇瓶)培养:按照培养基使用说明(40 g·L-1)进行配制,CdCl2终质量浓度同固体培养基,每瓶接种6块直径5 mm菌块,于恒温振荡培养箱20 ℃,150 r·min-1培养。每个菌株每个CdCl2质量浓度处理设置3个重复。
1.2.2 菌丝生长速度测定
待所有培养皿中接种块新萌发菌丝生长至培养基表面时开始记录,每2 d在菌丝生长前端进行标记,并用游标卡尺测量菌丝生长前后两端的距离,计算菌丝体日平均生长速度(mm·d-1)。
r=r2-r1;
(1)
v=rm/t。
(2)
式(1)和(2)中,r代表菌丝生长半径(mm);r2代表终止半径(mm);r1代表初始半径(mm);v代表菌丝生长平均生长速度(mm·d-1);rm代表菌丝生长半径平均值(mm);t代表生长时间(d)。
1.2.3 菌丝形态观察
将8个不同Cd质量浓度处理组的平板放在光学显微镜(ZEISS Axio Scope A1)下观察,物镜10×条件下观察菌丝微观形态。
1.2.4 菌丝Cd含量测定
参照《食品安全国家标准 食品中镉的测定》(GB 5009.15—2014)[27]执行。
样品前处理:用100目过滤网过滤液体培养基中的菌丝球,用去离子水洗去菌丝球表面培养基,用0.2 mol·L-1HNO3冲洗3次以洗去胞外Cd。随后将菌丝放置在真空冷冻干燥机(SIM公司,FD5-3T)内冻干,研磨后取0.5 g菌丝体粉末加至50 mL三角瓶内,待测。
湿法消解:向18 mL硝酸与高氯酸混合液(体积比5∶1)内加入待测样品,浸泡过夜,用电热板(JH404-2型)消化至1 mL无色透明液体,冷却后用去离子水定容至25 mL。
使用石墨炉原子吸收光谱仪(SpectrAA 600)和火焰原子吸收光谱仪(SpectrAA 200)测定菌丝Cd含量。通过菌丝与培养基Cd含量的比值计算菌丝Cd富集系数(BCF)。
1.2.5 酶活性测定
收集不同Cd质量浓度处理的菌丝,用于抗氧化剂酶活性和抗氧化活性物质含量的检测。SOD、CAT、GR、GSH-Px和APX活性,以及MDA、GSH和AsA含量测定方法按照苏州科铭生物技术有限公司的试剂盒说明书流程进行,然后使用酶标仪(Tecan Infinite 200)进行测定。
1.2.6 数据处理
采用Microsoft Excel 2021软件生成数据,使用SPSS 26.0软件分析数据,使用GraphPad Prism 9.0软件绘制图形,使用MATLAB 2022软件构建模型。
2 结果与分析
2.1 镉对羊肚菌菌丝生长和形态的影响
由图1-a可知,Cd胁迫使不同品种羊肚菌菌丝生长速度均降低。I15菌丝生长速度随Cd质量浓度的增加而缓慢下降;M25菌丝生长速度受Cd影响较大,在Cd质量浓度为0.25~2.00 mg·L-1时菌丝生长速度处于平稳状态,均低于5 mm·d-1,对照组生长速度是Cd胁迫组的2.5~4.2倍。在Cd质量浓度处于0.25~2.00 mg·L-1时,M25菌丝生长速度较对照组下降71.8%~80.6%,I15菌丝生长速度较对照组下降17.9%~78.0%,且在Cd质量浓度处于0.25~1.00 mg·L-1时I15的生长速度比M25快54.9%~229.6%(P<0.05)。当Cd质量浓度超过1.00 mg·L-1时,M25和I15菌丝生长速度无显著差异,菌丝生长均较缓慢,受Cd影响较大。
Cd胁迫下羊肚菌菌丝生物量测定结果表明,在Cd质量浓度为0~2.00 mg·L-1时,M25和I15菌丝生物量均呈先增大后减小的变化趋势(图1-b);Cd质量浓度为0~1.00 mg·L-1时,I15菌丝生物量整体高于M25,I15菌丝生长更旺盛,且I15空白组菌丝生物量比M25空白组菌丝高32.12%(P<0.05)。Cd质量浓度为0.75 mg·L-1时,I15菌丝生物量达到最大,比对照组高8.25%(P<0.05)。当Cd质量浓度为1.00 mg·L-1时,M25菌丝生物量达到最大值,比对照组高15.34%(P<0.05)。当Cd质量浓度为2.00 mg·L-1时,M25和I15菌丝生物量较对照组分别降低了82.36%和32.83%(P<0.01)。
观察不同品种羊肚菌菌落形态和微观结构发现:Cd胁迫下M25菌落直径受影响严重,但与Cd质量浓度无关;而I15菌落直径主要受Cd质量浓度的影响,Cd质量浓度越大,菌落直径受抑制越明显;随着Cd质量浓度的增加,M25菌丝外围逐渐出现白色抑菌圈,Cd质量浓度越高抑菌圈越明显(图1-c),而受Cd胁迫的I15菌丝则无白色抑菌圈产生。Cd胁迫使M25和I15菌丝生长均受到抑制,由粗壮稀疏变为纤细浓密,同时增大了菌丝分叉数和气生菌丝的比重(图1-d)。当Cd质量浓度在0.25 mg·L-1时,M25菌丝明显发生分叉;而在Cd质量浓度为1.00 mg·L-1时,I15菌丝分叉数才明显开始增多,说明M25比I15更易受到Cd的毒害。
2.2 镉对羊肚菌菌丝富集能力的影响
不同品种、相同品种不同菌株、相同菌株不同部位的食用菌,在重金属胁迫下重金属含量与其富集能力均存在一定差异[28]。随着环境Cd质量浓度的增加,M25菌丝Cd含量逐渐增加,I15菌丝Cd含量呈先增加后降低趋势;不同质量浓度Cd胁迫下羊肚菌菌丝Cd富集系数结果(图2)表明,在环境Cd质量浓度为1.00 mg·L-1时I15菌丝的Cd富集系数最大,在Cd质量浓度为2.00 mg·L-1时菌丝几乎停止生长(图1-a,图1-b),Cd吸收量较低;M25在Cd质量浓度为0.25~1.00 mg·L-1时,菌丝Cd吸收能力逐渐增强,当Cd质量浓度为1.00 mg·L-1时,菌丝开始对Cd产生富集作用,且Cd富集能力缓慢增加。对比发现,Cd质量浓度低于1.5 mg·L-1时,I15菌丝对Cd有一定的富集能力,且Cd质量浓度为1.00 mg·L-1时富集能力最强;M25菌丝在Cd质量浓度为1.00 mg·L-1时才对Cd产生富集作用。随着Cd质量浓度的增加,相同质量浓度Cd胁迫下不同品种羊肚菌对Cd的吸收能力不同,整体上I15比M25对Cd富集能力更强,这种差异可能是由于富Cd基因所控制的菌株特异性所决定的,需进一步研究。
用Logistic曲线数学模型建立培养基中Cd含量(x)与不同品种羊肚菌菌丝Cd含量(y)之间的关系,其通式为y=c/(1+ea-bx)。从表1可知,M25和I15回归方程的决定系数(R2)都在0.95以上,说明这2种曲线模型均能够直观地体现羊肚菌菌丝在培养基中的Cd富集规律,从回归方程可以看出,I15对Cd的理论最大吸附量大于M25。

表1 培养基中Cd含量与不同品种羊肚菌菌丝体Cd含量关系的数学模型
2.3 镉对羊肚菌菌丝MDA含量的影响
MDA是细胞膜响应ROS产生的物质,用于评估膜系统的受损程度,是生物体受损的第一响应指标[29]。重金属等非生物胁迫会影响生物体生长,导致生物体ROS失衡,扰乱细胞膜的过氧化,破坏细胞膜和细胞器膜。M25和I15菌丝的MDA含量均随Cd质量浓度的增加呈先增后减趋势(图3)。Cd质量浓度为0.75 mg·L-1时,M25菌丝的MDA含量达到最大值,较对照组高135%(P<0.05);I15菌丝在Cd质量浓度为0.50 mg·L-1时其MDA含量达到最大值,比对照组高90%(P<0.05)。不同Cd质量浓度胁迫下,M25菌丝的MDA含量整体高于I15菌丝,且Cd质量浓度小于1.00 mg·L-1时M25菌丝的MDA含量增加更快,说明M25细胞膜受损更严重。M25的MDA含量最大值是I15菌丝MDA含量最大值的2.05倍,表明Cd富集能力较弱的M25菌丝细胞膜过氧化损伤比Cd富集能力较强的I15菌丝更严重。M25和I15分别在Cd质量浓度为0.25 mg·L-1和1.50 mg·L-1时MDA含量达到最小值,但仍高于对照组,说明M25和I15分别在Cd质量浓度为0.75 mg·L-1和0.5 mg·L-1时膜脂过氧化程度加剧,导致大量MDA等毒害物质累积,细胞膜受损严重。

图3 Cd胁迫处理对不同品种羊肚菌菌丝MDA含量的影响Fig.3 Effects of Cd stress on MDA content in the different Morchella spp. mycelia
2.4 镉对羊肚菌菌丝抗氧化酶活性的影响

图4 Cd胁迫处理对不同品种羊肚菌菌丝SOD、CAT、APX、GR、GSH-Px的影响Fig.4 Effects of Cd stress on activities of SOD, CAT, APX, GR and GSH-Px in the mycelia of different Morchella spp.
CAT能够进一步将SOD的反应产物H2O2催化成H2O和O2,以减少或消除ROS带来的损害[32]。图4-b显示,M25和I15的CAT活性均随Cd质量浓度的升高呈先升后降趋势,区别在于M25和I15分别在Cd质量浓度为1.25 mg·L-1和1.00 mg·L-1时CAT活性最大,说明I15能在更低Cd胁迫下通过提高CAT活性缓解Cd对生物体的损伤,增强细胞防御解毒能力。
APX以抗坏血酸作为受体清除H2O2,使细胞免受H2O2的损伤[33]。图4-c显示,M25和I15的APX活性均随Cd质量浓度的增加呈先增加后降低趋势,Cd质量浓度低于1.50 mg·L-1时,I15菌丝的APX活性比M25菌丝高,说明在该Cd质量浓度范围内I15应对Cd的解毒效果更强;Cd质量浓度为1.50~2.00 mg·L-1时,M25菌丝的APX活性比I15菌丝更高,在Cd质量浓度为1.50 mg·L-1时I15菌丝的APX活性明显低于对照组,说明此时细胞过氧化严重,APX逐渐失活,不足以防御Cd胁迫对细胞的损害。
GR能够将谷胱甘肽从氧化型转变成还原型,起到清除ROS的目的[34]。图4-d显示,不同质量浓度Cd处理下,I15菌丝的GR活性整体比M25菌丝高,说明随着Cd质量浓度的增加,I15在GR的调控下应对机体防御能力更强。在Cd质量浓度低于1.00 mg·L-1时,M25和I15的GR活性均随Cd质量浓度的增加而增加;Cd质量浓度为1.00 mg·L-1时,GR活性开始降低;Cd质量浓度为2.00 mg·L-1时,2个品种羊肚菌菌株的GR活性均达到最小值,但仍高于对照组水平。Cd质量浓度为1.00 mg·L-1时,M25和I15菌丝的GR活性均达到最大值,较对照组分别增加了98.38%和145.54%。
GSH-Px可以催化ROS和还原型谷胱甘肽之间的反应,生成氧化型谷胱甘肽,从而降低生物体内ROS含量,保护生物体免受伤害[35]。图4-e显示,不同质量浓度Cd处理下,I15菌丝的GSH-Px活性整体比M25高。Cd质量浓度低于1.00 mg·L-1时,I15菌丝的GSH-Px活性随Cd质量浓度的增加而增加,相比之下M25几乎无变化。当Cd质量浓度为1.00 mg·L-1时,I15菌丝的GSH-Px活性达到最大,较对照组增加了80%;Cd质量浓度超过1.00 mg·L-1时,M25菌丝的GSH-Px活性几乎无变化,而I15菌丝的GSH-Px活性逐渐降低,直至Cd质量浓度为2.00 mg·L-1时GSH-Px活性达到最低,但仍高于对照组,说明Cd胁迫下GSH-Px对I15菌丝有保护作用,对M25菌丝几乎无影响。
通过测定Cd胁迫下M25和I15的抗氧化酶活性发现,Cd胁迫下I15菌丝比M25菌丝的防御能力更强。
2.5 镉对羊肚菌菌丝抗氧化活性物质的影响
作为非酶类抗氧化活性物质的还原型GSH和AsA,能够直接和间接清除ROS,使膜上的巯基和酶免受ROS侵害,起到保护细胞的作用[36]。图5显示了不同品种羊肚菌菌丝在Cd胁迫下AsA和GSH含量的变化情况。随着Cd质量浓度的增加,I15菌丝的GSH含量呈先增加后降低的趋势,而M25菌丝的GSH含量逐渐增加(图5-a),且I15菌丝的GSH含量整体比M25更高,说明GSH对Cd胁迫下I15的防御效果更强。与对照组相比,当Cd质量浓度为1.00 mg·L-1时,I15菌丝GSH含量达到最大值,比对照组高74%;Cd质量浓度为2.00 mg·L-1时,M25菌丝的GSH含量达到最大值,比对照组高120%。M25和I15的GSH含量与GSH-Px活性变化趋势一致。随着Cd质量浓度的增加,M25和I15的AsA含量均呈现先增加后降低的趋势(图5-b)。随着Cd质量浓度的增加,菌丝胞内ROS增多,GSH胞内合成量难抵其消耗量,导致GSH含量增加到一定程度就不再增加甚至下降。
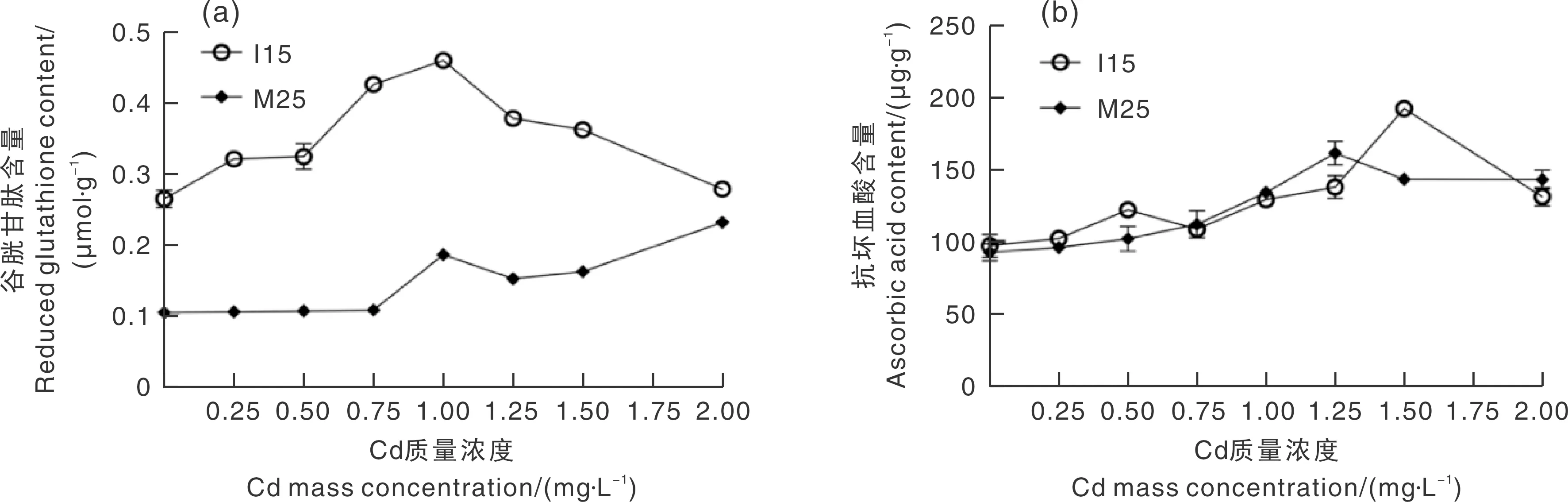
图5 Cd胁迫处理对羊肚菌菌丝GSH和AsA含量的影响Fig.5 Effects of Cd stress on the content of GSH and AsA in the mycelia of the different Morchella spp.
通过测定Cd胁迫下不同品种羊肚菌菌丝的抗氧化活性物质含量发现,Cd富集能力更强的I15比M25更能通过GSH含量调节Cd对细胞的损害,同时I15菌丝在Cd胁迫下的防御能力更强。I15菌丝的GR活性、GSH-Px活性和GSH含量比M25菌丝高,说明不同品种羊肚菌菌株抗氧化防御系统差异主要体现在谷胱甘肽转化体系,I15菌株的谷胱甘肽转化体系调节能力更强。
3 结论与讨论
羊肚菌现有研究主要集中在品种选育、栽培技术、生长机理和生物活性等[37],但覆土栽培的羊肚菌重金属超标现象时有发生,目前对羊肚菌菌丝重金属富集能力和生理变化的研究鲜有报道。本试验研究了不同质量浓度Cd对六妹羊肚菌M25和梯棱羊肚菌I15菌丝生长、Cd富集能力和抗氧化系统的影响,探讨不同品种羊肚菌Cd富集能力与抗氧化系统变化规律的响应机制。
重金属环境对生物体最明显的毒害表现就是对其生长产生抑制作用[38]。本研究中,不同质量浓度Cd对M25和I15菌丝均有抑制作用。相比而言,Cd对M25生长的抑制效果更明显。随着Cd质量浓度的升高,M25和I15菌丝生物量均呈先升高后降低趋势,Cd质量浓度分别为1 mg·L-1和0.75 mg·L-1时,六妹羊肚菌M25和梯棱羊肚菌I15生物量最大。徐鸿雁等[24]发现,Cd质量浓度为0.3 mg·L-1时小海绵羊肚菌的生物量最大,本研究结果与此不一致,可能是羊肚菌种属间差异所导致。李素玲等[39]发现,羊肚菌菌丝可分为颗粒型、毡绒型、匍匐型和气生型。Cd胁迫下M25比I15气生菌丝生长更旺盛。菌丝形态观察结果显示,Cd胁迫使M25外围产生乳白色抑菌圈,导致其气生型菌丝占比变大。Cd胁迫使羊肚菌菌丝末端分叉数增多,菌丝变细,分叉间距离变小;但Cd胁迫的M25比I15菌丝颜色更深,菌丝更粗壮;I15在Cd质量浓度为1.50~2.00 mg·L-1时,菌丝纤细且颜色浅,这一点对比I15同质量浓度下菌丝生物量也得到了证实。I15菌株的Cd富集能力比M25菌株强,这种差异可能是富Cd基因所控制的种属间差异所决定,需进一步研究。
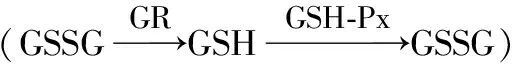
相比六妹羊肚菌M25而言,梯棱羊肚菌I15的Cd富集能力更强、生长更旺盛、更不易受Cd损害。六妹羊肚菌M25和梯棱羊肚菌I15中不同酶活性发生变化的Cd质量浓度拐点不同,梯棱羊肚菌I15在谷胱甘肽转化体系中解毒反应更强烈,其机制有待通过转录组学和蛋白质组学等分子生物学的手段进一步研究。此外,后续可深入研究各品种羊肚菌的Cd富集能力与谷胱甘肽转化体系的关系,探明不同品种羊肚菌Cd富集与解毒差异机理,为羊肚菌Cd抗性菌株筛选、产品安全源头管理与真菌生物修复提供理论依据。
