HPLC-MS/MS法测定新疆“ 凉皮、凉面 ”中3种真菌毒素
2023-11-04闫顺华苏比努尔巴克麻小圆滕文革
闫顺华 苏比努尔·巴克 麻小圆 滕文革
(1.新疆维吾尔自治区药品检验研究院,乌鲁木齐 830054;2.新疆昌吉州疾病预防控制中心,昌吉831100)
1 前言
真菌毒素是真菌产生的有毒次生代谢产物,对肝脏、肾脏、造血系统、免疫系统和生殖系统有严重的毒性,同时还有致癌、致突变、致畸等作用[1,2]。联合国粮食及农业组织( FAO)估计每年有高达25%的粮食受到真菌毒素的污染,而实际上真菌毒素污染的发生率在60%~80%左右[3,4]。谷物在种植、收获、运输及储藏过程中都可能遭受产毒真菌污染,受到污染谷物往往同时含有多种真菌毒素,多种真菌毒素共存通常会产生协同毒性增强效应[5]。有研究证实,低于国家食品安全限量标准的脱氧雪腐镰刀菌烯醇( DON,又称呕吐霉素)、玉米赤霉烯酮( ZEN ) 和黄曲霉毒素B1(AFB1)共存时能造成细胞代谢的严重紊乱[6,7]。
针对真菌毒素污染,我国制定了GB 5009.22-2016《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》[8]、5009.111-2016《食品安全国家标准 食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定》[9]和5009.209-2016《食品安全国家标准 食品中玉米赤霉烯酮的测定》[10]分别用来测定食品中的黄曲霉毒素B族及G族、DON及其衍生物和ZEN。由于食品中多种真菌毒素可能同时存在[11],在国家和省级食品监督抽验过程中,针对不同的真菌毒素,同一批次的样品需要采用不同的前处理方法处理多遍,成本高,又费时费力,因此开发高效的多功能免疫亲柱和同时检测多种真菌毒素的检测方法是需要不断深入研究的重要课题。SN/T 3136-2012[12]采用液质联用仪可同时测定8种真菌毒素,但不包含ZEN。目前,关于利用液质联用仪同时测定食品中多种真菌毒的研究在不断深入。
凉皮、凉面和凉粉(文中统称新疆“ 三凉 ”)是新疆各族群众喜食的地方性小吃之一,其制作原料为小麦粉,本实验以新疆凉皮、凉面为样本,采用高效液相色谱-质谱/质谱联用仪,探索同时测定食品中DON、ZEN和AFB1的检测方法,以期为食品监督抽检提供借鉴和参考。
2 实验部分
2.1 仪器与试剂
高效液相色谱-质谱联用仪:I-Class/Xevo TQS, 美国Waters公司;电子天平:百分之一,Mettler Toledo公司;粉碎机:HGB550,上海凌初环保仪器有限公司;多通量均质器:Ck1000,美国Thmorgan公司;AFB1/ZEN/DON三合一免疫亲和柱:北京华安麦科生物技术有限公开发中心。
DON对照溶液:100 μg/mL,BePure,批号-25328-010,北京曼哈格生物科技有限公司;ZEN对照溶液:100 μg/mL,批号-271829,德国Witega公司;AFTB1对照溶液:100 μg/mL,批号-S078495,FirstStandard,天津阿尔塔科技有限公司。
甲醇:色谱纯,美国Fisher公司;乙腈:分析纯,天津北辰方正化学试剂厂;吐温-20:分析纯,福辰(天津)化学试剂有限公司;盐酸和乙酸:天津北联精细化工有限公司;稀释液:PBS磷酸盐缓冲液(0.05 mol/L,pH为7.2~7.4),武汉卡诺斯科技有限公司。超纯水。
提取液:80%乙腈水溶液;洗涤液:0.1%吐温-20水溶液。
2.2 试样
2.2.1 样品来源
凉皮、凉面样品来源于《食品安全地方标准 新疆“ 三凉 ”》项目组抽取的90批样品,质控样品购置于北京美正生物科技有限公司生产的小麦粉中DON、ZEN和 AFB1分析质控样品。
2.2.2 样品预处理
将不同批次的样品分别用高速粉粹机进行粉粹,混匀后从中抽取100克左右,分别储存于两个样品袋中,贴签,冷藏保存,待处理。
2.2.3 样品提取
称取5 g试样(精确至0.01 g),加入25 mL乙腈-水溶液(80+20),涡旋混匀,置于摇床(200 r/min~300 r/min)剧烈振荡20min,用快速定性滤纸过滤,取10 mL滤液加入70 mLPBS稀释液稀释,混匀。用微纤维滤纸过滤至澄清,滤液待净化。
2.2.4 净化洗脱
事先将低温保存的三合一免疫亲和柱恢复至室温。待将免疫亲和柱内原有液体流尽后,准确移取上述滤液20 mL,注入玻璃注射器中。将空气压力泵与玻璃注射器相连接,调节下滴速度,控制样液以每秒1~2滴的流速通过免疫亲和柱;待液体排干后,用10 mL洗涤液和10 mL超纯水依次洗涤免疫亲和柱,流速约为每秒2~3滴;待液体排干后,加入2 mL洗脱液(乙酸:甲醇=2:98),堵上亲和柱下方堵头,静置3 min,控制每秒1滴的下滴速度,收集洗脱液;将洗脱液在50 ℃下用氮气吹至近干,加入2.0 mL初始流动相,涡旋30 s溶解残留物,0.22 μm滤膜过滤,收集滤液于进样小瓶中,待测。
2.2.5 方法检出限、定量限及加标样品制备
(1)方法检出限制备
称取5 g阴性三凉样品置于三角烧瓶中,分别加入10 ng/mL的AFB1标准溶液15 μL、100 ng/mL的ZEN标准溶液50 μL、1000 ng/mL的DON储备液50 μL,按样品同法制备。
(2)定量限及加标样品制备
本方法以定量限(即AFB1为0.1 μg/kg、ZEN为4 μg/kg、DON为20 μg/kg)加标作为样品的低浓度加标,以3种真菌毒素的限量值(即AFB1为5 μg/kg、ZEN为60 μg/kg、DON为1000 μg/kg)作为样品的一个加标浓度,然后根据标曲线性范围选择另外一个点的加标浓度。
称取5g阴性三凉样品,分别加入10 ng/mLAFB1标准溶液50 μL、1000 ng/mLZEN和DON储备液20μL、 100 μL,按样品同法制备,得到3种真菌毒素的定量限加标溶液,。
称取5g阴性三凉样品,分别加入1000 ng/mL AFB1标准溶液25 μL、1000 ng/mLZEN标准溶液0.3 mL、100 μg/mLDON对照原液12.5 μL,按样品同法制备,得到3种真菌毒素的限量值加标溶液。
称取5g阴性三凉样品,分别加入1000 ng/mL AFB1标准溶液50 μL、100 μg/mLZEN和DON储备液25 μL、16 μL,按样品同法制备,得到AFB1为10 μg/kg、ZEN为500 μg/kg、DON为320 μg/kg的加标溶液。
2.2.6 质控样品处理
称取5g质控样品(精确至0.01 g),按样品制备方法处理。
2.3 标准溶液配制
2.3.1 标准储备液配制
分别精密量取0.10 mLAFB1、ZEN 和DON标准溶液至3个10 mL容量瓶,用甲醇定容至刻度,得到浓度为1000 ng/mL的标准储备液。
2.3.2 标准中间液配制
精密量取1000 ng/mLAFB1的储备液1.00 mL至10 mL容量瓶,用甲醇定容至刻度,得到浓度为100ng/mL AFB1的标准中间液。
2.3.3 混合标准工作液系列配制
分别精密量取不同体积的AFB1的标准中间液、ZEN和DON标准储备液至7个10 mL容量瓶,用甲醇定容至刻度,得到浓度为0.025、0.05、0.1、0.5、1.0、2.0、5.0 ng/mL的AFB1工作液系列,1.0、5.0、10.0、20.0、50.0、100、200 ng/mL的ZEN工作液系列,5.0、10.0、20.0、40.0、80.0、160、320 ng/mLDON的标准工作液系列。
2.4 液质联用仪工作条件
色谱柱: ACQUITY UPLC® BEH C18,(2.1×100 mm,1.7 μm);流动相: 0.1%甲酸溶液(A相)+0.1%甲酸乙腈(B相),梯度洗脱条件见表1;流速:0.3 mL/min;电离模式:ESI;扫描方式:正负离子扫描;检测方式:MRM ,质谱条件见表2;进样量:10.0 μL 。
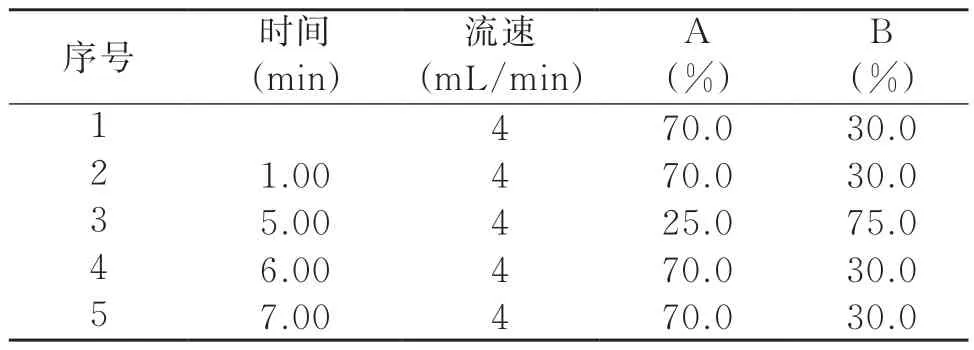
表1 液相色谱仪梯度洗脱条件
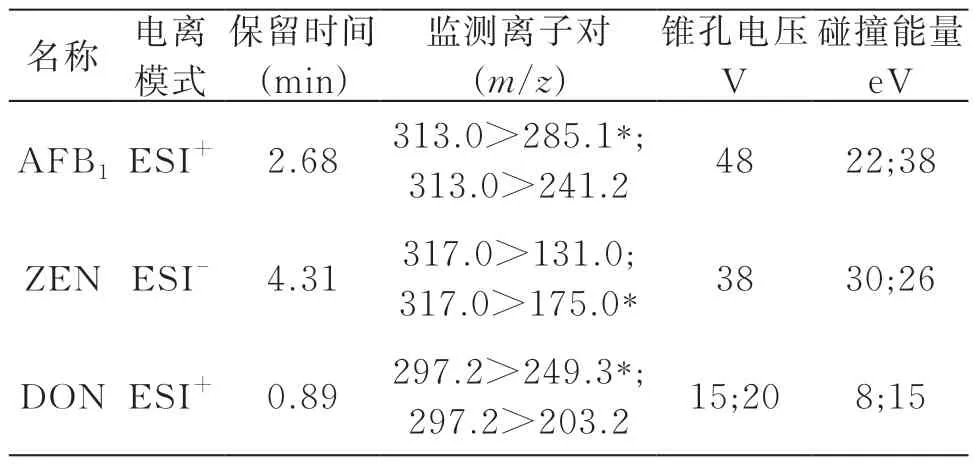
表2 3种真菌毒素质谱条件
2.5 3种真菌毒素总离子流图(图1)
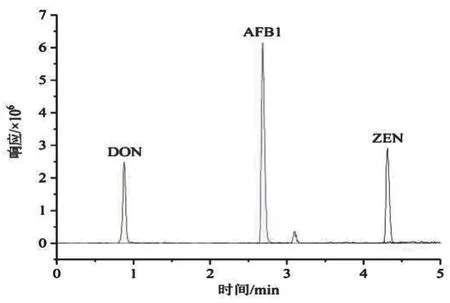
图1 3种真菌毒素总离子流图AFB1为0.05 ng/mL、ZEN为5.0 ng/mL、DON为10.0 ng/mL
3 结果与分析
3.1 色谱条件的优化
实验对流动相考察了水-甲醇、水-乙腈、5 mmol乙酸铵-乙腈、0.1%甲酸溶液-0.1%甲酸乙腈,结果表明0.1%甲酸溶液-0.1%甲酸乙腈的整体分离效果和峰形都比较好,因此,选择0.1%甲酸溶液-乙腈作为流动相,进行梯度洗脱,在7 min内对3种毒素进行分离。
3.2 线性方程、方法检出限和定量限
用LC-MS/MS对2.3.3项下的混合标准工作液系列进行测定,每个浓度重复测定2次,以相对应的响应值为纵坐标(y),以标准工作液的浓度为横坐标(x),绘制标准曲线,计算回归方程。对2.2.5项下的方法检出限样品进行测定,3种真菌毒素的信噪比均大于3;对加标样品进行测定,带入标曲方程计算,可得到方法定量限及加标回收率。检测结果见表3和表4。
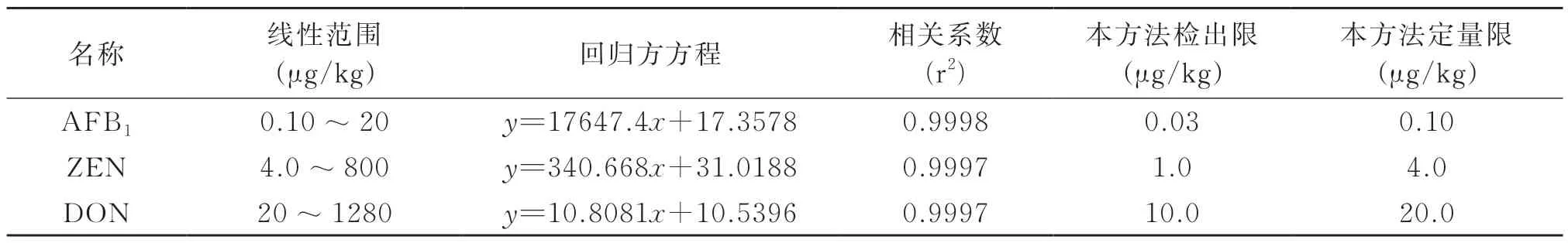
表3 3种真菌毒素的标曲方程、相关系数、检出限和定量限
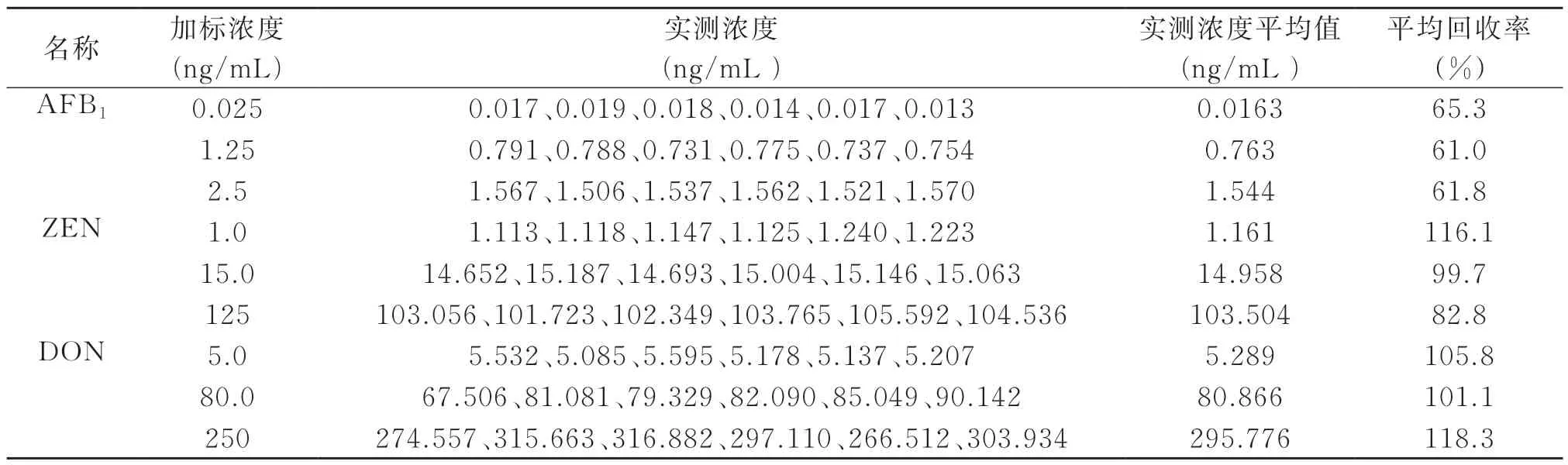
表4 3种真菌毒素加标回收率(n=6)
从表3可以看出,3种真菌毒素在一定范围内呈良好的线性关系,相关系数均大于0.999。本方法中AFB1、ZEN和DON的检出限和定量限分别与5009.22-2016、5009.111-2016和5009.209-2016中的液相色谱-串联质谱法所给出的检出限和定量限一致,因此本研究建立的方法能够满足上述国家标准对3种真菌毒素的检测要求。
3.3 方法回收率
按照GB/T 27404-2008《实验室质量控制规范食品理化检测》[13]中的质量控制要求,当被测组分含量小于0.1 μg/mL(即小于100 μg/mL)时,回收率应在60%~120%的范围内;当被测组分含量在0.1~1 μg/mL(即含量在100~1000 μg/mL范围内时,回收率应在80%~110%的范围内,据此,表4中3种真菌毒素低、中、高的回收率均符合要求。
用单组分的免疫亲和柱分别对样品进行前处理,测得AFB1、ZEN和DON的回收率分别在96%~102.7%、98.2%~101.4%、99.1%~100.8%之间,3种真菌毒素低、中、高回收率都比较高。从三合一的免疫亲和柱测定结果来看,AFB1的回收率相对较低,一方面可能与AFB1加标浓度较低,前处理时损失相对较大有关;另一方面也可能是三合一的免疫亲和柱对不同真菌毒素的净化萃取效率有差异。
3.4 样品分析
从90批次三凉样品中随机抽取5批次凉面、5批次凉皮,按本方法样品前处理方法制备后,经LC-MS/MS分析,结果表明10批次样品中均不含有AFB1,DON的含量范围在5.46 μg/kg~13.524 μg/kg之间,ZEN的含量范围在1.124 μg/kg~2.356 μg/kg之间,DON和ZEN虽然在样品中微量存在,但二者的含量均低于本方法的定量限(DON的定量限为20 μg/kg、ZEN的定量限为4 μg/kg),实际测定结果是3种真菌毒素均未检出。
3.5 质控样分析
用AFB1/ZEN/DON三合一免疫亲和柱对质控样处理后上机测定,3种质控样品的测定结果均在满意值范围内,一方面说明所使用的三合一的免疫亲和柱的萃取效率满足要求,另一方面也证明了本方法的适用性。结果见表5。
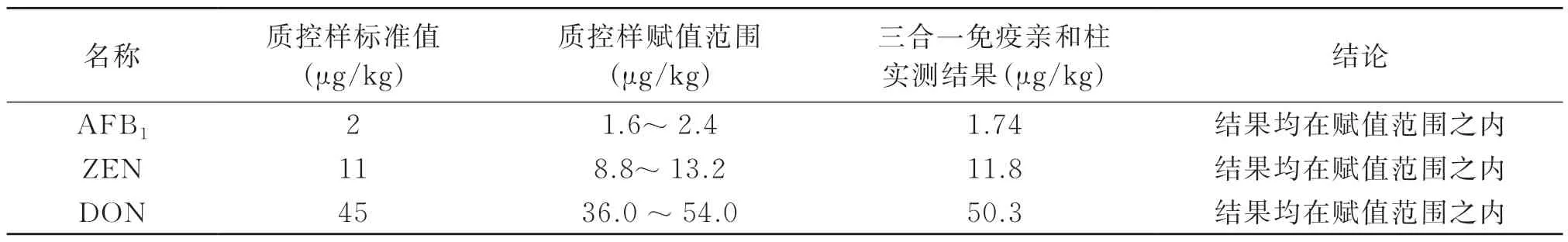
表5 质控样测定结果
多合一的免疫亲和柱对不同真菌毒素的柱容量是不同的,本方法中使用的三合一免疫亲和柱对AFB1的柱容量为300 ng、对ZEN和DON的柱容量均为2000 ng,在处理加标样品和质控样时,应根据柱容量选择合适的加标浓度、调整适当的上样液的体积。
4 结论
本实验建立了LC-MS/MS同时测定食品中AFB1、DON、ZEN的检测方法,方法的检出限、定量限和加标回收率均满足相关国家标准要求,质控样的测定值均在满意值范围之内,说明建立的方法是可行的。该方法处理一次样品就可同时测定3种真菌毒素,相对于同一样品要分别处理3次、测定3次的现行国家标准,节约了时间,大大提高了检验效率。目前,七合一的免疫亲和柱已经出现,一支免疫亲和柱可同时萃取净化的组分越多,价格也越高,对不同真菌毒素萃取效率不均衡的现象也越明显。因此,在下一步的工作中,探索研究价格低廉的通用型固相萃取柱对食品中多种真菌毒素的提取净化方法是非常有意义的[14,15]。
