安罗替尼联合TC化疗方案治疗驱动基因阴性晚期肺腺癌的临床效果
2023-11-04伍强云房亮吴清斌陈洁祝烨
伍强云,房亮,吴清斌,陈洁,祝烨
作者单位:421200 湖南省衡阳市中心医院肿瘤内科
肺腺癌属非小细胞癌,发展至晚期可出现咳嗽、呼吸困难、咯血等症状,病死率高,预后差[1-2]。现阶段,临床多采用化疗手段治疗晚期肺腺癌,TC化疗为常用方案之一,可一定程度上延长患者生存期,但易引发不良反应。安罗替尼为小分子酪氨酸激酶抑制剂,具有抑制肿瘤生长及血管生成的作用[3-4]。本研究观察安罗替尼联合TC化疗治疗驱动基因阴性晚期肺腺癌的临床效果,报道如下。
1 资料与方法
1.1 临床资料 回顾性选取2019年8月—2020年11月衡阳市中心医院收治的驱动基因阴性晚期肺腺癌患者80例,根据治疗方案不同分为观察组和对照组各40例。观察组男16例,女24例;年龄32~67(55.15±5.19)岁;TNM分期[5]:Ⅲb期15例,Ⅳ期25例。对照组男17例,女23例;年龄30~68(54.66±5.43)岁;TNM分期:Ⅲb期14例,Ⅳ期26例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准。
1.2 纳入及排除标准 (1)纳入标准:经细胞学、组织学检查均确诊为驱动基因阴性肺腺癌晚期患者;预计生存期3个月以上;患者或家属知情同意。(2)排除标准:近期内接受过抗肿瘤治疗(≤1个月)者;合并中央型肺癌者;伴大咯血风险者;伴大量胸腹腔积液者;合并严重自身免疫性疾病者;依从性较差者。
1.3 治疗方法 对照组采用TC化疗方案:紫杉醇(Hospira Australia Pty Ltd生产)135 mg/m2溶于5%葡萄糖溶液500 ml中静脉滴注,3 h内滴注完毕(第1天);同时给予注射用卡铂(江苏联环药业股份有限公司生产),以AUC=5计算剂量并将其溶于5%葡萄糖溶液250 ml中静脉滴注(第1天)。输注紫杉醇前给予常规抗过敏治疗,输注期间严密监测血压、脉搏。观察组在对照组治疗基础上给予盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司生产)12 mg,早餐前口服,每天1次,连续用药2周后停药1周。2组患者均以21 d为1个治疗周期,持续用药2个周期。
1.4 观察指标与方法 (1)比较2组疾病控制率(DCR)。(2)血清肿瘤标志物:包括神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、糖类抗原19-9(CA19-9)、糖类抗原125(CA125),于治疗前及治疗2个周期后,分别抽取患者清晨空腹静脉血,采用酶联免疫吸附试验测定NSE、CEA、CA19-9及CA125水平。(3)采用卡氏功能量表(KPS)及肺癌治疗功能性量表(FACT-L)评估治疗前后患者自理能力及生存质量。KPS评分:总分100分,>60分表示患者能够自理,分值越高表示自理能力越强;FACT-L评分:包括生理、社会、情感、功能状态等,评分越高表示生存质量越高。(4)比较2组患者不良反应发生情况,包括胃肠道反应、白细胞减少、脱发、肝功能异常等。
1.5 疗效评定标准 完全缓解(CR):病灶消失时间持续4周及以上;部分缓解(PR):基线病灶长径缩小50%,且持续4周以上;稳定(SD):基线病灶长径增加<20%;进展(PD):基线病灶长径增加≥20%或出现新生病灶。DCR=(CR+PR+SD)/总例数×100%。
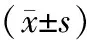
2 结 果
2.1 DCR比较 观察组DCR为95.00%,高于对照组的72.50%,差异有统计学意义(χ2=7.440,P=0.006),见表1。
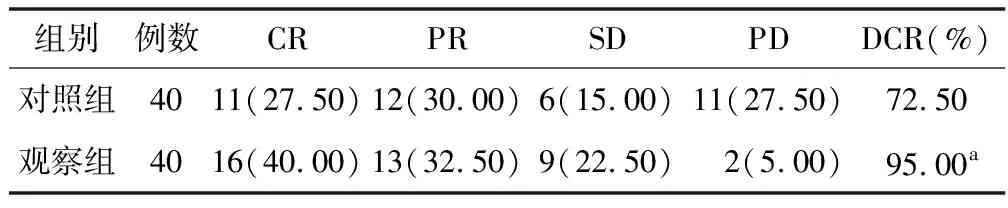
表1 对照组与观察组DCR比较 [例(%)]
2.2 血清肿瘤标志物水平比较 治疗前,2组NSE、CEA、CA19-9及CA125水平比较差异无统计学意义(P>0.05);治疗2个周期后,2组患者NSE、CEA、CA19-9及CA125水平均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.01),见表2。

表2 对照组与观察组治疗前后血清肿瘤标志物水平比较
2.3 KPS评分及FACT-L评分比较 治疗前,2组KPS评分及FACT-L评分比较差异无统计学意义(P>0.05);治疗2个周期后,2组KPS评分及FACT-L评分均高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.01),见表3。

表3 对照组与观察组治疗前后KPS评分及FACT-L评分比较分)
2.4 不良反应比较 观察组与对照组不良反应总发生率比较差异无统计学意义(17.50% vs. 20.00%,χ2=0.082,P=0.775),见表4。

表4 对照组与观察组不良反应比较 [例(%)]
3 讨 论
近年来,随着自然环境的恶化,驱动基因阴性晚期肺腺癌发病率逐年上升,且呈年轻化发展趋势,极大地威胁我国居民健康,增加社会负担。因此,积极探求有效的治疗方案,降低患者病死率为临床首要任务[6]。
晚期肺腺癌手术切除率较低,且预后不佳,因此,多采用化疗方案。TC化疗方案中紫杉醇是从紫山针叶中提取,具有广泛而显著的生物活性,可促进机体中微管蛋白合成微管并阻止其解聚,破坏微管蛋白及其二聚体的动态平衡,进而有效阻止肿瘤细胞的有丝分裂,加速肿瘤细胞凋亡[7]。卡铂可破坏肿瘤DNA结构,有效抑制肿瘤细胞增殖,作用与顺铂相似,但其肾毒性、神经毒性、胃肠道反应更小,且不会对紫杉醇药代动力学产生影响[8]。多数晚期肿瘤患者难以耐受多次高强度化疗,常需与高效低毒的分子靶向类药物联合使用,以减少药物不良反应,延长患者生存期。研究证实,安罗替尼在结直肠癌、软质肉瘤等多种恶性实体瘤治疗中具有良好的抗肿瘤作用[9]。冯继等[10]报道显示,在多西他赛二线治疗基础上给予安罗替尼治疗驱动基因阴性晚期非小细胞肺癌能显著提高疾病控制率。本研究结果显示,观察组疾病控制率高于对照组,说明安罗替尼联合TC化疗方案治疗驱动基因阴性晚期肺腺癌效果较好,可控制疾病进展。分析原因,安罗替尼是中国自主研发的小分子多靶点抗血管生成药物,可显著抑制血管内皮细胞生长因子受体(1~3)、成纤维细胞生长因子受体(1~4)、血小板衍生生长因子受体(α、β)及干细胞生长因子受体c-kit等,具有抑制肿瘤生长及血管生成的作用,从而发挥较好的抗肿瘤效果,且其作为一种分子靶向药物,具有起效迅速、不良反应小等优点。
NSE是一种酸性蛋白酶,在神经元、神经源性肿瘤细胞、神经内分泌细胞均有分布,已有研究证实NSE为肺癌特异性肿瘤标志物[11]。CEA为广谱性肿瘤标志物,在健康人体内含量极少。研究表明,肺癌患者血清CEA水平明显升高,可作为肺癌疾病诊断、监测病情发展的标志物[12]。CA19-9、CA125属粘蛋白型糖类蛋白,由肿瘤细胞表面的抗原物质或肿瘤细胞合成,在肺癌患者血清中浓度明显升高[13]。本研究结果显示,治疗2个周期后,2组患者NSE、CEA、CA19-9及CA125水平均低于治疗前,且观察组低于对照组,由此可见,联合治疗能进一步下调患者血清肿瘤标志物水平,从而更有效抑制肿瘤进展。本研究结果显示,2组患者KPS评分及FACT-L评分均高于治疗前,且观察组高于对照组,2组不良反应总发生率比较无统计学差异,表明联合治疗能提高患者自理能力及生存质量,且未增加不良反应。
综上所述,安罗替尼联合TC化疗方案治疗驱动基因阴性晚期肺腺癌效果较好,可控制疾病进展,有效改善血清肿瘤标志物水平,提升患者自理能力及生存质量,且安全性良好。
利益冲突:所有作者声明无利益冲突。
