左氧氟沙星联合芪归银方对铜绿假单胞菌生物膜和绿脓菌素的影响
2023-11-03赖晓静李颜伶吴珺徐广刘湉王凯赫母磊鑫刘清泉马群北京中医药大学中药学院北京0488北京中医药大学生命科学学院北京0488首都医科大学附属北京中医医院北京市中医研究所中医感染性疾病基础研究北京市重点实验室北京0000
赖晓静,李颜伶,吴珺,徐广,刘湉,王凯赫,母磊鑫,刘清泉,马群*(.北京中医药大学中药学院,北京 0488;.北京中医药大学生命科学学院,北京 0488;3.首都医科大学附属北京中医医院北京市中医研究所,中医感染性疾病基础研究北京市重点实验室,北京 0000)
铜绿假单胞菌是医院内感染中常见的革兰氏阴性病原菌,耐药机制复杂[1]。其中生物膜(biofilm,BF)是其典型的适应性耐药机制之一,生物膜能帮助铜绿假单胞菌躲避人体免疫系统清除和抗菌药物攻击,对常用抗菌药物产生耐药性[2];随着生物膜的形成,铜绿假单胞菌的重要毒力因子绿脓菌素的分泌水平将显著提高[3],导致细菌的致病性和感染性增强[4-5],病情迁延反复[6],给临床治疗带来了极大的挑战。
随着临床单用抗菌药物治疗生物膜感染的效果越来越不尽如人意,联合用药的给药策略获得了广泛的认可[6-8]。多项研究表明抗菌药物联合中药能有效抑制生物膜耐药机制,提高疗效[9-11]。芪归银方(Qiguiyin decoction,QGYD)由黄芪、金银花、当归、青蒿、虎杖5味中药配伍组成,联合广谱抗菌药物使用具有良好的抗感染效果[11-12],目前关于QGYD干预铜绿假单胞菌生物膜形成的研究还未见报道。本论文基于提取物和含药血清两个层次,研究芪归银方(QGYD)联合左氧氟沙星(LEV)对敏感/耐药铜绿假单胞菌生物膜和绿脓菌素的影响,为中药联合抗菌药物防治生物膜感染的临床用药提供参考。
1 材料
1.1 菌株来源
标准铜绿假单胞菌ATCC27853一代菌株(编号:BNCC337940,北京北纳创联生物技术研究院);多重耐药铜绿假单胞菌临床分离株(样本号:19PXSP2218,北京中医药大学东直门医院检验科)。
1.2 试药
中药饮片黄芪600 g、金银花150 g、当归100 g、青蒿150 g、虎杖100 g(批号分别为90541102、93451002、90280901、93051001、90510501,北京三和药业有限公司),经北京中医药大学杨瑶君教授鉴定均为正品。左氧氟沙星对照品(批号:Y02N7C23971,HPLC≥99%,上海源叶生物技术有限公司)。左氧氟沙星片[批号:BX00A1,第一三共制药(北京)有限公司]。
M-H琼脂、M-H肉汤(青岛高科技工业园海博生物技术有限公司,批号分别为20210124、20201202);0.4%草酸铵结晶紫染液(批号:R20710)、2.5%戊二醛固定液(批号:L26O11G12-8919)、氯化镁、甘油、硫酸钾(分析级,上海源叶生物技术有限公司);蛋白胨(批号:20190102,北京博奥拓达科技有限公司);浓盐酸,氯仿(分析级,北京中医药大学危化品管理仓库)。
1.3 实验动物
SPF级Wistar雄性大鼠80只,体重240~280 g,许可证号:SCXK(京)2016-0006,动物批号:No.111011211101075631,购自斯贝福(北京)生物技术有限公司,饲养于北京中医药大学动物房,饲养条件为恒温(24±2)℃,相对湿度为40%~70%,12 h 光照和黑暗循环模拟正常昼夜周期。动物实验经北京中医药大学动物伦理委员会批准(No.4-2021113001-4079)。
1.4 仪器
立式压力蒸汽灭菌器(型号:YXQ-100A,上海博迅实业有限公司);电热恒温鼓风干燥箱(型号:DHG-9070A,上海一恒科学仪器有限公司);电热恒温水浴锅(型号:HH-S6,北京科伟永兴仪器有限公司);高速冷冻离心机[型号:Sorvall ST 8R,赛默飞世尔(苏州)仪器有限公司];生物安全柜[型号:1374,赛默飞世尔(苏州)仪器有限公司];气浴恒温振荡仪(型号:ZD-85,济宁市翰业机械设备有限公司);微生物可编程培养箱[型号:LT-IBX120N,立德泰勊(上海)科学仪器有限公司];酶标分析仪(型号:DNM-9602,北京朗新技术有限公司)。
2 方法与结果
2.1 药物的制备
2.1.1 药液的制备 采用课题组前期工艺优化选定的提取方法[13]制备生药质量浓度为2 g·mL-1的QGYD药液。参照临床和实验室标准化协会(CLSI)(2019版)文件配制LEV对照品储备液,无菌分装-20℃冻存。课题组前期体外抑菌研究表明,单用LEV对照品药液对铜绿假单胞菌标准菌株(ATCC27853)和耐药菌株(19PXSP2218)的MIC分别为0.8 μg·mL-1、8 μg·mL-1;参照CLSI(2019版)中的二倍稀释法,用MHB培养基将LEV对照品溶液稀释至2、1、1/2、1/4、1/8 最低抑菌浓度(MIC)。根据QGYD临床人日处方量(110 g生药/60 kg)和LEV临床人日处方量(0.6 g/60 kg),用MHB培养基将2 g·mL-1的QGYD药液配制得293.3、146.7、73.3、36.7 µg·mL-1或2933.3、1466.7、733.3、366.7 µg·mL-1的QGYD药液。依次将LEV(除1/8MIC)和QGYD药液从高浓度到低浓度配对等体积混合,制备LEV+QGYD组药液。LEV组药液LEV终质量浓度分别为0.1、0.2、0.4、0.8 µg·mL-1或1.0、2.0、4.0、8.0 µg·mL-1(1/8、1/4、1/2、1MIC),LEV+QGYD组药液LEV终质量浓度同LEV组,QGYD终质量浓度分别为146.7、73.3、36.7、18.3 µg·mL-1(或1466.7、733.3、366.7、183.3 µg·mL-1)。
2.1.2 含药血清的制备 Wistar雄性大鼠80只,随机分为4组,分别是LEV组、QGYD组、LEV+QGYD组和空白对照组,每组20只。根据LEV说明书日给药剂量、QGYD临床日给药剂量和大鼠等效剂量系数折算,LEV组大鼠LEV给药剂量为0.0625 g/(kg·d);QGYD组大鼠QGYD给药剂量为11.5 g/(kg·d);LEV+QGYD组大鼠LEV给药剂量为0.0625 g/(kg·d),QGYD给药剂量为11.5 g/(kg·d);空白对照组大鼠灌胃等剂量的生理盐水,每日2 次,连续5 d。
末次给药前12 h禁食不禁水,灌胃后1 h经腹主动脉无菌手法采血,4℃离心分离血清(2500 r·min-1,20 min),同组血清混合,56℃水浴30 min灭活,-80℃保存。课题组前期血清药理学研究表明,LEV组含药血清对铜绿假单胞菌标准菌株和耐药菌株的MIC90依次为15%、55%[14]。用MHB培养基分别将各组血清稀释到1MIC后,采用二倍稀释法制备1/2、1/4、1/8MIC的含药血清,血清终浓度为1.9%、3.8%、7.5%、15.0%或6.9%、13.8%、27.5%、55.0%(1/8、1/4、1/2、1MIC)。
2.2 铜绿假单胞菌生长曲线的测定
吸取0.5 MCF 铜绿假单胞菌(ATCC27853)或耐药菌株(19PXSP2218)菌液加入药液或含药血清(1/8、1/4、1/2、1MIC)中,充分吹打混匀。吸取200 μL加入96孔板中,每孔铜绿假单胞菌菌浓度为1.5×106CFU·mL-1,各浓度设置4个平行孔,同时设置同稀释比例阴性对照孔(药液/血清)、MHB肉汤培养基阳性对照孔、MHB肉汤培养基阴性对照孔。将96孔板置于恒温震荡摇床中37℃、220 r·min-1培养24 h。每间隔1 h用酶标仪测定96孔板液体在波长600 nm下的吸光度值(A),重复以上实验3次。结果见图1、2。药液部分结果表明,与阳性对照组相比,当LEV药物浓度为1、1/2、1/4、1/8MIC时,LEV组和LEV+QGYD组铜绿假单胞菌(标准/耐药)24 h生长量均明显降低,铜绿假单胞菌(标准/耐药)的生长均被明显抑制。与LEV组相比,LEV联用QGYD后对铜绿假单胞菌(标准 /耐药)的抑制作用无明显变化。血清部分结果表明,当血清浓度为1、1/2、1/4、1/8MIC时,与阳性对照组相比,LEV组、QGYD组、LEV+QGYD组和空白对照组铜绿假单胞菌标准菌株生长量均明显降低。血清浓度为1/2MIC时,LEV联用QGYD后对铜绿假单胞菌标准菌株的抑制作用增强。与阳性对照组相比,当血清浓度为 1、1/2MIC时,LEV组、QGYD 组、LEV+QGYD组铜绿假单胞菌耐药菌株生长量均明显降低;当血清浓度为1/4、1/8MIC时,LEV组铜绿假单胞菌耐药菌株生长量明显提高。与LEV组相比,当血清浓度为1/2、1/4MIC时,LEV联用QGYD后对铜绿假单胞菌耐药菌株的抑制作用增强,血清浓度为1/8MIC时,LEV联用QGYD后对铜绿假单胞菌耐药菌株的抑制作用呈增强的趋势。
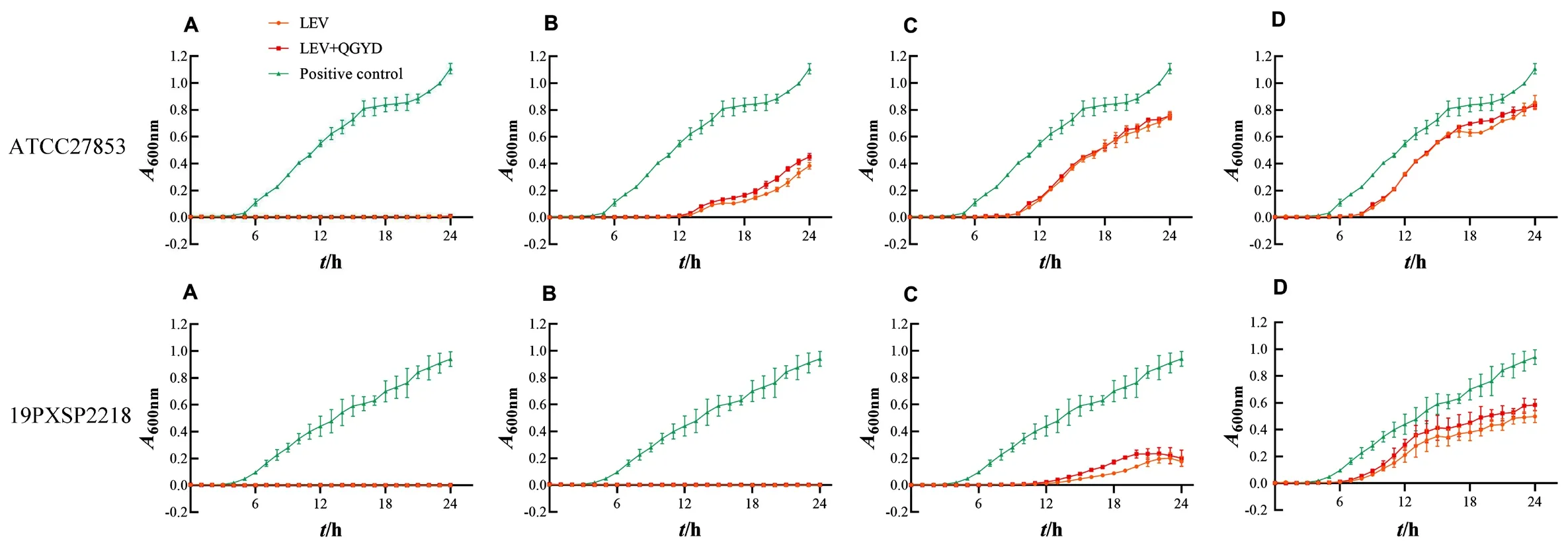
图1 药液对铜绿假单胞菌菌株生长的影响(±s,n=4)Fig 1 Effect of liquid medicine on the growth of Pseudomonas aeruginosa strains(±s,n=4)

图2 含药血清对铜绿假单胞菌菌株生长的影响(±s,n=4)Fig 2 Effect of medicated serum on the growth of Pseudomonas aeruginosa strains(±s,n=4)
2.3 结晶紫染色法测定铜绿假单胞菌生物膜形成量
参照“2.1”项下方法制备药液和含药血清。吸取0.5 MCF 铜绿假单胞菌(ATCC27853)或耐药菌株(19PXSP2218)菌液加入药液或含药血清(1/8、1/4、1/2、1MIC)中,充分吹打混匀。吸取200 μL加入96孔板中,每孔铜绿假单胞菌浓度为1.5×106CFU·mL-1,各浓度设置4个平行孔,同时设置MHB肉汤培养基阳性对照孔、MHB肉汤培养基阴性对照孔。将96孔板置于恒温培养箱中37℃培养24 h(铜绿假单胞菌 ATCC27853)或48 h(耐药菌株19PXSP2218)。取出96孔板,小心倒掉孔内菌液,生理盐水洗涤2次。加入200µL的2.5%戊二醛固定20 min(避光),生理盐水洗涤2次。加入 200 µL 的 0.4%结晶紫染色液染色15 min(避光),生理盐水清洗3~4次。96孔板室温下避光放置干燥,待孔内无明显液体,加入200 µL 95%乙醇脱色溶解10 min,用酶标仪测定96孔板液体595 nm波长下A值,结果如图3所示。
药液部分结果显示,与阳性对照组相比,1MIC的LEV组、LEV+QGYD组铜绿假单胞菌标准菌株生物膜形成量显著减少。与LEV组相比,LEV+QGYD组(1、1/2、1/4、1/8MIC)铜绿假单胞菌标准菌株生物膜形成量无减少的趋势。与阳性对照组相比,LEV组(1、1/2、1/4MIC)和LEV+QGYD组(1、1/2、1/4、1/8MIC)铜绿假单胞菌耐药菌株生物膜形成量均显著减少。与LEV组相比,LEV+QGYD组(1/2、1/4、1/8MIC)铜绿假单胞菌耐药菌株生物膜形成量均明显减少。
血清部分结果显示,与阳性对照组相比,血清浓度为1、1/2MIC的LEV组、QGYD组和空白对照组铜绿假单胞菌标准菌株生物膜形成量均明显减少。与LEV组相比,当血清浓度为1/2、1/4MIC时,LEV+QGYD组铜绿假单胞菌标准菌株生物膜形成量明显减少。与阳性对照组相比,当血清浓度为1、1/2MIC时,QGYD组、LEV+QGYD组和空白对照组铜绿假单胞菌耐药菌株生物膜形成量明显减少。与阳性对照组相比,LEV组(1MIC)铜绿假单胞菌耐药菌株生物膜形成量明显减少,LEV组(1/8MIC)生物膜形成量明显增加。与LEV组相比,LEV+QGYD组(1、1/2、1/4、1/8MIC)、QGYD组(1/2、1/4MIC)和空白对照组(1/2、1/4MIC)铜绿假单胞菌耐药菌株生物膜形成量明显减少。
2.4 氯仿萃取法测定铜绿假单胞菌的绿脓菌素含量
参照上述方法,用PDP培养基(不含琼脂)替代MHB培养基稀释药液和含药血清后,吸取0.5 MCF 铜绿假单胞菌(ATCC27853)或铜绿假单胞菌(19PXSP2218)菌液加入药液或含药血清(终浓度为1/8、1/4、1/2、1MIC)中,充分吹打混匀,每支摇菌管中铜绿假单胞菌菌浓度为1.5×106CFU·mL-1,体系为1 mL。将摇菌管放入恒温震荡摇床37℃、220 r·min-1培养24 h。实验设置阳性对照组和阴性对照组,每组设5个平行(血清3个平行),重复实验 3 次。吸取 860µL 的含菌液体加入到1.5 mL的离心管中,12 000 r·min-1离心1 min。吸取800 µL上清液转移至2 mL的离心管中,加入800 µL的氯仿,涡旋混匀后,4500 r·min-1离心 10 min,可观察到液体分层,上层为淡黄色,下层由无色变为淡蓝色或蓝绿色。吸取700 µL下层液体移至1.5 mL的离心管中,并加入140 µL的0.2 mol·L-1稀盐酸,涡旋混匀后,4500 r·min-1离心10 min。可观察到液体分层,上层液体由无色转为粉色或紫红色,下层液体变为无色。吸取100 µL上层液体加入96孔板,用酶标仪检测520 nm波长下吸光度值。结果如图4所示。

图4 药液(A)和含药血清(B)对铜绿假单胞菌标准菌株(ATCC27853)和耐药菌株(19PXSP2218)绿脓菌素的影响Fig 4 Effect of liquid medicine(A)and medicated serum(B)on the secretion of pyocyanin in Pseudomonas aeruginosa standard strain(ATCC27853)and drug-resistant strain(19PXSP2218)(±s,n=5)
药液部分结果表明,当LEV药物浓度为1、1/2、1/4、1/8MIC时,与阳性对照组相比,LEV组和LEV+QGYD组铜绿假单胞菌标准菌株绿脓菌素分泌量均明显减少。当LEV药物浓度为1/2、1/4MIC时,LEV联用QGYD后抑制铜绿假单胞菌标准菌株绿脓菌素产生的作用明显增强。与阳性对照组相比,LEV组(1、1/2、1/4MIC)和LEV+QGYD组(1、1/2、1/4、1/8MIC)铜绿假单胞菌耐药菌株绿脓菌素分泌量均明显减少。与LEV组相比,当LEV浓度为1/2MIC时,LEV联用QGYD后抑制铜绿假单胞菌耐药菌株产生绿脓菌素的作用明显增强。
血清部分结果表明,与阳性对照组相比,当血清浓度为1、1/2、1/4MIC时,QGYD组、LEV+QGYD组和空白对照组铜绿假单胞菌标准菌株绿脓菌素分泌量明显减少。与阳性对照组相比,LEV组(1、1/2MIC)铜绿假单胞菌标准菌株绿脓菌素分泌量明显减少;LEV组(1/4MIC)无明显变化;LEV组(1/8MIC)绿假单胞菌标准菌株绿脓菌素分泌量增加。与LEV组相比,LEV+QGYD组(1/2、1/4MIC)和QGYD组(1/4、1/8MIC)铜绿假单胞菌标准菌株绿脓菌素分泌量均明显减少,空白对照组(1、1/2、1/4、1/8MIC)无明显变化。当血清浓度为1、1/2、1/4、1/8MIC时,与阳性对照组相比,LEV组、QGYD组、LEV+QGYD组和空白对照组铜绿假单胞菌耐药菌株绿脓菌素分泌量均明显减少。与LEV组相比,当血清浓度为1/8MIC时,LEV+QGYD组、QGYD组和空白对照组铜绿假单胞菌耐药菌株绿脓菌素分泌量均明显减少。
2.5 大鼠含药血清中LEV浓度的测定
本研究沿用课题组前期确定的 UPLC-MS/MS测定大鼠含药血清中LEV的浓度[14]。用甲醇作溶剂制备80、40、20、10、4、2、1、0.4µg·mL-1的LEV系列对照溶液,同时制备环丙沙星(20 µg·mL-1)内标溶液。取空白血清20 μL,分别加入LEV系列溶液和内标溶液(20µg·mL-1)各5 μL,加入50 μL甲醇沉淀蛋白,涡旋1 min,4℃离心15 min(14 000 r·min-1),取上清液,氮气吹干后加入1 mL初始比例的流动相复溶,涡旋30 s,4℃离心15 min(14 000 r·min-1)取上清液,进样1 μL分析测定,含药血清用相同方法处理并进样分析。
① 色谱条件:Waters Acquity TMUPLC色谱柱ACQUITYCSHC18(2.1 mm×100 mm,1.7 μm),流速0.3 mL·min-1,样品室温度10℃,柱温40℃,进样体积1 μL。流动相0.1%甲酸水(A)-乙腈(B),梯度洗脱:0~0.1 min,90%→85%A;0.1~3.0 min,85%→20%A;3.0~3.5 min,20%→90%A。② 质谱条件:Waters三重四极杆串联质谱仪,采用电喷雾离子源,正离子检测模式,离子对选择LVFXm/z362.2395~261.1767,锥孔电压44 V,碰撞能量22 eV;CPFXm/z332.1651~245.1919,锥孔电压42 V,碰撞能量20 eV。毛细管电压2.5 kV,离子源温度150℃,去溶剂气温度350℃,去溶剂气流速650 L·h-1,多反应监测模式检测。测得LEV在大鼠血清中标准曲线方程为y=0.057 97x+0.1266(r=0.9991)。LEV在 2~400 ng·mL-1与峰面积线性关系良好。含药血清中LEV的质量浓度结果如表1所示。

表1 含药血清中左氧氟沙星的药物浓度(n=6)Tab 1 Concentration of levofloxacin in the serum with drug (n=6)
2.6 大鼠血清中 TNF-α和 IL-2 的测定
测定结果见表2,与空白对照组相比,LEV组TNF-α表达水平明显升高,IL-2表达水平无明显变化;QGYD组、QGYD联合LEV组TNF-α和IL-2均无明显变化。与LEV组相比,QGYD联合LEV组TNF-α和IL-2表达水平均明显降低。
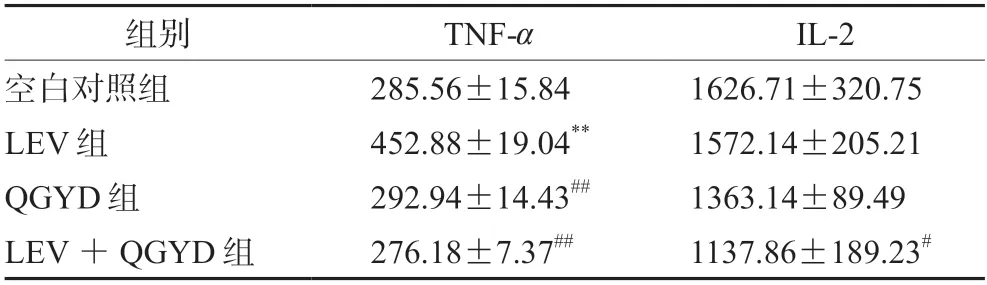
表2 含药血清中TNF-α和IL-2表达水平(n=5,ng·mL-1)Tab 2 TNF-α and IL-2 expression in the serum with drug (n=5,ng·mL-1)
2.7 数据处理
采用SPSS Statistics 21.0、GraPhPad Prism 8.0.1分别进行数据统计和作图,计量资料采用±s表示,符合正态分布且方差齐时采用单因素方差分析,组间比较采用LSD-t法,符合正态分布但方差不齐时采用单因素方差分析,组间比较采用Dunnett-T3法,对不符合正态分布的计量资料采用非参数检验。
3 讨论
LEV是一种氟喹诺酮类抗菌药物,具有广谱和强效的抗菌特点,对铜绿假单胞菌的抗菌活性显著,中国成人社区获得性肺炎和治疗指南中推荐LEV与其他药物联合用于临床上耐药铜绿假单胞菌感染的治疗。目前国内外关于中药联合抗菌药物对细菌生物膜和绿脓菌素影响的研究多为体外研究[15-18],但中药复方复杂的成分和理化性质,会对体外抑菌实验形成干扰,影响研究结果的准确性和科学性[19-20]。血清药理学为中药复方提供了新的思路[21],中药含药血清不受无机盐、鞣质等化学成分,渗透压和pH值等物理因素的影响,更符合中药在体内代谢的实际情况,有利于中药复方的药效及作用机制研究[22-23]。本文针对铜绿假单胞菌标准菌株和耐药菌株两种菌株,基于QGYD中药提取物和含药血清两个层次开展生物膜和绿脓菌素的研究,同时实验测得LEV组与LEV+QGYD组血清中LEV含量相近(分别为6.14 μg·mL-1和5.12 μg·mL-1),避免了联用组血清中抗菌药物浓度高于单用组血清影响实验结果的现象,同时本研究测定了各组大鼠血清中炎症因子的表达量,探索QGYD增敏LEV的作用机制,可为中药联合抗菌药物防治生物膜感染的研究提供参考。
本文基于体外和半体内两个层次对LEV联合QGYD对铜绿假单胞菌生物膜和绿脓菌素的影响进行研究,体外实验表明:LEV组和LEV+QGYD组药液均能抑制铜绿假单胞菌(标准/耐药)的生长;LEV组、LEV+QGYD组药液对铜绿假单胞菌(标准/耐药)生物膜的形成、绿脓菌素分泌量均具有一定的抑制作用,LEV联用QGYD后抑制作用增强。含药血清实验表明:LEV组、LEV+QGYD组血清均能抑制铜绿假单胞菌(标准/耐药)的生长,LEV+QGYD后对铜绿假单胞菌(标准/耐药)的抑制作用增强;LEV组、LEV+QGYD组均能抑制铜绿假单胞菌(标准/耐药)生物膜的形成和绿脓菌素的分泌,LEV联用QGYD后抑制作用增强。体外和含药血清研究结果趋势一致,互相支持。进一步表明了联合QGYD能增强LEV的抗菌活性,有效抑制铜绿假单胞菌生物膜的形成和绿脓菌素的分泌,为中药与抗菌药物联用防治细菌生物膜耐药提供可靠的科学依据。本论文采用 ELISA 分子生物学技术测定LEV单用及联用QGYD时大鼠血清免疫因子的变化,结果表明QGYD增强LEV抗菌活性的作用可能与免疫因子相关。课题组前期研究证实,QGYD能通过下调TLR4/MyD88/NF-κB 信号通路关键基因和蛋白的表达,调控TNF-α、IL-6、IL-12等炎性因子的表达,减轻炎症反应紊乱,维持机体免疫平衡[12],本实验与前期研究相一致。
本文基于药效学研究探讨中药与抗菌药物联用防治细菌生物膜耐药的作用,并进行相关机制初探,后期会继续探讨中药与抗菌药物联用防治细菌生物膜耐药的作用机制,为临床给药方案的优化提供支持。
