阿替利珠单抗修饰二氢丹参酮Ⅰ纳米粒的制备及其抗肿瘤作用研究
2023-11-03王雪荆紫琪李妍怡李楚闫天月黄晓滨张玉杰马鹏凯北京中医药大学中药学院北京102488
王雪,荆紫琪,李妍怡,李楚,闫天月,黄晓滨,张玉杰,马鹏凯(北京中医药大学中药学院,北京 102488)
二氢丹参酮Ⅰ(dihydrotanshinone Ⅰ,DHT)是从中国传统植物丹参的根茎中提取出的一种脂溶性菲醌类成分,具有扩张冠状动脉和改善心肌缺血等作用[1]。研究表明,DHT对卵巢癌、肝癌、胃癌等多种恶性肿瘤均具有良好的治疗作用[2-5]。尽管DHT具有极高的药用价值,但存在水溶性差、靶向性差、副作用大等问题,极大限制了其临床应用和新药开发。
聚合物纳米粒是以适当的载体材料与药物结合形成的具有纳米尺度的药物制剂[6-7]。纳米粒作用优势在于药物可包封于纳米粒中以提高溶解度,通过其纳米尺度特有的肿瘤增强的渗透和滞留效应(EPR效应)选择性在肿瘤部位聚集,实现被动靶向功能[8]。并且可通过各类功能分子对聚合物材料进行修饰实现特定功能,如针对肿瘤细胞过表达的受体或抗原,通过氨基酸、糖类、多肽和抗体等对纳米粒进行修饰,利用配体-受体或抗原-抗体的特异性相互作用,进一步提高纳米粒对肿瘤细胞的主动靶向能力,增强肿瘤细胞摄取,增加胞内药物浓度以提高药效[9-10]。
近年来,以免疫检查点阻断(immune checkpoint blockade,ICB)为代表的免疫疗法逐渐成为肿瘤治疗主流[11-13]。目前以程序性死亡受体-1(programmed death 1,PD-1)及其配体1(programmed death 1 ligand 1,PD-L1)[14]为靶点的免疫检查点阻断疗法最为成熟[15]。阿替利珠单抗(atezolizumab,ATEZO)是针对PD-L1的人源化免疫球蛋白G1单克隆抗体,通过作用于肿瘤细胞过表达的PD-L1,阻止PD-1和PD-L1相互结合,激活免疫细胞杀伤肿瘤[16-19]。有研究发现,通过抗PD-L1单抗或多肽修饰纳米载体[20],可以提高药物对肿瘤组织靶向性,与化疗药物产生协同治疗作用,更好地治疗肿瘤。
基于此,本研究以聚乳酸-羟基乙酸-聚乙二醇-马来酰亚胺(PLGA-PEG-Mal)为载体材料,制备载DHT纳米粒,提高DHT生物利用度及肿瘤组织靶向性,并在纳米粒表面修饰ATEZO,制备主动靶向PD-L1的ATEZO DHT NP,进一步提高肿瘤细胞靶向性和胞内药物浓度,提高抗肿瘤药效。
1 材料
1.1 动物
7周龄BALB/c雄性裸鼠36只,体重(20±2)g[北京维通利华生物技术有限公司,合格许可证号:SCXK(京)2021-0006]。饲养期间自由进水进食,实验流程符合实验动物管理和保护的相关规定。
1.2 试药
二氢丹参酮Ⅰ(纯度:98%,成都植标化纯生物技术有限公司,批号:210409);甲氧基聚乙二醇-聚乳酸-羟基乙酸(mPEG-PLGA,批号:RM0212213)、PLGA-PEG-Mal(批号:RA0220627)(西安瑞禧生物科技有限公司);阿替利珠单抗注射液(上海罗氏制药公司,批号:H0228801);Sephadex G-50 medium(北京索莱宝科技有限公司,批号:20210930);2-亚氨基硫杂环戊烷盐酸盐(Traut’s试剂,纯度:98%,上海源叶生物科技有限公司,批号:J28GS156194);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号:090321220106);人胃癌细胞HGC-27(北京北纳创联生物科技有限公司);IR808(纯度:99%,上海凯瑜琳医药科技有限公司,批号:IR808-202001);Annexin-V-FITC/7-AAD细胞凋亡检测试剂盒(北京百瑞极生物技术有限公司,批号:273D0101);注射用紫杉醇脂质体(南京绿叶制药有限公司,批号:221120921)。
1.3 仪器
RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);LGJ-10真空冷冻干燥机(北京松源华兴科技发展有限公司);ZEN3600 Nano微射流均质机(上海诺泽流体科技有限公司);T10 basic S025高速分散机(德国IKA);1290 Infinity Ⅱ超高效液相色谱仪[安捷伦科技(中国)有限公司];Malvern Zetasizer Nano-ZS动态光散射粒度仪(英国Malvern Instruments);TCS-SP8激光共聚焦显微镜(德国Leica);SRSPECTROstar Nano多功能酶标仪(德国BMG);A00-1-1102流式细胞仪[贝克曼库尔特商贸(中国)有限公司]。
2 方法与结果
2.1 DHT NP的制备
采用乳化溶剂扩散法制备DHT NP。称取处方量mPEG-PLGA和DHT溶解在丙酮中,作为有机相,乳化剂溶于去离子水中作为水相,将有机相逐滴滴入水相后在高速分散机作用下分散30 min,形成粗乳液,粗乳液经微射流均质机整粒形成细乳液,将细乳液滴入5倍体积的4℃冷水中,固化形成纳米粒混悬液。旋转蒸发仪去除丙酮后,纳米粒溶液经50 kDa超滤离心管4℃离心3次(3000 g,15 min),去除游离药物,收集超滤离心管上部溶液,冻干,得到DHT NP。
2.2 载药量和包封率的测定
采用超高效液相色谱法对DHT进行含量测定。色谱条件:流动相为甲醇和水(80∶20),色谱柱为Akzo Nobel Kromasil C18(4.6 mm×150 mm,5µm),检测波长为280 nm,流速为0.8 mL·min-1,柱温为25℃。经方法学验证符合药典要求。
将DHT NP完全溶解在甲醇中,定容后测定DHT含量,计为W总;取等量DHT NP溶液超滤离心去除游离药物,纯化后的DHT NP溶液溶解在甲醇中,测定DHT NP中封装的DHT含量,计为WD;将等量纯化后的DHT NP溶液冻干得到DHT NP,称重计为WNP,载药量和包封率计算如下:包封率(%)=WD/W总×100%;载药量(%)=WD/WNP×100%。
2.3 正交试验优化DHT NP制备工艺
以有机相浓度(A)、药物与载体质量比(B)、有机相与水相体积比(C)为影响因素(见表1),以包封率为指标,利用SPSS 20.0软件进行正交试验设计,结果见表2和3,方差分析结果表明,整体模型未达到显著水平(P<0.05),可通过直观分析进行判断。由直观分析可知,3个因素对DHT NP的影响程度依次为A>C>B,最优工艺条件确定为A2B1C2,即有机相浓度为1.5%,药物与载体质量比1∶2,有机相与水相体积比为1∶1.8。在此条件下,DHT NP 的二氢丹参酮Ⅰ载药量和包封率分别为11.73% 和 54.49%。

表1 因素水平Tab 1 Factor and level
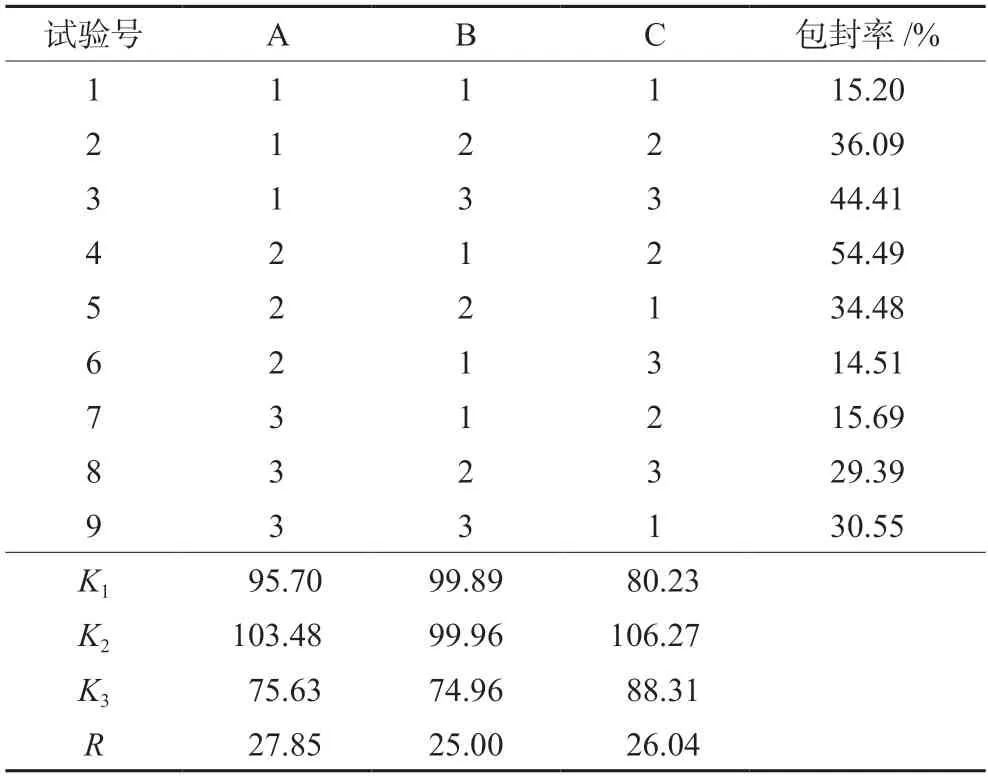
表2 正交试验结果Tab 2 Orthogonal experimental

表3 误差分析Tab 3 Error analysis
DHT NP的制备工艺如下:精密称取DHT 5 mg、mPEG-PLGA 10 mg于反应瓶中,加入1 mL丙酮,超声溶解形成有机相;精密称取胆酸钠36 mg溶于1.8 mL去离子水中形成水相;高速分散作用下形成粗乳液,经微射流均质机整粒,均质强度10 000 psi,均质15 min形成细乳液;将细乳液滴入5倍体积的4℃去离子水中固化形成纳米粒混悬液。采用旋转蒸发的方法去除纳米粒混悬液中的有机溶剂,超滤离心管离心除去未包封的药物。上述制备条件下,预冻后冷冻干燥48 h,即得DHT NP。在此条件下进行试验验证,3次试验得到DHT NP包封率的平均值为54%,与理论值接近,说明模型可靠。
2.4 ATEZO DHT NP 的制备
取1 mL 阿替利珠单抗注射液(60 mg·mL-1)置10 kDa超滤离心管中,加4 mL pH 8.0 PBS,4℃超滤离心(3000 g,15 min)至液体量剩余1/2,再补加等体积PBS,重复5次后,得到ATEZO磷酸盐缓冲溶液。通过Traut’s试剂对抗体进行巯基化修饰,BCA法和DTNB法分别测定蛋白和巯基含量,计算每个抗体修饰巯基个数。ATEZO溶液与Traut’s试剂反应比例为1∶20时,单位抗体修饰的巯基为7.7个,为最佳反应比例,ATEZO溶液与Traut’s试剂反应时间为1 h时,溶液浑浊,所以ATEZO溶液巯基化的反应时间不宜过长。将巯基化ATEZO与马来酰亚胺基封端的DHT NP混合,在黑暗中搅拌12 h,反应后的混合物在12 000 r·min-1、4℃下离心40 min,收集含有游离巯基化ATEZO的上清液,采用BCA法测定上清液中游离的单抗含量。同时收集离心后沉淀进行冻干,获得ATEZO DHT NP,ATEZO偶联率和载药量计算公式如下,ATEZO DHT NP的ATEZO偶联率为56.93%,载药量为14.43%。偶联率(%)=(ATEZO投入量-上清中ATEZO的量)/ATEZO投入量×100%;载药量(%)=(ATEZO投入量-上清液中ATEZO的量)/ATEZO DHT NP的质量×100%。
2.5 纳米粒的表征
将冻干的纳米粒分别分散于超纯水和含10%FBS的PBS(10 mol·L-1,pH 7.4)溶液中,并且分别取静置2、4、8、12、24、48、72 h后的纳米粒溶液,用马尔文粒度仪进行粒径的测定,观察粒径变化,同时测量纳米粒电位。如图1所示,DHT NP粒径为184.9 nm,Zeta电位为-18.55 mV;ATEZO DHT NP粒径为246.9 nm,Zeta电位为-19.57 mV,72 h内两种纳米粒在水溶液和含10% FBS的PBS溶液中粒径变化不大,表明其具有良好的稳定性。将DHT NP和ATEZO DHT NP分散于超纯水中,选择合适的浓度,吸取500 μL样品,多次滴加于电镜专用铜网表面,待自然干燥后,通过透射电子显微镜拍摄到DHT NP和ATEZO DHT NP都近似球形,分布均匀,结果见图2。
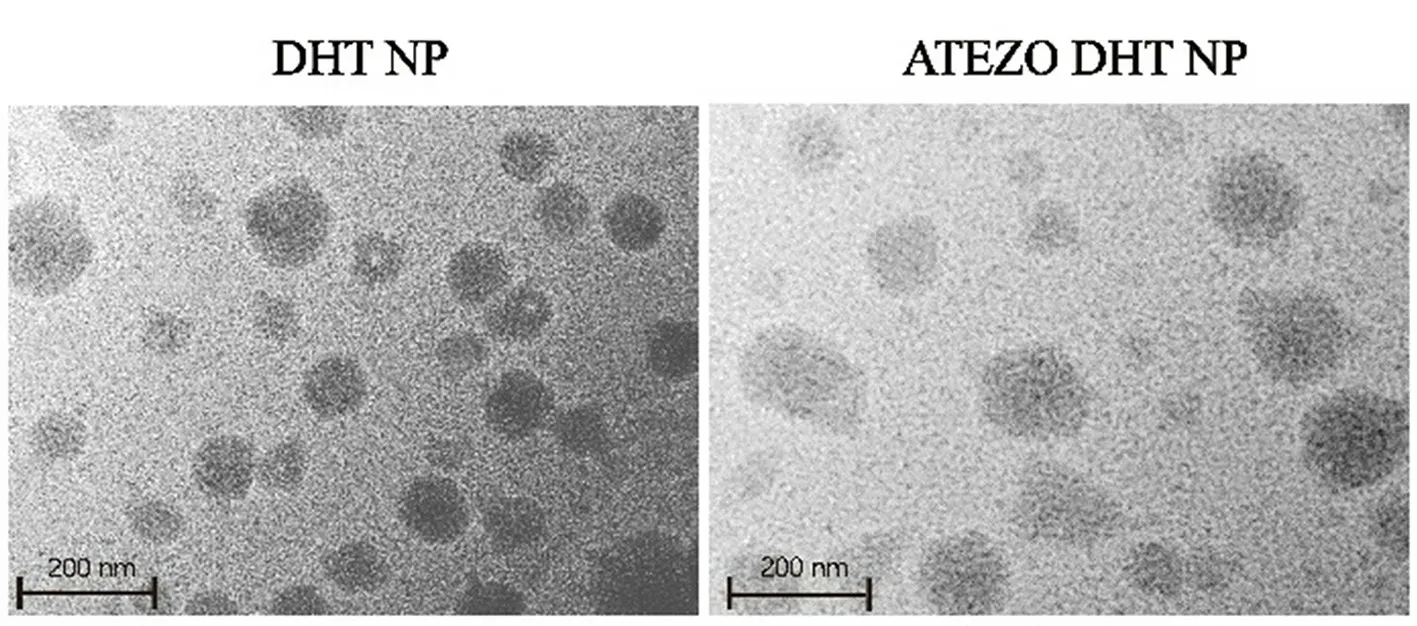
图2 DHT NP和ATEZO DHT NP的透射电镜图(×30 000)Fig 2 Morphology image of DHT NP and ATEZO DHT NP(×30 000)
2.6 纳米粒体外释药特性
采用透析法对体外释药特性进行考察。精密称取纳米粒分散于PBS溶液中,得1 mg·mL-1的含药溶液(以DHT计)。精密移取1.0 mL纳米粒溶液于透析袋中(MWCO:7 kDa),置于50 mL的释放介质中(含0.2%吐温80的PBS溶液),在温度为37℃、转速为100 r·min-1的恒温振荡水浴培养箱摇床中振荡。分别于0、1、2、4、8、12、24、48、72 h后取1.0 mL释放介质,测定DHT浓度Cd,与此同时补加1.0 mL新鲜的释放介质至原释放介质中。按下式计算校正浓度Cc,其中Wt为纳米粒中DHT的含量,每组设3个平行样品,计算累积释放率(F,%):F=(Cc×50)/Wt×100%。
结果如图3所示,DHT NP和ATEZO DHT NP在前10 h的累积释放不超过60%,然后在接下来的62 h内观察到药物释放缓慢,表明纳米颗粒具有持续释药的特性。
2.7 激光共聚焦显微镜评价药物体外细胞摄取情况
将HGC-27细胞以1×106个/孔接种于玻璃底激光共聚焦细胞培养皿中,细胞培养12 h后,加入荧光标记的纳米颗粒IR808 NP和ATEZO IR808 NP(以IR808计,终浓度为4 µmol·L-1),与细胞共孵育3 h后,除去含药培养基,细胞核用Hoechst 33342染色15 min后,用激光共聚焦激光扫描显微镜观察细胞。为了进一步证实PD-L1受体介导的特异性细胞摄取,HGC-27细胞用ATEZO预处理30 min后,加入ATEZO IR808 NP,观察荧光强度变化。如图4所示,游离的IR808、IR808 NP和ATEZO IR808 NP都能被肿瘤细胞有效摄取,经ATEZO修饰后,细胞对ATEZO IR808 NP的摄取进一步增强。此外,当ATEZO预处理30 min时,由于ATEZO的阻断作用,ATEZO IR808 NP的荧光强度下降。
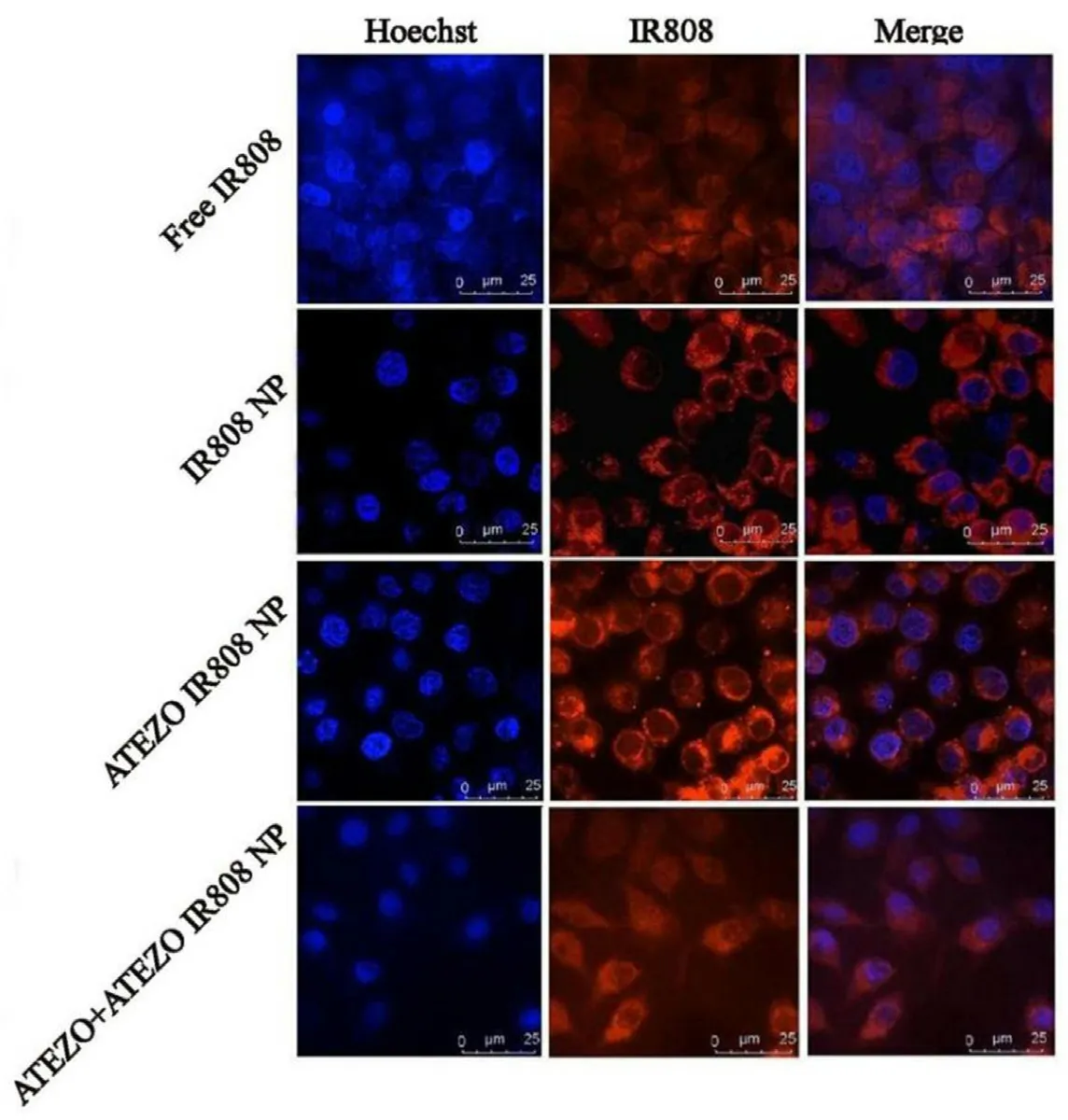
图4 HGC-27细胞对不同载药纳米粒的摄取Fig 4 Uptake of different drug-loaded nanoparticles by HGC-27 cells
2.8 体外药效学评价
采用MTT法评价细胞毒性。HGC-27细胞以1×104个/孔的密度接种于96孔板中。当细胞达到对数生长期时,用100 μL的药物与细胞共孵育,浓度梯度分别为0.5、1、2、4、8、16、32和64 μmol·L-1(以DHT计),48 h后小心移去含药培养基,每孔加入100 μL的MTT(0.5 mg·mL-1)溶液,放入培养箱中继续孵育4 h,去除各孔内溶液,加入150 μL DMSO,振荡后,用酶标仪测定570 nm处各孔吸光度,计算细胞存活率,结果如图5所示。

图5 DHT和DHT+ATEZO,DHT NP 和 ATEZO DHT NP的细胞毒性(n=6)Fig 5 Cell viability of DHT,DHT+ATEZO,DHT NP and ATEZO DHT NP(n=6)
采用流式细胞仪和Annexin-V-FITC/7-AAD细胞凋亡检测试剂盒检测细胞凋亡情况。HGC-27细胞以1×106个/孔的密度接种于6孔板中,各给药组处理细胞(以DHT计,浓度为8 µmol·L-1)。孵育48 h后,用胰蛋白酶消化细胞,以1800 r·min-1离心5 min,然后分散在100 µL预冷的PBS中。在黑暗中分别加入5 µL的Annexin-V-FITC/7和PI染色液,孵育15 min。用400 µL PBS稀释细胞,流式细胞仪检测细胞凋亡水平,以未加药液处理孔为对照组,对照组与各给药组均设有3个复孔。结果如图6所示,游离DHT、游离DHT+ATEZO、DHT NP和ATEZO DHT NP组的细胞凋亡率分别为(12.6±0.213)%、(13.2±0.145)%、(39.6±0.243)%、(44.2±0.318)%,与其他各组相比,ATEZO DHT NP的细胞凋亡率最高,与细胞摄取实验和细胞毒性实验结果一致,表明ATEZO DHT NP可以增强DHT诱导细胞凋亡的能力。

图6 对照组及各给药组的细胞凋亡情况Fig 6 Cells apoptosis of the control group and different administration groups
2.9 体内药效学评价
HGC-27肿瘤移植BALB/c裸鼠模型的建立。用4℃的PBS将HGC-27细胞稀释为2×108个·mL-1的细胞悬液,取0.1 mL细胞悬液,裸鼠用戊巴比妥钠(50 mg·kg-1)麻醉后,在裸鼠右腋窝皮下注射接种进行造模,肿瘤体积达到100 mm3时进行给药。将36只荷瘤裸鼠随机分为6组:生理盐水组,游离DHT组,游离DHT+ATEZO组,DHT NP组,ATEZO DHT NP组,紫杉醇脂质体(Lps-P)阳性对照组,每组6只。给药方案为:DHT 15 mg/(kg·d),ATEZO 10 mg/(kg·d),Lps-P 10 mg/(kg·d),2 d给药一次,给药周期14 d。在给药期间,2 d记录一次裸鼠体重,并使用游标卡尺测量肿瘤体积,结果如图7所示。给药结束后第2日,所有裸鼠脱颈椎处死,剥离肿瘤组织称重,计算抑瘤率。抑瘤率=(生理盐水组肿瘤重量-给药组肿瘤重量)/生理盐水组肿瘤重量×100%。

图7 不同给药组荷瘤裸鼠肿瘤体积的变化曲线(n=6)Fig 7 Tumor volume of nude mice in different administration groups(n=6)
结果如图8所示,与生理盐水组相比,所有给药组均可抑制HGC-27肿瘤裸鼠的肿瘤生长,ATEZO DHT NP组肿瘤抑制率是原药DHT组1.90倍,约为DHT NP组的1.75倍。切取部分肿瘤组织用4%多聚甲醛固定,肿瘤组织切片用HE染色和TUNEL染色评估药物对肿瘤细胞的作用,如图9所示,相比于DHT NP组,ATEZO DHT NP组肿瘤组织大片坏死,肿瘤细胞凋亡增强,证实了修饰ATEZO以后可增强DHT NP的抗肿瘤疗效。
图9 肿瘤组织HE染色(×30)(A)和TUNEL染色(×30,×300)(B)Fig 9 HE staining(×30)(A)and TUNEL staining(×30,×300)of tumor tissue sections(B)
2.10 体内药物安全性评价
在整个给药期间,各组荷瘤裸鼠体重基本保持不变,表明ATEZO DHT NP没有明显的全身毒性。给药结束后第2日,所有裸鼠脱颈椎处死,取血及心、肝、脾、肺、肾脏组织。血液于4℃、3500 r·min-1离心15 min,收集血浆,并通过生理生化测定试剂盒[丙氨酸氨基转移酶 ALT 测定试剂盒、天门冬氨酸氨基转移酶AST测定试剂盒、尿素氮 BUN 测定试剂盒、肌酐 CRE 测定试剂盒(南京建成生物工程研究所)]分析谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(CRE)和尿素氮(BUN)生化指标,ATEZO DHT NP给药组ALT的含量为(119.73±2.989)U·L-1,AST的含量为(146.21±8.423)U·L-1,CRE的含量为(26.064±2.756)µmol·L-1,BUN的含量为(7.813±0.139)mg·dL-1,均在正常范围内,表明ATEZO DHT NP无肝肾毒性。心、肝、脾、肺、肾脏组织用4%多聚甲醛固定,组织切片后用HE染色评估组织的形态学变化,结果如图10所示,显示各治疗组组织形态没有明显变化,进一步确证纳米粒具有良好的安全性。

图10 裸鼠心、肝、脾、肺、肾脏各脏器的HE染色结果(×100)Fig 10 HE stained micrographs of heart、liver、spleen、lung、kidney organ sections(×100)
2.11 统计学分析
采用SPSS 20.0统计学软件进行分析,数据以平均值±标准差(±s)表示。采用t检验和单因素方差分析(ANOVA)来比较两组或两组以上之间的数据差异。P<0.05为差异有统计学意义。
3 讨论
DHT是中药丹参的活性成分,具有抗肿瘤作用,作为极具开发潜力的药物分子,如何提高DHT生物利用度和肿瘤靶向性是其临床转化面临的关键问题。纳米药物递送系统可以改善药物理化性质,增强药物肿瘤靶向能力和降低药物毒性。免疫治疗联合化疗是目前癌症治疗的研究热点,本研究选择ATEZO作为靶头,对DHT NP进行表面修饰,不仅可以通过纳米粒的被动靶向作用提高药物在肿瘤部位的分布,而且可以借助ATEZO对肿瘤细胞表面过表达PD-L1的靶向作用提高药物的胞内浓度,增强药物抗肿瘤作用。
本研究通过乳化溶剂扩散法制备DHT NP,正交试验考察有机相浓度、药物与载体质量比和有机相与水相体积比对包封率的影响,优化得到最佳制备工艺,制得的DHT NP的载药量为11.73%,包封率为54.49%。将巯基化的阿替利珠单抗修饰在DHT NP表面,通过BCA法测定蛋白偶联率和载药量分别为56.93%和14.43%。粒度仪测量DHT NP粒径为184.9 nm,粒径合适;修饰ATEZO后ATEZO DHT NP的粒径有所增加,电位降低;72 h内ATEZO DHT NP在水溶液和含10% FBS的PBS溶液中粒径变化不明显,表现出较好的稳定性;透射电镜观测到DHT NP和ATEZO DHT NP形貌为球形;纳米粒体外释药情况良好。细胞实验结果显示,ATEZO DHT NP可显著抑制HGC-27细胞的增殖;促进HGC-27细胞的凋亡。体内抗肿瘤药效评价结果显示,ATEZO DHT NP在动物模型上具有良好的抑制肿瘤生长的能力,肿瘤坏死情况明显。在整个给药周期内,ATEZO DHT NP组动物体重无明显变化,血浆ALT、AST、CRE和BUN水平均在正常范围内,未见明显毒性作用;HE染色结果显示各主要脏器未见明显异常,说明ATEZO DHT NP具有较好的生物安全性。ATEZO DHT NP在提高抗肿瘤效果方面具有巨大的潜力,后续实验可以进一步验证药物具有激活体内T淋巴细胞免疫从而杀伤肿瘤的作用,为深入开发提供研究基础。
