小鼠早期牙胚发育的三维结构重建研究
2023-11-02张晗,孙瑶
张 晗, 孙 瑶
(同济大学口腔医学院,同济大学附属口腔医院口腔种植科,上海牙组织修复与再生工程技术研究中心,上海 200072)
啮齿动物牙列的前牙区和后牙区之间存在一个无牙的空隙,称为无牙区(diastema)(图1)。其形成原因可能是该区牙胚在自然进化过程中因发育受阻而退化[1-4]。虽然已有利用连续切片后三维重建技术观察无牙区的研究[4],但目前的重建仅基于上皮形态,缺乏对无牙区与磨牙区之间间充质形态差异的观察与分析。本研究采用了包括间充质在内的三维重建技术,旨在全面观察小鼠无牙区早期牙胚发育的形态变化。
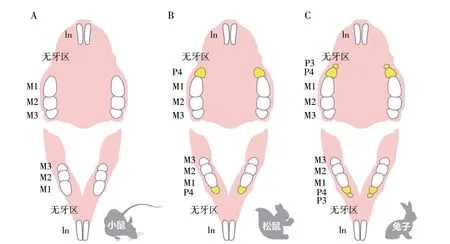
图1 啮齿动物牙列示意图Figure 1 Diagram of rodent dentition
1 材料和方法
1.1 实验动物
母鼠见孕栓时计为胚胎 0.5 d(E0.5),取 E12.5、E13.5的 C57BL/6 小鼠各 3~5 只。实验动物均为SPF 级,购于上海捷思杰实验动物有限公司。所有动物实验经同济大学附属口腔医院伦理委员会审核[批准号:(2019)-DW-089]。
1.2 主要材料和设备
石蜡切片机(型号:LeicaRM2235;Leica公司,德国);正置显微镜(型号:Nikon Eclipse Ni;Nikon公司,日本)。
1.3 方法
1.3.1 连续切片后利用Mimics软件进行3D重建
1.3.1.1 连续切片制备 所有样本经4%多聚甲醛固定12 h后进行脱水、石蜡包埋;连续冠状位切片,厚度5 μm,每2~3张切片贴于1张载玻片上,按顺序编号,55 ℃烤片 2 h 后收起备用。
1.3.1.2 苏木精-伊红(hematoxylin and eosin,HE)染色 组织切片经65 ℃烤片30 min;二甲苯处理2次,30 min/次;梯度乙醇水化;二次蒸馏水(ddH2O)处理 5 min;苏木精染色 45 s,流动水冲洗后,磷酸盐缓冲液(phosphate buffered saline,PBS)浸泡3 min 返蓝;伊红染色 15 s,流动水冲洗;65 ℃ 烘干2 h;二甲苯透明25 min;中性树脂封片(图2A)。
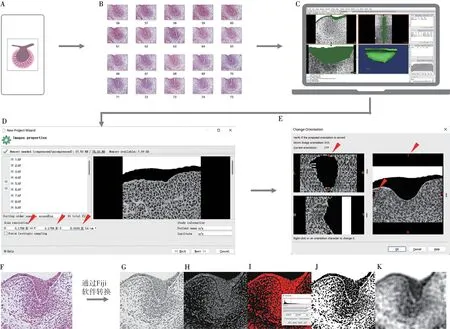
图2 三维重建前切片图像处理示意图Figure 2 Processing of serial section images before three-dimensional reconstruction
1.3.1.3 图像采集 剔除组织折叠、破损及被牵拉移位的切片后,用正置显微镜拍摄,获取牙胚部位二维全景图像。图像采集时应尽可能保持每一张切片的方向、角度和拍摄参数一致,将拍摄图像编号并以TIF格式保存。
1.3.1.4 图像初次配准及裁剪 将图像导入Photoshop CC 2018软件(Adobe公司,美国)后调整角度、明暗度,并以牙胚为中心进行图像裁剪。在初步处理后,选定合适的图像作为参考,调整参考图像不透明度参数至50%,根据解剖结构进行旋转、移动以排齐与参考图像相邻的图片。排齐过程中需利用2~3个解剖标志,以确保对位准确。随后以经过排齐的第2张图片作为参考图片,排齐第3张图片。其余以此类推。完成10张图片配准后,下一批次的第1张图像需同时与已配准的2张图像(其中一张为上一批次的第10张图像)对位配准,以避免配准过程中误差的累积。所有配准后的图像以TIF格式输出。
1.3.1.5 牙胚上皮的选取与图像的二次配准 图像导入Photoshop CC 2018软件后,利用“快速选择工具”初步选择图像中的牙胚上皮,而后放大图像,使用“套索选择工具”对选区进行进一步修整,使选区边缘与上皮边缘相吻合,最后用“油漆桶工具”将选区填充为黑色。处理后的图像按序列以TIF格式输出至新建文件夹。将新建文件夹以图像栈(stack)的形式导入Fiji软件(NIH公司,美国),利用Register Virtual Stack Slices插件,定义需要配准图像的变换类型为Translation(移动)及Rigid(移动+旋转),进行二次配准(图2B)。
1.3.1.6 三维重建 处理后的图像文件以Non-Strict DICOM 3.0格式导入Mimics Research 19.0软件(Materialise公司,比利时)(图2C)。设置图像长、宽分辨率 (X,Y)及切片厚度 (Z)。图像长宽分辨率 (X,Y)为图像单位像素所代表的长度。以100 μm比例尺为例,利用Fiji软件测得其长度像素为569 pixel,则其X,Y = 100/569 ≈ 0.175 7(图2D)。随后,选择图像的空间参数(A:anterior;P:posterior;L:left;R:right;T:top;B:bottom)并进行重建(图2E)。
1.3.2 利用Fiji软件赋予图像虚拟CT值 将配准后的图像导入Fiji软件(图2F),转为8-bit黑白图片(图2G),反转图像颜色后设立统一的阈值(threshold),让选中区域(红色)与原HE染色图像中的组织重叠(图2H—J)。随后,对图片进行参数为30的均值模糊(图2K)。
1.3.3 EdU-488细胞增殖检测试验 E13.5孕鼠腹腔注射50 mg/kg EdU(BeyoClick™ EdU-488细胞增殖检测试剂盒;碧云天生物技术公司,中国),2 h后收样,按上述步骤制作矢状面及冠状面石蜡切片,随后按说明书进行EdU检测染色。
1.3.4 统计学分析 使用GraphPad Prism 8.0.1软件进行分析,采用独立样本t检验,P<0.05被认为差异具有统计学意义。
2 结果
2.1 牙发育早期无牙区及磨牙区的形态特点
连续切片后三维重建的牙胚具有立体感,可对其进行任意角度的观察和切割(图 3)。E12.5时,无牙区与磨牙区均可见增厚的上皮组织,这与先前的研究结果[4]一致。如图 3A—C所示,此时无牙区牙胚(R2)上皮陷入间充质的深度比磨牙区牙胚(M1)更深,更早形成牙基板(tooth placode)。E13.5时,M1上皮呈明显的蕾状,周围紧密环绕着密度较高的间充质细胞;而R2蕾状的上皮较M1小,且其周围间充质的凝聚不如M1明显(图3D—F)。

图3 无牙区R2上皮可向间充质内陷形成蕾状Figure 3 The R2 epithelium in the diastema region invaginates into the mesenchyme to form a bud
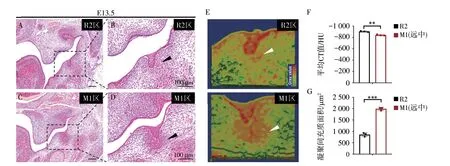
图4 R2蕾状上皮下方缺乏凝聚的高密度间充质细胞团Figure 4 Lack of condensational mesenchymal cell cluster below R2 bud-like epithelium
2.2 蕾状期小鼠无牙区缺乏高密度的间充质细胞团
为进一步对比R2与M1之间间充质凝聚的差异,我们选取了M1后段与R2对比,该段上皮形态与R2相似,可比性更高。对E13.5小鼠牙胚HE图像赋予虚拟CT值后行三维重建分析,发现R2区缺乏高密度的间充质细胞团,而M1区存在大量凝聚的间充质细胞(图 4A—E)。蕾状期R2区牙胚间充质的平均CT值较M1区低,且CT值大于-800的面积也较M1区小 (图 4F、G)。这些数据均证明,R2牙胚与M1牙胚不同,其在发育过程中缺乏大量的间充质细胞凝聚。
2.3 小鼠牙发育早期间充质细胞的增殖特征
随着基板的发育,上皮中会形成一个称为起始结(initiation knot,IK)的信号中心。该信号中心向周围邻近的细胞发出信号,诱导细胞增殖以完成基板—蕾状期的过渡[5]。于是,我们猜测R2区间充质细胞团形成能力的丧失可能与细胞增殖有关。对矢状面切片的EdU检测结果(图5A、B)显示,M1区存在一团增殖活跃的间充质细胞,而在R2区并没有发现明显的增殖信号;同时,冠状面切片的EdU检测结果(图5C、D)也支持这一发现。
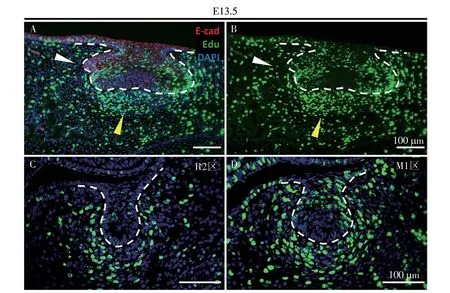
图5 M1区间充质细胞的增殖比R2区间充质细胞的增殖活跃Figure 5 The proliferation of M1 mesenchymal cells was more active than that of R2 mesenchymal cells
3 讨论
组织形态学研究有助于深入了解组织动力学与细胞行为间的关系,其研究方法依赖于各种成像技术。传统的方法多局限于二维平面,而现在的研究方法正朝着三维化、可视化和可量化的方向发展[6]。本研究根据石蜡切片重建了小鼠发育早期的牙胚,在Mimics Research 19.0软件中,该模型可在任意方向上进行旋转、观察和切割。此外,通过统一阈值后,均值模糊赋予虚拟CT值的方法,对细胞密度进行了可视化和半定量的分析。这些研究方法可观察和分析牙胚发育过程中的三维形态变化,为进一步研究牙发育机制奠定了组织形态学基础。
牙齿的发育模型被广泛用于研究生物系统发育模式、信号转导和物种进化[7],其中无牙区牙胚因其发育的可再激活性而逐渐受到关注。R-spondin2是Wnt信号转导激活剂,其突变鼠的磨牙和切牙没有明显的发育异常,但无牙区牙胚可继续发育,从而形成一颗多生牙[8]。除Wnt信号外,Shh同样在无牙区牙发育中有着重要作用[9]。牙胚上皮Shh受增强子MRCS1 和 MFCS4的调节;同时删除 MRCS1和 MFCS4 后,无牙区会出现一颗多生牙[10]。除此之外,Gas1——一种位于间充质的Shh 蛋白拮抗剂,可通过促进 Shh 信号转导起到限制 Wnt 和下游FGF 信号在牙源性上皮中的作用,从而调控牙齿数量[11-12]。对无牙区牙胚发育机制的探索既有助于研究如何在体外调控组织工程重组牙胚的成牙潜能与成牙能力,又有助于回溯啮齿类动物牙齿进化的过程[13]。
形态变化研究是探索无牙区牙胚发育机制的基础。利用连续切片后的三维重建技术,我们发现小鼠无牙区牙胚间充质不能在蕾状上皮周围凝聚形成多层状结构,这可能是无牙区间充质成牙能力丧失的先兆或标志之一。正常牙发育过程中,随着牙基板体积的增大,基板颈部缩窄,并进一步推动牙胚上皮嵌入间充质[14]。同时,间充质细胞响应上皮分泌的信号形成凝聚的细胞团,表达Pax9、Msx1等重要的牙源性转录因子[15-17]。而我们发现,虽然发育早期无牙区牙胚上皮能内陷形成蕾状,但间充质失去了形成凝聚为细胞团的能力。这暗示着间充质成牙能力的丧失可能是无牙区牙胚不能继续发育的主要原因。小鼠无牙区与磨牙区的牙胚重组实验也支持这一假说。E11.5时的无牙区上皮和间充质均能诱导邻近组织成牙,而在E13.5时无牙区间充质丧失了此种能力[18]。
细胞增殖在牙发育过程中起着非常重要的作用。牙发育起始阶段的最显著表现是在未来牙的位置,牙板上一系列细胞的增殖变得活跃。随着增生的上皮向深层间充质内伸延,上皮下方的外胚间充质也快速分裂增殖,在上皮周围积聚。这些局部增生的上皮与间充质共同组成了牙胚[19-21]。我们发现无牙区牙胚缺乏凝聚间充质细胞团的原因可能是细胞增殖的不足。对于缺乏增殖信号而不能形成牙齿的无牙区牙胚而言,适当的刺激可以激活其牙发育程序,使其继续发育为独立的牙齿[22-24]。比如,给予无牙区牙胚外源性成纤维细胞生长因子8(fibroblast growth factor 8, FGF8)可促进无牙区牙胚细胞增殖,使其在体外能发育为类似于其他哺乳动物前磨牙的类牙器官[25]。而在Spry2-/-突变小鼠中,随着FGF信号水平的升高,无牙区牙胚中细胞凋亡减少而细胞增殖增加,最终发育为一颗单根双尖牙[26-27]。
此外,进一步探索凝聚成团的间充质细胞与牙发育程序间的关系也为组织工程学牙再生提供了新的线索与方向。在传统牙胚组织重组实验中,间充质细胞的数量可调控牙齿的数量[28]。利用人工聚合物支架形成的间充质干细胞团,可在合适的体外培养条件下启动成牙性分化,表达包括Pax9和Msx1等转录因子在内的牙发育关键标志物。进一步将这些细胞移植到小鼠的肾包膜下,也可产生牙本质样组织[29]。
综上所述,本研究从三维结构上观察和分析了无牙区与磨牙区牙胚发育情况的差异,发现蕾状期的无牙区牙胚缺乏凝聚的间充质细胞团,此现象可能与细胞增殖有关。这提示间充质凝聚在牙发育中起着关键的作用。而本研究所用的方法与发现有助于从新的角度认识牙发育机制,且为促进牙齿的再生带来了崭新视野。
