18F-NaF PET/CT显像诊断肾性骨病的价值
2023-11-02刘亚玲陈利明温向琼黄占文欧三桃
刘亚玲 陈利明 温向琼 谢 鑫 费 敏 黄占文 欧三桃
[作者单位]11西南医科大学附属医院肾病内科(泸州,646000);2四川省肾脏疾病临床医学研究中心;3西南医科大学附属医院核医学科;4核医学与分子影像四川省重点实验室;5四川省院士(专家)工作站
肾性骨病(ROD)是慢性肾脏病矿物质和骨异常(CKD-MBD)中骨重建和代谢异常的病理状态,通过影响骨转换、矿化以及皮质和小梁微结构,增加了骨折风险,并可出现骨痛、骨折、骨畸形等一系列的临床表现。早期诊断并全面评估ROD对于改善CKD患者生活质量及降低死亡率具有重要意义。四环素双标记的髂骨骨活检目前仍然是诊断ROD的金标准[1],但费用昂贵、技术难度高、可重复性差等弊端导致其难以在临床中开展,因此寻找其他无创性诊断手段成为目前的研究方向。目前常用骨转换标志物(BTM)、全段甲状旁腺激素(iPTH)等生化指标结合双能X线吸收法(DXA)等检查来评价骨病的严重程度[2-3],但这些方法仍存在一定的局限性。18F-NaF PET/CT是一种新兴的高分辨率的骨成像技术,融合了功能信息和解剖影像,呈现出更高质量的显像效果,在评估多种骨骼系统疾病中发挥了重要作用[4]。已有研究发现[5-6],腰椎、髂嵴、骨盆对18F-NaF的平均血浆清除率与维持性血液透析(MHD)患者大多数骨组织形态学参数均显著相关,可以较好地鉴别ROD。因此,本研究旨在回顾性观察MHD伴ROD患者18F-NaF PET/CT的骨显像特点,并分析其与骨转换标志物的相关性,探讨18F-NaF PET/CT显像在MHD患者ROD中的诊断价值。
对象和方法
研究对象选取2020年5月至2022年11月就诊于西南医科大学附属医院肾脏内科行18F-NaF PET/CT检查并采集骨代谢标志物的MHD患者20例。所有患者行规律血液透析≥3月,透析时间≥4 h/次,2~3次/周。ROD诊断标准参照2019版《中国慢性肾脏病矿物质和骨异常诊治指南》[7]。排除标准:(1)既往有甲状旁腺切除史、肾移植史的患者;(2)确诊恶性肿瘤、原发性骨肿瘤等其他可影响钙磷代谢疾病的患者;(3)临床资料不完整者。
研究方法收集患者的临床资料,(1)一般情况:年龄、性别、透析龄、CKD病因等;(2)18F-NaF-PET/CT检查前或后一周内的生化指标(均在透析前检测):血钙、血磷、白蛋白(Alb)、碱性磷酸酶(ALP)、iPTH、总Ⅰ型胶原氨基端延长肽(t-P1NP)、N端中段骨钙素(N-MID OS)、β胶原特殊序列(β-CTX)等。
18F-NaFPET/CT检查及图像分析18F-NaF PET-CT检查采用Philips Gemini TF16,按1.85~2.96 MBq/kg剂量静脉注射18F-NaF后静卧1 h后行PET-CT检查。由两名有经验的核医学科医师阅片,阅片内容包括全身骨骼摄取显像剂的情况,有无局灶异常放射性浓聚或稀缺,需排除手术或创伤部位、骨良性病变、关节退变等显像剂异常分布灶,并对ROD可能具有的骨显像特征进行单独评价。为定量评估18F-NaF的摄取量,分别绘制髂前上棘、腰椎、股骨颈设置感兴趣区域(ROI)并测量标准摄取值(SUV),由工作站自动计算平均值。
统计学分析应用《SPSS 25.0》软件,计数资料用均数±标准差表示,两组组间比较若符合参数检验的要求,用两样本t检验;若不符合,则采用Mann-Whitney U检验。采用Spearman相关性分析法分析腰椎、股骨颈、髂前上棘SUV值与生化指标之间的关系。P<0.05为差异有统计学意义。
结 果
患者一般情况本研究入组患者20例,其中男性10例,中位年龄为53岁,中位透析时间为75周。原发病为慢性肾小球肾炎10例,高血压肾病4例,糖尿病肾病5例,多囊肾1例。
18F-NaFPET/CT检查结果及生化指标20例MHD患者18F-NaF PET/CT骨显像结果:(1)4例未见异常:全身显像剂分布均、对称,未见明显显像剂异常浓聚和(或)稀疏缺损(图1A)。(2)2例局部显像剂摄取增高:1例表现为右侧第6~8肋骨皮质扭曲,显像剂摄取稍增高;另1例表现为左侧第7肋腋段骨质欠规整,可见结节状显像剂摄取增高影。(3)14例全身显像剂摄取广泛增高:10例存在颅骨及上、下颌骨显影明显,表现为“黑颅征”或“狮面征”(图2A);12例存在肋骨和肋软骨连接处表现为对称性显影,呈“串珠状”(图2B);4例表现为四肢长骨近端显像剂摄取弥漫性均匀增高,7例表现为四肢骨皮质增厚伴显像剂摄取增高,呈“双轨道征”(图2C)。全身显像剂摄取广泛增高组的iPTH、t-P1NP、N-MID骨钙素、β-CTX均明显高于未见异常组,而三种图像类型的钙、磷、Alb、ALP差异无统计学意义(表1)。
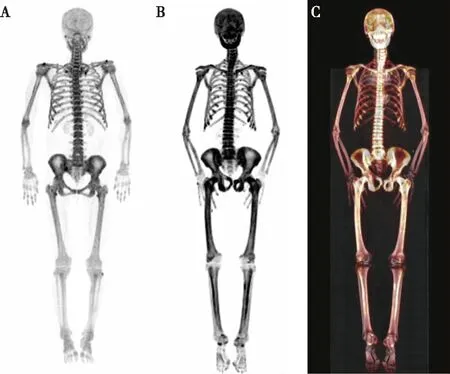
图1 MHD患者的18F-NaF PET/CT骨显像

表1 20例MHD患者18F-NaF PET/CT骨显像及其生化指标
全身显像剂摄取广泛增高图像的共同特点为最大密度投影(MIP)图显示全身骨骼广泛密度不均匀,骨质结构欠规则,显像剂摄取广泛增高,呈现出中轴骨和骨盆组成骨显影明显,软组织显影模糊,双肾和膀胱未见显影,符合超级骨显像表现(图1B、C)。其余病变主要分布在颅骨及上、下颌骨(71.43%)、肋骨和肋软骨连接处(85.71%)、四肢骨(78.57%)。该组患者均存在明显的骨病症状,包括全身不定位的骨骼疼痛,双下肢乏力、僵硬以及间歇性跛行等。
在表现为超级骨显像的14例患者中,有5例的全身骨骼分布有多处“棕色瘤”,这是ROD中高转换型骨病的特征性表现。其原理是由于:iPTH过高,破骨细胞过度活跃引起骨盐溶解、骨质重吸收增加,而代以纤维组织,形成纤维囊性骨炎。以其中1例患者的肋骨为例,可见骨小梁密度不均,有多发囊状骨质密度下降伴边缘硬化,表现为显像剂高摄取的“棕色瘤”,考虑为纤维囊性骨炎(图3)。同时,这5例患者的生化指标结果与影像学诊断结果也一致,其iPTH水平均>1 200 pg/mL,且t-P1NP、N-MID骨钙素、β-CTX显著升高并超过正常上限的2倍,考虑诊断为继发性甲状旁腺功能亢进,提示高转换型骨病。
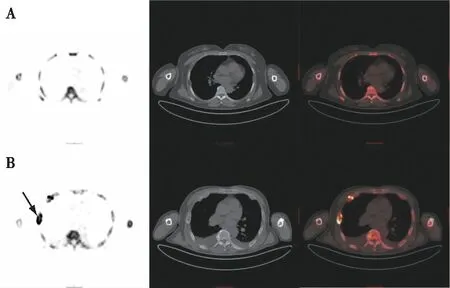
图3 MHD患者的纤维囊性骨炎影像改变
SUV值与生化指标的相关性分析计算SUV是量化18F-NaF吸收和骨代谢的主要方法之一,在按体重(kg)和显像剂注射剂量(MBq)进行标准化的单次静态扫描中,该值反映了ROI的18F-NaF浓度(kBq/mL)[8]。针对所有患者腰椎、股骨颈和髂前上棘的SUV测定结果见表2。

表2 维持性血液透析患者感兴趣区域的SUV值
腰椎、股骨颈、髂前上棘SUV值与生化指标的Spearman相关性分析见表3。其中,腰椎SUV值与ALP呈正相关(r=0.493,P=0.027)。股骨颈SUV值与iPTH、t-P1NP、β-CTX均呈正相关。而髂前上棘SUV值与ALP、iPTH、t-P1NP、β-CTX均没有显著相关性。

表3 SUV值与生化指标之间的相关性
讨 论
本研究分析了20例MHD患者的18F-NaF PET/CT骨显像特点,发现70%患者的骨显像呈现全身骨骼广泛密度不均匀,多处显像剂异常浓聚,尤其中轴骨和骨盆组成骨更加明显,表现为超级骨显像改变,而病变部位分布从高到低依次为肋骨和肋软骨连接处,四肢骨,颅骨及上、下颌骨。18F-NaF是一种高灵敏、亲骨性的PET显像剂,能够优先沉积于骨转换率高的部位[9],根据显像机制表明这些患者呈现出活跃的骨代谢状态,与他们高水平的骨代谢标志物特点相一致。既往也有研究发现,18F-NaF-PET/CT可通过在病变中显示成骨细胞活性增加或高血管化来诊断纤维囊性骨炎[10],表现为骨小梁密度不均,囊状骨质密度下降伴边缘硬化而显像剂高摄取的“棕色瘤”,这更有利于ROD中高转换型骨病的定性和定位。本研究中14例超级骨显像患者中也有5例全身骨骼分布有多处“棕色瘤”,结合其明显升高的血清iPTH水平及骨代谢标志物,考虑存在继发性甲状旁腺功能亢进,提示高转换型ROD[11],与上述研究一致。另外,小部分患者的图像未见明显的显像剂分布异常,其iPTH及骨代谢标志物水平显著低于全身显像剂摄取广泛增高的患者,推测其ROD病变不明显,未来还需要大样本量的研究进一步明确原因。
近年来,已有多个研究发现18F-NaF PET/CT有助于ROD的诊断及分类,18F-NaF在骨盆中的血浆清除率与骨组织形态计量学参数密切相关,且对识别高转换和低转换型骨病也有较高的诊断效能[5,6,12]。使用18F-NaF PET/CT成像评估骨代谢主要有两种方法,即测量SUV和测量血浆清除率(Ki),SUV是从静态PET图像中获得的半定量测量,通常在示踪剂注射后45~60 min获得[13],而Ki是通过60 min的PET动态扫描和血液采样进行计算[14],本研究中采用了静态扫描数据量化18F-NaF的摄取。测量SUV的局限性在于,只能向患者施用限量的示踪剂,并且必须在各种竞争组织之间共享。如果患者接受强效骨合成代谢药物治疗(特立帕肽等)或患有广泛的转移性骨病,NaF将由于示踪剂竞争的加剧,导致SUV的测量减少[15]。因此,未来还需研究证明18F-NaF PET/CT动态与静态扫描数据对ROD诊断的差异性。本研究发现,腰椎SUV值与ALP呈正相关,而股骨颈SUV值与iPTH、t-P1NP、β-CTX均呈正相关,表明MHD患者腰椎和股骨颈对18F-NaF摄取与骨代谢标志物的密切相关性。ALP的高表达是成骨细胞分化成熟的早期标志,暗示着骨形成增强并促进骨基质矿化形成[16]。PTH在维持机体钙磷代谢平衡和调节骨转换中发挥重要作用,当其明显升高时可导致骨吸收增加及矿物缺失[17],是诊断ROD及其分类的重要指标[18-19]。此外,MHD患者的骨转换状态同时受iPTH绝对水平和其主要片段1-84PTH与7-84PTH的相对水平影响,当iPTH显著升高时,7-84PTH也同时升高并对1-84PTH促进骨转换起到拮抗作用,因而同时检测iPTH及1-84PTH有助于评估骨转换状态[20]。t-P1NP和β-CTX分别用于评估骨形成和骨吸收的水平,其升高也暗示着骨转换的增强,常被应用于ROD的早期诊断及筛查[21]。SUV值反映了18F-NaF在骨骼中的积累水平,而骨骼内18F-NaF的积累则反映了骨骼的代谢状态。因此,当SUV值高时,意味着患者的骨代谢异常程度较高,可能存在骨质疏松和骨折等问题的风险。本研究中SUV值与骨代谢标志物之间的关联表明了在评估ROD的骨转换过程中多种指标的互补作用。基于18F-NaF与骨转换标志物的密切相关性,提示18F-NaF PET/CT结合BTM检测可提高对ROD的诊断效能,通过测量SUV值可以为MHD患者的骨代谢异常问题的筛查、诊断和治疗提供有价值的参考。
本研究也存在一定的局限性,包括纳入的患者数量较少,未能通过骨穿刺活检验证ROD骨转换类型与18F-NaF摄取量之间的准确关系。此外,本研究为回顾性研究,未对患者进行随访评估等,因此,尚需更高质量的前瞻性研究加以论证。
综上所述,本研究发现18F-NaF PET/CT能够诊断MHD患者的ROD并全面评估其病变部位及范围,可弥补目前骨活检及骨转换标志物等评估手段的不足。同时,腰椎、股骨颈部位的18F-NaF摄取与评估ROD的生化指标之间密切相关,这为未来18F-NaF PET/CT检查结合BTM是否提高对ROD的诊断性能提供新的研究方向。18F-NaF PET/CT作为一种非侵入性的成像技术,在ROD的诊断中值得推广。
