广西沃柑根系内生真菌的多样性分析
2023-11-02徐杰温云英莫惠捷康贻豪陈廷速张金莲姜明国
徐杰 温云英 莫惠捷 康贻豪 陈廷速 张金莲 姜明国



DOI:10.3969/j.issn.2095-1191.2023.06.021
摘要:【目的】探究清耕和生草措施對沃柑根系内生真菌多样性的影响,为筛选和开发促生、防病和抗逆等功能的有益内生真菌资源提供科学依据。【方法】选取广西南宁市武鸣区6个代表性沃柑果园(生草模式和清耕模式各3个),调查其土壤养分水平,利用高通量测序技术对沃柑根系内生真菌ITS区进行测定,分析沃柑根系样品中真菌群落的多样性及其分布规律。【结果】广西南宁市武鸣区沃柑果园的土壤为酸性,速效钾、有机质含量丰富。从沃柑果树根系样品中共检测出内生真菌12门42纲102目224科416属,其中真菌在门分类水平上的主要优势类群是子囊菌门(Ascomycota),在属分类水平上的主要优势类群为新赤壳属(Neocosmospora)和青霉属(Penicillium),自然生草及清耕模式下的沃柑根系内生真菌群落结构无明显差异。典型相关分析(CCA)结果表明,沃柑果园根系真菌群落与硝态氮、铵态氮、土壤有机质呈极显著相关(P<0.01),与pH呈显著相关(P<0.05),与速效磷、速效钾无显著相关性(P>0.05)。所有试验果园根系中的营养功能类群结构均相似,以腐生—营养型内生真菌菌群的相对丰度最高,其次为未鉴定的功能群、病理—腐生—共生营养型,其他营养功能类群在不同果园中占比均较低。【结论】广西沃柑根系内生真菌以新赤壳属和青霉属为优势属,该区域尺度下的沃柑根系内生真菌群落组成与生草管理无显著相关,但受部分土壤环境因子调控。
关键词:沃柑;植物内生真菌;群落多样性;FUNGuild;广西
中图分类号:S666.1 文献标志码:A 文章编号:2095-1191(2023)06-1800-10
Diversity of endophytic fungi in Orah mandarin
roots in Guangxi
XU Jie1,2, WEN Yun-ying2, MO Hui-jie2, KANG Yi-hao2, CHEN Ting-su2,
ZHANG Jin-lian2*, JIANG Ming-guo1*
(1School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning,Guangxi 530008, China;
2Institute of Microbiology, Guangxi Academy of Agricultural Sciences, Nanning,Guangxi 530007, China)
Abstract:【Objective】This paper investigated the effects of clean tillage and grassing measures on the diversity of endophytic fungi in Orah mandarin roots, to provide a scientific basis for screening and developing beneficial endophytic fungal resources with functions such as growth promotion, disease prevention and stress resistance. 【Method】Six representative Orah mandarin orchards in Wuming District, Nanning City,Guangxi (three grassing mode and three clean tilla-ge mode) were selected to investigate their soil nutrient levels. And the ITS zones of endophytic fungi in Orah mandarin roots were determined using high-throughput sequencing technology to analyze the diversity of fungal communities in Orah mandarin root samples and their distribution patterns. 【Result】The soil of Orah mandarin orchards in Wuming District, Nanning, Guangxi was mainly acidic, being rich in available potassium and organic matter. Endophytic fungi were detected in endophytic fungi in Orah mandarin root samples, including 12 phylums, 42 classes, 102 orders, 224 families and 416 genera of endophytic fungi, of which the main dominant taxa at the phylum level was Ascomycota, and at the genus level were Neocosmospora, Penicillium. There was no great difference in the community structure of endophytic fungi in Orah mandarin roots under natural grassing and clean tillage modes. The results of canonical correlation analysis (CCA) showed that the fungal communities in Orah mandarin root were highly significantly correlated with nitrate nitrogen, ammonium nitrogen and soil organic matter (P<0.01), significantly correlated with pH (P<0.05), and not significantly correlated with available phosphorus and available potassium (P>0.05). The structures of nutrient functional groups in the root system were similar in all the experimental orchards, with the highest relative abundance of saprophytic-nutrient endophytic fungal communities, followed by unidentified functional groups, pathological-saprophytic-symbiotic nutrient fungal communities. And the other nutrient functional groups occupied lower proportions in different orchards. 【Conclusion】The dominant genera of fungi in Orah mandarin roots in Guangxi are dominated by the genera Neocosmospora, Penicillium. The endophytic fungal community composition in the roots of Orah mandarin at this regional scale is not significantly related to grassing management, but is regulated by some soil environmental factors.
Key words: Orah mandarin; plant endophytic fungi; community diversity; FUNGuild; Guangxi
Foundation items: Guangxi Science and Technology Major Special Project (Guike AA18242026); Special Project of Guangxi Science and Technology Bases and Talents (Guike AD20159001); Joint Project of Xiamen University (KJ2023480B); Basic Scientific Research Project of Guangxi Academy of Agricultural Sciences (2023YM96)
0 引言
【研究意义】沃柑(Orah mandarin)由坦普尔桔橙和丹西红桔杂交得到。广西南宁市武鸣区自2012年引入沃柑进行试种,表现出高糖低酸、晚熟和丰产优质等特点,武鸣也发展成为全国沃柑种植面积最大的县(区),沃柑种植面积约61333 ha,占全国沃柑种植总面积的1/3,产值近百亿元。截至2021年,以沃柑为主的千亩以上种植企业,南宁有近30家,百亩以上的种植企业、大户近300家(冯梓剑,2023),小面积分散种植的柑橘户约16000户。武鸣沃柑于2019年获准注册为地理标志证明商标。沃柑生产中由于根毛稀少,根系分布浅,对土壤养分利用有效性低、较敏感,自然条件下通常与丛枝菌根(Arbuscular mycorrhizal,AM)真菌建立共生关系,可增加根系对磷等养分的吸收和植株的生长(刘洁雯等,2020)。与AM真菌相比,对柑橘园根系中内生真菌资源的研究相对较少。植物与根系内生真菌的共生能促进宿主植物的生长,增强宿主的胁迫抗性(Ren et al.,2019;Ujvári et al.,2021)。内生真菌的群落组成及功能特性对宿主植物微环境产生极大影响,而区域和植被等因素也可影响内生真菌群落多样性(顾美英等,2022)。目前,沃柑根系内生真菌的共生关系研究相对较少,发掘利用沃柑根系内生真菌资源,对促进沃柑生长、抗病虫害及提高沃柑品质等具有积极作用(周家喜等,2019)。【前人研究进展】至今,柑橘根系共生真菌研究方面已取得了一定进展。宋放(2018)以来自8个柑橘产区的柑橘实生苗为材料,鉴定了柑橘AM真菌的群落多样性,发现柑橘AM真菌群落结构受到生境和寄主基因型的显著影响,其中生境是最主要的影响因素。Xu等(2018)对来自六大洲、不同柑橘品种的土壤和根际样品进行扩增子和深鸟枪宏基因组测序,发现7个核心根际真菌属为核心菌群,隶属于子囊菌属(Ascomycetes)。Sadeghi等(2019)从健康柑橘叶、茎、干、根中分离真菌,发现黑酵母菌(Aureobasidium pullulans),桔青霉(Penicillium citrinum)和座囊菌屬(Dothideomycetes sp.)是最常见的分离株。陆鑫君(2021)比较不同地面覆盖处理对衢州椪柑根际微生物群落的影响,发现生草处理同时增大了根际土壤细菌和真菌的丰富度与多样性。肖力婷等(2022)以南丰蜜橘为研究对象,探究橘园不同生草条件对土壤微生物群落结构与功能特征的影响,发现黑麦草处理能显著提高真菌群落Chao1指数和Simpson指数,在橘园土壤中,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)为优势菌门。朱文倩(2022)对果园沃柑根系健康根进行分析,发现高通量测序中根系内生真菌以子囊菌门和担子菌门为主,健康植株白根上相对丰度最高是担子菌门(Herpotrichiellaceae)科枝孢瓶霉属(Cladophialophora),可培养分离得到的根系内生真菌有镰孢菌属(Fusarium)、毛壳菌属(Chaetomium)、二分枝毛壳属(Dichotomopilus)、壳球孢菌属(Macrophomina)及青霉属(Penicillium)等。颜桢灵等(2021)从柑橘枝条和叶片中分离得到72株内生真菌,其中优势属为刺盘孢属(Colletotrichum)、球座菌属(Guignardia)、链格孢属(Alternaria)和镰孢菌属。【本研究切入点】至今,有关南宁武鸣沃柑根系内生真菌多样性及群落组成的研究鲜见报道。【拟解决的关键问题】以广西南宁武鸣沃柑为研究对象,采用高通量测序技术对沃柑根系内生真菌群落特征进行分析,探究管理模式、土壤理化性质对沃柑根系内生真菌群落结构及多样性的影响,为广西沃柑根系内生真菌多样性的影响机制提供科学依据。
1 材料与方法
1. 1 调查地及采样果园情况
调查地位于广西南宁沃柑主产区武鸣区(东经107°49′26″~108°37′22″、北纬22°59′58″~23°33′16″,平均海拔100~150 m),地处亚热带季风气候区,光热充足,雨量充沛,夏季炎热多雨,春秋季易干旱,冬季温暖少雨,偶有霜雪,年平均气温21.7 ℃。武鸣沃柑果园在实际种植中主要存在生草(SC)和清耕(QG)种植模式,为保证所选果园的真实与充分性,从现有果园中随机选取2种种植模式各3个果园为调查样地,样地详细信息见表1。
1. 2 果园土壤性质测定
使用1 mol/L KCl溶液浸提后以电位法测定土壤pH(水土比为2.5∶1);土壤硝态氮用双波长分光光度法测定;土壤铵态氮使用靛酚蓝比色法测定;土壤速效磷(Avilable phosphorus,AP)用盐酸—氟化铵浸提剂浸提后,以钼锑抗比色法测定;土壤速效钾(Avilable potassium,AK)用1 mol/L乙酸铵溶液浸提后,以原子吸收分光光度计法测定;土壤有机质(Organic matter,OM)测定采用外加热重铬酸钾氧化—容量法(鲍士旦,2000)。
1. 3 沃柑根系样品的高通量测序
于2021年12月在每个果园内采集5份根系样本(选取15个采样点,并将每3个点采集的根样混合)。采集0~20 cm健康的沃柑白色根系,根系表面土壤一同收集,用于土壤理化性质分析。首先以自来水清洗沃柑根段表面,然后在超净台上进行消毒:75%酒精浸泡30 s,2%次氯酸钠浸泡2 min,无菌水冲洗。取少量末次冲洗液涂布于PDA培养基上,25 ℃黑暗培养4~5 d后,若基质表面未观察到菌落,表明表面消毒已彻底。
采用改良的CTAB方法提取沃柑总DNA(Doyle,1991)。引物ITS1F(5'-CTTGSCCATTTAGAGGAAS CAA-3')/ITS2R(5'-GCTGCSCTCTTCATCGATGC-3')擴增真菌的ITS区,采用Illumina MiSeqPE300平台对扩增产物进行测序(委托上海美吉生物医药科技有限公司完成)。
1. 4 高通量测序信息处理
将高通量测序的原始数据提交到NMDC数据库(http://nmdc.cn),接受号为PRJNA914072。原始数据经质控和拼接后,使用UPARSE(v7.1),根据97%的相似度对序列进行OTUs聚类,利用RDP Classifier(v2.11)比对Unite基因数据库(release 8.0)进行OTUs物种分类学注释,置信度阈值为70%,并在不同物种分类水平下统计每个样本的群落组成。
对初始OTUs进行比对到叶绿体和线粒体序列的去除,按照最小样本序列数进行样本序列抽平。采用Mothur计算α多样性指数,并采用Wilxocon秩和检验进行α多样性的组间差异分析;使用基于Bray-Curtis距离算法的主成分分析(PCoA)检验样本间真菌群落结构的相似性,并结合PERMANOVA非参数检验分析样本组间微生物群落结构差异是否显著;用线性判别分析(LEfSe)(LDA>2,P<0.05)确定不同组间从门到属分类水平相对丰度的显著性。
基于距离的冗余分析(db-RDA)及使用abund_ jaccard距离算法,研究土壤理化指标对根系内生真菌群落结构的影响。用线性回归分析评估db-RDA中确定的主要土壤理化指标对微生物α多样性指数的影响,采用FUNGuild对根系内生真菌群落功能信息从生态营养型上进行预测。
1. 5 统计分析
采用Excel 2020和SPSS 27.0进行数据统计分析,分别进行单因素方差分析(One-way ANOVA)和Duncan’s多重比较;用Pearson法和典型相关分析(CCA)对土壤理化性质和微生物多样性进行相关分析,并以Excel 2020作图。
2 结果与分析
2. 1 广西沃柑果园的土壤理化性质
由表2可看出,广西南宁市武鸣区沃柑果园为酸性土壤。其中生草果园SC2的土壤pH最大,为5.90,清耕果园QG2的pH最小,为4.10。生草处理果园SC2和SC3的土壤pH和有机质含量均显著高于清耕处理果园(P<0.05,下同)。生草与清耕处理果园间的硝态氮、铵态氮、速效磷和速效钾含量无显著差异(P>0.05,下同)。因此,生草果园SC2和SC3的土壤养分优于清耕果园,果园SC1土壤养分综合较差,可能与其土壤含有大量沙石有关。
2. 2 广西沃柑根系内生真菌的测序深度及OTU分析
稀释曲线可用来检测测序数据量能否反映样品的物种多样性及丰富程度,由图1可看出,各处理的稀释曲线末端基本趋于平缓,说明取样合理,能真实地体现沃柑根系内生真菌的群落结构。
2. 3 广西沃柑根系内生真菌群落组成分析
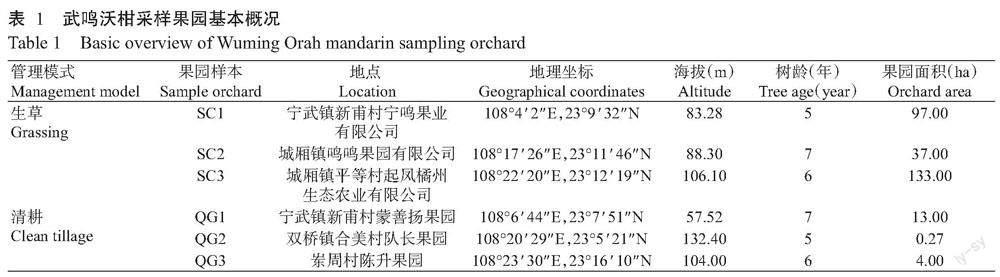
在门分类水平,沃柑根系内生真菌群落共注释得到12个门(图2-A)。在广西沃柑根系内生真菌群落中,门分类水平上占主导地位的真菌分别是子囊菌门(83.64%)、担子菌门(10.18%)和罗兹菌门(Rozellomycota,1.15%),三者之和占总OTUs的94.97%。其中,子囊菌门在果园SC2和QG3中相对丰度较高,分别在其果园占比94.87%和91.27%,担子菌门在果园SC1相对丰度最高(23.53%),罗兹菌门在果园SC3中相对丰度最高(2.35%)。相对于其他果园,果园SC3中含有被孢霉门(1.22%),果园QG1中含有较丰富的球囊菌门(Glomeromycota,1.79%),其他门类在真菌群落组成中占比很小(已去除未识别门类)。
在科分类水平,沃柑根系内生真菌群落共注释到224个科(图2-B)。其中丛赤壳科(Nectriaceae,45.69%)、曲霉科(Aspergillaceae,11.11%)和小皮伞科(Marasmiaceae,5.42%)是优势科,三者之和占总OTUs的62.22%。此外,果园SC2含有亚隔孢壳科(Didymellaceae,12.06%),果园QG1含有黑盘孢科(Melanconidaceae,12.88%)(已去除未识别科类)。
在属分类水平,6个果园根系内生真菌相对丰度前7位分别是新赤壳属(Neocosmospora,37.25%)、青霉属(14.10%)、镰孢菌属(9.93%)、Poaceascoma(3.72%)、黑盘孢属(Melanconiella,3.58%)、Roussoella(2.18%)和枝孢属(Cladosporium,1.77%)(图2-C)。其中,新赤壳属和青霉属在6个果园沃柑根系内生真菌占比均位于前列,因此认为上述2种真菌属是沃柑根系内生真菌的优势菌属。青霉属在果园SC3的相对丰度(24.72%)较果园SC2(6.07%)高307.25%,新赤壳属在果园QG3的相对丰度(55.51%)较果园QG1(19.27%)高188.06%,说明真菌种属在不同果园的丰度有明显差异(已去除未识别属类)。
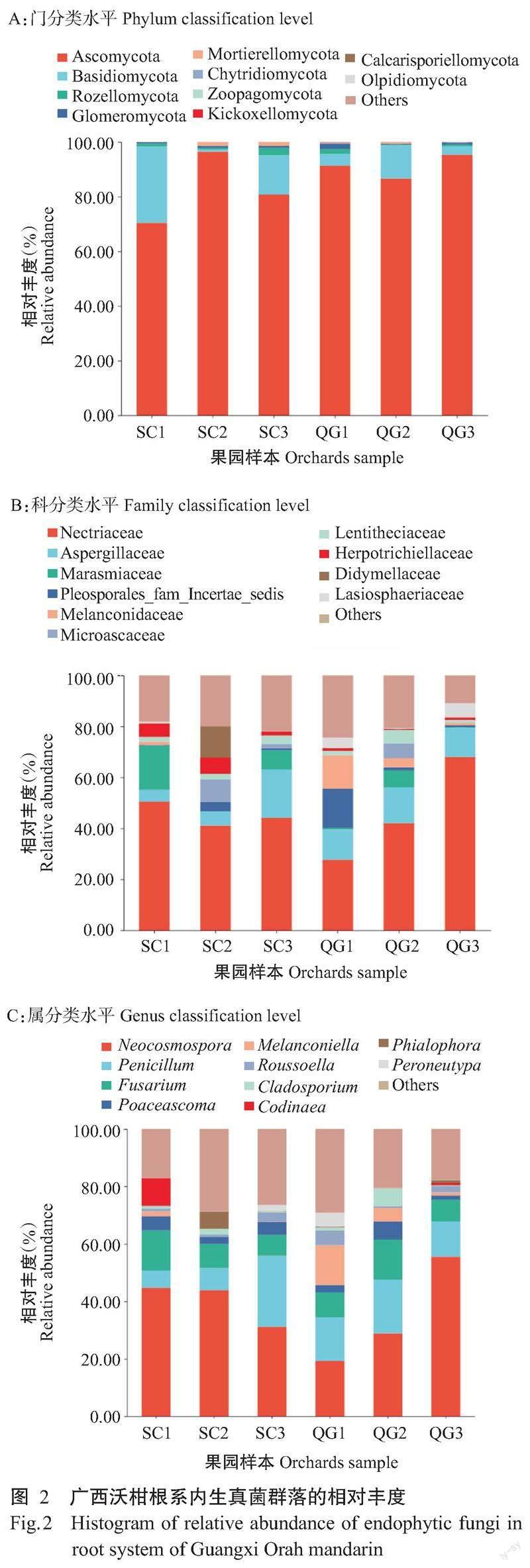
由图3可知,较清耕果园,根系内生真菌规整霉属(Codinaea)和瓶霉属(Phialophora)在生草果园中的相对丰度更高;较生草果园,黑盘孢属和枝孢属在清耕果园中的相对丰度更高;其他属在2种模式果园中丰度差距较小。
2. 4 广西沃柑根系内生真菌群落多样性分析
2. 4. 1 α多样性 Chao1指数和ACE指数反映群落丰富度,均为正相关;Shannon指数和Simpson指数反映群落多样性,其中Shannon指数与群落多样性为正相关,Simpson指数与群落多样性为负相关。6个果园根系内生真菌的Chao1指数、ACE指数无显著差异,即沃柑果园生草及清耕管理模式下,根系内生真菌的群落丰富度均无显著差异(表3)。果园SC1根系内生真菌的Shannon指数显著低于果园QG1,反映果园SC1根系内生真菌的多样性低于果园QG1,其他果园间多样性无显著差异。综合来看,果园SC1的Chao1指数和ACE指数最高,而Shannon指数最低,Simpson指数最高,因此果园SC1沃柑根系内生真菌的丰富最高,多样性最低。
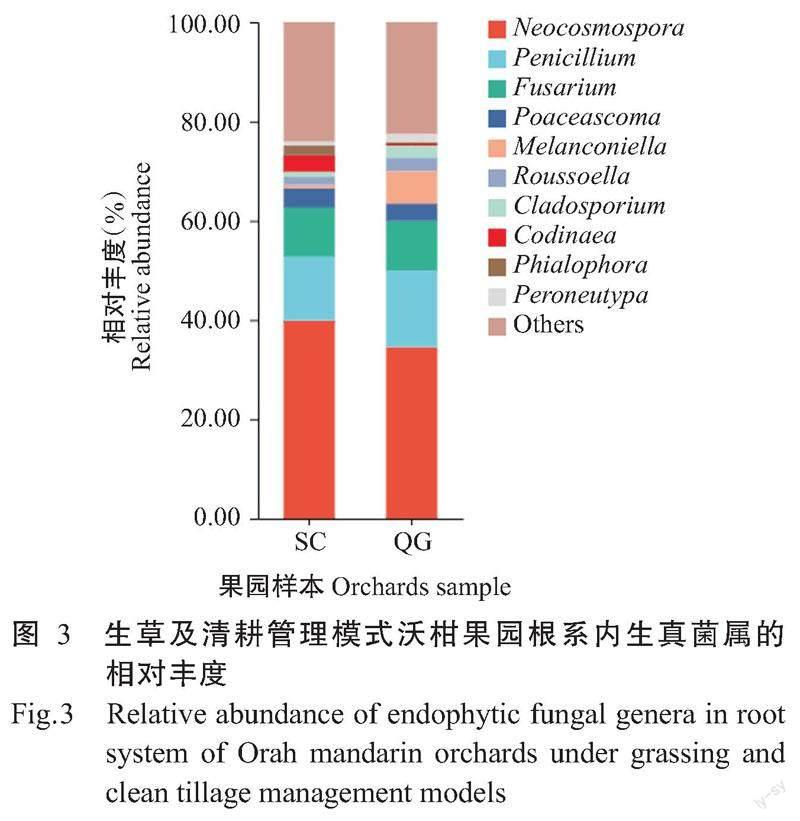
2. 4. 2 β多样性 在属分类水平上对不同沃柑果园根系内生真菌多样性进行PCoA分析,前2个主成分PC1和PC2的主成分解释度分别为17.88%和14.12%(图4)。6个果园间的群落组成呈分散状,同一果园的各样本也较分散,表明不同果园间及同一果园内各样本的群落组成存在差异。使用abund_jaccard距离算法,结果表明各果园群落在属水平上组成差异极显著(P=0.001,R2=0.2053)。
2. 5 广西沃柑根系内生真菌群落组成差异分析
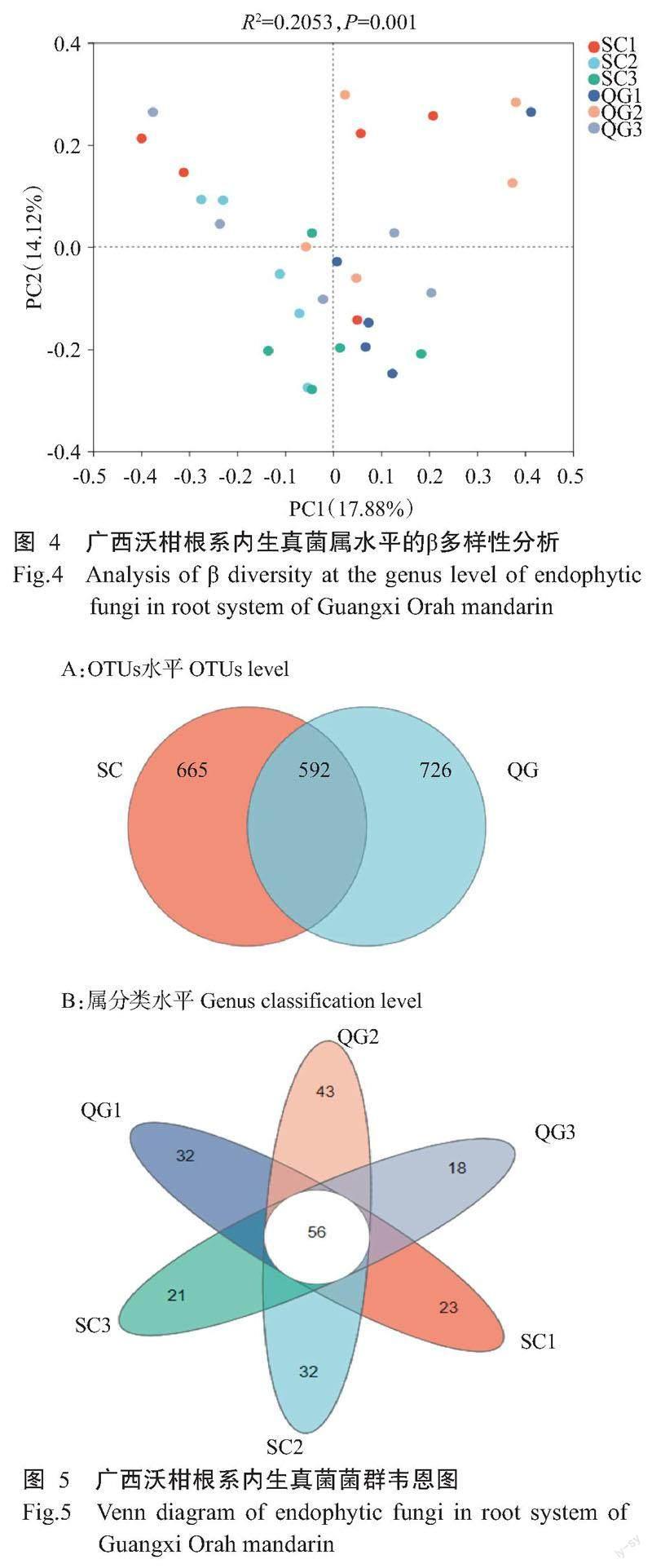
6个果园沃柑根系内生真菌的OTUs总数为1983个,生草组特有665个OTUs,清耕组特有726个OTUs(圖5-A),其中共有的OTUs占生草组和清耕组的比率分别为47.10%和44.92%,生草和清耕组的OTUs重叠较多,说明2种管理模式的根系内生真菌种类具有较高的相似性。
6个果园根系内生真菌共有属56个,果园SC1、SC2、SC3、QG1、QG2和QG3特有属分别为23、32、21、32、43和18个(图5-B),果园QG2的特有属较果园QG3多138.89%。不同果园特有属的相对丰度也有所差别,果园QG3特有的根系内生真菌相对丰度最低(8.00%),果园QG2特有的根系内生真菌相对丰度最高(19.11%)。
6个果园共有属中优势属为新赤壳属(24.35%)、青霉属(8.22%)和镰孢菌属(5.21%)。果园SC1、SC2、SC3、QG1、QG2和QG3中,相对丰度≥5%的真菌属分别有2、5、6、4、4和6个,其中,马利亚霉属(Mariannaea)、枝氯霉属(Ramichloridium)、无茎真菌属(Acaulium)、亚隔孢壳属(Didymella)、Hawksworthiomyces和嗜热链球菌属(Mycothermus)分别是上述果园特有优势属。可见,6个沃柑果园根系内生真菌群落的组成和相对丰度不同,果园SC3和QG3的根系内生真菌菌群相对丰度≥5%的真菌属最多,具有更高的偏好性。
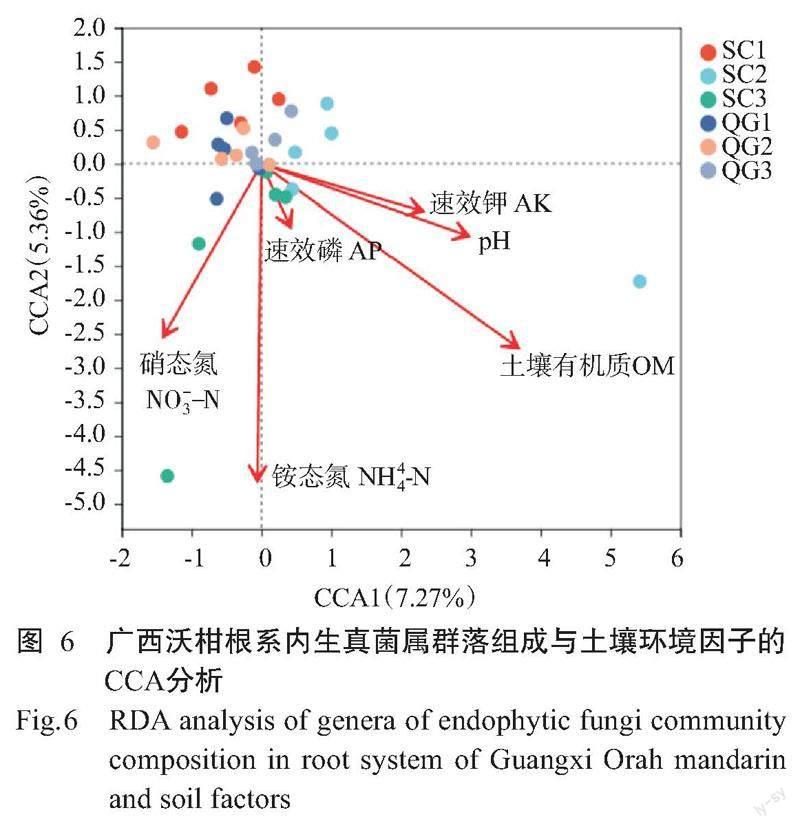
2. 6 广西沃柑根系内生真菌群落组成和土壤因子的相关分析
从CCA分析结果(图6)可看出,大多数果园内生真菌聚集在靠近坐标原点的位置,果园SC1和QG1的真菌群落与土壤有机质呈负相关;果园SC2的真菌菌落与硝态氮呈负相关;果园SC1的真菌菌落与铵态氮呈负相关。广西沃柑果园根系真菌群落与土壤pH存在显著相关,与硝态氮、铵态氮和有机质存在极显著相关(P<0.01),与速效磷、速效钾无显著相关(表4)。
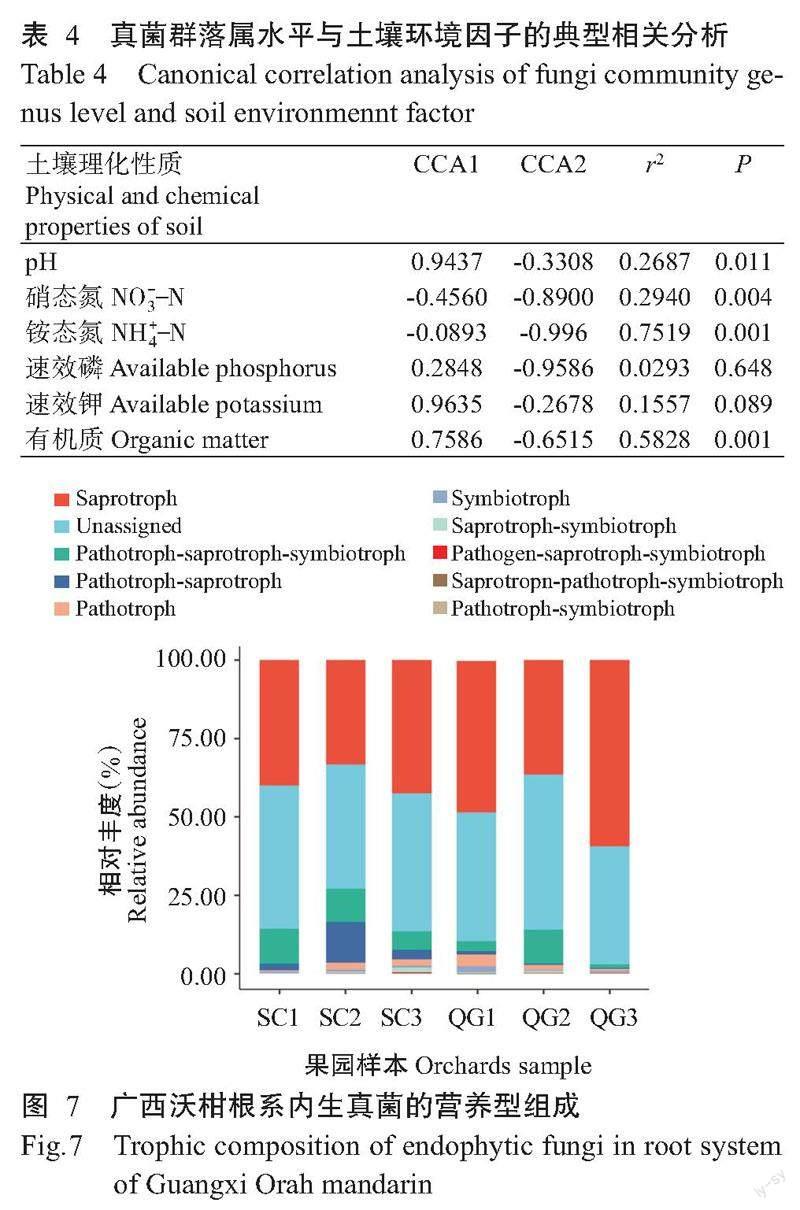
2. 7 广西沃柑根系内生真菌群落的FUNGuild功能类群预测
基于FUNGuild数据库解析广西沃柑根系内生真菌的生态功能类别,仅选择可信等级为极可能(Highly probable)的OTU和分类单元进行分析。生态营养型及各营养型在不同沃柑果园根系内生真菌中的丰度信息(图7)显示,以腐生营养型(Saprotroph)内生真菌菌群的相对丰度最高,为各样品的优势类群,在果园SC1、SC2、SC3、QG1、QG2和QG3中的相对丰度分别为40.01%、33.39%、42.59%、48.34%、36.58%和59.41%;其次为未鉴定(Unassigned)的功能群,分别为45.67%、39.58%、43.89%、41.06%、49.40%和37.69%;病原菌—腐生—共生营养型(Pathogen-saprotroph-symbiotroph)功能菌群在果园SC1、SC2和QG2中较为丰富,相对丰度分别为11.20%、10.59%和10.92%;果园SC2沃柑根系含有12.97%的病理—腐生营养型(Pathotroph-saprotroph)功能群,其他营养功能类群在不同果园中占比较低(相对丰度≤6%)。
3 讨论
3. 1 广西沃柑果园的土壤理化性质及对根系内生真菌群落的影响
根系是植物与微生物相互作用的重要场所,蕴含大量的内生真菌(江尚焘等,2023)。根据全国第二次土壤普查养分分级标准,本研究中广西沃柑果园(SC1、SC2、SC2、QG1和QG3)土壤中速效钾处于一级标准(>200 mg/kg,极高),果园QG2土壤处于二级标准(150~200 mg/kg,较高),速效钾含量的丰富,可能与钾肥可提高柑橘的单果重和产量有关(张绩,2020)。土壤有机质累积程度是土壤肥力的重要特征,3个清耕处理果园土壤中的有机质含量处于三级标准(20~30 g/kg,中等),生草处理果园SC2和SC3土壤有机质含量处于一级标准(>40 g/kg,丰富),除果园SC1外,生草处理果园土壤的有机质含量高于清耕处理果园。在果园行间种植鼠茅草、百喜草(蒙正兵等,2016)、长柔毛野豌豆(姜莉莉等,2019)也可明显改善果园土壤有机质的含量。本研究中果园特有真菌的存在受地理因素影响,沃柑果园根系真菌群落与土壤pH存在显著相关,与硝态氮、铵态氮、有机质存在极显著相关,与速效磷、速效钾无显著相关。
3. 2 广西沃柑果园根系内生真菌的优势属
对广西武鸣沃柑果园根系内生真菌群落组成和优势菌群进行分析,结果表明武鸣沃柑果园中蕴含着丰富的内生真菌群,各果园的OTUs数量在192~311个。门分类水平上,子囊菌门和担子菌门属于优势真菌门。科分类水平,丛赤壳科、曲霉科和小皮伞科是优势科。属分类水平上,除优势属新赤壳属和青霉属外,还包括镰孢菌属、Poaceascoma、黑盘孢属、Poussoella、枝孢属等。朱文倩(2022)对健康沃柑根系样本的真菌种类多样性进行调查分析,发现该样地果园内沃柑根系内生真菌相对丰度最高的属分别是枝孢瓶霉属、Phialocephala和镰孢菌属,健康沃柑白根根系内生真菌相对丰度最高的属分别是镰孢菌属、隔球囊霉属(Septoglomus)和根孢囊霉属(Rhizophagus)。由此可见,不同地区及不同种植模式均会影响柑橘根系内生真菌的群落结构特征。其中,新赤壳属被划分为未定义腐生菌,在不同果园中的占比范围为8.99%~36.43%。也有研究发现新赤壳属真菌具有抗肿瘤和抗疟疾的活性,以及清除或淬灭活性氧(ROS)的能力(Matsuo et al.,2020;樊锐锋等,2021)。此外,其他一些种类的内生真菌在沃柑根系也不可忽视,如青霉属在不同果园中的占比范围为1.91%~11.17%。淡紫拟青霉(Purpureocillium lilacinum)是对柑橘木虱具有强致病性的病原真菌(闫建全等,2022),淡紫拟青霉的存在可能在沃柑的生长发育中起到一定保护作用。
在属分类水平上,各果园中根系内生真菌相对丰度≥5%以上属的数量有所差异,表明不同果园的沃柑根系内生真菌群落组成及相对丰度有差异,与大多数果园相比,果园SC3和QG3的根系内生真菌菌群具有更高的偏好性。除了共有的真菌群落外,一些果園中还含有更多特有的真菌类群,如果园QG2特有的根系内生真菌属种类多于其他沃柑果园,可能是该果园阳光充足、土壤疏松,土壤理化因子处于适量水平,更有利于根系内生真菌的生长。
3. 3 不同植被管理模式对广西沃柑根系内生真菌多样性的影响
本研究中选取生草及清耕管理模式的沃柑果园为研究对象,发现2种管理模式下根系内生真菌的多样性并未出现规律性变化趋势。自然生草模式和清耕模式的根系内生真菌共有218个属,自然生草模式较清耕模式的属数降低15.89%。而相关研究表明,生草栽培有利于土壤中微生物增多,如对渭北旱地苹果园采取行间生草处理后可提高果园微生物群落的丰富度和功能多样性(刘富庭等,2014);人工种草可显著提高微生物群落丰富度和多样性,优化土壤细菌和真菌群落结构(肖力婷等,2022)。根系内生真菌由于长期生活在植物体内的特殊环境中,其对不同生草模式的影响较土壤真菌影响较小(张玉平,2007)。广西不同果园中沃柑根系内生真菌群落多样性、组成及相对丰度无显著差异。果园SC1的丰富度最高,多样性较低;果园SC2的丰富度较低,果园QG1较各果园的多样性较高。采样的武鸣区6个果园的沃柑根系内生真菌群落α多样性与有无植被无显著关系,对于β多样性,各果园群落组成分布较分散且同一果园的各样本也并非未完全聚在一起,说明不仅果园间存在差异,同一果园内也存在差异。
3. 4 广西沃柑根系内生真菌的FUNGuild功能预测分析结果
FUNGuild功能预测结果显示,沃柑根系内生真菌腐生营养型的相对丰度最高。由于土壤中腐生真菌的种类相当广泛(周雯娟等,2022),在长期的相互作用过程中,土壤中的腐生真菌更有机会选择性地进入根内成为内生真菌(张哲超,2022)。FunGuild是基于已有的文献报道对真菌功能进行预测,目前只注释到病原、共生和腐生三大营养功能类群,其准确性和全面性在未来还有待进一步提高(Simons et al.,2021)。本研究利用高通量测序技术对沃柑根系内生真菌群落组成和多样性进行了研究,发现了大量未分类的OTUs,其一,与传统分离培养方法相比,利用高通量测序技术可鉴定到更多的内生真菌;其二,沃柑根系内生真菌中存在大量未分类的真菌群落,受限于真菌数据库,无法对这些真菌群类进行功能分类;其三,很多未被发掘的真菌类群可能难以进行人工分离培养,需要通过改良分离培养技术进一步发掘内生真菌资源。
4 结论
广西沃柑根系内生真菌以新赤壳属和青霉属为优势属,该区域尺度下的沃柑根系内生真菌群落组成与生草管理无显著相关,但受部分土壤环境因子调控。
参考文献:
鲍士旦. 2000. 土壤农化分析[M]. 第3版. 北京:中国农业出版社. [Bao S D. 2000. Soil agrochemical analysis[M]. The 3rd Edition. Beijing:China Agricultural Press.]
樊锐锋,王若凡,杜艳秋,刘艳,黄庆阳. 2021. 黄精根际及药用部位内生真菌群落组成和生态功能分析[J]. 广西植物,41(5): 799-807. [Fan R F,Wang R F,Du Y Q,Liu Y,Huang Q Y. 2021. Community composition and ecological function of rhizosphere fungi and medicinal parts endophytic fungi in Polygonatum sibiricum[J]. Guihaia,41(5):799-807.] doi:10.11931/guihaia.gxzw202004042.
冯梓剑. 2023. 南宁打造沃柑百亿“甜蜜产业”[N]. 南宁日报,2023-03-03(007). [Feng Z J. 2023. Nanning to build tens of billions of Orah mandarin “sweet industry”[N]. Nanning Daily News,2023-03-03(007).] doi:10.28604/n.cnki.nnnrb.2023.000407.
顾美英,张志东,唐光木,古丽尼沙·沙依木,张丽娟,朱静,唐琦勇,楚敏,艾尼江·尔斯满,欧提库尔·玛合木提,徐万里. 2022. 黑果枸杞不同组织内生真菌群落组成及生态功能分析[J]. 菌物学报,41(8):1254-1267. [Gu M Y,Zhang Z D,Tang G M,Gulrinisha Shayimu,Zhang L J,Zhu J,Tang Q Y,Chu M,Ghenijan Osman,Outikuer Mahmut,Xu W L. 2022. Community composition and ecological function of endophytic fungi in different tissues of Lycium ruthenicum[J]. Mycosystema,41(8):1254-1267]. doi:10.13346/j.mycosystema.210476.
江尚焘,栗晗,彭海英,梅新兰,陈廷速,徐阳春,董彩霞,沈其荣. 2023. 有机肥替代部分化肥对芒果丛枝菌根真菌群落的影响[J]. 应用生态学报:34(2):481-490. [Jiang S T,Li H,Peng H Y,Mei X L,Chen T S,Xu Y C,Dong C X,Shen Q R. 2023. Effects of partial substitution of chemical fertilizer with organic fertilizer on arbuscular mycorrhizal fungal community of Mangifera indica[J]. Chinese Journal of Applied Ecology,34(2):481-490.] doi:10.13287/j.1001-9332.202302.011.
姜莉莉,宫庆涛,武海斌,盛福敬,孙瑞红. 2019. 不同生草处理对苹果园土壤微生物群落的影响[J]. 应用生态学报,30(10):3482-3490. [Jiang L L,Gong Q T,Wu H B,Sheng F J,Sun R H. 2019. Effects of different grasses cultivation on apple orchard soil microbial community[J]. Chinese Journal of Applied Ecology,30(10):3482-3490.] doi:10.13287/j.1001-9332.201910.039.
刘富庭,张林森,李雪薇,李丙智,韩明玉,谷洁,王晓琳. 2014. 生草对渭北旱地苹果园土壤有机碳组分及微生物的影响[J]. 植物营养与肥料学报,20(2):355-363. [Liu F T,Zhang L S,Li X W,Li B Z,Han M Y,Gu J,Wang X L. 2014. Effects of inter-row planting grasses on soil organic carbon fractions and soil microbial community of apple orchard in Weibei dryland[J]. Journal of Plant Nutrition and Fertilizer,20(2):355-363.] doi:10.11674/zwyf.2014.0211.
刘洁雯,冯曾威,朱红惠,张鲜姣,秦永强,姚青. 2020. 柑橘园土壤中解磷细菌多样性及其功能潜力分析[J]. 生物资源,42(5):568-575. [Liu J W,Feng Z W,Zhu H H,Zhang X J,Qin Y Q,Yao Q. 2020. Diversity of phosphate solubilizing bacteria in citrus orchard soil and their functional potential analysis[J]. Biotic Resources,42(5):568-575.] doi:10.14188/j.ajsh.2020.05.011.
陆鑫君. 2021. 不同地面覆盖处理对柑橘根际微生物群落和土壤理化性质的影响[D]. 武汉:华中农业大学. [Lu X J. 2021. Effects of different mulching treatments on rhizosphere microbial community and soil physicochemical properties of citrus[D]. Wuhan:Huazhong Agricultural University.]
蒙正兵,劉华荣,龙忠富,张瑜. 2016. 行间种草对火龙果果园土壤特性及果实产量的影响初探[J]. 贵州畜牧兽医,40(5):50-54. [Meng Z B,Liu H R,Long Z F,Zhang Y. 2016. Effect of intercropping with Paspalum notatum in pitaya orchard on soil characteristics and fruit production[J]. Guizhou Journal of Animal Husbandry & Veterinary Medicine,40(5):50-54.]
宋放. 2018. 柑橘根系微生物群落分析及菌根共生相关miRNA的鉴定[D]. 武汉:华中农业大学. [Song F. 2018. Characterization of root microbiome and identification of miRNAs involved in arbuscular mycorrhizal symbiosis in citrus[D]. Wuhan:Huazhong Agricultural University.]
肖力婷,杨慧林,黄文新,付学琴. 2022. 生草栽培对南丰蜜橘园土壤微生物群落结构与功能特征的影响[J]. 核农学报,36(1):190-200. [Xiao L T,Yang H L,Huang W X,Fu X Q. 2022. Effects of grass cultivation on soil microbial community structure and functional characteristics in Nanfeng tangerine orchard[J]. Journal of Nuclear Agriculture Sciences,36(1):190-200.] doi:10.11869/j.issn. 100-8551.2022.01.0190.
閆建全,刘豪,陈逢浩,卢慧林,欧阳革成,孟翔. 2022. 一株淡紫拟青霉GDIZM-2的分离鉴定及其对柑橘木虱的毒力评价[J]. 环境昆虫学报. https://kns.cnki.net/kcms/detail/44.1640.Q.20220831.1028.004.html. [Yan J Q,Liu H,Chen F H,Lu H L,Ouyang G C,Meng X. 2022. Islation and identification of a Purpureocillium lilacinum GDIZM-2 isolate and its toxicity evaluation against Diaphorina citri[J]. Journal of Environmental Entomology. https://kns.cnki.net/kcms/detail/44.1640.Q.20220831.1028.004.html.]
颜桢灵,陈洁萍,农小霞,李鑫,骆海玉,韦柳柳,阮家欢,关祥媛,陆莎. 2021. 柑橘内生真菌的分离鉴定及其发酵产物对柑橘溃疡病菌的抑制活性[J]. 广西植物,41(7):1196-1208. [Yan Z L,Chen J P,Nong X X,Li X,Luo H Y,Wei L L,Ruan J H,Guan X Y,Lu S. 2021. Isolation and identification of endophytic fungi from citrus cultivars and their inhibitory activity against Xanthomonas citri subsp. citri causing citrus canker[J]. Guihaia,41(7):1196-1208.] doi:10.11931/guihaia.gxzw202002021.
张绩. 2020. 纽荷尔脐橙钾肥施用技术研究[D]. 重庆:西南大学. [Zhang J. 2020. Study on the application technology of potassium fertilizer in Newhall Navel Orange[D]. Chongqing:Southwest University.]
张玉平. 2007. 披碱草—内生真菌共生体生物学与生理学特性的研究[D]. 兰州:兰州大学. [Zhang Y P. 2007. Biological and physiological characteristics of Elymus dahu-ricus/Neotyphodium endophyte symbiont[D]. Lanzhou:Lanzhou University.]
张哲超. 2022. 耐盐碱根际促生菌与丛枝菌根真菌联合提高牧草盐碱耐受性的微生物机制研究[D]. 呼和浩特:内蒙古大学. [Zhang Z C. 2022. Microbial mechanism of combined inoculation with haloalkalitolerant rhizosphere growth promoting bacteria and arbuscular mycorrhizal fungi to improve saline-alkaline tolerance of herbage[D]. Hohhot:Inner Mongolia University.]
周家喜,王茂胜,喻理飞,刘京,邹晓. 2019. 烟草根部内生真菌群落结构和功能特征[J]. 菌物学报,38(10):1610-1619. [Zhou J X,Wang M S,Yu L F,Liu J,Zou X,2019. The structure and function of endophytic fungal community in tobacco root[J]. Mycosystema,38(10):1610-1619.] doi:10.13346/j.mycosystema.190206.
周雯娟,卜崇峰,韦应欣. 2022. 秦岭石生苔藓结皮的微生物群落组成和多样性特征[J]. 西北植物学报,42(9):1600-1610. [Zhou W J,Bu C F,Wei Y X. 2022. Microbial community composition and diversity characteristics of lithophytic moss biocrusts of Qinling Mountains[J]. Acta Botanica Boreali-Occidentalia Sinica,42(9):1600-1610.] doi:10.7606/j.issn.1000-4025.2022.09.1600.
朱文倩. 2022. 柑橘根系真菌种类多样性分析及重要真菌种类对香橙苗生长的影响[D]. 南宁:广西大学. [Zhu W Q. 2022. Species diversity analysis of citrus root fungi and effects of major fungi species to the growth of Citrus jiunos seedlings[D]. Nanning:Guangxi University]. doi:10.27034/d.cnki.ggxiu.2022.001672.
Doyle J. 1991. DNA protocols for plants[M]//Hewitt A B,Johnson B,Young J PW. Molecular techniques in taxonomy. England:NATO Scientific Affairs Division. 57:283-293.] doi:10.1007/978-3-642-83962-7_18.
Matsuo H,Htrose T,Mokudoi T,Nonaka,Niwano Y,Sunazuka T,Takahashi Y,Ōmura S,Nakashima T. 2020. Absolute structure and anti-oxidative activity of chaetochiversin C isolated from fungal strain Neocosmospora sp. FKI-7792 by physicochemical screening[J]. The Journal of General and Applied Microbiology,66(3):181-187. doi:10.2323/jgam.2019.06.001.
Ren J,Dong G Z,Yan D H. 2019. Organs,cultivars,soil,and fruit properties affect structure of endophytic mycobiota of Pinggu peach trees[J]. Microorganisms,7(9):322. doi:10.3390/microorganisms7090322.
Sadeghi F,Samsampour D,Seyahooei M A,Bagheri A,Soltani J. 2019. Diversity and spatiotemporal distribution of fungal endophytes associated with Citrus reticulata cv. Siyahoo[J]. Current Microbiology,76(3):279-289. doi:10.1007/s00284-019-01632-9.
Simons N K,Felipe-Lucia M R,Schall P,Ammer C,Bauhus J,Bluthgen N,Boch S,Buscot F,Fischer M,Goldmann K,Gossner M M,Hänsel F,Jung K,Manning P,Nauss T,Oelmann Y,Pena R,Polle A,Renner S C,Schloter M,Schöning I,Schulze E-D,Solly E F,Sorkau E,Stempfhuber B,Wubet T,Müller J,Seibold S,Weisser W W. 2021. National Forest Inventories capture the multifunctionality of managed forests in Germany[J]. Forest Ecosystems,8(1):50-68. doi:10.1186/s40663-021-00280-5.
Ujvári G,Turrini A,Avio L,Agnolucci M. 2021. Possible role of arbuscular myorhizal fungi and associated bacteria in the recruitment of endophytic bacterial communities by plant roots[J]. Mycorrhiza,31(5):527-544. doi:10.1007/s00572-021-01040-7.
Xu J,Zhang Y Z,Zhang P F,Trivedi P,Riera N,Wang Y Y,Liu X,Fan G Y,Tang J L,Coletta-Filho H D,Cubero J,Deng X L,Ancona V,Lu Z J,Zhong B L,Roper M C,Capote N,Catara V,Pietersen G,Vernière C,Al-Sadi A M,Li L,Yang F,Xu X,Wang J,Yang H M,Jin T,Wang N. 2018. The structure and function of the global citrus rhizosphere microbiome[J]. Nature Communications,9(1):4894. doi:10.1038/s41467-018-07343-2.
(責任编辑 邓慧灵)
收稿日期:2023-02-06
基金项目:广西科技重大专项(桂科AA18242026);广西科技基地和人才专项(桂科AD20159001);厦门大学联合项目( KJ2023480B);广西农业科学院基本科研业务专项(2023YM96)
通讯作者:张金莲(1978-),https://orcid.org/0000-0002-0375-5121,博士,主要从事丛枝菌根真菌研究工作,E-mail:zhangjinlian1@126.com;姜明国(1973-),https://orcid.org/0000-0003-2279-5740,博士,教授,主要从事微生物生物技术研究工作,E-mail:mzxyjiang@gxun.edu.cn
第一作者:徐杰(1997-),https://orcid.org/0000-0002-6307-5486,研究方向为微生物与植物互作,E-mail:1329426926@qq.com
