基于生物信息学分析PNCK在肝癌中的表达及其与预后、免疫浸润的相关性*
2023-11-02岳明强孙立华郜庆祖王昕红
岳明强 孙立华 郜庆祖 王昕红
河南省新乡医学院第一附属医院感染科 (河南 新乡, 453000)
肝细胞癌简称肝癌,肝癌死亡率位居全球癌症死亡第4位,主要风险因素包括慢性乙型病毒性肝炎、慢性丙型病毒性肝炎、黄曲霉毒素、饮酒、代谢异常等[1]。流行病学研究结果显示[2],2020年全球肝癌死亡例数约为80万例,中国肝癌发病率约为18.2/(10万),死亡率约为17.2/(10万),且肝癌发病数随年龄增加逐渐上升。发生局部侵袭、转移的肝癌患者预后更差,死亡率更高[3],因此,早期明确肝癌的发病机制、侵袭转移及预后标志物显得尤其重要。妊娠上调的非泛素性钙调蛋白激酶(PNCK)是钙调蛋白激酶Ⅰ家族成员之一,近年来发现PNCK属于一种促癌基因,在多种肿瘤如鼻咽癌[4]、乳腺癌[5]等显著高表达,且与不良预后有关。然而,目前关于PNCK在肝癌中的表达及相关机制尚不清楚,本研究通过生物信息学方法探讨PNCK在肝癌中的表达水平及临床意义。
1 材料与方法
1.1 数据库 TCGA数据库(https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga);GEPIA数据库(http://gepia.cancer-pku.cn/);HPA数据库(https://www.proteinatlas.org/);TIMER数据库(https://cistrome.shinyapps.io/timer/);DAVID数据库(https://david.ncifcrf.gov/home.jsp);LinkedOmics数据库(http://www.linkedomics.org)?
1.2 研究方法
1.2.1 PNCK mRNA在肝癌组织中的表达及其与预后的关系TCGA数据库中下载肝癌患者的基因表达数据,其中肝癌组织374例,正常组织50例,还包括50例癌组织及配对的癌旁组织,样本中PNCK mRNA表达水平采用Log2转换。肝癌患者预后的危险因素采用Cox回归分析。
1.2.2 K-M曲线生存分析 利用GEPIA数据库分析肝癌组织中PNCK mRNA表达水平和患者中位生存时间的关系。
1.2.3 肝癌组织中PNCK蛋白表达水平 利用HPA数据库分析PNCK蛋白在肝癌组织及正常组织中的表达差异。
1.2.4 免疫浸润分析 通过TIMER数据库中的“Immune association”模块探索PNCK与肝癌组织中免疫细胞浸润程度的相关性,包括T淋巴细胞、B淋巴细胞、巨噬细胞和中性粒细胞(Neutrophils细胞)、树突状细胞(DC细胞)等。
1.2.5 肝癌组织中PNCK共表达基因 从LinkedOmics数据库中筛选肝癌组织中与PNCK共表达基因,参数设置P-Spearman<0.01。分别获取前50个与PNCK显著正相关和显著负相关的基因。
1.2.6 GO、KEGG富集分析 采用DAVID数据库对100个共表达基因进行功能注释和富集分析,主要包括基因本体论(GO)和KEGG信号通路。GO分析包括细胞组成(CC)、分子功能(MF)和生物学过程(BP)。本研究中选择富集最为显著的前5个条目。
1.3 统计学方法 肝癌组织中和正常组织及癌旁组织中PNCK mRNA表达差异的比较采用Wilcoxon检验,肝癌患者预后的危险因素采用Cox回归分析,PNCK mRNA表达水平与肝癌患者中位生存时间的相关性采用K-M曲线分析,免疫浸润分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 PNCK mRNA表达水平和肝癌患者预后的相关性分析 单因素结果显示,T分期、M分期、病理学分期、PNCK mRNA表达水平与肝癌患者预后有关;多因素分析结果显示,PNCK mRNA表达水平(高表达)是影响肝癌患者预后的危险因素,见表1。K-M曲线结果证实,PNCK mRNA高表达及低表达的肝癌患者生存时间为46.6和84.4个月,与PNCK mRNA低表达相比,PNCK mRNA高表达患者中位生存时间显著降低(P=0.002),见图1。
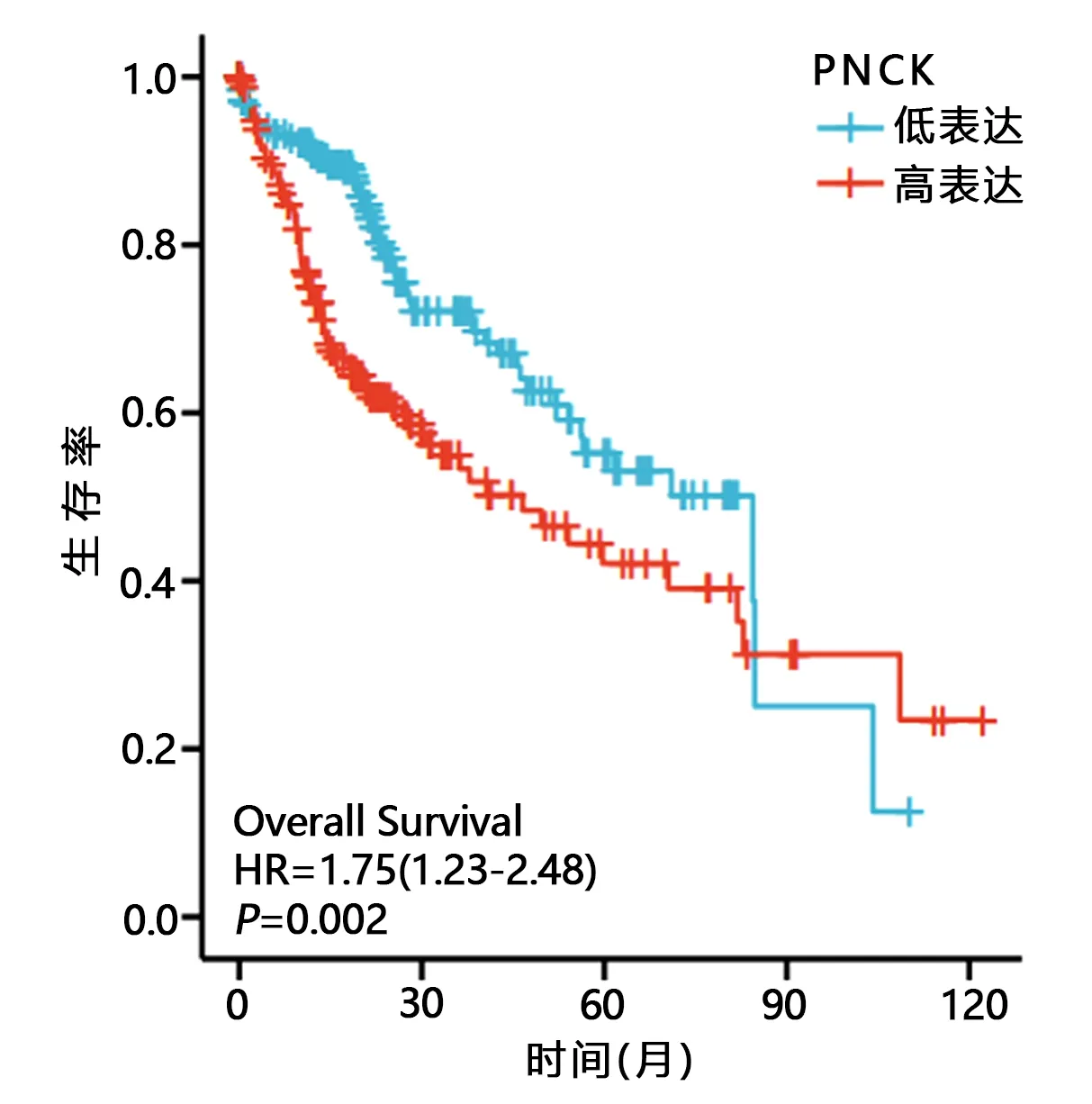
图1 PNCK mRNA表达水平与肝癌患者预后的K-M曲线

表1 肝癌患者预后的危险因素COX回归分析
2.2 PNCK mRNA在肝癌组织中的表达水平 肝癌组织374例,正常组织50例,肝癌组织中PNCK mRNA表达水平为0.041(0.010,0.365),正常组织中PNCK mRNA表达水平为0(0,0.015),与正常组织相比,肝癌组织中PNCK mRNA表达水平显著升高(P<0.001);50例肝癌组织及配对的癌旁组织,肝癌组织中PNCK mRNA表达水平为0.028(0,0.194),正常组织中PNCK mRNA表达水平为0(0,0.015),与正常组织相比,肝癌组织中PNCK mRNA表达水平显著升高(P<0.001)。见图2。
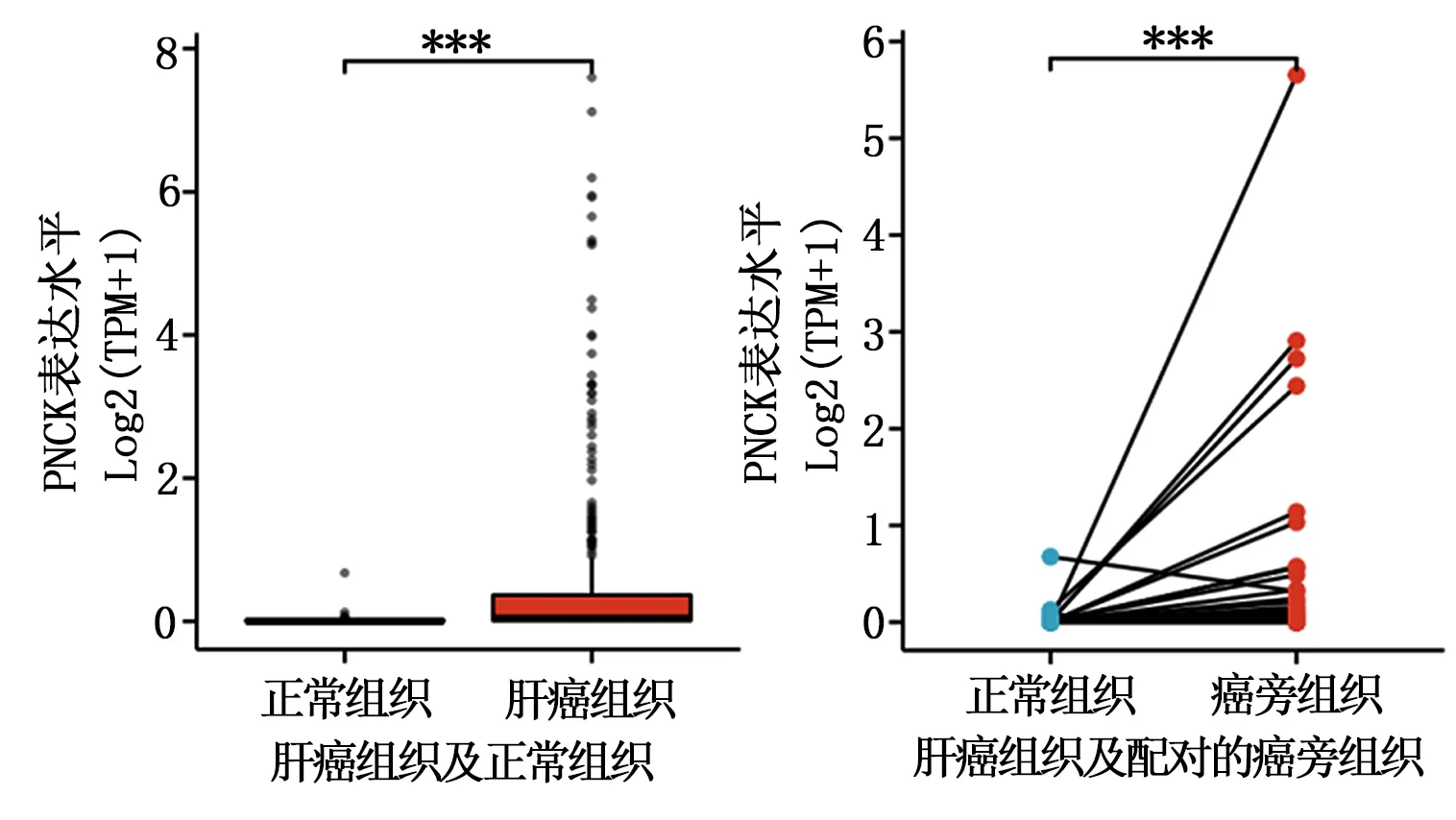
图2 不同组织中PNCK mRNA表达水平
2.3 肝癌组织中PNCK蛋白表达情况 HPA数据库结果提示,PNCK蛋白在肝癌组织中呈高表达,在正常肝脏组织中呈低表达。PNCK在肝癌中主要表达于细胞质中, 见图3。

图3 HPA数据库中PNCK在正常组织及肝癌组织中的表达(×200 μm)
2.4 肝癌中PNCK与免疫浸润细胞的相关性 进一步探讨肝癌组织中PNCK和免疫浸润细胞的相关性,结果显示,肝癌组织中PNCK mRNA表达水平与Th2细胞、TFH细胞、NK CD56bright细胞等呈显著正相关(P<0.001),与DC细胞、Neutrophils、Th17 细胞等呈显著负相关(P<0.001)。见图4和表2。

图4 肝癌组织中PNCK mRNA表达水平与免疫细胞浸润的相关性

表2 肝癌组织中PNCK mRNA表达水平与免疫细胞浸润的相关性
2.5 肝癌中PNCK共表达基因及GO、KEGG富集分析 通过数据库进一步筛选前50个与PNCK显著正相关和负相关的基因,将100个共表达基因进行GO、KEGG富集分析,结果显示,肝癌组织中PNCK共表达基因主要富集的BP包括胰岛素分泌调节等;主要富集的CC包括线粒体基质等;主要富集的MF包括氧化还原活动等;主要富集的KEGG信号通路包括代谢途径、丙酮酸代谢、糖酵解和糖异生等。结果见表3。

表3 肝癌组织中PNCK共表达基因的GO、KEGG富集分析
3 讨论
肝癌属于全球最为常见的恶性肿瘤之一,多由于慢性乙型病毒性肝炎发展导致,发病率和死亡率均较高。鉴于肝癌发病机制复杂,筛选出新的肝癌预后标志物对提高肝癌患者的预后和实现个体化靶向生物治疗均有着重要意义。PNCK是钙调蛋白激酶Ⅰ家族成员之一,具有丝氨酸/苏氨酸激酶活性,人PNCK基因定位于Xq28,既往认为,PNCK表达可能限于特定的乳腺上皮细胞类型[6],而近年来发现PNCK在多种肿瘤中均呈现高表达现象[4-5,7],Xu等[7]通过体内外实验发现PNCK在鼻咽癌中显著高表达,PNCK沉默后通过PI3K-AKT信号通路抑制鼻咽癌细胞的增殖、侵袭并促进凋亡。然而,目前PNCK在肝癌中的具表达水平尚不清楚。本研究基于多个数据库结果证实,PNCK在肝癌组织中显著高表达,且预后分析也证实PNCK高表达是影响肝癌患者不良预后的独立危险因素,PNCK高表达的肝癌患者中位生存时间显著缩短,这结果均提示PNCK可能在一定程度上促进了肝癌的发生发展,PNCK可作为肝癌预后不良的标志物之一,PNCK可作为肝癌个体化靶向治疗的一个新靶点。
肿瘤常常伴随着免疫微环境异常,肿瘤细胞、免疫细胞、细胞因子、细胞外基质等共同构成肿瘤免疫微环境,近年来发现免疫微环境在在肝癌进展、免疫耐受、免疫逃逸和治疗抵抗中发挥着重要作用[8-10]。本研究发现肝癌组织中PNCK mRNA表达水平与多种免疫细胞浸润程度显著相关,如PNCK mRNA与Th2细胞、巨噬细胞等浸润程度具有显著正相关性,Th2细胞作为一种T淋巴细胞亚型,研究显示Th2细胞相关细胞因子IL-4和IL-6在肝癌患者血清中显著高表达[11],且相对于无肝癌家族成员而言,Th2细胞相关因子IL-4表达水平在肝癌家族患者中表达水平更高[12],在肝癌经过热消融治疗后,癌组织和血清中Th2相关性细胞因子表达水平显著下降[13]。巨噬细胞主要起源于骨髓源性单核细胞,M2型巨噬细胞可通过分泌细胞因子和趋化因子刺激肿瘤的发生、发展及转移[14]。孙文兵等[15]证实肝癌细胞来源外泌体miR-151可诱导巨噬细胞发生M2型转化从而促进肝癌细胞的迁移及侵袭,此外,抗肿瘤药物高良姜素可通过调控Wnt/β-catenin通路促进巨噬细胞M2型向M1型转化,降低Zbed3表达水平并促进肝癌细胞凋亡并减小瘤体体积[16]。
为进一步探讨PNCK在肝癌发生发展中的调控机制,我们基于LinkedOmics 数据库共鉴定出肝癌中与PNCK显著相关的100个共表达基因,对共表达基因进行GO和KEGG富集分析,结果显示,这些共表达基因主要富集于丙酮酸代谢、糖酵解等途径,提示PNCK主要涉及代谢编程途径等参与肝癌的发生发展。在肿瘤细胞中,有氧糖酵解是肿瘤细胞获取能量的主要途径,肿瘤免疫微环境中成熟T细胞会发生代谢重编程,可活化有氧糖酵解途径,为肿瘤细胞的快速增殖提供能量[17]。郭舜等[18]研究发现,黄芩素可抑制肝癌细胞的增殖、侵袭,同时显著降低肝癌细胞的能量代谢水平,作用机制与其能抑制肝癌细胞糖酵解及谷氨酰胺代谢有关,此外,白藜芦醇同样可通过调节糖代谢重编程抑制肝癌细胞的增殖[19]。因此,上述结果提示PNCK可能通过调节代谢编程促进肝癌的进展。
综上所述,PNCK在肝癌中高表达,可能作为肝癌预后不良的标志物之一,PNCK可能通过调控肿瘤免疫微环境及代谢编程等途径参与了肝癌的发生发展,本研究为肝癌的个体化诊疗提供了新的靶点,然而,PNCK在肝癌中的功能和作用还需要分子生物学实验进一步验证。
