干扰素-α通过PD-1/PD-L1途径减轻HBV感染引起的肝组织损伤和肝纤维化*
2023-11-02闪海霞吴玉卓颜成果夏盼盼李延玲范崇桂
闪海霞 吴玉卓 颜成果 夏盼盼 李延玲 高 星 范崇桂
1.南阳市中心医院感染性疾病科 (河南 南阳, 473000) 2.南阳市中心医院超声科 3.南阳市中心医院神经内科
乙型肝炎病毒(HBV)是引起乙型肝炎(CHB)最主要病原体类型。我国是CHB高发地区,全球约1/3的HBV携带者在中国[1]。CHB的高发病率和致死率,使得该病成为威胁我国居民生命健康和生活质量的重要疾病[2]。HBV是一种嗜肝性病毒,尽管CHB患者接受了抗病毒治疗,但仍有部分可出现肝纤维化进展[3]。干扰素-α(IFN-α)不仅具有广谱抗病毒作用,还有免疫调节作用[4]。近来研究发现,IFN-α可能具有抗肝纤维化,改善肝功能的作用[5]。程序性死亡受体1(PD-1)/程序性死亡-配体1(PD-L1)通路是HBV感染及其相关肝病进展关键机制之一[6],亦是目前CHB免疫治疗的重要靶点途径。本研究制备了HBV感染小鼠模型,并以pKCMvint.IFN-α上调体内IFN-α水平,以探讨IFN-α对HBV感染引起的肝组织损伤和肝纤维化的作用及机制。现将结果报道如下。
1 材料与方法
1.1 实验动物 BALB/c小鼠45只,雌性,SPF级,周龄6~8周,平均(6.56±0.23)周,体质量18~20 g,平均(19.13±0.56)g,购自山东博安生物技术股份有限公司[SCXK(鲁)2020 0006]。自由饮食,单笼喂养,温度25~27℃,湿度40%~45%。
1.2 主要试剂与仪器 pAAV/HBV1.2质粒:BioVector NTCC中国质粒载体菌种细胞基因保藏中心。pKCMvint.IFN-α及pKCMvint质粒:德国埃森医院病毒研究所。无菌PBS溶液、HE试剂盒:武汉博士德生物。小鼠HBeAg试剂盒、小鼠HBsAg试剂盒、qPCR试剂盒、通用RT-PCR试剂盒、超敏ECL化学发光试剂盒:上海恒斐生物。小鼠ALT试剂盒、小鼠AST试剂盒、总蛋白提取试剂盒:江西艾博因生物。血清总RNA提取试剂盒、逆转录试剂盒、Masson染色试剂盒:北京百奥莱博。PD-1抗体、PD-L1抗体:美国Abcam。Multiskan Sky全波长酶标仪、NANODROP 2000微量紫外分光光度计:美国赛默飞世尔。7900型PCR仪:美国ABI。
1.3 分组、模型构建及干预 参考文献[7,8]将BALB/c小鼠随机分为对照组、模型组、IFN-α组,每组各15只。模型组和IFN-α组小鼠经尾静脉高压快速注射pAAV/HBV1.2 10 μg,注射总量为小鼠体质量的8%~10%,对照组小鼠经尾静脉注射等剂量PBS溶液,后IFN-α组小鼠经尾静脉高压注射pKCMvint.IFN-α 10 μg,注射总量为小鼠体质量的8%~10%,模型组则注射等剂量pKCMvint。4周后进行指标观察。
1.4 取材
1.4.1 血清样本 于模型构建4周后,经小鼠眼眶取血,6 000 r/min离心10 min,取血清,-20℃保存备用。
1.4.2 肝脏组织 颈椎脱臼法处死小鼠,消毒腹部,打开腹腔,暴露肝脏,取出肝脏组织;0.9%氯化钠溶液冲洗,滤纸擦除残留水分,4%多聚甲醛固定,-80℃保持备用。
1.5 观察指标及检测方法
1.5.1 一般情况 记录各组小鼠进食量、饮水量、毛发色泽及行为表现。
1.5.2 酶联免疫吸附法(ELISA) ELISA法测定HBV血清病毒学指标、肝功能指标及IFN-α水平,其中HBV血清学指标包括乙型肝炎e抗原(HBeAg)、乙型肝炎表面抗原(HBsAg),肝功能指标包括:天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)。取血清样本,PBS溶液以1∶20比例稀释,按照试剂盒说明书操作。
1.5.3 实时荧光定量聚合酶链式反应(qPCR) qPCR技术测定血清HBV DNA复制水平。提取血清样本总RNA,全波长酶标仪测定RNA浓度;以RNA为模板,按照试剂盒说明书操作,将其逆转录为cDNA;以β-actin为内参,上游引物5'-GCC-CTGAGGCTCTCTTCCA-3',下游引物5'-GCGGATGTCGACGTCA-CA-3',HBV上游引物5'-TGGTGTCTTTGGAGTGTGGAT-3',下游引物5'-TAACATTGAGATTCCCGAGATTG-3';PCR反应体系:cDNA 2.0 μl、上游和下游引物各1.0 μl、qPCR mix 10.0 μl、ddH2O 6.0 μl;反应条件:95℃ 2 min,94℃ 20 s,60℃ 20 s,72℃ 30 s,40个循环;PCR仪测定HBV DNA值,实验重复3次,取平均值。
1.5.4 苏木精-伊红(HE)染色法 HE染色法观察肝组织形态学改变。取由4%多聚甲醛固定的肝脏组织,经不同浓度乙醇脱水、二甲苯透明后,石蜡包埋,制备厚0.4 μm切片;后经二甲苯脱蜡,不同浓度乙醇水化,纯净水冲洗3~5 min;苏木素染色5 min,水洗1~3 min;0.5%盐酸酒精分化3~10 s,磷酸氢二钠溶液反蓝10 min;70%乙醇和80%乙醇各5 min,伊红染色30 s,蒸馏水冲洗;脱水、透明,中性树胶封片,光学显微镜下观察肝组织形态学。
1.5.5 Masson染色法 Masson染色观察肝组织纤维化程度。取组织石蜡切片,经脱蜡、水化后,苏木精染核5~10 min;蒸馏水冲洗,Masson染液染色5~10 min;2%冰醋酸浸洗,1%磷钼酸水溶液分化3~5 min,苯胺蓝染色5 min;2%冰醋酸浸洗,脱水、透明,中性树胶封片,光学显微镜下观察染色情况,胶原纤维呈蓝色,胞质、纤维素、神经胶质呈红色,胞核呈黑蓝色。
1.5.6 免疫组化染色法 免疫组化染色法测定肝组织PD-1和PD-L1表达。取组织石蜡切片,经脱蜡、水化后,滴加PD-1抗体(1∶50)和PD-L1抗体(1∶25),4℃过夜孵育;滴加二抗,室温孵育2 h;DAB液显色,镜下观察染色情况,自来水终止反应;苏木精复染,脱水、透明,中性树胶封片;随机选取5个高倍视野,观察染色强度和阳性细胞数量,根据免疫反应积分评分法[9],两者积分乘积大于3视为阳性。
1.5.7 蛋白免疫印迹法(Western Blot) WB法测定肝组织PD-1和PD-L1蛋白表达水平。提取肝组织总蛋白,BCA法进行蛋白定量;EP管内加入20 μl 5×蛋白上样缓冲液,沸水煮沸;琼脂糖凝胶电泳,收集蛋白样本,湿法转至PVDF膜;4℃下脱脂奶粉封闭4 h,滴加PD-1抗体、PD-L1抗体,4℃过夜;TBST洗膜3次,每次20 min;滴加二抗,4℃孵育2 h;TBST洗膜3次,每次20 min;ECL显影,ImageJ软件分析。
1.5.8 逆转录聚合酶链式反应(RT-PCR) RT-PCR技术测定肝组织PD-1和PD-L1 mRNA相对表达量。Trizol法提取肝组织总RNA,逆转录为cDNA;以GAPDH为内参,上游引物5'-GGTAGAACGTCCGTGTTTCA-3',下游引物5'-TTCAGTCCCA-GTCATGGAAC-3',PD-1上游引物5'-ATCTCACCGCTCGTTT-CCT-3',下游引物5'-CACTGCAAACCTCGGTGATG-3',PD-L1上游引物5'-GGTAATCCGTTTCCCTTGA-3',下游引物5'-CCTAA-TTTATGAGCCTATC-3';PCR反应体系:cDNA 1.0 μl、上游和下游引物各0.4 μl、PCR mix 10.0 μlL、ddH2O 8.2 μl;反应条件:98℃ 30 s预变性,98℃ 10 s,50℃ 30 s,72℃ 45 s,35个循环;结果采用2-△△Ct法分析,实验重复3次,取平均值。

2 结果
2.1 3组小鼠一般情况 与对照组比较,模型组小鼠进食量和饮水量减少,毛发色泽变暗,活动减少,部分出现精神萎靡或腹水;与模型组比较,IFN-α组小鼠进食量和饮水量逐渐恢复正常,毛发色泽较前改善,精神状态亦变好,无明显腹水。
2.2 3组小鼠肝组织病理学形态及纤维化情况 对照组小鼠肝细胞形态完整,肝小叶结构完整,肝组织内未发现纤维化染色。与对照组比较,模型组小鼠肝细胞排列异常,出现假肝小叶,细胞内大量炎症浸润,且肝组织内有大量蓝色或灰蓝色胶原纤维染色;与模型组比较,IFN-α组小鼠肝细胞损伤明显减轻,仅有少量炎症浸润,肝组织内纤维化染色减少。图1、2。
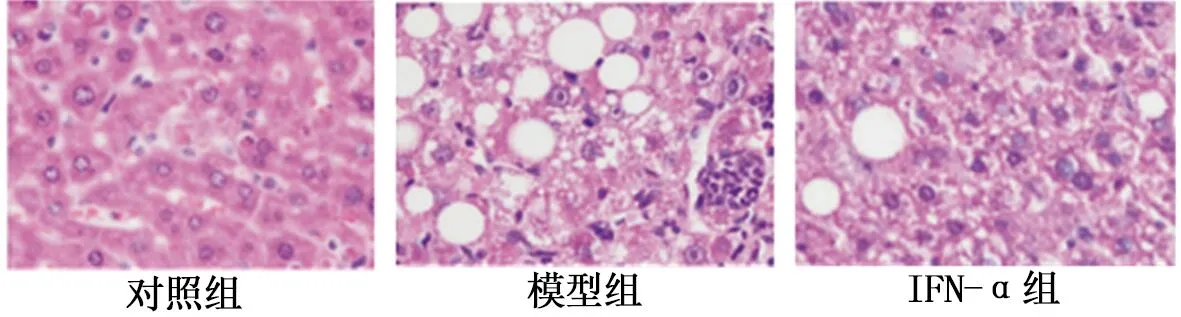
图1 各组小鼠肝组织病理学形态比较 (HE染色×400)

图2 各组小鼠肝组织病理肝纤维情况比较 (HE染色×400)
2.3 3组小鼠HBV血清学病毒指标及HBV DNA复制水平IFN-α组小鼠血清HBeAg、HBsAg及HBV DNA水平均显著低于模型组(P<0.05)。
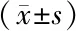
表1 各组小鼠HBV血清学指标及HBV DNA复制水平
2.4 3组小鼠肝功能指标及IFN-α表达水平 模型组小鼠血清AST和ALT水平显著高于对照组(P<0.05);IFN-α组小鼠血清IFN-α水平显著高于模型组,AST和ALT水平显著低于模型组(P<0.05)。表2。
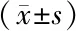
表2 各组小鼠AST、ALT和IFN-α表达情况比较
2.5 3组小鼠肝组织PD-1和PD-L1表达 免疫组化染色显示,对照组小鼠肝组织内PD-1和PD-L1表达均呈阴性,模型组小鼠肝组织内可见大量阳性染色细胞,IFN-α组小鼠肝组织内PD-1和PD-L1阳性染色细胞明显减少,图3。Western Blot和RT-PCR显示,模型组小鼠肝组织内PD-1和PD-L1蛋白及mRNA水平显著高于对照组,IFN-α组上述指标水平则显著低于模型组(P<0.05)。见图4。
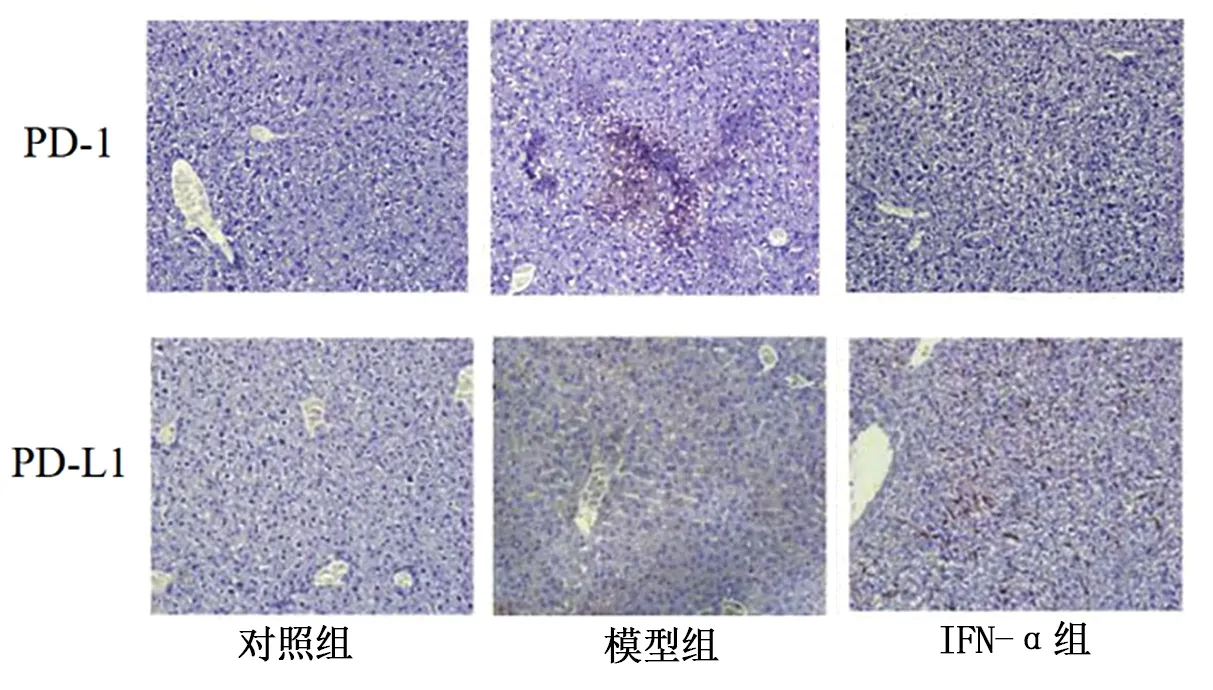
图3 各组小鼠肝组织PD-1和PD-L1表达情况比较(免疫组化×200)
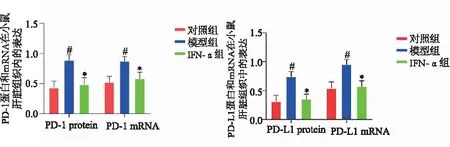
图4 各组小鼠肝组织内PD-1和PD-L1 mRNA及蛋白表达水平
3 讨论
HBV感染是各种肝病的重要发病原因,我国现存HBV感染者约有7 000万例,占全球1/3发病人数[10]。抗病毒治疗是清除HBV,促进疾病转归的主要手段。但临床实践发现,传统抗病毒治疗后,仍有相当一部分HBV感染患者有明显肝脏炎症和肝纤维化改变,疗效欠佳[11,12]。研究表明,HBV持续感染是肝硬化、肝细胞癌等终末期肝病的危险因素[13]。如何降低HBV复制水平,逆转肝纤维化进程,促进肝功能恢复是临床医生关注焦点。
本研究经小鼠尾静脉高压注射pAAV/HBV1.2制备HBV感染小鼠模型,HE染色和Masson染色分别观察肝组织形态学及纤维化改变发现,与对照组比较,模型组小鼠肝细胞排列异常,出现假肝小叶,细胞内大量炎症浸润,且肝组织内有大量蓝色或灰蓝色胶原纤维染色,且在肝功能指标上,模型组小鼠血清AST和ALT水平显著高于对照组,提示HBV感染可引起肝脏病理学及纤维化改变,进而影响肝功能。另外,测定血清HBV血清学和肝功能指标发现,对照组小鼠血清HBeAg、HBsAg及HBV DNA阴性,模型组小鼠血清中可检测出HBeAg、HBsAg及HBV DNA,以上结果提示HBV感染小鼠模型构建成功[14]。
干扰素一类具有抗病毒、抗肿瘤、免疫调节等多功能糖蛋白。既往研究多聚焦于IFN-γ在HBV感染中的作用,发现IFN-γ可通过增强HBV DNA复制水平参与慢性乙型肝炎发病过程[15]。与IFN-γ不同的是,IFN-α是聚集在9号染色体的Ⅰ型干扰素,几乎所有有核细胞均能在感染时分泌IFN-α。IFN-α2为IFN-α亚型之一。已有研究发现,IFN-α2可促进血清HBeAg和HBsAg转阴,具有一定抗病毒效果[16]。且有报道称,IFN-α可有效阻滞促炎因子生成,低肝纤维化小鼠体内炎症反应水平,同时通过调控相关通路信号传导,抑制肝纤维化形成[17]。本研究经HBV感染小鼠尾静脉高压注射pKCMvint.IFN-α发现,小鼠血清IFN-α水平显著升高,且与模型组比较,差异具有统计学意义,提示IFN-α上调模型构建成功[18]。通过与模型组比较发现,上调IFN-α表达后,HBV感染小鼠肝细胞损伤明显减轻,炎症浸润和肝纤维化改变减少,AST和ALT水平显著降低,提示IFN-α可减轻HBV引起的肝组织损伤和肝纤维化。同时在分析IFN-α对HBV复制和抗原表达影响发现,IFN-α组小鼠血清HBeAg、HBsAg及HBV DNA水平均显著低于模型组,进一步证实了IFN-α抗HBV作用,符合以往研究结果[19]。研究表明,PD-1及其配体PD-L1的上调在如CHB等病毒感染过程中有着重要作用[20]。有报道称,阻断PD-1/PD-L1途径可达到较高的HBV病毒应答率,并有抗肝纤维化作用[21]。本研究结果显示,模型组小鼠肝组织内PD-1和PD-L1蛋白及mRNA水平显著高于对照组,表明PD-1/PD-L1途径的激活参与HBV感染,符合以往研究结果[20],通过上调IFN-α水平发现,小鼠肝组织内PD-1和PD-L1蛋白及mRNA水平显著降低,提示IFN-α减轻HBV引起的肝组织损伤和肝纤维化的机制可能与阻断PD-1/PD-L1途径有关,这一结果为HBV感染治疗提供了更多选择。
综上所述,IFN-α可减轻HBV引起的肝组织损伤和肝纤维化,其机制可能通过PD-1/PD-L1途径阻止HBV DNA链延伸,进而终止病毒复制。
