青霉素V 钾的有机半合成及其抑菌效果表征
——推荐一个化学生物学综合实验
2023-11-02林诗妍张雨豪李翀王青青张慧君魏爱琳吴丽娜
林诗妍,张雨豪,李翀,王青青,张慧君,魏爱琳,吴丽娜
厦门大学化学化工学院,化学国家级实验教学示范中心(厦门大学),福建 厦门 361005
1 引言
青霉素是英国细菌学家亚历山大·弗莱明发现的世界上的第一种抗生素,属于β-内酰胺类抗生素(β-lactams)。青霉素让猩红热、白喉、淋病等许多曾经的不治之症得到了有效治疗[1,2],但是其大量使用引发了细菌的耐药性。为了得到活性更强、对耐药菌有破坏能力的青霉素,人们将青霉素裂解得到母核6-氨基青霉烷酸(6-Aminopenicilanic acid,6-APA),以其为原料用化学或生物化学等方法制成带有各种不同侧链的青霉素。这样合成的青霉素称为半合成青霉素,具有抗酶、耐酸、广谱抗菌性等优点。
青霉素的有机半合成及其抑菌效果表征是囊括知识点极广的综合性实验,目前国外仅有MIT等少数高校开设相关实验内容[3],国内关于该实验的教学仍为空白。青霉素主要可分为:青霉素G类;青霉素V类;耐酶青霉素;广谱青霉素;抗绿脓杆菌的广谱青霉素和氮咪青霉素等。其中青霉素V的钾盐具有很好的耐酸性,不易被胃酸破坏,是世界上第一个口服抗生素。为丰富该实验的教学意义并提高其可推广性,我们锁定了青霉素家族中较为常用的青霉素V钾,优化其合成方法,并设计化学生物学实验表征青霉素的抑菌效果。
为提高青霉素V钾产品的纯度,我们对MIT教学资料中青霉素有机半合成方法进行了改进。首先,引入循环冷凝装置使酰化反应由常温改为在恒定低温下进行,减少酰氯水解副产物的生成;其次,将硫酸酸化步骤温度条件由室温改为冰浴,防止产物的β-内酰胺环在高温下被破坏;最后,为彻底除去酰氯水解生成的羧酸等副产物,我们用无水乙醇洗涤粗产物,有效提高产品的纯度。以上改进使该实验具备经济、高效等优点,更适用于高校基础实验教学。
在青霉素的抑菌效果表征部分,我们采用微量二倍稀释法进行抑菌实验,既直观表征抑菌效果,又精确地确定最低抑菌浓度(MIC),也使学生掌握酶标仪的使用方法。同时,我们设计了青霉素的牛津杯抑菌实验,重现当年弗莱明观察到的抑菌圈,使青霉素的抑菌效果得到更直观生动的展示。为了进一步丰富该实验的教学意义、将科研成果融入教学,我们使用可标记细菌细胞壁的小麦胚芽凝集素(WGA)荧光标记结合荧光共聚焦显微镜,考察青霉素对细菌细胞壁的破环,让学生从机制上了解青霉素的抑菌作用,激发学生的科研热情。
本实验融合了有机化学和化学生物学等多学科知识,让学生体会到学科的交叉融合和前沿科学研究的魅力。该实验涉及酰化反应、最低抑菌浓度、抑菌圈、荧光标记等多个知识点,综合性强,有利于学生视野的拓展;其次,在实验过程中也能使学生熟练掌握连续萃取、pH控制、分离纯化等基本有机合成操作,以及微量二倍稀释法测定MIC和牛津杯法抑菌圈实验等生物实验操作;此外,让学生学习使用酶标仪、荧光共聚焦显微镜等新型仪器,感受仪器进步在科学研究上的推动作用。
2 青霉素V钾有机半合成
2.1 合成机理
青霉素V钾的合成涉及到一个重要的有机反应,即酰化反应(图1):以青霉素母核6-APA (1)为起始原料,将其溶解于碳酸氢钠的丙酮/水溶液,使其转变为羧酸钠盐(2)。随后,在循环冷凝装置控制的5-10 °C低温条件下[4],利用苯氧乙酰氯与化合物2的氨基发生酰化反应,即可得到6α-(苯氧乙酰基氨基)青霉素钠盐(3)。
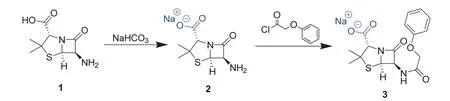
图1 青霉素V钾合成的酰化反应
盐和羧酸之间转化的过程中涉及两次萃取操作,以及一次用冷水清洗后的分液、除水操作。首先萃取出水相部分,在冰浴下通过酸化钠盐(3)使其转变为青霉素V (4)[2](图2)。进一步萃取出有机相部分,加入有机钾盐使青霉素V转变为最终产物青霉素V钾(5)。

图2 青霉素V钾的合成
最后,用少量丙酮洗涤产物以除去水等杂质,无水乙醇洗涤产物除去苯氧乙酰氯的水解产物苯氧乙酸。
在本实验中安装循环冷凝、萃取、过滤装置的步骤和保留水相或有机相的连续两次的萃取操作,锻炼了学生基础有机实验的操作技能。
2.2 器材与试剂
仪器:磁力搅拌器(Heidolph MR Hei-Teo)、低温冷却液循环泵(庚雨仪器DLDB-5/20)、分析天平、红外光谱仪(Thermo Nicolet IS10)、核磁共振谱仪(AVANCE III HD 500MHz)、抽滤装置。
试剂:6-氨基青霉烷酸、苯氧乙酰氯、2-乙基己酸钾(上海阿拉丁生化科技股份有限公司,AR),碳酸氢钠、乙酸正丁酯(国药集团化学试剂有限公司,AR)。
2.3 实验步骤
投料:用橡胶管将循环冷凝装置与100 mL双层夹套烧杯相连,设置温度为10 °C,双层夹套烧杯中注水并放置在磁力搅拌器上。用夹子将50 mL圆底烧瓶竖直固定在双层夹套烧杯中,搭建如图3所示的装置。搅拌下依次加入碳酸氢钠(1.05 g)、丙酮(3 mL)和水(9 mL),搅拌10 min。在溶液中加入6-APA (0.540 g,0.0025 mol);
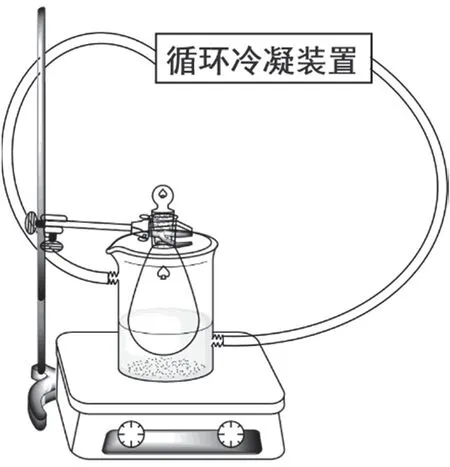
图3 酰化反应装置
酰化:向1 mL丙酮中加入苯氧乙酰氯(0.45 mL,0.00325 mol),在6-APA溶液中缓慢逐滴加入酰氯-丙酮溶液,10 °C下搅拌20 min;
萃取:将反应混合物倒入250 mL的分液漏斗中,用3 × 6 mL室温乙酸正丁酯萃取后分液,收集下层水相于50 mL锥形瓶,弃去上层有机相;
酸化:在冰浴冷却条件下,往水相中加入6 mL冰浴的乙酸正丁酯,用冰浴冷却过的5 mol·L-1硫酸酸化反应液至pH = 2.0;
反萃取:将溶液倒入125 mL分液漏斗中,分出水层弃去,酯层用2 × 6 mL冷水洗涤后分液。收集上层有机相于50 mL锥形瓶,弃去下层水相。使用无水硫酸钠干燥15-30 min,过滤;
转变为钾盐:滤液收集于50 mL锥形瓶中,在搅拌下加入2 mL 25%的2-乙基己酸钾的丁醇溶液;
后处理:用少量丙酮清洗,抽滤;用12 mL的无水乙醇清洗,抽滤后自然风干过夜。收集青霉素V钾产品,产量为0.1744 g,总产率为32.26%;
仪器表征:通过红外光谱和核磁共振氢谱对产物进行表征。
2.4 结果与讨论
2.4.1 青霉素V钾的红外光谱表征
通过红外光谱分析对青霉素V钾产物结构进行表征,得到的红外光谱如图4所示。其中合成产物(改进前)是依照MIT教学实验方案所得青霉素V钾[3],合成产物(改进后)是依照步骤2.3所得青霉素V钾。商品试剂、改进前后青霉素V钾产物中的酰胺C=O键的伸缩振动特征峰位于~1680 cm-1,β-内酰胺上C=O键的伸缩振动特征峰位于~1774 cm-1,芳香环上C―H的伸缩振动特征峰位于~3040 cm-1,与文献中青霉素红外光谱的特征峰一致[5]。
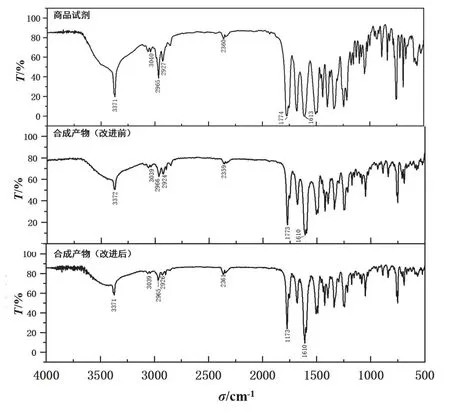
图4 商品试剂与合成青霉素V钾产物红外光谱对比
2.4.2 青霉素V钾的核磁表征
以DMSO为溶剂时青霉素V钾商品试剂的1H核磁数据如图5所示:1H NMR (400 MHz, DMSOd6):δ8.42 (d, 1H,J= 8.0 Hz), 7.72 (m, 2H), 6.92 (m, 3H), 5.41 (m, 2H), 4.62 (d, 2H,J= 2.2Hz), 3.88 (s,1H), 1.52 (s, 3H), 1.46 (s, 3H)。与文献中青霉素的核磁共振氢谱数据一致[6]。
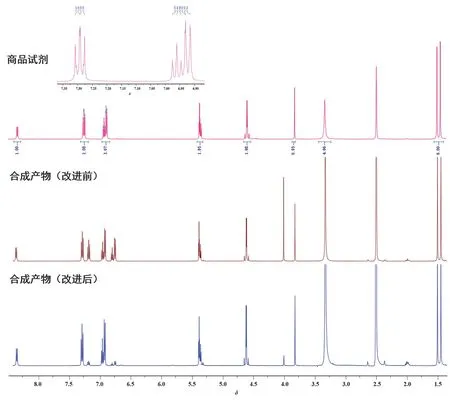
图5 商品试剂与青霉素V钾合成产物核磁共振氢谱图对比
改进前青霉素V钾的合成产物核磁共振氢谱如图5所示,与商品试剂氢谱比对在δ7.0左右多了两个杂峰,可能来自底物苯氧乙酰氯水解产生苯氧乙酸。为了除去副产物,我们做了以下改进:用循环冷凝装置使酰化反应在10 °C下进行,减少酰氯水解副产物的生成;通过查阅资料我们发现,常温下苯氧乙酸在无水乙醇中有一定的溶解度,而青霉素V钾几乎不溶。为彻底除去酰氯水解等副产物,我们用无水乙醇洗涤粗产物。改进后青霉素V钾的合成产物核磁氢谱图中δ7.0左右的两个杂峰基本已被消除,可判定其基本为青霉素V钾纯品。
3 青霉素V钾的抑菌效果表征
3.1 青霉素抑菌原理
青霉素是一种β-内酰胺类抗生素,其抗菌效果主要来源于其结构中的β-内酰胺环。在细菌细胞壁合成的转肽阶段,由于青霉素的β-内酰胺环与细胞壁肽聚糖单体五肽尾末端中的D-丙氨酰-D-丙氨酸结构相似,可与后者竞争转肽酶的活性中心[7](图6),阻止两个肽聚糖单体之间肽桥的形成,造成细菌细胞壁的缺损,从而起到杀死细菌的作用。由于哺乳动物的细胞没有细胞壁,青霉素在杀死细菌的同时,不损害人体自身细胞[8]。
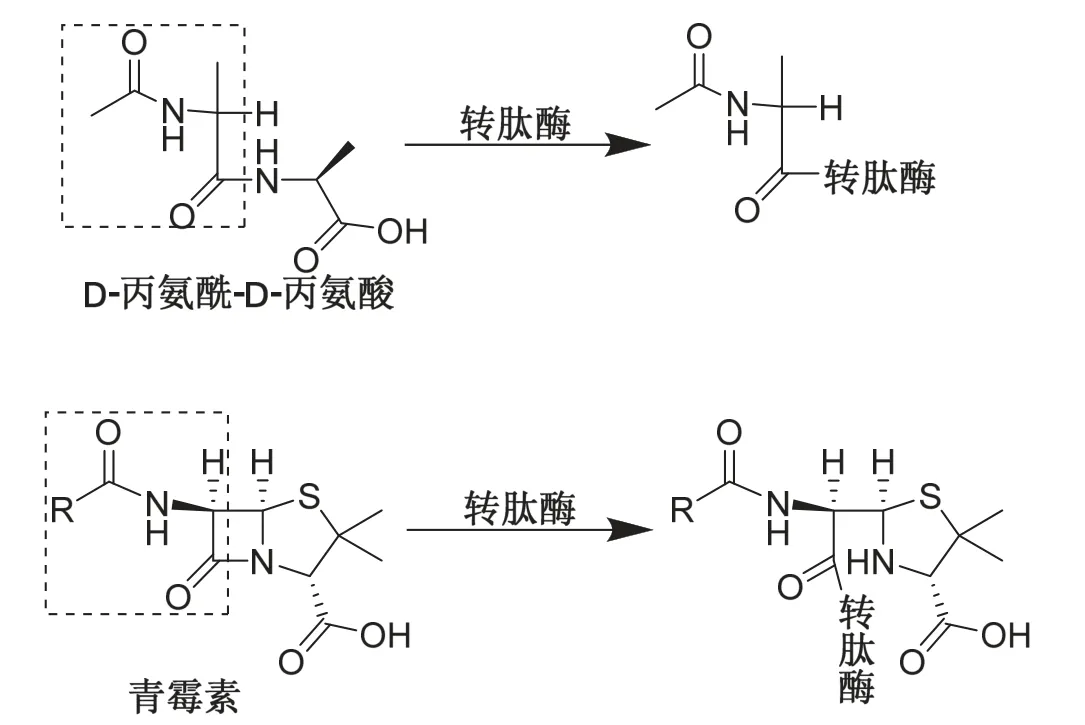
图6 青霉素的抑菌原理:与肽聚糖中的D-丙氨酰-D-丙氨酸竞争转肽酶活性中心
3.2 器材与试剂
仪器:酶标仪(SpectraMax iD5)、涡旋仪(SCILOGEX MX-F)、酶标板、牛津杯(Tansoole)、移液枪、恒温培养箱(DHP-9162)、4 °C 冰箱、涡旋仪(SCILOGEX MX-F)、小型台式冷冻离心机(eppendoff 5424R)、摇床(SUKUN SKY-2102C)。
材料:金黄色葡萄球菌CICC 23656减毒株。
试剂:牛肉膏蛋白胨培养基(LB培养基,上海生工)、商品化青霉素V钾(上海生工)、青霉素V钾药片(哈药集团)、无水乙醇(国药集团化学试剂有限公司,AR)、1 × HBSS (Hank’s平衡盐溶液,0.22 μm滤膜过膜,上海生工)、WGA荧光染料(1 × HBSS配制,1 mg·mL-1,赛默飞世尔科技)。
以下实验均采用无菌操作。
3.3 微量二倍稀释法测定最低抑菌浓度
3.3.1 实验步骤
菌液配制:挑取3个金黄色葡萄球菌(Staphylococcus aureus, S. aureus)单菌落于LB培养基中,250 r·min-1、37 °C振荡培养12 h (~109CFU·mL-1);用LB培养基以10倍梯度稀释法稀释至终浓度~106CFU·mL-1;
配制青霉素V钾溶液:① 取青霉素V钾片1片(含青霉素V钾236 mg),超声溶于2.36 mL超纯水中,得到浓度为100 mg·mL-1的原液;② 取商品化青霉素V钾100 mg溶于1 mL超纯水中,得到浓度为100 mg·mL-1的原液;③ 取半合成青霉素10 mg溶于1 mL超纯水中,得到浓度为10 mg·mL-1的原液。根据具体实验需要,将抗生素原液用LB培养基以10倍梯度稀释法稀释至所需浓度(本实验中将三组青霉素稀释至1 μg·mL-1)。
最低抑菌浓度(MIC)的测定:最低抑菌浓度是指药物抑制微生物生长的最低浓度[8]。采用微量二倍稀释法确定青霉素V钾的MIC,如图7所示:(1) 在酶标板的每个孔中加入LB培养基75 μL;(2) 在每排的第1孔加配好的青霉素V钾溶液75 μL,然后对青霉素V钾溶液进行二倍稀释。即第1孔中加入青霉素V钾溶液后用移液枪充分吹吸混匀(至少三次以上),然后吸取75 μL加入第2孔再充分吹打,照此重复直至第10孔,第10孔中吸出75 μL弃去;(3) 在第1孔至第10孔中加入稀释好的菌液75 μL,吹吸混匀;(4) 在同一块板上的第11孔做阴性对照,即仅加LB培养基150 μL不加菌液;第12孔做阳性对照,即仅加150 μL菌液不加青霉素V钾溶液。
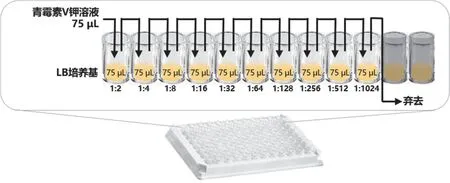
图7 微量二倍稀释法确定最低抑菌浓度
每种青霉素重复上述操作3次,分别使用3组菌液做平行实验。加样完成后,酶标板于37 °C摇床中孵育12 h,在酶标仪中选择600 nm作为测定波长。(酶标板中,第1孔至第10孔青霉素V钾浓度分别为0.250、0.125、6.25 × 10-2、3.13 × 10-2、1.56 × 10-2、7.81 × 10-3、3.91 × 10-3、1.96 × 10-3、9.77 ×10-4、4.88 × 10-4μg·mL-1,第11号孔作为无菌阴性对照,第12号孔作为有菌阳性对照,如图8所示)。
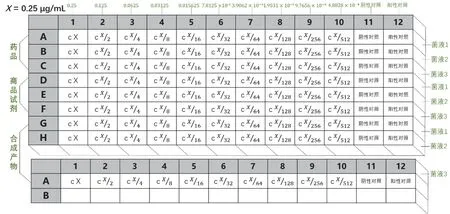
图8 药品、商品试剂和合成青霉素V钾在酶标板中的浓度分布
3.3.2 结果与讨论
振荡孵育12 h后,从摇床中取出酶标板(图9),肉眼可观察到第5列与第6列之间存在明显的浑浊度差异,说明细菌在第5列左右开始生长,此前浓度的青霉素均无细菌生长,抑菌效果较强。
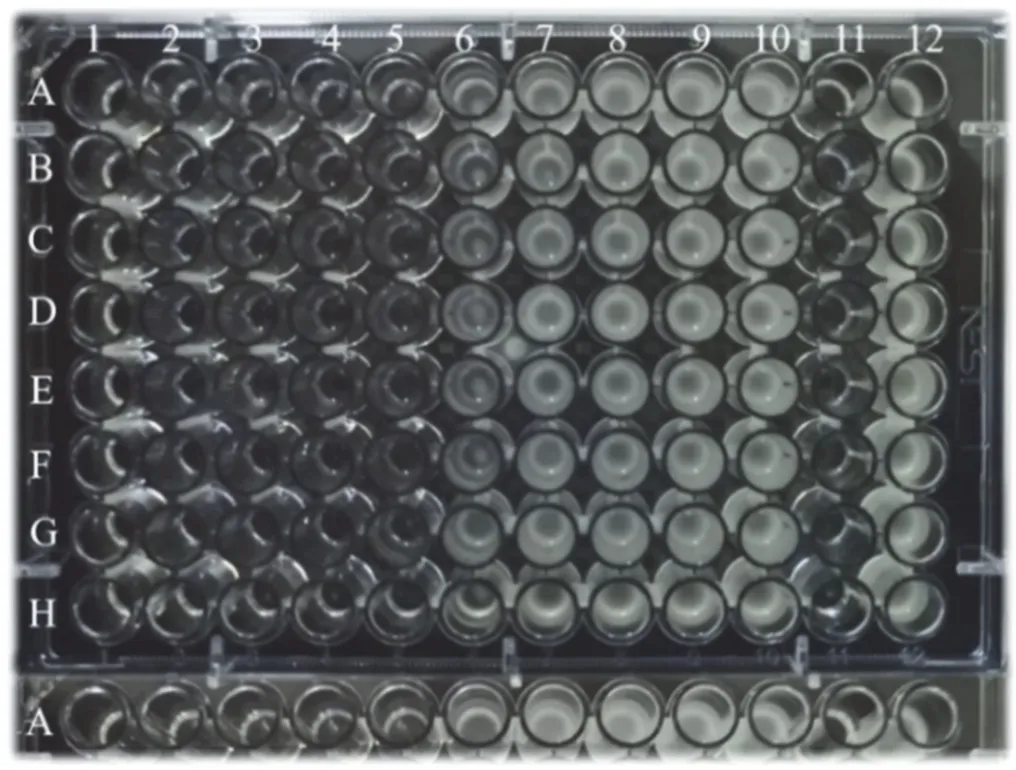
图9 微量二倍稀释法确定青霉素V钾MIC
用酶标仪进行抑菌效果的精确测定,酶标板中各孔的吸光值如图10热图所示。药品组、商品试剂组和合成产物组的OD600值均在第5列开始有所增加,说明合成的青霉素V钾与商品化药品具有相似的抑菌效果,进一步证明了该合成产物的纯度。三组青霉素V钾的MIC在1.56 × 10-2-3.13 × 10-2μg·mL-1之间。

图10 药品、商品试剂和合成青霉素V钾的抑菌效果的热图展示
3.4 牛津杯法抑菌实验
3.4.1 实验步骤
牛津杯灭菌:提前准备四个牛津杯浸泡于无水乙醇中灭菌;
青霉素V钾配制:将3.3.1中配制好的1 μg·mL-1青霉素V钾稀释至5 × MIC、10 × MIC、20 ×MIC;
指示菌悬液配制:挑取S. aureus单菌落于LB培养基中,250 r·min-1、37 °C振荡培养12 h (~109CFU·mL-1);用LB培养基以10倍梯度稀释法稀释至终浓度~106CFU·mL-1;
双层平板制备:取平板倾注LB培养基10 mL,使其在平板内均匀摊布,放置于水平台面上凝固,作为底层。另取4.5 mL提前融化的LB培养基冷却至50 °C左右,加入0.5 mL稀释好的指示菌悬液,混合均匀后,倒入平板中,使其在底层上均匀摊布,作为菌层。放置在水平台上冷却。将牛津杯从无水乙醇中取出并风干。用镊子将4个无菌的牛津杯轻轻放入培养基平板中,呈正方形排列,如图11所示;

图11 牛津杯在培养基平板中的排列
牛津杯加样:牛津杯中分别加入5 × MIC、10 × MIC和20 × MIC青霉素V钾溶液和LB培养基各0.20 mL;
菌液扩散及指示菌培养:将培养基平板放置于4 °C冰箱中使青霉素V钾溶液扩散12 h,再放置于37 °C恒温箱中培养12 h[4],观察结果。
3.4.2 结果与讨论
青霉素V钾的牛津杯抑菌情况如图12所示,经过测量,青霉素V钾浓度为5 × MIC、10 × MIC、20 × MIC的牛津杯抑菌圈大小分别为14.30、17.66、21.45 mm,阴性对照LB培养基的牛津杯未出现抑菌圈。已知:抑菌直径 ≥ 20 mm,为极度抑菌;15 mm ≤ 抑菌直径 ≤ 20 mm,为高度抑菌;10 mm ≤抑菌直径 ≤ 15 mm,为中度抑菌;抑菌直径 ≤ 10 mm为无抑菌作用[9]。因此,浓度为5 × MIC的青霉素V钾溶液具有中度抑菌作用;浓度为10 × MIC的青霉素V钾具有高度抑菌作用;浓度为20 × MIC的青霉素V钾溶液具有极度抑菌作用。

图12 不同浓度青霉素V钾的抑菌圈测定
3.5 青霉素作用机理的Alexa Fluor 633-WGA荧光标记结合共聚焦荧光显微镜表征
3.5.1 WGA荧光标记原理
小麦胚芽凝集素(WGA)是广泛应用于细胞生物学的凝集素。WGA识别糖受体尾N-乙酰葡萄糖胺,倾向于与其二聚体和三聚体结合[10]。细菌细胞壁肽聚糖、几丁质、软骨糖胺聚糖和糖脂也能与WGA结合,当荧光染料与WGA耦联时,可用于细菌细胞壁的标记。
3.5.2 实验步骤
Alexa Fluor 633-WGA (flWGA)染色:分别取27 μL微量二倍稀释法实验中4号孔和12号孔的菌液至1.5 mL灭菌EP管中,用1 × HBSS洗涤一次(4 °C、12000 g、8 min),按合适的染色比例进行flWGA染色(预实验染色比例为1.33 × 106CFU·μL-1,即1 μL 1 mg·mL-1flWGA染1.33 × 106CFU的菌),建议使用20 μL 1 mg·mL-1flWGA;37 °C、250 r·min-1避光振荡培养1 h 30 min;
洗涤:染色完成的菌液用1 × HBSS洗涤两次(4 °C、12000 g离心8 min),最终用1 × HBSS调节浓度约为109CFU·mL-1;
固定:以上菌液经4 °C、12000 g离心8 min,相同体积的4%多聚甲醛(PFA) 37 °C水浴30 min;
重悬:细菌固定完成后4 °C、12000 g离心8 min,1 × HBSS洗涤一次,后用相同体积重悬,置于4 °C冰箱保存;
制片:在载玻片中滴入8 μL重悬菌液,盖上盖玻片;
观察:使用荧光共聚焦显微镜成像。设置激发光源波长为632 nm,荧光通道波长为647-662 nm,使用100 ×油镜作为物镜。
3.5.3 结果与讨论
细胞壁有固定细胞外形和提高机械强度,使细菌免受渗透压等外力损伤的作用[11],为验证青霉素通过阻碍细菌细胞壁合成的抑菌机理,我们对荧光共聚焦成像结果进行分析:如图13a,未受青霉素作用的金黄色葡萄球菌呈典型的葡萄串状排列,荧光场显示flWGA将细菌细胞壁染成红色,完整地包裹在细胞外围。MIC浓度的青霉素作用12小时后(图13b),有些细菌细胞壁部分残缺,缺少细胞壁机械固定作用的细菌明显溶胀,细菌体积比正常菌体明显增大在荧光共聚焦显微镜下显示出红色的残影。
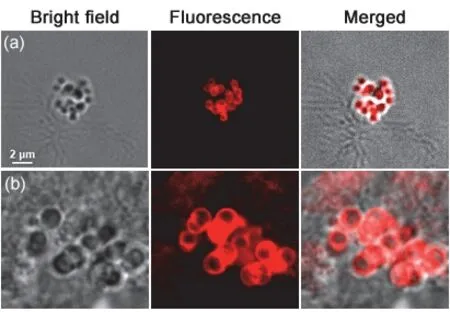
图13 荧光共聚焦显微镜表征青霉素作用细菌细胞壁完整性
通过对青霉素作用的细菌细胞壁的荧光表征,我们验证了青霉素的杀菌机理为阻碍生长期细菌的细胞壁合成,从而影响细菌细胞壁的完整度,使细菌因缺少细胞壁的机械保护作用而溶胀破碎。
4 实验安排及建议
(1) 本实验所需要的时间为12课时,其中青霉素V钾的有机半合成需要6个课时完成,微量二倍稀释法实验和牛津杯抑菌实验需要3个课时完成,青霉素作用机理的flWGA荧光标记结合共聚焦荧光显微镜表征作为展示实验需要3个课时完成。建议将本实验作为学生的综合实验。
(2) 考虑到细菌培养和培养基配制的时间要求,建议教学组提前准备好指示菌菌液及LB培养基。学生完成微量二倍稀释法实验和牛津杯抑菌实验后,教学组负责将酶标板和固体培养基由37 °C恒温环境转移至4 °C冰箱中保存,待学生查看实验结果。
(3) 为节约实验耗材与方便学生实验操作,建议微量二倍稀释法测定最低抑菌浓度在实际教学中可适当简化实验步骤,如学生仅需完成商品试剂和合成产物的MIC测定。
(4) 考虑到flWGA荧光标记结合共聚焦荧光显微镜表征实验操作对本科生要求较高,建议将本部分以展示实验的形式开设,即学生完成制片,共聚焦荧光显微镜的操作由教师展示并和同学们一起观察成像结果。
(5) 实验前学生需要查阅青霉素的发展历史及抑菌作用机理。要求学生学习巩固大学三年级学习的酰化反应机理和荧光共聚焦显微镜的使用。
(6) 实验主要针对大学四年级化学生物学专业学生开设,每2人一组进行实验。要求组内成员合理分工,协作完成实验。实验也可作为综合拓展实验为化学中心科学实验班及化学专业高年级学生开设。
(7) 实验完成后,建议实验报告以研究型论文格式提交,要求对实验结果进行讨论和总结。
(8) 若以拓展实验的形式开设,学生在实验中可自行选择合成青霉素的侧基,以合成不同类型的青霉素;自行设计青霉素的浓度,以确定最低抑菌浓度和表征抑菌效果。
5 结语
对标国家建设一流课程的“两性一度”(高阶性、创新性和一定的挑战度)要求,我们引进MIT实验课程“Synthesis and Biological Testing of Penicillins”,对其进行了改进和拓展。我们通过改进实验步骤提高了有机合成部分青霉素产品的纯度,设计化学生物手段表征青霉素的抑菌效果和抑菌机制,该实验的流程如图14所示。希望能更有效推广这个科学内涵丰富且极具展示度的综合性实验。
图14 青霉素V钾有机半合成及其抑菌效果表征
该实验综合有机化学和化学生物学的实验原理和操作方法,是集化学合成与生物表征为一体的综合性强的实验。该实验所涉及的综合实验技术和前沿知识将帮助学生通过不同的视角理解化学生物学这个交叉学科。
6 创新性
1) 引入循环冷凝装置控制低温,冰浴条件下酸化和无水乙醇后处理,提高青霉素产品纯度。
2) 引入微量稀释法、牛津杯抑菌法表征青霉素抑菌效果,flWGA荧光标记结合荧光共聚焦显微镜展示青霉素抑菌机理。
3) 模拟探索性科学研究过程,实现学科交叉融合,激发学生科研热情。
致谢:感谢厦门大学化学国家级实验教学示范中心周金梅高级实验师及有关技术人员的帮助和指导。
