循环伏安法原理的分析与讨论
2023-11-02郭慧林程永亮李延郭晓辉
郭慧林,程永亮,李延,郭晓辉
西北大学化学与材料科学学院,西安 710127
循环伏安(Cyclic Voltammetry,CV)法是一种暂态电化学测试方法,是获得电化学反应快速定量数据的一种最常用的电分析技术。该方法不但可以提供发生在电极界面上的异相电子传递过程动力学和热力学信息,而且可为深入了解电极/界面结构、电势分布及电化学反应机理等提供有价值的信息。然而,目前绝大多数仪器分析与实验教材[1,2]中仅将CV描述为:在工作电极与参比电极之间施加一个三角波型的电势信号,并同时记录工作电极上获得的电流与施加电势之间的关系曲线。这种描述只简单陈述了在实践该方法时研究者需要给电极施加及记录的一些参数,而未对上述过程中电极可能发生的变化(物理的和化学的)及电流信号与所施加电势之间的关系做出深入介绍。此外,多数高校并未开设关于电化学原理的课程,使学生在学习CV法时容易产生很多疑惑和不解。针对上述问题,本文尝试在不涉及复杂的电极过程动力学的前提下,分析当一个三角波电势信号作用于电极表面时,电极/溶液界面处电活性物质浓度的变化,以及由此引起的响应电流信号的特点,扫描速度、电活性物质浓度等对CV曲线特性的影响规律及峰电流、峰电势、半波电势等参数的正确读取。最后,还分析了获得稳定的、可重现的CV曲线的必要条件,并进一步介绍了CV法的应用以及其蕴含的哲学原理。
1 电极反应及特点
1.1 电极反应与电极过程分析
电极反应是指在电极/溶液界面(也称电极表面)处发生的有电子参加的氧化还原反应。通常将电流通过电极/溶液界面时所发生的一系列变化的总和,统称为电极过程。因此,电极过程不是一个简单的化学反应,而是由一系列性质不同的单元步骤以串行或平行方式组成的复杂过程。一般情况下,电极过程由若干个单元步骤串行组成(图1)。在某些情况下,其实际历程可能更复杂。此外,电极过程中每个单元步骤都需要一定的活化能,其大小取决于其自身的特性。由于活化能不同,各步骤反应速率也不同。然而,当几个步骤依次进行时,在稳态条件下,各步骤的实际速率应当相等,即整个电极过程的速率将由最慢的步骤决定,并控制整个电极过程的反应速率。

图1 电极过程的基本历程
这里重点分析物质的传质(也称传递)对电极反应的影响规律。物质的传质方式主要有对流、扩散及离子在电场下的电迁移三种形式。在电化学体系中,虽然这三种传质方式总是同时存在,但其过程是一个连串过程(图2),所以,在一定条件下起作用的往往只有一种或两种传质方式。例如,不搅拌溶液,在离电极表面较远处,由于自然对流而引起的液流速率往往比离子的扩散速率和离子淌度大几个数量级,此时扩散和电迁移的作用可以忽略不计;而在电极表面附近的薄层液体中,液流速度一般很小,此时传质方式主要是扩散和电迁移[3]。如果溶液中存在大量不参加电极反应的“支持电解质”(其浓度一般是在电活性物质的10-100倍),则离子的电迁移将大大降低,此时则可以认为电极表面附近薄层液体中仅存在扩散传质;当连通电化学反应回路时,如果扩散传质速率远小于电子转移反应速率,此时整个电极过程的速率将由扩散传质过程控制。
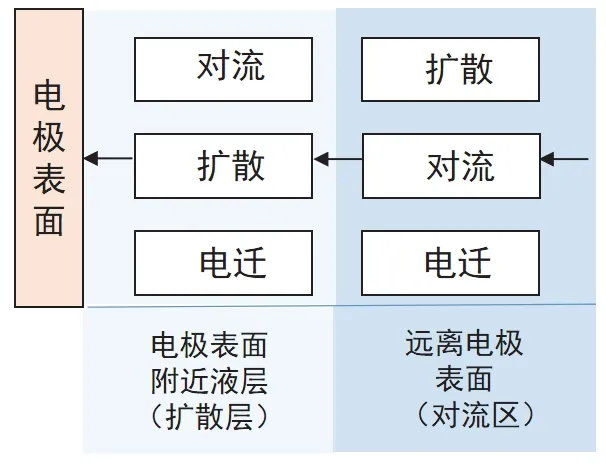
图2 液相传质的过程分析
1.2 电极过程的特点
电极反应与一般的均相氧化还原反应不同,其差异主要表现在:① 分区进行。电极反应中的电子可以通过电极向外电路传递,所以氧化和还原反应可以分别发生在阳极和阴极。电极表面作为“反应场所”,起着类似于异相催化剂表面的作用。② 电极表面存在双电层和表面电场。与一般催化剂存在的表面力场不同,人们可以在一定范围内改变电极电势以实现对电极反应活化能和反应速度(这里用速度是因为:改变电极电势不但可以影响反应的快慢,甚至可以改变反应的方向)的控制,即可以在一定范围内人为控制电极表面的“催化活性”,因此电极过程是一种特殊的异相氧化还原反应。图3为均相与异相电子转移反应示意图[4]。由图3可以看出,电极上电子能量的高低可以通过电势大小来控制;当电子能量适宜时即可引发电子转移过程。

图3 均相(i)与异相(ii)电子转移反应示意图
2 CV法的基本原理与分析
CV是研究体系电化学性质的一种暂态方法。通过分析CV曲线,可获得用于研究电极过程、反应机理及电极反应动力学性质的重要参数,如阴阳极峰电势Epc和Epa及其差值ΔEp和峰电流的比值ipc/ipa。
2.1 CV的测量原理
CV的测量原理是使电势在工作电极上作三角波扫描的同时,即电势以给定的速率υ从起始电势E0扫描到终止电势Eλ后,再以相同速率反向扫描至E0,并记录相应的电流-电势(i-E)曲线,也称伏安曲线(图4A),λ为电势换向时间。电势与时间的关系可表示为:
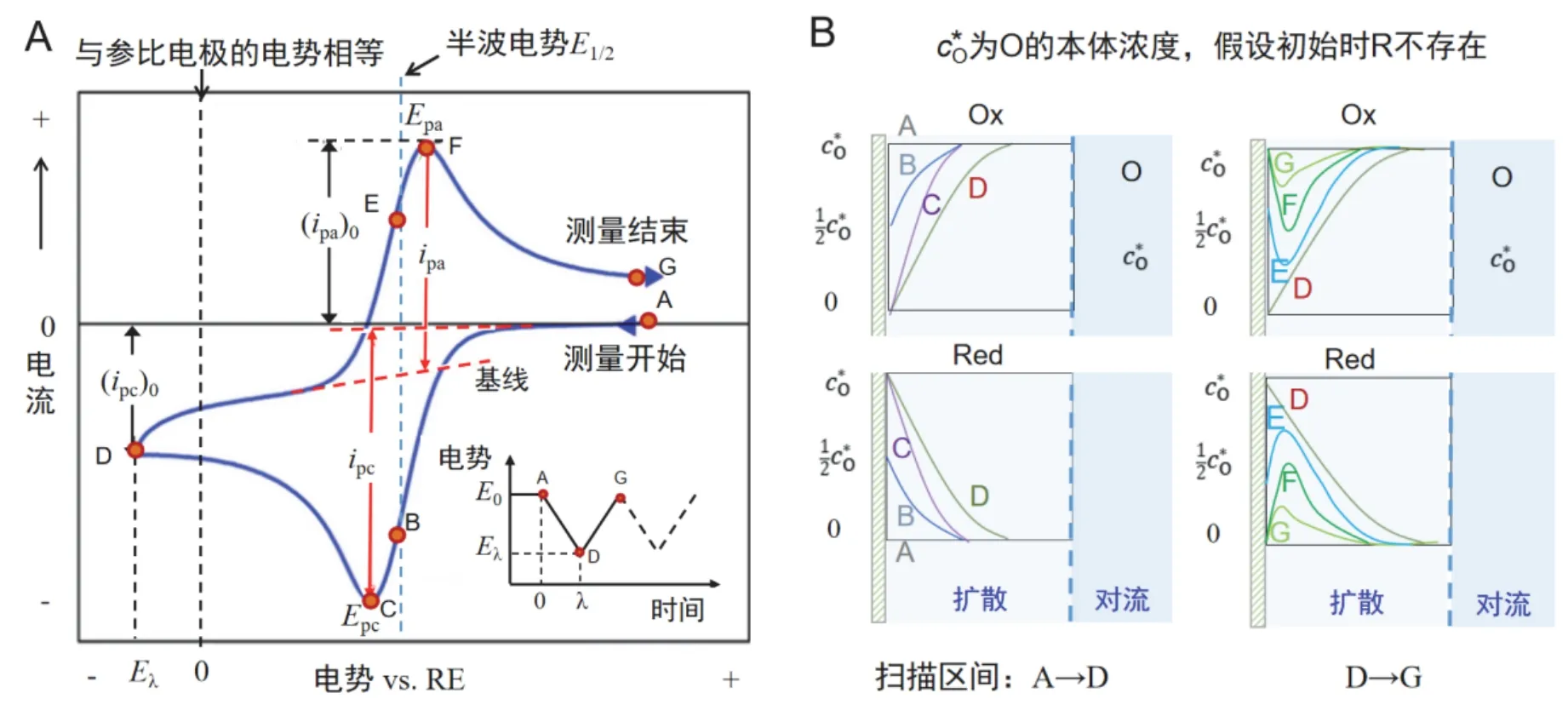
图4 (A) 典型的CV曲线(插图为电势-时间曲线);(B) 电势扫描过程中电极表面处氧化还原电对的浓度变化示意图(假设初始时Red的浓度为0)
式中,υ为扫描速度,t为扫描时间。在一次三角波电势扫描过程中,完成一个氧化和还原的循环过程,故称为循环伏安法。需要说明,伏安曲线有两种记录习惯,即IUPAC (International Union of Pure and Applied Chemistry,国际纯粹与应用化学联合会)习惯和US (United States,美国)习惯。IUPAC习惯是将阳极电流记为正电流,阴极电流为负电流。而US则定义阴极电流为正电流。读者在看图时首先要明确其采用的记录习惯。本文采用IUPAC习惯。
2.2 典型的CV曲线特点及成因分析
图4A所示为典型的CV图,其曲线呈“鸭嘴”型[4]。当电势由正向负(A → D)扫描时,体系发生还原反应,CV图中出现一个阴极峰,对应于氧化态物种在电极表面的还原;电势由负向正(D → G)扫描时,体系发生氧化反应,CV图中出现相应的阳极峰,对应于还原态物种的氧化。那么,为什么会得到一个“鸭嘴”型的CV曲线呢?这里以可逆的单电子反应(Ox + e-→ Red)为例进行说明,并假设氧化态Ox和还原态Red都是溶解态的,且初始时体系中只有Ox没有Red。任一时刻可逆电极电势满足Nernst方程,即
其中E、EӨ、EӨ’分别为氧化还原电对的电极电势、标准电极电势和形式电势,R为气体常数,T为热力学温度,n为参加电极反应的电子转移数,F为Faraday常数,as和cs为物质在电极表面处的活度和浓度。
当电势由正向负扫描(A → D)时,随着电势的负移,电极表面处Ox被还原为Red,Ox浓度逐渐降低(图4B左上),Red的浓度逐渐增加(图4B左下)。当电势扫描至C点时,电流出现极大值,此时电极表面处Ox的还原速率达到最大,即发生完全浓差极化的扩散速率赶不上Ox的还原速率;当电势继续由C扫描至D点,依旧维持为0,此时扩散层厚度向纵深处发展(扩散层厚度增加),致使Ox的扩散速率变缓,故而阴极电流下降。当到达D点后,电势开始回扫,随着外加电势的正移,电极表面还原生成的Red重新被氧化为Ox,使增加,减少。电势扫描过程中Ox和Red的浓度变化直观动态图可参看有关网站[5]。图4A中B点和E点对应根据Nernst方程,此时电极电势E对应于CV图中两个峰(C和F)的半波电势E1/2,这也可直接用于估算可逆电子转移反应的形式电势EӨ’。
需要注意的是,与阳极峰电流ipc的测定相比,CV曲线中阴极峰电流ipc的测定要更为方便,这是因为电势由正向负扫描是从法拉第电流为零的电势开始的,因此ipc可根据零电流基线得到。而在反向扫描时,Eλ处的阴极电流尚未衰减到零,所以不能选择此处的电流作为零电流基线。这是因为在电势换向时,阴极反应已经达到了完全浓差极化状态,此时的阴极电流为暂态的极限扩散电流id,符合Cottrell方程[6],的规律衰减。所以在反向扫描最初的一段电势范围内,Red的重新氧化反应尚未开始,此时电流仍为阴极反应的衰减电流。这种情况下,可以选择阴极电流衰减曲线的延长线(图4A中的虚线)作为电流基线测定ipa。另外,氧化-还原过程中双电层的存在,使得峰电流一般不是从零电流线测量的(ipc)0和(ipa)0,应扣除背景电流。
综上所述,在CV电势扫描过程中,伴随着Ox和Red表面浓度的“此消彼长”,对应的电流信号呈现“鸭嘴”形状。电活性物质在电极表面处的扩散(分别为靠近和远离)导致了氧化峰和还原峰的分离(ΔEp≠ 0)。此外,受扩散传质的影响,物质的表面浓度与其扩散系数有关。
2.3 CV曲线的数学分析
电化学中常用电流i来描述反应速率r,两者之间的关系为i=nFr。CV图中电势由正向负扫描时的电流i(必须是第一次循环的)可用Randles-Sevčik方程表示[6-9]:
可以看出,峰电流ip(A)的大小与电极面积A(cm2)、电子转移数n、反应物浓度(mol·cm-3)、扩散系数D(cm2·s-1)的平方根、扫描速度υ(V·s-1)有关。对于给定的可逆电极体系,其动力学数据一般要由第一圈CV曲线确定,CV曲线上任意一点的电流,包括峰电流ipc(或ipa)都正比于若已知扩散系数DOx,可以通过式(4)中的比例系数计算得到反应得失的电子数;或由ipc∝对反应物浓度进行定量分析。关于i∝υ1/2可以解释为[6]:υ越大,达到峰电势所需要的时间越短(图5),此时的暂态扩散层厚度越薄,扩散速率越大,因此i越大。
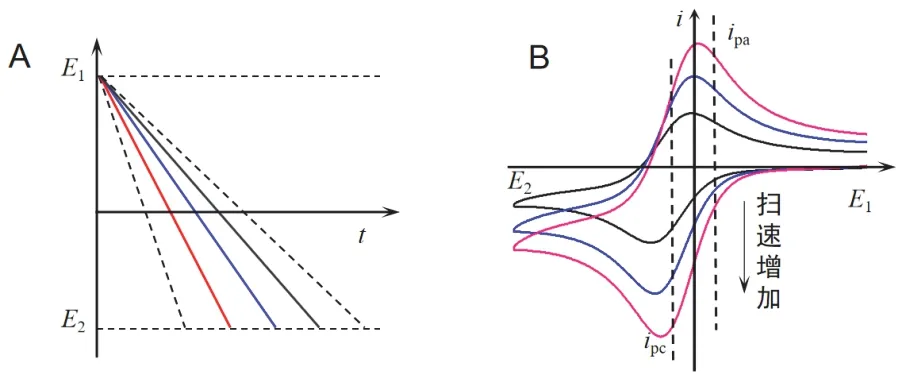
图5 ip与υ的关系
对于可逆的Nernst电极反应体系,ipa与ipc基本相等,即ipa/ipc≈ 1;Epc与Epa,及其差值ΔEp与扫描速度υ无关,ΔEp与换向电势Eλ略有关系但总是满足[6,8,9]:
形式电势EӨ’则位于Epc和Epa中间,即
然而,对于大多数电极反应而言,由于其反应的不可逆性或反应涉及不可逆步骤,其CV曲线形状通常会偏离“鸭嘴”型。图6为几种不同可逆性电极体系的CV图。(注意:与热力学上电极的可逆性概念有所不同,电极反应的可逆性是一个动力学概念,用于判断电极反应进行的难易程度,也可用于表示电极反应的去极化作用的能力。换句话讲,就是当电流通过电极时,在金属/溶液表面的电子转移步骤速率足够快(如扩散步骤作为控制步骤)时,电极反应在动力学上基本满足电化学平衡条件。)可以看出,对于准可逆体系,其|ipc| ≠ |ipa|,|ΔEp|不仅比可逆体系的大,且随扫描速度υ的增大而增大。通常将|ΔEp|及其随υ的变化情况作为判断电极反应是否可逆和不可逆程度的重要判据。如果|ΔEp| ≈且不随υ变化,说明反应可逆;如果且随υ增大而增大,则反应不可逆,且|ΔEp|偏离的程度越大,反应的不可逆程度就越高。当电极反应完全不可逆时,其逆反应非常迟缓,正向扫描产物来不及反应就扩散到溶液内部,此时,在CV图中就无法观察到反向扫描的电流峰。
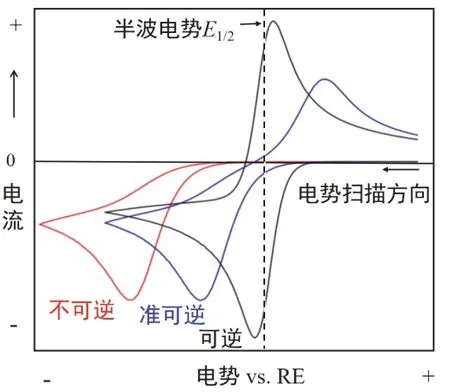
图6 不同可逆性电极体系的循环伏安图
2.4 三电极体系法及CV曲线的稳定性和重现性
CV通常通过三电极体系进行测量。所谓三电极体系[6,10],是指由工作电极(Working Eectrode,WE)、参比电极(Reference Electrode,RE)和辅助电极(Counter Electrode,CE)组成的测试体系。图7为三电极体系测量回路的示意图。可以看出,三个电极构成两个回路:工作电极与辅助电极构成极化电流回路,工作电极与参比电极构成电势测量与控制回路。测量与控制回路中几乎没有电流通过,且不受极化回路电流的影响。因此,利用三电极体系既可使工作电极上有电流通过,又可保证参比电极电势的稳定,从而实现对电流和电势的测量或控制,进而得到工作电极的电流-电势(i-E)关系曲线。
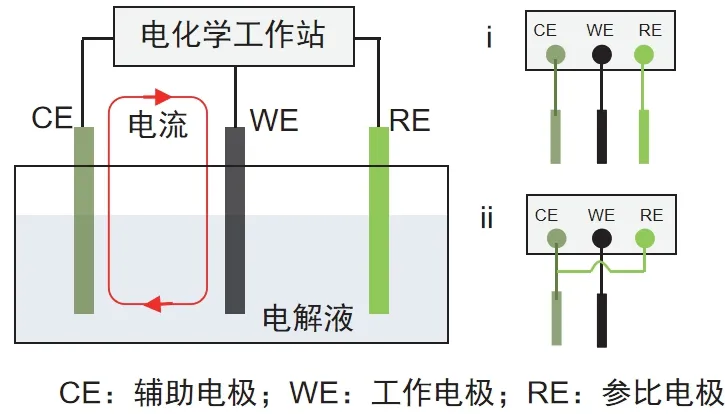
图7 三电极体系测量原理
与三电极体系相比,两电极体系主要用于测试电池正负极整体的电化学反应行为,如扣式电池、软包电池的CV。在两电极体系中,辅助电极同时兼作参比电极,极化回路与测量回路合并,获得的电流信号依然为通过工作电极的电流,但电势为工作电极与辅助电极之间的电势差,实际反映的是工作电极和辅助电极两个电极叠加的响应行为,无法获得单一工作电极的真实电化学行为。此外,由于两电极体系中有较大的电流通过,不可避免地存在浓差极化与电化学极化,使电极电势偏离平衡电极电势。而三电极体系中正是通过引入参比电极,基本解决了由于极化所带来工作电极电势的控制与测量的稳定性问题。
CV曲线测量实验虽然比较简单,然而要获得可靠的、稳定的、可重现的CV曲线还是存在很大的挑战性。电极作为反应的场所,其材料的选择、表面状态等都对电极反应的活化能和速率有影响。要获得可靠的、稳定的、可重现的曲线,必须满足以下两个必要条件。
1) 工作电极表面状态一致。特别是采用固体电极时,要确保每次测量时电极的面积和表面状态基本一致,且不存在吸附杂质,这就必须建立合适的电极预处理步骤。例如,在每一次测试之前对工作电极表面进行打磨、清洗等处理。不同材料电极的处理方法不同,读者可以参考文献[4,7]。
2) 参比电极电势要稳定。参比电极应是理想的不极化电极,具有已知的、稳定的电极电势。为此需要满足:① 可逆电极,其电极电势符合Nernst方程;② 具有较大的交换电流密度,即具有较大的反应速率常数,流过微小的电流时电极电势能迅速恢复原状;③ 应具有良好的电势稳定性和重现性等。此外,参比电极的选择必须根据被测体系的性质来决定。例如,氯化物体系应选用甘汞电极或氯化银电极;硫酸溶液体系应选用硫酸亚汞电极;碱性溶液体系应选用氧化汞电极等。此外,还必须考虑尽可能减小液体接界电势。
有关工作电极、参比电极、辅助电极、盐桥、电解池、鲁金毛细管等更为详细的介绍,读者可以参考文献[6,10]。
3 CV测试的优势及其应用
在电化学的各种研究方法中,电势扫描技术应用最为普遍。得益于数学解析的充分发展,这些技术已广泛应用于测定各种电极过程的动力学参数和鉴别复杂电极反应的机理。CV法最大的优势就是便于直接观察并快速了解物质在电极上(或电极材料自身)的氧化和还原反应、氧化和还原的价态、电极反应的可逆性,并在电化学、分析化学、材料化学、有机化学、生物化学等领域具有重要应用,其中包括但不限于电池与超级电容器、金属电沉积、电化学传感器、膜电极材料的制备;金属离子、环境污染物、电活性神经传递物质的分析检测;药物与血清蛋白和DNA的相互作用等。例如利用CV,可以快速检测反应物(包括中间体)的稳定性,判断电极反应的可逆性,了解固体电极电化学行为,测定电极过程动力学参数,研究活性物质的吸附以及电化学-化学偶联反应机理[9],以及估测有机材料的能级位置[11]。再如,在二次电池领域中,根据CV,通过式(4)计算电池反应过程中的离子扩散系数,了解离子在电池中的扩散行为,进而分析影响电极反应过程的主要影响因素;在超级电容器中,通过分析CV中峰电流与υ之间的关系判断电极材料的储能机理[12]等。
4 CV法中蕴含的哲学原理
电化学中蕴含丰富的唯物辩证法基本原理。电化学基本概念,如正极与负极、阴极与阳极、暂态与稳态、吸附与脱附、极化与去极化、可逆与不可逆等,它们是对立统一的,在一定条件下是可以相互转化的。电化学中阴极反应和阳极反应是不可分割的。如果工作电极上发生阴极还原反应,辅助电极上则同时发生阳极氧化反应。因此,在设计实验时必须考虑辅助电极上会发生什么反应,是否会对工作电极的研究造成影响。再如,电极过程分为暂态阶段和稳态阶段。在暂态阶段,电极电势、电极表面的吸附状态以及电极/溶液界面扩散层内的物质的浓度分布、电流等都可能与时间有关,处于变化中。电极过程从暂态到达稳态是一个逐渐过渡的过程,稳态和暂态是相对而言的。(注意:稳态不等于平衡态,平衡态是稳态的一个特例,稳态时电极反应仍以一定的速度进行,只不过是各变量(如电流、电势等)不随时间变化而已;而电极体系处于平衡态时,净的反应速度为零。)此外,唯物辩证法告诉我们,事物的发展是复杂的,需要根据具体情况进行具体分析,要分清主要矛盾与次要矛盾,紧抓主要矛盾。前面分析,当溶液中存在大量的“支持电解质”时,认为可以忽略电极表面附近薄层液体中离子的对流和电迁移传质,只需考虑离子的扩散传质。再如,在CV中,伴随着电势扫描过程,Ox和Red表面浓度的“此消彼长”,完美体现了我国古代的“太极”哲学思想。
5 结语
CV法是最重要的电化学测量方法之一。CV测试中,电势在工作电极上作三角波扫描时,氧化态和还原态表面浓度的“此消彼长”,使曲线呈现“鸭嘴”形状。对于可逆的Nernst电极反应体系,峰电流满足Randles-Sevčik方程,这也是进行定性和定量分析的基础。CV法最大的优势在于可直接观察并快速了解物质在电极上(或电极材料自身)的氧化和还原反应、氧化和还原的价态、电极反应的可逆性,因而在能源、材料、环境、生物等领域具有重要应用。此外,若要获得具有可靠性、稳定性及重现性的CV曲线,须严格控制实验过程中的每一环节,特别是确保工作电极表面的重现性和参比电极的稳定性。
