多酸基复合光催化剂的合成及其太阳光驱动CO2制甲酸研究在实验教学中的设计与探究
2023-11-02胡路发李张扬居马布比依沙克王春玲马荔
胡路发,李张扬,居马布比·依沙克,王春玲,*,马荔
1上海交通大学环境科学与工程学院,上海 200240
2上海交通大学化学化工学院,上海 200240
1 引言
二氧化碳(CO2)等温室气体的大量排放是影响全球气候变暖的主要因素。将CO2有效转化为高附加价值燃料或化学品是减缓温室效应、缓解能源危机的有效手段。由于CO2分子是高度对称的线型结构,在传统热催化过程中,直接活化C=O碳氧双键所需的能耗巨大。太阳能是清洁的可再生能源,利用太阳光驱动CO2还原可以大幅降低能耗,减少化石能源消耗,实现安全绿色的碳循环[1]。
多酸(Polyoxometalates,POMs)作为一种类半导体材料,因其优异的氧化还原性能,在光催化、光敏器件、绿色能源等领域具有广泛的应用前景[2,3]。Anderson型多酸具有平面分子结构,便于光生电子分离,同时丰富的配位点有利于CO2吸附[4,5]。本实验采用简单浸渍法合成基于Anderson型多酸和TiO2的复合光催化剂,并对其结构进行表征。光催化CO2转化实验结果显示,CO2高选择性转化为甲酸这一高附加值液体产物。
本实验涉及光催化材料合成、光催化反应装置实验操作以及红外光谱、固体紫外漫反射光谱、X射线粉末衍射、气相色谱、液相色谱、紫外分光光度计等仪器的使用。光催化反应条件温和绿色,操作简单安全,反应后产物易收集分析。本实验融合了无机化学、物理化学、材料化学、有机化学和分析化学等多门基础化学课程内容,适合大学高年级学生开展综合实验,有利于激发学生的实验兴趣,提高学生的实验操作能力和科学思维能力。
2 实验部分
2.1 实验目的
让学生了解并掌握光催化原理,了解Anderson型多酸的结构和制备,熟悉光催化反应,在大量研究的基础上,设计涉及Anderson型多酸/TiO2复合光催化剂的制备、催化剂的简单表征和催化活性评价的综合性实验。让学生对光催化二氧化碳转化有较深的了解,并熟悉仪器的操作。
2.2 实验原理
2.2.1 Anderson型多酸化合物的制备
在酸性条件下,向钼酸盐水溶液中加入硝酸铬,将混合液加热至沸腾,冷却结晶,获得Anderson型多酸[H6(CrO6)Mo6O18]3-,其结构如图1所示。
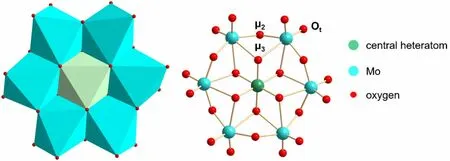
图1 平面Anderson型POMs[XM6O24]n-的结构示意图
2.2.2 多酸复合光催化剂的制备
将Anderson型多酸[H6(CrO6)Mo6O18]3-溶解于去离子水中,获得均匀的多酸水溶液,在剧烈搅拌下向其中加入二氧化钛(TiO2,P25)粉末,加热干燥,即得CrMo6/TiO2催化剂,如图2所示。
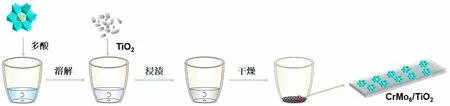
图2 浸渍法合成光催化剂
2.2.3 光催化CO2催化性能
CO2加氢转化为甲醇、甲醛、甲酸、乙醛和乙酸的原理如式①-⑤所示,
2.3 试剂
本实验所用硝酸、钼酸钠、甲醇、甲醛、乙醛、甲酸、乙酸等均购于国药集团化学试剂有限公司,除硝酸为化学纯外,其余均为分析纯试剂。二氧化钛为Sigma-Aldrich公司试剂,纯度99.5%,硝酸铬为麦克林公司试剂,纯度99.95%。
2.4 设备与表征方法
2.4.1 仪器设备与表征方法
使用Shimadzu XRD-6100 PC型X射线衍射仪表征催化剂的晶相(λ= 1.5406 Å) (1 Å = 0.1 nm),扫描角度为10°-80°,扫描速度为5 (°)·min-1;使用FEI Tecnai G2STwin F20场发射透射电子显微镜表征催化剂的形貌;使用Thermo Fisher iS10型傅里叶红外光谱表征催化剂结构,测试范围为500-1500 nm;使用Shimadzu UV2600型紫外-可见光分光光度计对催化剂进行紫外漫反射测试,测试范围为200-800 nm。
本实验使用的其他仪器列于表1中。

表1 实验中所用主要仪器设备
2.4.2 光催化反应装置
光催化反应装置如图3所示,由光源、反应系统、通气排气系统、温控系统和压力监测系统五个部分组成。
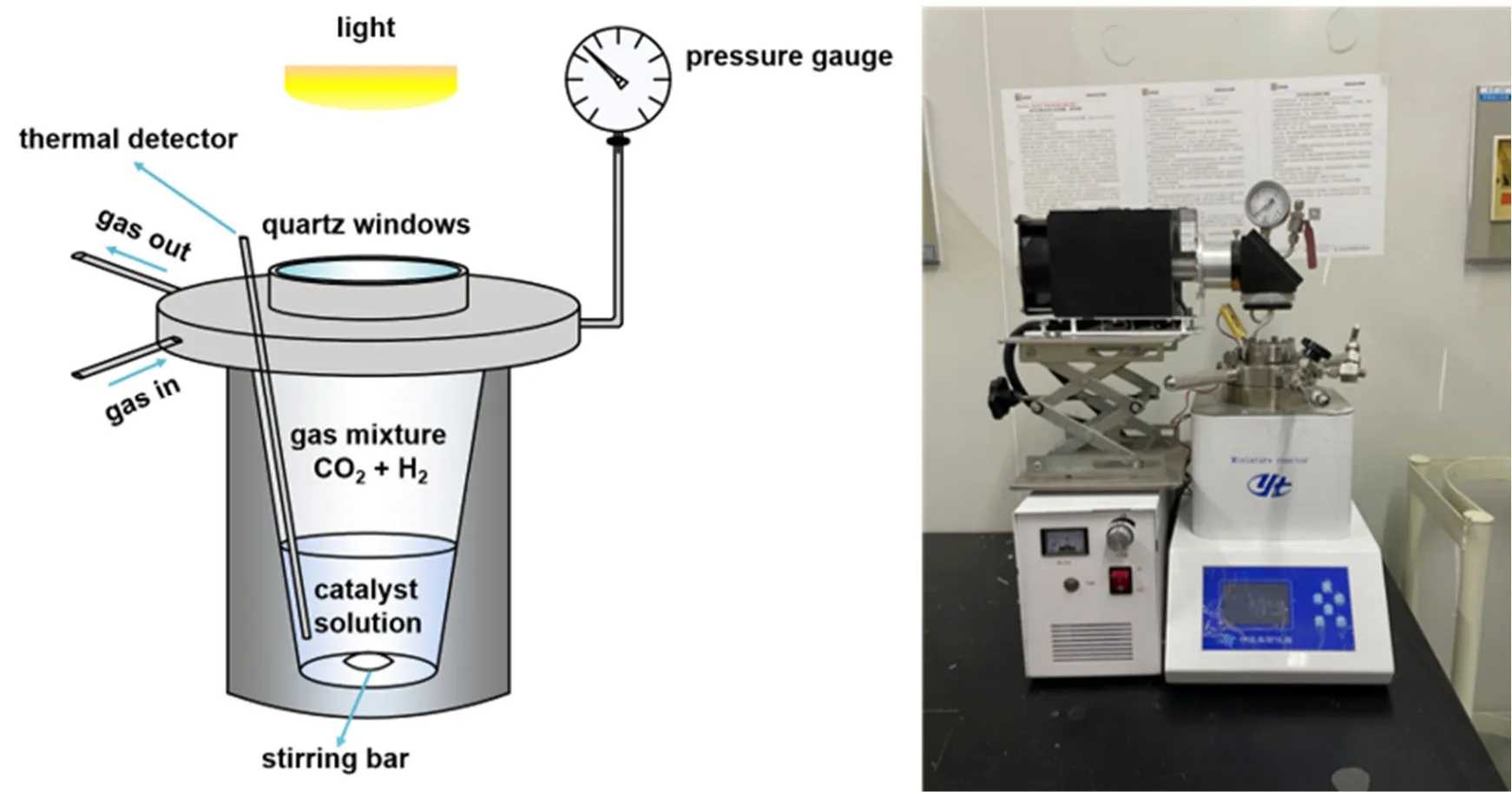
图3 反应装置示意图(左)和实物图(右)
2.4.3 光催化产物的测定
使用装有氢离子火焰监测器(FID)的气相色谱仪检测溶液中的甲醇和乙醛含量。使用高效液相色谱仪(HPLC)检测溶液中的甲酸、乙酸、丙酸等物质,HPLC的紫外线吸收检测器(VWD)检测波长为210 nm,分析柱为Shodex RSpak KC-G (60 × 50 mm) + RSpak KC-811 (8.0 × 300 mm) × 2,流动相为2 mmol·L-1HClO4溶液,洗脱方式采用等度洗脱法。采用乙酰丙酮显色法测定溶液中甲醛的含量,其测试原理:在乙酸-乙酸铵缓冲溶液中(pH = 6),HCHO会与乙酰丙酮和铵根离子反应生成黄色的2,6-二甲基-3,5-二乙酰基-1,4-二氢吡啶,该物质在413 nm处有最大吸收,因此可以用紫外-可见光分光光度计间接测定溶液中甲醛的含量。
2.5 实验步骤
2.5.1 Na3[CrMo6O24H6]·8H2O (CrMo6)的制备
将14.5 g Na2MoO4·4H2O溶于30 mL去离子水中,用浓HNO3调节溶液pH至4.5,另将4.0 g Cr(NO3)3·9H2O溶于4 mL去离子水中,将两种溶液混合,得到的混合液加热至沸腾1 min,过滤,将滤液置于150 mL烧杯中静置,约1 h后开始析出晶体,滤液放置2-3 h至析晶完全,滤出产物,冷水洗涤,得到7.6 g紫色晶体,收率为52.3%。
2.5.2 CrMo6/TiO2复合光催化剂的制备
取50 mg的固体CrMo6粉末溶于2 mL去离子水中,搅拌至固体完全溶解。向溶液中加入1 g TiO2粉末(P25),继续加热搅拌均匀,70 °C条件下干燥,得到的固体粉末产物为CrMo6/TiO2复合光催化剂。
2.5.3 光催化CO2转化
称取15 mg催化剂,置于反应器内胆中,加入20 mL去离子水,密闭装置,用混合气(CO2/H2,V/V= 1 : 4)置换装置中的空气,然后向其中通入3 MPa混合气,在150 °C,磁子转速为1000 r·min-1,1.5 G太阳光强下反应120 min。冷却至室温,收集反应后液体,测定其中的产物。
3 结果与讨论
3.1 催化剂的结构表征
我们通过高分辨率透射电镜(HR-TEM),X射线粉末衍射(XRD)和红外光谱(FT-IR)等手段分析了复合光催化剂的结构。并通过固体紫外漫反射光谱研究了复合催化剂的带隙,从而分析多酸负载氧化钛复合光催化剂光催化性能提升的原因。
复合催化剂CrMo6/TiO2的HR-TEM表征结果显示,TiO2表面均匀分散了CrMo6多酸小颗粒,证明CrMo6高度分散到TiO2载体表面(图4a)。其中TiO2的晶格间距为0.354 nm (图4b),说明TiO2的101面为催化活性表面。

图4 CrMo6/TiO2光催化剂电镜图
Anderson结构多酸CrMo6和复合光催化剂CrMo6/TiO2的FT-IR表征结果如图5所示。在950、900和650 cm-1处分别有Mo―Od、Mo―Ob―Mo和Mo―Oa―Mo的不对称伸缩振动谱带,是Anderson结构的特征谱带,与文献报道一致[6],说明合成的多酸具有Anderson型结构。在CrMo6/TiO2催化剂的FTIR光谱图中,可以明显看出Anderson型特征振动谱带,尤其是Mo―Od键和Mo―Ob―Mo键不对称伸缩振动,这表明合成的CrMo6/TiO2复合催化剂中,CrMo6成功负载在TiO2上,并保持了Anderson型基本结构。
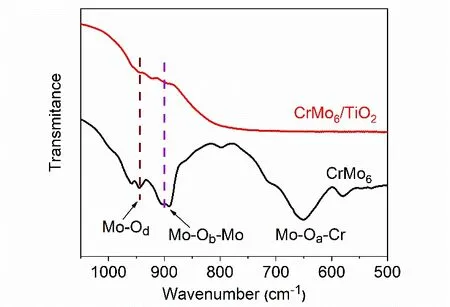
图5 CrMo6和CrMo6/TiO2的FTIR图
XRD结果如图6所示,复合光催化剂CrMo6/TiO2峰型与TiO2的数据匹配度更高。这主要是因为多酸负载量过低,仅为5%的质量浓度(摩尔浓度大约为0.33%),因而无法显示XRD特征峰。复合光催化剂中多酸分子CrMo6的高度分散也是导致无法出现多酸分子的XRD特征峰的原因之一。

图6 TiO2、CrMo6和CrMo6/TiO2催化剂的XRD图
利用固体紫外-可见光光谱测定了TiO2和CrMo6/TiO2的能带结构。如图7a所示,复合催化剂CrMo6/TiO2在可见光附近有吸收峰,说明多酸的加入增加了催化剂的可见光吸收范围。利用Tauc plot法求禁带宽度如图7b所示,基于以下公式:
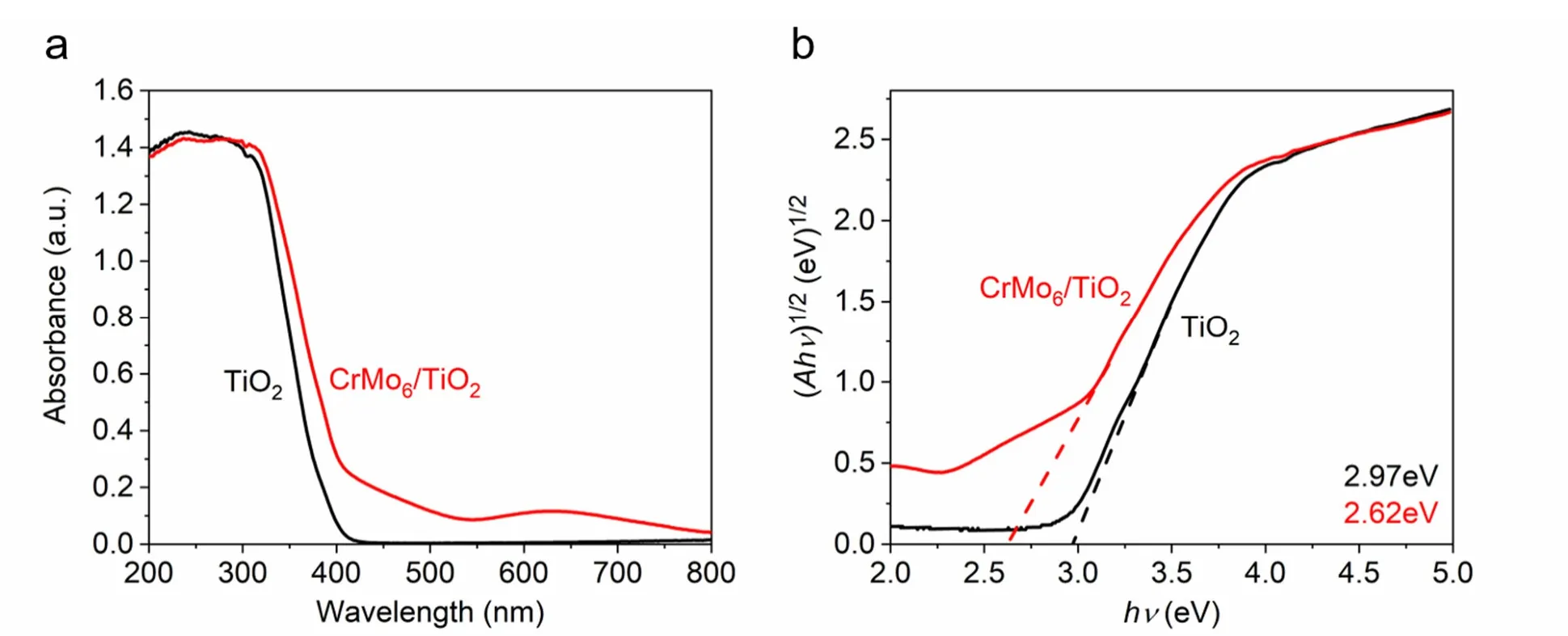
图7 TiO2和CrMo6/TiO2的结构表征图
其中,α为吸光指数,h为普朗克常数,ν为频率,A为常数,Eg为半导体禁带宽度。指数n与半导体类型直接相关:直接带隙半导体:n= 1/2;间接带隙半导体:n= 2。通过切线与坐标轴的交点,可以计算出TiO2(P25)的能带间隙为2.97 eV,CrMo6/TiO2的能带间隙为2.62 eV。说明负载了Anderson型多酸的催化剂的能带间隙比纯TiO2(P25)大幅减小,证明了光生电子从价带跃迁到导带所需要的能量更低,跃迁更加容易发生。
3.2 光催化反应性能讨论
TiO2和多酸复合催化剂CrMo6/TiO2光催化CO2还原反应结果如表2和图8a所示。
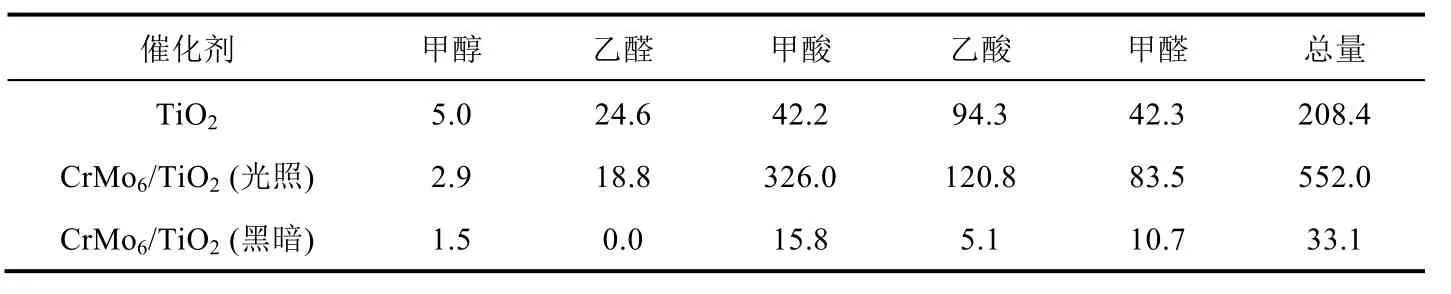
表2 CO2转化数据表(单位:μmol·gcat-1)
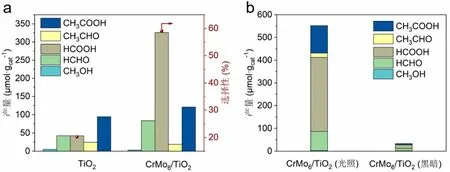
图8 光催化CO2还原反应
相比于传统TiO2光催化剂,负载了Anderson型多酸的复合催化剂CrMo6/TiO2催化CO2转化为甲酸的产量从42.2 μmol·gcat-1提升至326.0 μmol·gcat-1,产量是原来的7.7倍。甲酸的选择性从22.2%提升至59.1%,选择性提升了1.6倍。说明多酸复合催化剂可以有效地将CO2转化甲酸产物。分析原因,可能是由于多酸的修饰减小了TiO2能带间隙,从而增加了光谱的吸收范围,提高了太阳光的利用效率。同时,负载在TiO2上的CrMo6多酸会及时转移光生电子,减少光生电子和光生空穴的复合,从而提升了光催化反应性能。相同体系,不加光照的黑暗条件下,几乎很少的CO2被转化(图8b),这也进一步证实了在该体系是光催化反应体系,光照是必不可少的条件。
4 课时安排
课时安排列于表3中。
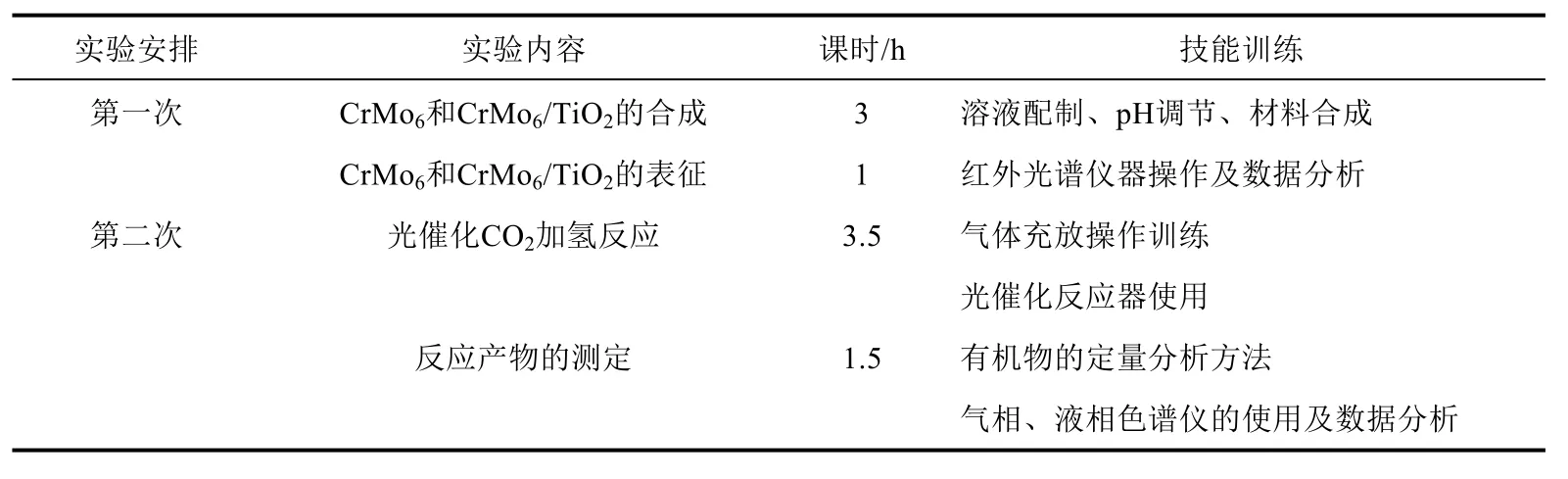
表3 本实验的建议课时安排方案
本实验中各个板块可单独成课,也可整体教学,既能提升学生合成材料的能力,也能提升学生们仪器操作、数据分析能力,可以适应不同阶段学生的实验学习需求,具有普适性。
5 结语
本实验首先合成了Anderson型多酸CrMo6,再利用简单的浸渍法将CrMo6负载在TiO2表面,制备了一种CrMo6/TiO2复合催化剂。光催化CO2加氢实验结果显示,复合催化剂可以有效地将CO2转化为甲酸这一高附加值液体产物。本实验利用光能实现CO2的高效转化,为解决温室效应提供新方法和思路。实验过程中操作简单、安全,光催化条件温和绿色,反应后产物易收集分析,可明显激发学生的实验兴趣,提高学生的实验操作能力,锻炼学生的思考问题方式。
