学以致用,教以致远
——基于TiO2/g-C3N4光催化降解水中有机染料的综合实验
2023-11-02陆虹艳杨涛韩博徐情曾晓飞朱乔虹
陆虹艳,杨涛,韩博,徐情,曾晓飞,朱乔虹
杭州师范大学材料与化学化工学院,杭州 311121
近年来,随着城市化的推进,各类污染物的排放和渗入[1],地下水中的有毒有害物质增加,导致地下水资源的水质出现污染现象,对人类健康甚至整个生态系统危害极大。因此,解决水污染问题迫在眉睫。目前,材料学家广泛认可的新型功能材料处理水中污染物的方法有两种:多孔材料吸附法和光催化法。其中光催化法[2]是通过太阳光照射半导体光催化剂,光催化材料受光激发后产生光生电子和空穴,进而生成一些活性自由基(包括羟基自由基、超氧自由基和单线态氧等),实现把水中的有机污染物或重金属以氧化还原的方法转化为无毒或低毒害性物质。充分利用清洁的太阳能来实现水中污染物的降解,不仅绿色无污染,而且材料种类众多。
光催化法已广泛用于降解有机污染物领域,研究者们通过克服各种材料各自的缺点,从而达到最好的光催化效果[3]。例如,TiO2是被研究与应用最广泛的半导体光催化剂之一,利用TiO2作为光催化剂进行污水处理,可以克服传统处理方法效率低、适用范围窄、能效高等问题,能将有机物彻底降解为CO2和H2O等无机小分子[4],但TiO2仅能在紫外光范围内响应,存在能量利用率低的问题。基于此,具有可见光吸收能力的石墨相氮化碳(g-C3N4)的出现,较为有效地改善了这一问题,同时将两者复合的研究报道也应运而生[5]。刘威等[4]制备的TiO2/g-C3N4异质结复合材料对亚甲基蓝(MB)的降解率可达90.3%,与纯g-C3N4相比,其光催化性有显著提高,同时循环测试表明该异质结光催化材料具有稳定的光催化稳定性。这一系列研究都表明基于g-C3N4和TiO2构建的复合纳米材料在光催化应用中具有一定的潜在发展可能性,因此也可被考虑用于综合实验的设计中。
从教育部高等学校化学类教学指导委员会制定并发布的《化学类专业本科教学质量国家标准》[6]中可知,目前的实验教学要求已从“知识导向型”和“技能导向型”向“能力导向型”和“素质导向型”转变[7],这要求化学实验教学需要向综合性、设计性和创新性转变,使学生在掌握化学实验基础知识、基本理论的基础上,能通过资料搜集、实验探究等手段,提出相关的解决方法,从而提高学生自主学习、合作探究、创新发展的能力。此外,在实验教学过程中选择性地介绍材料科学、环境科学等相关学科的知识,引入基础和应用研究的新进展,将“化学知识-实验操作-实际应用”结合起来,形成一个具有较强综合性的实验教学过程,培养具有环保意识和可持续发展理念的创新型人才。
基于以上研究,结合国家标准和新时代化学教育的导向和方针,我们设计了“TiO2/g-C3N4光催化促进水中有机污染物以罗丹明B (RhB)和甲基橙(MO)为例的综合实验”。该实验包括以焙烧法实现TiO2/g-C3N4复合催化剂的制备、复合催化剂的表征以及其对RhB和MO的降解性能测试等多个模块,通过巧妙设计流程,有利于增强实验综合性。根据建构主义学习理论,在开展实验之前,鼓励学生查阅文献,了解光催化降解水中污染物的原理,而教师则从水中污染物对生态环境和人类健康具有潜在的危害[8]出发,设置处理污水中有机污染物的情景,让学生在真实情境中尝试做到发现问题、分析问题、解决问题,进一步培养学生创新性思维和环保意识。本实验涉及无机化学、物理化学、环境科学,实现多学科的交叉融合,在实验内容的编排上,我们将诸如材料科学、绿色化学以及无机合成等基础内容与TiO2/g-C3N4光催化污染物降解等化学当前热点应用结合,实现科技前沿、实际应用与基础教学深度融合,拉近学生与科研的距离,更真切体验化学学科的魅力,培养创造性思维,将理论运用于实际,让学生真正体会化学是服务于生活。本实验也可通过不同编排,满足各种教学模式的需要,更加贴合学生的实际与发展,其总体实施方案见图1。
1 实验教学目标
(1) 知识方面:学习半导体材料光催化降解的原理;了解紫外分光光度计、X射线衍射仪、X射线光电子能谱仪等仪器的工作原理;知道暗吸附在光催化降解实验中的作用;了解当下的水污染现状。
(2) 能力方面:培养学生文献收集和整合能力;掌握马弗炉高温煅烧制备无机纳米材料的方法;学会使用基本的材料表征手段,如XRD、XPS、BET、UV-Vis;掌握Origin软件的使用,学会数据处理与分析。
(3) 素养方面:通过模拟治理水中有机污染物的真实情境,让学生通过实验将绿色化学的知识运用于实际生活中,同时鼓励学生为实现现代化强国建设树立远大目标。
2 实验原理
半导体是一种介于导体与绝缘体之间的材料,其最高占据轨道相互作用形成价带(VB),最低未占据轨道相互作用而形成导带(CB),价带顶与导带底之间存在一个没有电子的禁带,它们之间的能量差被称为禁带宽度或带隙(Eg)[9]。
当足够能量的光照射在半导体材料时,价带处产生光生电子和空穴对(e-/h+),电子和空穴发生分离和迁移,进而与水中溶解氧和水分子(或氢氧根阴离子)反应,生成过氧化物和羟基自由基等自由基,这些自由基和电子空穴对可以攻击介质中存在的有机污染物,将其分解成更小的片段,并最终被矿化为水和二氧化碳。
当受光照射时,具有合适带隙的g-C3N4和TiO2都会产生光生电子和空穴,其光生电子易从g-C3N4的导带迅速转移到TiO2的导带上,TiO2价带上的空穴则转移到g-C3N4的价带上。复合异质结构中光生载流子的这种迁移作用,可以有效地抑制光生电子与空穴的复合,提高载流子的分离效率。此外,TiO2导带上较多的电子以及g-C3N4价带上更多的空穴,使异质结表面的活性位点大大增加,能够加速体系中活性基团的产生,位于TiO2导带上的电子可以与溶液中的O2发生反应生成O2-•,而g-C3N4价带上的空穴可以与•OH-或H2O反应生成氧化性更强的•OH,羟基自由基和超氧自由基可以与污染物发生氧化反应,使之降解为无机小分子、CO2和H2O等物质[6],如图2所示。

图2 TiO2/g-C3N4复合催化剂可见光降解罗丹明B机理示意图
3 试剂与仪器
3.1 试剂
本实验所需主要试剂如表1所示。

表1 所需主要实验试剂
3.2 仪器
本实验所用主要仪器如表2所示。
表2 所用主要实验仪器
4 实验内容
4.1 g-C3N4催化剂的合成
用分析天平称取1.8750 g三聚氰胺和3.1250 g氯化铵于研钵中研磨均匀,随后倒入瓷方舟中密封放入马弗炉中,以5 °C·min-1的升温速率加热到550 °C保温4 h,然后冷却至室温,取出研磨得到g-C3N4粉末。
4.2 TiO2/g-C3N4复合催化剂的合成
将TiO2与g-C3N4按质量比分别为2 : 1在研钵中研磨均匀混合,转移至离心管,加入少量水,超声分散并搅拌20 min,随后离心得沉淀,放入60 °C恒温箱中烘干。烘干后,研磨样品并将其转移至瓷方舟中,放入马弗炉中煅烧,以5 °C·min-1的升温速率加热到200 °C保温1 h,然后冷却至室温得TiO2/g-C3N4复合光催化剂,制备流程如图3所示。
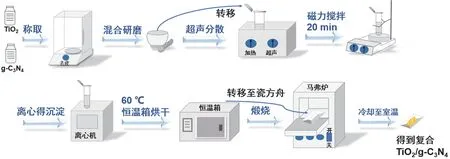
图3 TiO2/g-C3N4复合催化剂的制备流程
4.3 罗丹明B (RhB)、甲基橙(MO)水溶液的配制
取10 mg罗丹明B、甲基橙于螺口玻璃瓶中,用移液枪定量移取10 mL超纯水加入到螺口玻璃瓶中,配成1 g·L-1的母液,随后用移液枪移取1 mL RhB、MO母液于干燥的光催化管中,加入99 mL超纯水,并通过超声将RhB分散均匀,将其配制成10 mg·L-1的溶液,待光催化性能测试时使用。
4.4 TiO2/g-C3N4复合催化剂的结构表征
利用X射线衍射仪(XRD)对样品的物相结构进行表征;样品的形貌结构和元素组成通过透射电镜进行观察;X射线光电子能谱通过Thermo ESCALAB 250 XI型仪器进行测试;样品的比表面积和孔径分布通过自动物理吸附仪测得;样品的光吸收性能由紫外-可见分光光度计进行测试。
4.5 TiO2/g-C3N4复合催化剂光催化性能测试
以RhB、MO染料溶液为目标降解对象,加入光催化剂后,用300 W氙灯模拟太阳光照射,在光催化管中进行降解实验。向装有10 mg·L-1染料溶液的光催化管中分别加入50 mg g-C3N4、TiO2、TiO2/g-C3N4复合光催化剂粉末,在超声机中进行超声分散,使催化剂粉末分散均匀,用滴管取4 mL样品,离心得上清液。随后在光催化管中加入磁子避光搅拌15 min,进行暗吸附,使体系达到吸脱附平衡。
暗吸附结束后,用滴管取4 mL样品,离心得上清液,随后用300 W氙灯作为光源照射光催化管,并用滴管在15、30、45、60 min取4 mL样品,快速离心得上清液。最后用紫外-可见分光光度计在染料溶液的最大吸收波长(554 nm、463 nm)处测上述5组清液的吸光度,计算得染料溶液的浓度变化以及降解率。溶液降解率 = [(C0-Ct)/C0] × 100% = [(A0-At)/A0] × 100%,C0为初始的染料溶液浓度(mg·L-1),Ct为光照一定时间后的染料浓度(mg·L-1);A0为初始的染料的吸光度,At为光照一定时间后染料的吸光度。
5 结果与讨论
5.1 催化剂的结构表征
5.1.1 物相分析
图4所示为样品TiO2/g-C3N4复合催化材料的XRD谱图,由g-C3N4可知,其在13.4°、27.5°处出现衍射峰,而样品TiO2/g-C3N4复合催化剂中缺少了g-C3N4在13.4°处的衍射峰,分析可知,该复合材料中g-C3N4掺杂成功,但结晶度较低。此外,与图中锐钛矿相TiO2标准PDF卡片(JCPDS:21-1272)对比可知,该复合光催化剂含有TiO2的所有特征峰,进一步证实复合催化材料的成功制备。
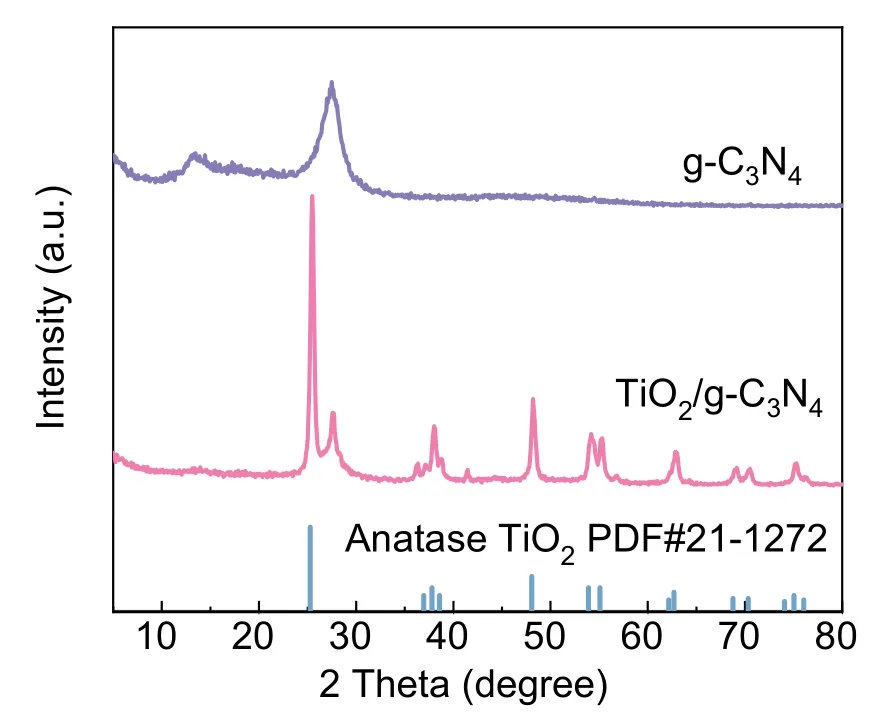
图4 g-C3N4、TiO2和TiO2/g-C3N4复合光催化剂的XRD图
5.1.2 形貌分析
样品TiO2/g-C3N4复合催化材料的形貌结构如图5所示。可以看到具有纳米颗粒状的TiO2较为均匀地负载在纳米片形态的g-C3N4上,说明TiO2/g-C3N4复合材料被成功制备。此外,从图中可知,TiO2颗粒与g-C3N4之间接触较为紧密,其界面有利于光生电子与空穴在二者之间迅速转移,进一步提高材料的光催化性能。

图5 TiO2/g-C3N4复合光催化剂的TEM图
5.1.3 XPS分析
图6为TiO2/g-C3N4复合光催化剂的XPS图谱。从图中可看出,TiO2/g-C3N4复合光催化剂含有C、O、N、Ti四种元素。由图6(a)可知,复合光催化剂在284.28、287.78 eV处有两个峰,分别对应C―C键和C―O键[10];由图6(c)可知,该催化剂在398.24、399.68、400.88 eV处有三个峰,分别对应C―N=C键、N―(C)3键和N―H键[11];图6(d)是该催化剂的Ti 2p的图谱,从图中可知,在458.08、463.68 eV处有两个峰,分别对应为Ti4+中Ti 2p3/2和Ti 2p1/2轨道的分裂峰[11]。
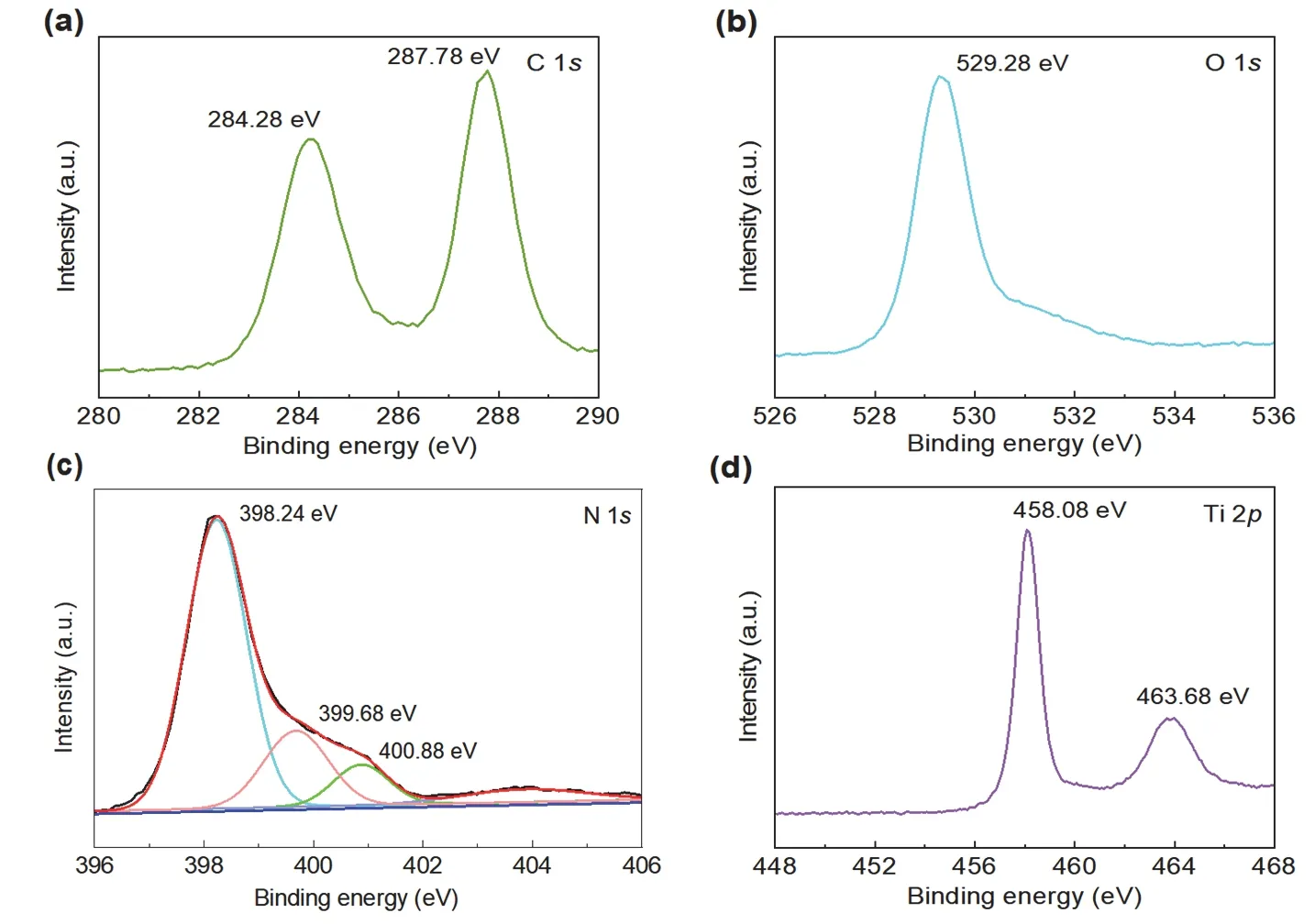
图6 TiO2/g-C3N4复合光催化剂的C 1s (a)、O 1s (b)、N 1s (c)、Ti 2p (d)的XPS谱图
5.1.4 比表面积和孔径分析
TiO2/g-C3N4复合光催化剂的N2吸附-脱附等温线和孔径分布如图7所示。由图7(a)可知,该催化剂的N2吸脱附等温线属于IUPAC[12]分类中的第IV类等温线,说明该样品中存在介孔结构,且测试所得该样品的比表面积为48.5 m2·g-1。由图7(b)可知,该催化剂孔径分布在3-32 nm左右,测试所得其孔容为0.255 m3·g-1。综上所述,可知制备所得的催化剂有较大的比表面积、孔径范围和孔容,有利于催化剂对染料的吸附。
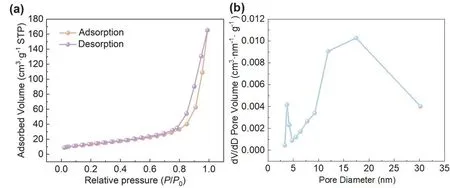
图7 TiO2/g-C3N4复合光催化剂的N2吸附-脱附等温线(a)和孔径分布图(b)
5.1.5 紫外-可见吸收光谱分析
图8为g-C3N4和TiO2/g-C3N4复合光催化剂的紫外-可见光漫反射吸收光谱,由图可知,g-C3N4的吸收波长的最大值为460 nm,而TiO2/g-C3N4复合光催化剂吸收波长的最大值大于g-C3N4,存在红移现象,证实该复合光催化剂扩大了光响应范围。
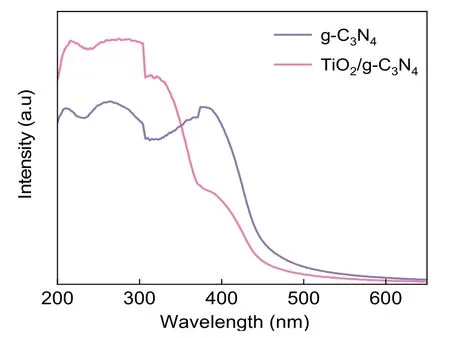
图8 g-C3N4和TiO2/g-C3N4复合光催化剂的紫外-可见光漫反射吸收光谱
5.2 催化剂的光催化降解性能
本实验分别对RhB和MO两种染料进行光催化降解实验,研究TiO2/g-C3N4复合光催化剂对两种不同染料的降解性能。图9为TiO2/g-C3N4复合光催化剂催化降解RhB的紫外-可见吸收光谱图。实验过程中,我们发现降解时间为0 min时,在528.57 nm出现了RhB的最大吸收峰,随着时间的延长,该吸收峰不断下降,说明TiO2/g-C3N4复合催化剂对RhB能够起到降解效果,将其降解为CO2、H2O,且具有良好的降解性能,在45 min时实现完全降解。
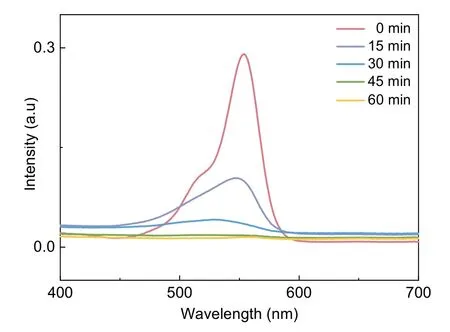
图9 TiO2/g-C3N4复合光催化剂催化可见光降解RhB降解过程的紫外可见吸收光谱图
图10(a)为空白g-C3N4和TiO2以及TiO2/g-C3N4复合光降解RhB的情况。从图中可以看出,暗吸附15 min对降解过程几乎没有影响,此外,复合催化剂在45 min时便能将RhB完全降解,实现最优异的光催化性能。图10(b)为不同催化剂催化降解RhB的一级动力学拟合曲线,由图可知,该催化剂降解RhB的过程为一级动力学反应。通过计算可知降解RhB的反应速率常数及相关系数(表3),由表可知,TiO2/g-C3N4复合催化剂、空白g-C3N4、TiO2的速率常数分别为0.07568、0.01273、0.00808 min-1,可见,TiO2/g-C3N4复合催化剂的催化速率为空白g-C3N4、TiO2的5.95、9.37倍,故可知,比起空白g-C3N4、TiO2,复合光催化剂具有更好的降解性能。
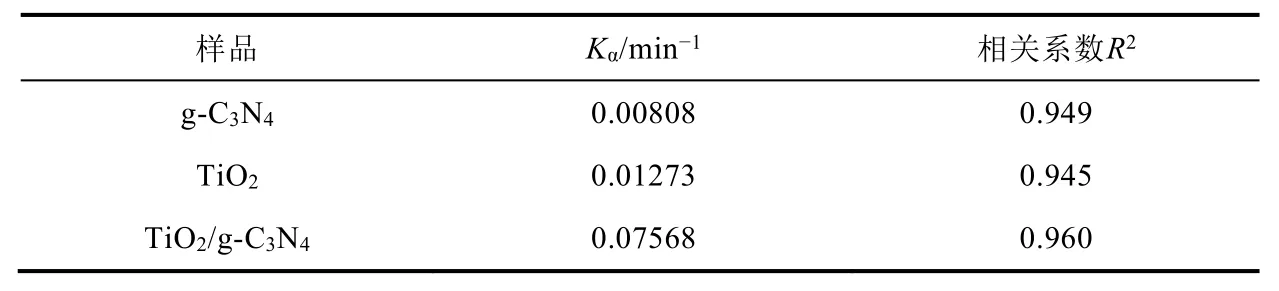
表3 光催化降解RhB的一级动力学方程表观反应速率常数
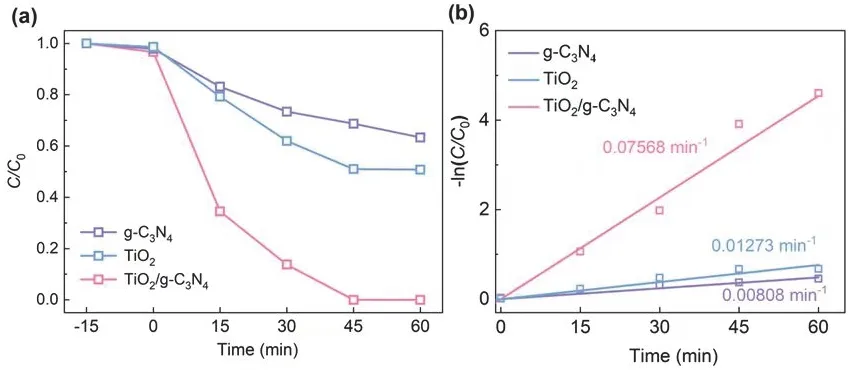
图10 不同催化剂催化可见光降解RhB性能比较(a)以及一级动力学拟合曲线(b)
为进一步探究该复合光催化剂对其他污染物是否有良好的降解效果,我们选用了MO为降解物。图11(a)展示了空白g-C3N4和TiO2以及TiO2/g-C3N4复合光催化剂对MO的降解情况,又由图11(b)得知,TiO2/g-C3N4复合催化剂、g-C3N4、TiO2的速率常数分别为0.01817、0.01579、0.00222 min-1。综上所述,该复合光催化剂对MO也有良好的催化降解性能。
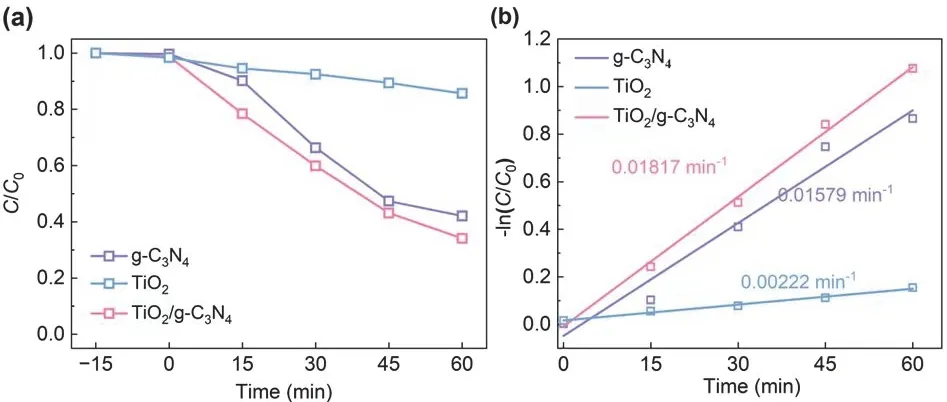
图11 不同催化剂催化可见光降解MO性能比较(a)以及一级动力学拟合曲线(b)
6 思考题
(1) 简述TiO2/g-C3N4复合光催化剂在可见光作用下驱动有机物降解的机理。
(2) 在RhB降解步骤中,为何要对RhB进行暗吸附实验?
(3) TiO2/g-C3N4复合光催化剂的降解效果与哪些因素有关?
(4) 如何判断是否成功合成了TiO2/g-C3N4复合光催化剂?
(5) 如何比较制备出的复合光催化剂的降解效果?
7 注意事项
(1) 使用马弗炉时先开电源、再加热、最后调温,且马弗炉在高温阶段不能打开炉门。
(2) TiO2和g-C3N4混合时需研磨均匀,使之混合均匀。
(3) 进行催化降解时要进行暗吸附,使催化剂和降解物达到吸附平衡。
(4) 光催化剂在染料溶液中需均匀分散,且每次取样时需取相同体积的混合液。
8 教学组织建议
(1) 本实验以治理污水中有机染料废物的真实情境为依托,以半导体材料分解有机污染物原理和XRD、TEM、XPS、BET、UV-Vis等催化剂结构形貌表征原理为基础,以“复合光催化剂降解有机染料”为载体,融合无机化学、物理化学等多学科理论知识,具有较强的综合性,且实验原料易得、操作简单、表征难度适中,将其选为本科实验,既能锻炼本科生实验操作技能,又能提高本科生的科研素养。
(2) 建议将本实验设置为化学、应用化学等专业的大三年级的必修综合性实验,每组2-3人,建议催化剂制备实验2课时、降解性能测试实验4课时,仪器测试6课时,共计12课时。因本实验催化剂制备实验操作简单,而催化性能测试时间久,建议在实际教学过程中每组各选择一种污染物进行实验。此外,考虑到本实验涉及到的仪器较多,操作较为繁琐,在进行表征方式的选择上可视学校实际情况而定。
(3) 在进行仪器测试前,需对学生进行仪器原理的学习和仪器操作的培训,如我院有X射线衍射测试、透射电镜测试等虚拟仿真软件,在实验开始之前,组织学生进行线上虚拟仿真软件操作,充分利用数字化教学资源,实现“线上+线下”融合教学。
(4) 考虑到透射电镜、X射线衍射仪、X射线光电子仪等仪器较为昂贵且操作复杂,建议实际教学中,学生主要以制样、送样和数据分析为主,观摩学习实验教师的仪器操作;而在降解性能测试实验中,以学生为主体,进行紫外分光光度仪的操作和数据分析。
(5) 建议有一定科研基础的学生,在教师的指导下,课外查阅资料,从制备g-C3N4的原料,复合光催化剂的配比、煅烧时间、改性,水中污染物的种类、浓度等角度出发进行深入研究,提出问题、制定新的实验方案,在制备表征性能测试的基础上,寻找制备具有良好降解性能催化剂的方案,以便应用于实际水中污染物的处理。
9 结语
习近平总书记在二十大报告中指出,要推进绿色发展、促进人与自然和谐共生,深入推进环境污染防治,持续深入打好蓝天碧水净土保卫战,基本消除城市黑臭水体、建设美丽中国。在能源短缺的今日,研究利用清洁能源太阳能进行光催化降解水中污染物的技术势在必行。故我们结合化学、应用化学等专业的相关知识设置本实验,将习近平生态文明思想与绿色化学的观念潜移默化地传递给当代青年大学生。本实验在治理水中有机污染物的教学情境下,综合大三年级学生的所学知识,更好地激发了高年级学生的研究热情,将所学理论知识及时转化为实践,同时强化“保护环境、绿色发展”的意识,加强生态文明建设。此外,本实验在教学中,以立德树人为主线,融入绿色发展观,在提升学生的实验综合素养的同时提高其思想道德水平。
综合实验教学是培养创新型应用人才的重要途径,根据《化学类专业本科教学质量国家标准》[6],本综合实验不仅是知识的综合,也是能力的综合,学生在学习无机材料光催化降解水中污染物原理以及各类仪器表征原理的同时,提高了实验操作,数据收集、处理等方面的能力,是从“基础性实验”到“研究性实验”的必经环节,为高年级学生后续步入科研生涯打下基础。
