过量铁摄入对孕鼠糖代谢和肝脏氧化损伤的影响
2023-11-01刘佩蔡雁
刘佩,蔡雁
过量铁摄入对孕鼠糖代谢和肝脏氧化损伤的影响
刘佩,蔡雁
哈尔滨医科大学附属第四医院产科,黑龙江哈尔滨 150001
探究过量铁摄入对孕鼠糖代谢和肝脏氧化损伤的影响。选取28只SPF级C57BL/6雌鼠适应2周后,根据体质量进行区组随机化分组,分为对照(normal dose,ND)组、低剂量补铁(low dose,LD)组、中剂量补铁(middle dose,LD)组和高剂量补铁(high dose,HD)组,铁含量分别为35、175、350、525mg/kg,喂养2周后,雌雄3∶1同笼。孕0、6、12、18d测量小鼠空腹血糖(fasting blood glucose,FBG);孕17d行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT);测定孕18d血清空腹胰岛素(fasting insulin,FINS)水平,并计算稳态模型评估的胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR);测定肝脏组织的总铁离子含量、丙二醛(malondialdehyde,MDA)浓度和总超氧化物歧化酶(total superoxide dismutase,T-SOD)活性。HD组和MD组小鼠的肝脏总铁离子含量明显高于ND组(<0.05);与ND组相比,HD组、MD组和LD组小鼠在孕0、6、12、18d的FBG差异均无统计学意义(>0.05);HD组小鼠服糖后30、60min后血糖浓度显著高于ND组(<0.05);HD组小鼠FINS和HOMA-IR显著高于ND组。HD组、MD组和LD组小鼠肝脏的MDA含量明显高于ND组(<0.05);但仅有HD组小鼠T-SOD活性明显低于ND组(<0.05)。小鼠孕前及孕期膳食补充中、高剂量的铁可显著增加肝脏储铁量,但只有高剂量补铁时才会导致孕鼠的肝脏出现一定程度的氧化损伤,以及胰岛素抵抗、高胰岛素血症和糖耐量减低。
小鼠;铁过量;妊娠;糖代谢;氧化应激
妊娠期糖尿病(gestational diabetes mellitus,GDM)是常见的妊娠并发症之一,可导致多种母儿并发症,如巨大儿、肩难产和2型糖尿病等[1-2]。高龄、孕前超重、肥胖和糖尿病家族史等是GDM的已知危险因素[3]。近年来,孕期铁的摄入量与GDM的相关性也引起了重视,在妊娠期间是否常规进行补铁已经成为一个极具争议的话题[4]。铁缺乏(iron deficiency,ID)在孕妇中是常见的,临床上通常推荐常规补铁,以预防孕产妇贫血并确保胎儿铁储存充足[5]。然而铁也是一种强氧化剂,过量的铁所诱发的氧化损伤可导致机体糖代谢受损[6]。研究表明,过量血清铁蛋白(serum ferritin,SF)和葡萄糖代谢紊乱之间存在显著关联[7-10]。研究显示,孕期较高的SF和血红蛋白(hemoglobin,Hb)与GDM风险增加有关,但关于补铁和GDM风险的研究结果还不明确,部分结果相互矛盾,这可能与基线铁状态、补铁剂量和持续时间相关[11-12]。
关于铁过量导致GDM的机制尚不明确,根据铁的促氧化作用及氧化应激与GDM的关系,目前认为机体内铁水平升高可能通过氧化应激影响胰岛素信号通路及胰岛β细胞功能,进而导致糖代谢紊乱和GDM的发生[13]。因此,本研究以小鼠为实验对象,拟通过模仿人类孕期补铁,在孕前和孕期给予小鼠高铁膳食,建立孕鼠铁过量模型,并进一步探讨孕期非病理状态下铁过量相关的氧化损伤以及与糖代谢紊乱之间可能存在的关联。
1 材料与方法
1.1 主要试剂与仪器
总铁离子试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒(武汉伊莱瑞特生物科技股份有限公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);Synergy HTX多功能酶标仪(美国BioTek公司);AU5800全自动生化分析仪(美国贝克曼库尔特有限公司);安稳+快速血糖仪(三诺生物传感股份有限公司)。
1.2 动物饲料
饲料购买于南通特洛菲饲料科技有限公司,根据美国营养学会(American Institute of Nutrition,AIN)93生长期饲料配方(铁含量12mg/kg)定制饲料,通过向饲料中添加枸橼酸铁,配制成含铁量不同的饲料,分别为正常饲料(铁含量35mg/kg,生理需要剂量),低剂量补铁饲料(铁含量175mg/kg,5倍标准铁含量),中剂量补铁(铁含量350mg/kg,10倍标准铁含量),高剂量补铁饲料(铁含量525mg/kg,15倍标准铁含量)。
1.3 实验动物
SPF级6周龄C57BL/6小鼠36只(其中雌性28只,雄性8只),体质量16~18g,购自辽宁长生生物技术股份有限公司,实验动物许可证号:SCXK(辽)2020-0001。将小鼠饲养于哈尔滨医科大学附属第四医院实验动物中心,保持适应的环境温度、湿度和光照,自由饮水和摄食。本研究获得哈尔滨医科大学附属第四医院动物伦理委员会批准(伦理审批号:2022-DWSYLLCZ-12)。
1.4 实验分组干预
小鼠饲养于SPF级动物房中,适应性喂养2周后,雌鼠根据体质量进行区组随机化分组,分为对照(normal dose,ND)组、低剂量补铁(low dose,LD)组、中剂量补铁(middle dose,LD)组和高剂量补铁(high dose,HD)组。分组喂养2周后,每日18时将小鼠按雌雄3∶1合笼,次日8时见阴栓者记为孕第0天,未见阴栓者继续行阴道涂片检查,如果涂片见到精子者记为孕第0天。隔日监测孕鼠体质量,若孕10d体质量增长<2g,则视为未孕,将其继续与雄鼠合笼。定期观察小鼠的一般情况并记录小鼠的摄食量及体质量。
1.5 样本采集
禁食不禁水14h,在基线(随机分组前)和孕0、6、12、18d经尾静脉采血测定空腹血糖(fasting blood glucose,FBG);孕17d给予小鼠50%葡萄糖(1g/kg)灌胃处理,然后于0、30、60、120min经尾静脉采血测定血糖浓度;孕18d实验结束后,用10%水合氯醛(4ml/kg)经腹腔注射麻醉小鼠,经眼球取血后处死小鼠,剖取肝脏。
1.6 糖代谢相关指标测定
采用快速血糖仪测量血糖水平,全自动生化分析仪检测血清空腹胰岛素(fasting insulin,FINS)水平,并计算稳态模型评估的胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=FBG(mmol/L)×FINS(μIU/ml)/22.5,评估胰岛素抵抗水平。
1.7 肝脏铁离子和氧化应激水平检测
分别取0.1g小鼠肝脏组织,按照试剂盒说明分别进行组织总铁离子含量、MDA含量和SOD活性测定,采用BCA法定量测定蛋白浓度,计算得到总铁离子含量(μmol/kg湿重)、MDA含量(μmol/g prot)和SOD活性(U/mg prot)。
1.8 统计学方法
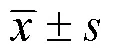
2 结果
2.1 一般情况
最终成功受孕24只雌鼠(ND组6只、LD组7只、MD组5只、HD组6只)。各组小鼠摄食量正常、毛色光泽、反应灵敏、生长发育正常、精神状态良好、活动正常,组间无明显差异。受孕后小鼠体质量逐渐增加,但各组之间差异无统计学意义(>0.05),见图1。
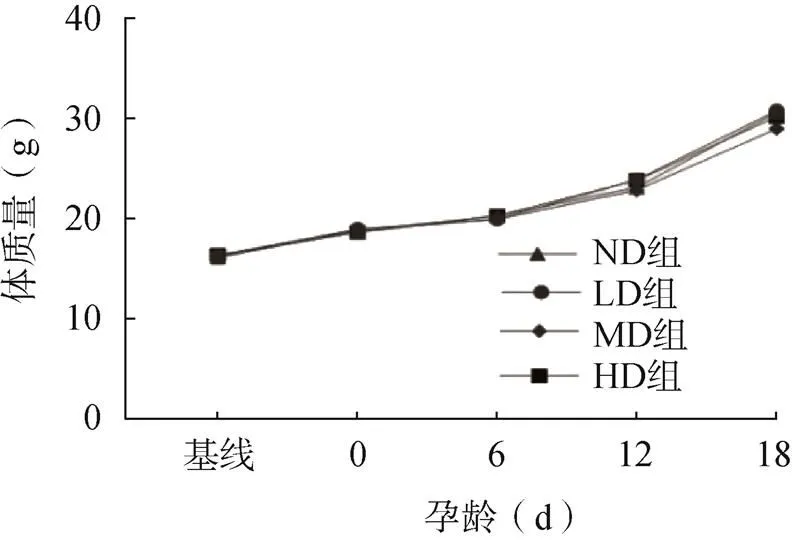
图1 小鼠体质量增长情况
2.2 小鼠肝脏组织铁离子变化
小鼠肝脏铁离子含量随着补铁剂量的增加而升高,HD组(<0.01)、MD组(<0.05)肝脏铁离子含量显著高于ND组,LD组与ND组差异无统计学意义(>0.05),见图2。
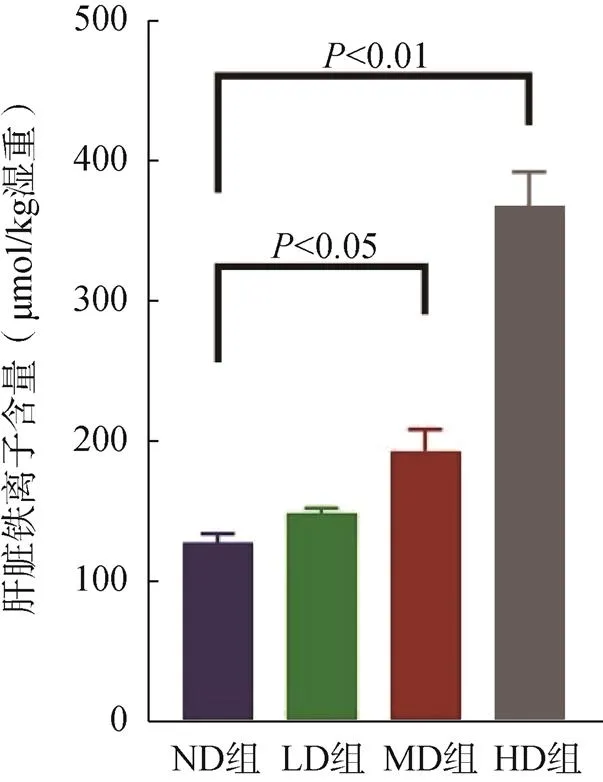
图2 小鼠肝脏铁离子变化
2.3 铁过量对小鼠糖代谢相关指标的影响
各组小鼠基线FBG差异无统计学意义(>0.05),随着妊娠的进展,血糖水平逐渐上升,孕12d后血糖水平开始下降。LD组、MD组和HD组在孕6、12、18d的FBG高于ND组,但差异无统计学意义(>0.05,图3A)。服糖30min和60min后,HD组血糖浓度显著高于ND组(<0.05,图3B),各组小鼠在0min及服糖120min后的血糖值差异无统计学意义(>0.05,图3B)。HD组的FINS浓度和HOMA-IR显著高于ND组(<0.05,表1)。
2.4 小鼠肝脏氧化应激指标变化
LD组、MD组、HD组小鼠的MDA含量均明显高于ND组(<0.05,图4A);各组小鼠的肝脏T-SOD活性逐渐下降,仅HD组则显著低于ND组(<0.05,图4B)。
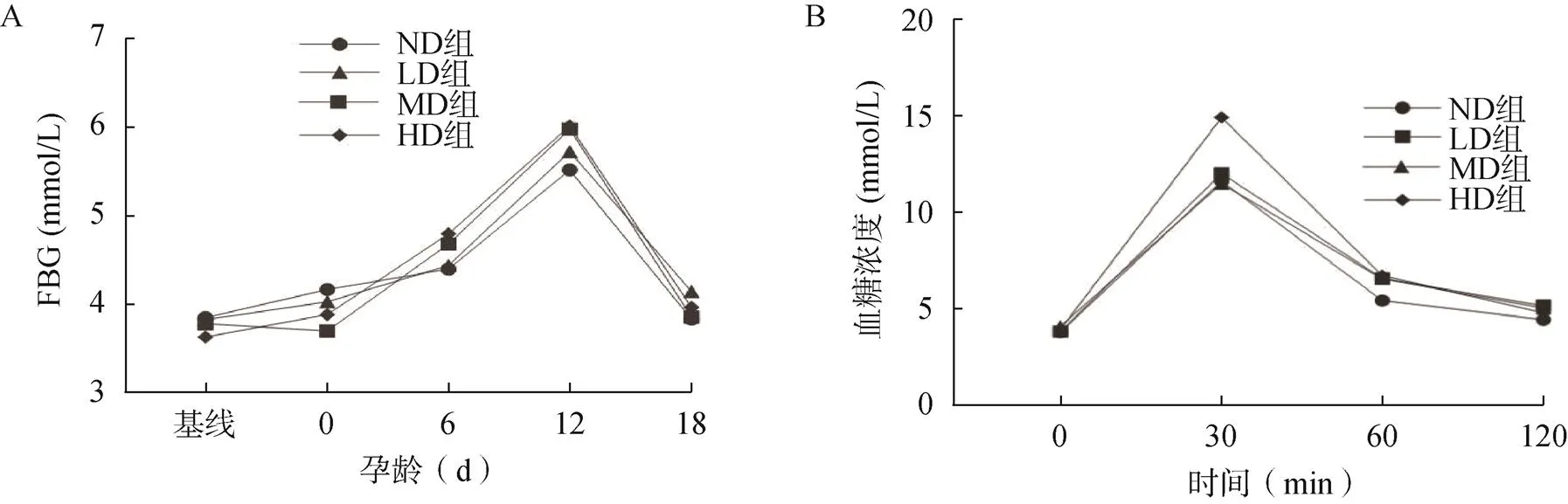
图3 小鼠空腹血糖及口服葡萄糖耐量变化
A.小鼠空腹血糖变化;B.小鼠口服葡萄糖耐量变化
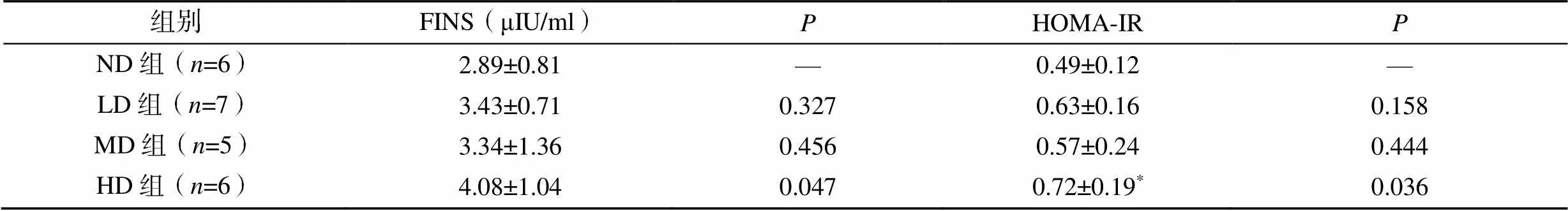
表1 小鼠空腹胰岛素及胰岛素抵抗指数变化
注:与ND组比较,*<0.05
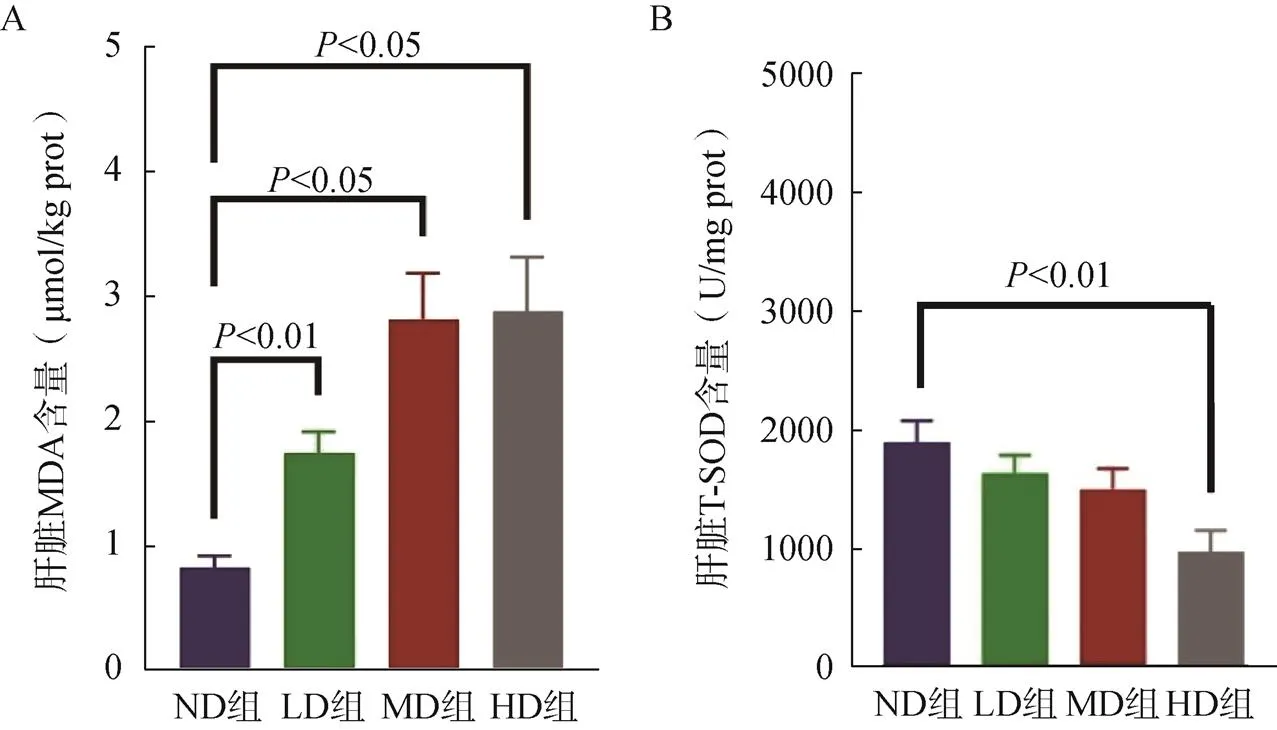
图4 小鼠肝脏氧化应激指标变化
A.小鼠肝脏丙二醛含量;B.小鼠肝脏总超氧化物歧化酶活性
3 讨论
越来越多的临床研究发现,孕期铁储备增加和GDM发生风险相关,这引起了临床医师对孕期普遍补铁的重视[10,14-15]。随着人们对孕期ID及IDA的重视以及生活水平的提高,许多妇女可能已经达到了膳食铁的推荐摄入量,无论她们是否贫血,都可能在孕前和孕期补充含有不同剂量铁元素的复合维生素或单纯铁剂,因此很有可能面临铁过量的风险。同时研究表明,孕期母体铁调素将受到抑制,这将促进膳食铁的吸收,可能使母体暴露于铁过量的状态下[5]。
本研究以C57BL/6小鼠为实验对象,通过向动物饲料中添加不同含量的枸橼酸铁,建立了孕鼠铁过量模型,观察对孕鼠糖代谢的影响和肝脏的损伤情况。根据各类指南共识的推荐剂量,在我国孕妇中补充铁剂的剂量范围为30~300mg/d元素铁,比我国膳食铁推荐摄入量20~29mg/d高出约15倍[16-18]。因此,为了模仿人类的孕期补铁,在本研究的小鼠饲料中铁含量范围与推荐给孕妇的比例相似,补铁组添加的铁含量在175~525mg/kg之间,比正常对照组(35mg/kg)高出5~15倍。
本实验中对照组和补铁组之间的摄食量没有差异,这表明摄食量对实验结果的干扰较小,该模型可以用来探究膳食铁过量对孕期糖代谢的影响。肝脏是全身铁稳态的关键器官,肝脏的铁含量被认为是代表机体铁状态的重要指标[19]。膳食铁缺乏时肝脏铁含量将显著降低,而铁过量时将增加[20]。随着膳食补铁剂量的不断增加,肝脏中的铁含量也逐渐增加。本研究结果显示,HD组和MD组小鼠的铁含量显著高于ND组,这说明通过中、高剂量的补铁成功建立了孕期铁过量的小鼠模型。
由于孕期的血糖水平随着妊娠时间的变化而不同,且小鼠的孕期为19~21d,因此本研究在孕0、6、12、18d动态监测小鼠的血糖[21]。既往的研究表明,膳食补铁可使小鼠FBG升高,膳食铁限制可降低FBG[22]。而在本研究结果中,补铁组小鼠的血糖水平与对照组之间差异无统计学意义,这可能是因为本研究的膳食铁含量较低,尚不足以引起小鼠糖代谢的紊乱。研究发现,膳食补铁可干扰葡萄糖的摄取和利用,导致妊娠大鼠的糖耐量减低,而铁耗竭可使胰岛素敏感度增加[23-24]。本研究中小鼠的OGTT结果显示,HD组在服糖30min及60min后的FBG高于ND组,这说明孕期膳食铁过量对小鼠糖代谢有一定的影响。由于孕期采血量过多易导致小鼠流产,因此,本研究仅在处死当天进行了FINS测量,结果显示,仅HD组空腹胰岛素和HOMA-IR显著高于ND组。这些结果均表明膳食补充高剂量铁会干扰胰岛素信号通路,并导致一定程度的胰岛素抵抗。
当自由基的生成速度超过机体的抗氧化能力时,就会导致氧化应激,氧化应激是胰岛素抵抗和糖尿病发展的主要上游事件[25]。当细胞内的游离铁增加时,羟基自由基的产生将会增加,进而促进氧化应激的发生。MDA通常用于反映细胞脂质过氧化的程度,间接反映细胞损伤的程度,而SOD作为机体最重要的抗氧化酶之一,通常与MDA共同测定用于反映机体的氧化应激水平[26]。研究表明,铁过量相关的氧化应激可能导致胰岛素抵抗和胰岛β细胞损伤;肝脏作为全身最大的代谢器官及机体主要的储铁器官,在胰岛素抵抗中发挥着关键作用,铁过量所诱发的氧化损伤将首先发生在肝脏[27]。因此,本研究测定了肝脏的氧化损伤标志物以反映铁过量对孕期氧化应激水平的影响。本研究结果显示,LD组、MD组、HD组小鼠MDA含量均显著高于ND组,仅HD组的SOD活性显著高于ND组。这表明当摄入过量铁时,机体脂质过氧化损伤增加,同时抗氧化作用也会增强,只有高剂量补铁时才会导致机体的氧化和抗氧化作用失衡,进而导致氧化应激的发生。
综上所述,本研究认为小鼠孕前及孕期过量摄入铁可以使小鼠肝脏的铁沉积增加,同时摄入高剂量的铁将导致肝脏组织出现一定程度的氧化损伤。过量摄入铁虽不会对小鼠FBG造成明显的影响,但却导致了糖耐量减低、高胰岛素血症和胰岛素抵抗。随着社会经济水平的提高,孕前及孕期膳食和各种营养素中铁元素的摄入量也逐渐增加,临床医生应警惕过量补铁的潜在风险,根据孕妇的个体铁代谢水平推荐合适的补铁方案,严密监测铁缺乏的指标,避免补铁过量可能带来的危害。
[1] YE W, LUO C, HUANG J, et al. Gestational diabetes mellitus and adverse pregnancy outcomes: systematic review and meta-analysis[J]. BMJ, 2022, 377: e067946.
[2] JOHNS E C, DENISON F C, NORMAN J E, et al. Gestational diabetes mellitus: mechanisms, treatment, and complications[J]. Trends Endocrinol Metab, 2018, 29(11): 743–754.
[3] LEE K W, CHING S M, RAMACHDRAN V,et al. Prevalence and risk factors of gestational diabetes mellitus in Asia: a systematic review and meta-analysis[J]. BMC Pregnancy Childbirth,2018, 18(1): 494.
[4] SUN C, WU Q J, GAO S Y,et al. Association between the ferritin level and risk of gestational diabetes mellitus: a meta-analysis of observational studies[J]. J Diabetes Investig, 2020, 11(3): 707–718.
[5] FISHER A L, NEMETH E. Iron homeostasis during pregnancy[J]. Am J Clin Nutr, 2017, 106(Suppl 6): 1567S–1574S.
[6] FISHER A L, SANGKHAE V, BALUSIKOUA K, et al. Iron-dependent apoptosis causes embryotoxicity in inflamedand obese pregnancy[J]. Nat Commun, 2021, 12(1): 4026.
[7] HAIDER B A, OLOFIN I, WANG M,et al. Anaemia, prenatal iron use, and risk of adverse pregnancy outcomes: systematic review and meta-analysis[J]. BMJ, 2013, 346: f3443.
[8] ZHANG X, WU M, ZHONG C, et al. Association between maternal plasma ferritin concentration, iron supplement use, and the risk of gestational diabetes: a prospective cohort study[J]. Am J Clin Nutr, 2021, 114(3): 1100–1106.
[9] CHENG Y, LI T, HE M,et al. The association of elevated serum ferritin concentration in early pregnancy with gestational diabetes mellitus: a prospective observational study[J]. Eur J Clin Nutr, 2020, 74(5): 741–748.
[10] ZHANG C, RAWAL S. Dietary iron intake, iron status, and gestational diabetes[J]. Am J Clin Nutr, 2017, 106(Suppl 6): 1672S–1680S.
[11] DONGIOVANNI P, RUSCICA M, RAMEETTA R,et al. Dietary iron overload induces visceral adipose tissue insulin resistance[J]. Am J Pathol, 2013, 182(6): 2254–2263.
[12] PETRY C J. Iron supplementation in pregnancy and risk of gestational diabetes: a narrative review[J]. Nutrients, 2022, 14(22): 4791.
[13] 刘俊秀, 贺木兰, 程琰, 等. 孕期补铁与妊娠期糖尿病关系的研究进展[J]. 中华围产医学杂志, 2017, 20(5): 393–396.
[14] RAWAL S, HINKLE S N, BAO W, et al. A longitudinal study of iron status during pregnancy and the risk of gestational diabetes: findings from a prospective, multiracial cohort[J]. Diabetologia, 2017, 60(2): 249–257.
[15] DURRANI L, EIAZ S, TAVARES L B, et al. Correlation between high serum ferritin level and gestational diabetes: a systematic review[J]. Cureus, 2021, 13(10): e18990.
[16] 中华医学会围产医学分会. 中国妊娠期铁缺乏和缺铁性贫血诊治指南[J]. 中华围产医学杂志, 2014, 17(7): 451–454.
[17] PAVORD S, DARU J, PRASANNAN N, et al. UK guidelines on the management of iron deficiency in pregnancy[J]. Br J Haematol, 2020, 188(6): 819–830.
[18] 中国营养学会膳食指南修订专家委员会妇幼人群膳食指南修订专家工作组. 孕期妇女膳食指南[J]. 中华围产医学杂志, 2016, 19(9): 641–648.
[19] PANTOPOULOS K, PORWAL S K, TARTAKOFF A, et al. Mechanisms of mammalian iron homeostasis[J]. Biochemistry, 2012, 51(29): 5705–5724.
[20] SANGKHAE V, FISHER A L, WONG S, et al. Effects of maternal iron status on placental and fetal iron homeostasis[J]. J Clin Invest, 2020, 130(2): 625–640.
[21] 任甲翠, 丁叶, 殷璐, 等. 高糖高脂饲料喂养时间对建立妊娠期糖尿病小鼠模型的影响[J]. 卫生研究, 2018, 47(1): 128–133.
[22] DONGIOVANNI P, RUSCICA M, RAMETTA R, et al. Dietary iron overload induces visceral adipose tissue insulin resistance[J]. Am J Pathol, 2013, 182(6): 2254–2263.
[23] HE M, JIANG J, LIU S, et al. Effect of iron supplementation on glucose transporter 4 expression in adipose tissue and skeletal muscle of pregnant rats[J]. OJOG, 2013, 3(6): 500–507.
[24] DONGIOVANNI P, VALENTI L, LUDOVICA FRACANZANI A, et al. Iron depletion by deferoxamine up-regulates glucose uptake and insulin signaling in hepatoma cells and in rat liver[J]. Am J Pathol, 2008, 172(3): 738–747.
[25] YARIBEVGI H, SATHVAPALAN T, ATKIN S L, et al. Molecular mechanisms linking oxidative stress and diabetesmellitus[J]. Oxid Med Cell Longev, 2020, 2020: 8609213.
[26] LIANG D, MINIKES A M, JIANG X. Ferroptosis at the intersection of lipid metabolism and cellular signaling[J]. Mol Cell, 2022, 82(12): 2215–2227.
[27] BACKE M B, MOEN I W, ELLERVIK C, et al. Iron regulation of pancreatic beta-cell functions and oxidative stress[J]. Annu Rev Nutr, 2016, 36: 241–273.
Effects of excessive iron intake on glucose metabolism and liver oxidative damage in pregnant mice
Department of Obstetrics, the Fourth Affiliated Hospital of Harbin Medical University, Harbin 150001, Heilongjiang, China
To investigate the effects of excessive iron intake on glucose metabolism and liver oxidative damage in pregnant mice.After two weeks of adaptation, twenty-eight SPF C57BL/6 female mice were divided into control group (ND group), low-dose iron supplement group (LD group), medium-dose iron supplement group (MD group) and high-dose iron supplement group (HD group) by block randomization based on body weight, the iron content was 35mg/kg, 175mg/kg, 350mg/kg and 525mg/kg, respectively. After two weeks of feeding, the male and female were in the same cage at a rate of 3∶1. Fasting blood glucose (FBG) was measured at 0d, 6d, 12d and 18d after pregnancy. Oral glucose tolerance test (OGTT) was performed at 17d after pregnancy. The level of serum fasting insulin (FINS) was measured and homeostasis model assessment of insulin resistance (HOMA-IR) was calculated at 17 d after pregnancy. The content of total iron ions, the concentration of malondialdehyde (MDA) and the activity of total superoxide dismutase (T-SOD) in liver were measured.The content of total iron ions of liver were significantly higher in HD group, and MD group than those in ND group (<0.05). There were no significant differences in the FBG between HD group, MD group, LD group and ND group at 0d, 6d, 12d, 18d after pregnancy. The blood glucose concentration of HD group was significantly higher than that of ND group at 30min, 60min after taking sugar (<0.05); FINS and HOMA-IR in HD group was significantly higher than those in ND group (<0.05). The content of MDA in liver of HD group, MD group and LD group was significantly higher than those of ND group (<0.05); however, only the activity of T-SOD in HD group was significantly lower than that in ND group (<0.05).Dietary supplementation of medium and high doses of iron before and during pregnancy can significantly increase iron storage in liver of mice, however, only high doses of iron supplementation can lead to a certain degree of oxidative damage to the liver of pregnant mice, as well as insulin resistance, hyperinsulinemia and impaired glucose tolerance.
Mice; Iron excess; Pregnancy; Glucose metabolism; Oxidative stress
R714
A
10.3969/j.issn.1673-9701.2023.29.016
蔡雁,电子信箱:caiyan318@126.com
(2022–12–19)
(2023–09–02)
