基于NK细胞亚群与调节性T细胞的前列腺癌风险评估研究
2023-11-01马权陈永良王楷峰田伟
马权,陈永良,王楷峰,田伟
基于NK细胞亚群与调节性T细胞的前列腺癌风险评估研究
马权,陈永良,王楷峰,田伟
绍兴市中心医院泌尿外科,浙江绍兴 312000
探讨自然杀伤(natural killer,NK)细胞亚群和调节性T(regulatory T,Treg)细胞在前列腺癌患者外周血中的表达及其与前列腺癌的关系。选取2020年9月至2022年2月绍兴市中心医院收治的51例前列腺癌患者作为观察组,52例同期健康体检者作为对照组。采用流式细胞术检测两组患者外周血中NK细胞亚群和Treg细胞比例,分析不同TNM分期和Gleason评分的前列腺癌中NK细胞亚群、Treg细胞表达差异及相关性。观察组CD56brightCD16-、CD56dimCD16+明显小于对照组(<0.05),Treg细胞水平明显大于对照组(<0.05);不同TNM分期和Gleason评分的前列腺癌患者CD56brightCD16-、Treg细胞水平比较,差异有统计学意义(<0.05)。Spearman相关性分析显示,CD56brightCD16-与前列腺癌TNM分期及Gleason评分呈负相关(<0.05),Treg细胞与前列腺癌TNM分期及Gleason评分呈正相关(<0.05)。CD56brightCD16-水平的下降以及Treg水平的升高,与前列腺癌的发生、发展密切相关,其可能成为临床评估前列腺癌恶性程度及判断预后的特异性指标,为前列腺癌的诊治提供新思路。
NK细胞;调节性T细胞;前列腺癌;免疫功能;流式细胞术
目前前列腺癌已成为我国男性泌尿系统中发病率及死亡率最高的恶性肿瘤,对男性健康造成严重威胁[1]。越来越多的研究表明,前列腺癌的发生、发展与机体免疫功能密切相关[2-3]。自然杀伤(natural killer,NK)细胞是具有直接杀伤功能的天然免疫细胞,主要分为CD56brightCD16–和CD56dimCD16+亚群,具有监视恶性病变细胞的作用,构成了机体抗肿瘤的第一道防线。CD4+CD25+CD127low调节性T(regulatory T,Treg)细胞是具有免疫抑制能力的T细胞,既能防止人体产生自身免疫性疾病,又能促进肿瘤细胞发生免疫逃逸[3]。目前,NK细胞亚群和Treg细胞与前列腺癌发生、发展各阶段关系的探讨有限。本研究通过流式细胞术检测,探究NK细胞亚群(CD56brightCD16–和CD56dimCD16+)和CD4+CD25+CD127lowTreg细胞在前列腺癌患者外周血中的表达情况及其与前列腺癌各阶段的关系,以期为前列腺癌的诊治提供新思路。
1 资料与方法
1.1 临床资料
收集2020年9月至2022年2月绍兴市中心医院收治的51例前列腺癌患者作为观察组,52例同期健康体检者作为对照组,纳入标准:①经前列腺穿刺活检确诊为前列腺癌;②在检查前未接受过前列腺癌相关治疗。排除标准:①伴有急性或慢性炎症;②患自身免疫性疾病或接受过免疫调节类药物;③患有其他恶性肿瘤;④临床资料不完整。本研究经绍兴市中心医院伦理委员会审核批准(伦理审批号:2023伦审论第004号),研究对象均签署知情同意书。
1.2 方法
观察组患者穿刺前抽取新鲜外周血,对照组人群体检时空腹抽取新鲜外周血,两组均以乙二胺四乙酸(ethylene diamine tetraacetie acid,EDTA)抗凝。流式细胞仪:NovoCyte 2060R[安捷伦生物(杭州)有限公司]、DiagCyto[科技(浙江)有限公司]。检测试剂:CD3、CD4、CD16、CD25、CD56、CD127检测试剂及溶血素[科技(浙江)有限公司]。取抗体(不同项目加入不同抗体)加入流式管中,将混匀后的EDTA抗凝血样本置于流式管底部,低速涡旋混匀,室温下避光孵育15min。加入2ml(1×)UB Lysis solution置于流式管中,低速涡旋混匀,室温下避光孵育15min。室温下300×离心5min,弃去上清,加入2ml磷酸盐缓冲液(phosphate buffer saline,PBS),低速涡旋混匀。室温下300×离心5min,弃去上清,加入500μl 1%多聚甲醛。上机检测,如无法立即检测,将样本放置在2~8℃下避光储存(在细胞收获/染色/裂解程序的24h内完成),上机检测前涡旋混匀。核查检测项目包括NK细胞亚群(CD56brightCD16-、CD56dimCD16+)、Treg细胞(CD4+CD25+CD127low)。
1.3 统计学方法
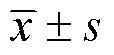
2 结果
2.1 两组一般资料比较
两组年龄、体质量指数比较,差异均无统计学意义(>0.05)。观察组前列腺特异性抗原(prostate specific antigen,PSA)、Treg大于对照组,观察组CD56brightCD16–、CD56dimCD16+小于对照组,差异均有统计学意义(<0.05),见表1。
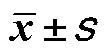
表1 两组一般资料比较()
2.2 观察组不同TNM分期及Gleason评分患者NK细胞亚群及Treg细胞水平比较
观察组不同TNM分期及GLeason评分患者CD56brightCD16–、Treg细胞比较,差异均有统计学意义(<0.05),不同TNM分期及GLeason评分患者CD56dimCD16+比较,差异均无统计学意义(>0.05),见表2、表3。
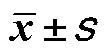
表2 不同TNM分期前列腺癌患者外周血中NK细胞亚群及Treg细胞水平比较()
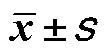
表3 不同Gleason评分前列腺癌患者外周血中NK细胞亚群以及Treg细胞水平比较()
2.3 NK细胞亚群与Treg细胞水平与前列腺癌TNM分期及Gleason评分的相关性分析
Spearman相关性分析结果显示,CD56brightCD16–与前列腺癌TNM分期及Gleason评分呈负相关(<0.05),Treg细胞与前列腺癌TNM分期及Gleason评分呈正相关(<0.05),CD56dimCD16+与前列腺癌TNM分期及Gleason评分无显著相关(>0.05),见表4。
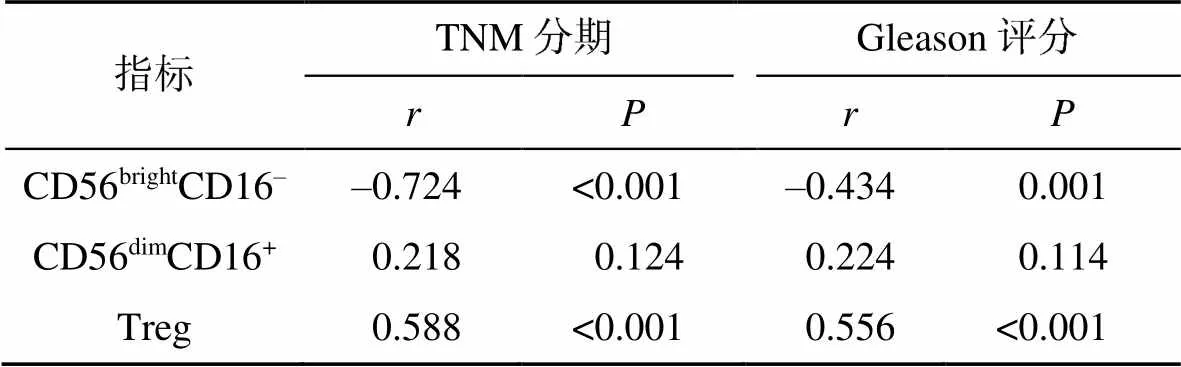
表4 前列腺癌患者外周血中NK细胞亚群及Treg细胞水平与前列腺癌TNM分期及Gleason评分的相关性分析
3 讨论
随着人口老龄化、饮食习惯的改变,前列腺癌发病率呈现逐年升高趋势,已成为男性泌尿生殖系统最常见的恶性肿瘤。目前已有研究表明,适应性或先天性免疫细胞参与了前列腺癌的发生、进展、转移和治疗[4]。因此,及时了解前列腺癌患者免疫状态具有十分重要的意义。
NK细胞是一种先天性淋巴细胞,占循环淋巴细胞5%~20%,具有细胞毒作用和免疫调节功能,无需致敏,即可非特异性地识别并快速消灭肿瘤细胞,同时还能分泌细胞因子来促进适应性免疫抵抗肿瘤,在免疫监视和免疫清除方面发挥重要作用。在人体内,NK细胞由位于骨髓中的CD34+造血干细胞分化而来,主要特征为CD3-CD56+淋巴细胞群。根据CD56表达水平可分为CD56bright和CD56dim两种亚型,CD56brightCD16-具有高分泌细胞因子的作用和较低的细胞毒性,而CD56dimCD16+具有更高的细胞毒性[5]。NK细胞抗肿瘤功能主要通过释放穿孔素及颗粒酶裂解靶细胞、受体介导细胞凋亡、分泌各种细胞因子及通过抗体依赖性细胞介导的细胞毒作用来实现。NK细胞数量及细胞活性的降低使得抗肿瘤能力弱化,进而导致机体患癌风险升高[6]。目前已有研究表明,较低的NK细胞活性与前列腺癌患病风险升高及术后切缘阳性密切相关,NK细胞水平的降低与前列腺癌进展呈正相关[7-9]。有研究基于外周血NK细胞亚群的变化建立机器学习模型预测前列腺癌患病风险,认为其可能成为前列腺癌诊断的新方法。Koo等[10]研究发现,在前列腺癌患者中NK细胞亚群CD56brightCD16–的减少可能先于NK细胞活性值的降低,且随着病情加重,CD56brightCD16–水平也随之逐渐降低,这或许是NK细胞功能障碍背后的机制之一。本研究结果显示,前列腺癌患者外周血中CD56brightCD16–、CD56dimCD16+明显低于健康人群,且随着前列腺癌的进展及Gleason评分的升高,CD56brightCD16–水平也随之下降,这些NK细胞亚群的降低可能导致NK细胞活性降低,进而导致前列腺癌细胞发生免疫逃逸。
Treg是CD4+T细胞的一个亚群,具有抑制自身免疫及促进肿瘤细胞免疫逃逸的作用,目前认为CD4+CD25+CD127low是较理想的检测Treg的分子表面标志。近年来研究显示,在多种实体肿瘤中均发现了浸润性Treg,其水平与肿瘤的进展和预后密切相关[11]。去除Treg细胞或封闭其抑制功能,可增强抗肿瘤免疫效应,提示机体可能处于一种免疫抑制状态,更是Treg细胞参与肿瘤免疫逃逸的有力佐证[12]。2006年,Miller等[13]研究发现,与正常前列腺组织相比,前列腺癌组织中的Treg细胞水平显著升高,其具有免疫抑制作用,参与了早期前列腺癌的形成。Davidsson等[14]的研究进一步发现,在前列腺癌组织中,Treg细胞水平往往与Gleason评分及病理分期呈负相关,并且Treg细胞的存在可能促使前列腺癌形成。此外,与健康人群相比,前列腺癌患者外周血中Treg细胞显著升高,免疫抑制功能也更强[13,15-16]。本研究也发现,与健康人群相比,前列腺癌患者外周血Treg细胞水平明显升高,并且随着前列腺癌的进展及Gleason评分的升高,Treg细胞水平也随之升高,提示前列腺癌患者免疫功能失调与外周血Treg细胞水平升高有关,前列腺癌的发生、进展与机体免疫功能抑制有密切相关。
综上所述,NK细胞亚群和Treg细胞能较好地反映前列腺癌患者免疫功能状态,CD56brightCD16-和Treg参与前列腺癌的发生、发展,可能成为临床评估前列腺癌恶性程度及判断预后的特异性指标,为前列腺癌的诊治提供新思路。但是本研究是回顾性研究,样本量较小,存在一定的偏差,因此,NK细胞亚群和Treg细胞在前列腺癌外周血的表达及相关性有待于大样本、多中心的研究进一步验证。
[1] Health Commission of PRCN. Chinese guidelines for diagnosis and treatment of prostate cancer 2018 (English version)[J]. Chin J Cancer Res, 2019, 31(1): 67–83.
[2] WEINER A B, VIDOTTO T, LIU Y, et al. Plasma cells are enriched in localized prostate cancer in Black men and are associated with improved outcomes[J]. Nat Commun, 2021, 12(1): 935.
[3] 陈良佑, 朱再生, 童建勇, 等. 前列腺癌患者外周血Th17/Treg细胞的变化及意义[J]. 中国卫生检验杂志, 2017, 27(21): 3108–3110.
[4] WANG C, ZHANG Y, GAO W Q. The evolving role of immune cells in prostate cancer[J]. Cancer Lett, 2022, 525: 9–21.
[5] PERERA M A A. Human NK cells: From development to effector functions[J]. Innate Immun, 2021, 27(3): 212–229.
[6] IMAI K, MATSUYAMA S, MIYAKE S, et al. Natural cytotoxic activity of peripheral-blood lymphocytes and cancer incidence: an 11-year follow-up study of a general population[J]. Lancet, 2000, 356(9244): 1795–1799.
[7] VIDAL A C, HOWARD L E, WIGGINS E, et al. Natural killer cell activity and prostate cancer risk in veteran men undergoing prostate biopsy[J]. Cancer Epidemiol, 2019, 62: 101578.
[8] LU Y C, KUO M C, HONG J H, et al. Lower postoperative natural killer cell activity is associated with positive surgical margins after radical prostatectomy[J]. J Formos Med Assoc, 2020, 119(11): 1673–1683.
[9] GANNON P O, POISSON A O, DELVOYE N, et al. Characterization of the intra-prostatic immune cell infiltration in androgen-deprived prostate cancer patients[J]. J Immunol Methods, 2009, 348(1-2): 9–17.
[10] KOO K C, SHIM D H, YANG C M, et al. Reduction of the CD16(-)CD56bright NK cell subset precedes NK cell dysfunction in prostate cancer[J]. PLoS One, 2013, 8(11): e78049.
[11] DRANOFF G. The therapeutic implications of intratumoral regulatory T cells[J]. Clin Cancer Res, 2005, 11(23): 8226–8229.
[12] SAVAGE P A, MALCHOW S, LEVENTHAL D S. Basic principles of tumor-associated regulatory T cell biology[J]. Trends Immunol, 2013, 34(1): 33–40.
[13] MILLER A M, LUNDBERG K, OZENCI V, et al. CD4+CD25high T cells are enriched in the tumor and peripheral blood of prostate cancer patients[J]. J Immunol, 2006, 177(10): 7398–7405.
[14] DAVIDSSON S, ANDREN O, OHLSON A L, et al. FOXP3+regulatory T cells in normal prostate tissue, postatrophic hyperplasia, prostatic intraepithelial neoplasia, and tumor histological lesions in men with and without prostate cancer[J]. Prostate, 2018, 78(1): 40–47.
[15] 章步文, 黎钢, 叶津津, 等. 不同分期前列腺癌患者外周血CD4+CD25+Foxp3+调节性T细胞的变化及与胰岛素抵抗的相关性[J]. 中华男科学杂志, 2015, 21(5): 420–423.
[16] EBELT K, BABARYKA G, FRANKENBERGER B, et al. Prostate cancer lesions are surrounded by FOXP3+, PD-1+ and B7-H1+ lymphocyte clusters[J]. Eur J Cancer, 2009, 45(9): 1664–1672.
Prostate cancer risk assessment based on NK cell subsets and regulatory T cells
Department of Urology, Shaoxing Central Hospital, Shaoxing 312000, Zhejiang, China
To investigate the expression of natural killer (NK) cell and regulatory T (Treg) cell in peripheral blood of patients with prostate cancer and their relationship with prostate cancer.Fifty-one patients with prostate cancer who were admitted to Shaoxing Central Hospital from September 2020 to February 2022 were selected as the observation group, and 52 healthy subjects who underwent physical examination during the same period were selected as the control group. Flow cytometry was used to detect the proportion of NK cell subsets and Treg cell in peripheral blood of the two groups, and to analyze the difference and correlation of NK cell subsets and Treg cell expression in prostate cancer with different TNM stages and Gleason score.The levels of CD56brightCD16-and CD56dimCD16+in the observation group were significantly lower than those in the control group (<0.05), and the levels of Treg cell were significantly higher than those in the control group (<0.05). There were significant differences in CD56brightCD16-and Treg cell levels in prostate cancer patients with different TNM stage and Gleason score (<0.05). Spearman correlation analysis showed that CD56brightCD16-was negatively correlated with TNM stage and Gleason score (<0.05), while Treg cell was positively correlated with TNM stage and Gleason score (<0.05).NK cell subsets and Treg cell can better reflect the immune function of prostate cancer patients and are closely related to the occurrence and development of prostate cancer. They may become specific indicators for clinical evaluation of the malignancy degree and prognosis of prostate cancer, and provide new ideas for diagnosis and treatment of prostate cancer.
NK cells; Regulatory T cells; Prostate cancer; Immune function; Flow cytometry
R737
A
10.3969/j.issn.1673-9701.2023.29.003
浙江省医学会临床科研基金项目(2019ZYC-A146);柯桥区社发类经费自筹科技计划项目(2020KZ07)
陈永良,电子信箱:729917300@qq.com
(2023–01–12)
(2023–09–05)
