重型β地中海贫血儿童异基因造血干细胞移植后并发出血性膀胱炎的危险因素分析
2023-11-01陈晓玲罗小娟曹科黄涛罗远桂杨春兰陈运生
陈晓玲 罗小娟 曹科 黄涛 罗远桂 杨春兰 陈运生
(1.汕头大学医学院深圳儿科临床学院,广东深圳 518038;2.深圳市儿童医院检验科,广东深圳 518038;3.深圳市儿童医院血液肿瘤科,广东深圳 518038)
异基因造血干细胞移植 (allogeneic hematopoietic stem cell transplantation, allo-HSCT)是指通过大剂量放化疗预处理,清除受者体内的肿瘤或异常细胞,再将异体造血干细胞移植给受者,使受者重建正常造血及免疫系统[1]。而出血性膀胱炎(hemorrhagic cystitis, HC)是allo-HSCT 后常见并发症之一,会直接影响移植患者的生活质量和成功率[2]。HC 的诊断和治疗在整个造血干细胞移植过程中占有非常重要的地位,相关致病因素也已经成为临床关注的焦点。我国儿童造血干细胞移植起步较晚,目前对于重型β地中海贫血(β-thalassemia major, TM)患儿allo-HSCT 后并发HC的病因尚不明确,缺乏早期识别和诊断指标。本研究回顾性分析在深圳市儿童医院进行allo-HSCT的247 例TM 患儿的临床资料,探讨TM 患儿allo-HSCT 后并发HC 的独立危险因素,并采用受试者操作特征曲线(receiver operator characteristic curve, ROC 曲线)验证其诊断意义,为HC 的早期识别和诊断提供依据。
1 资料与方法
1.1 研究对象
回顾性分析2021 年1 月—2022 年11 月在深圳市儿童医院进行allo-HSCT的247例TM患儿的临床资料。纳入标准:(1)18 岁以下儿童;(2)确诊为TM;(3) 在深圳市儿童医院行allo-HSCT;(4)定期监测血EB 病毒核酸(Epstein-Barr virus deoxyribonucleic acid, EBV-DNA)、人巨细胞病毒核酸(human cytomegalovirus deoxyribonucleic acid,HCMV-DNA) 和尿BK 病毒核酸(BK virus deoxyribonucleic acid, BKV-DNA)、JC 病毒核酸(JC virus deoxyribonucleic acid, JCV-DNA) 载量;(5)临床资料和实验室检查完整。排除标准:(1)同基因或自体造血干细胞移植的患儿;(2)α地中海贫血、其他复合型地中海贫血患儿;(3)明确存在泌尿系统细菌、真菌感染和占位性病变等患儿。
根据《造血干细胞移植治疗重型β地中海贫血儿科专家共识》[3],采用NF-08-TM 移植预处理方案,即白消安+环磷酰胺+氟达拉滨+塞替派。
1.2 诊断标准
HC的诊断标准[4]包括:(1)既往有放疗、化疗或病毒感染史及其他药物史;(2)临床表现轻重不一,典型表现为镜下或肉眼血尿,可伴尿频、尿急、尿痛等膀胱刺激征,严重者可引起尿路梗阻、肾衰竭;(3)尿培养及真菌培养均为阴性;(4)需排除其他引起膀胱出血的疾病如尿路感染、血管内溶血、血小板减少所致的出血、泌尿系结石及肿瘤等。以术后是否并发HC,分为HC 组(91例)和非HC组(156例)。
1.3 BKV-DNA、JCV-DNA、EBV-DNA和HCMVDNA检测方法及阳性判断标准
采用实时荧光定量PCR 技术检测尿液标本中BKV-DNA、JCV-DNA 和血液标本中EBV-DNA、HCMV-DNA 含量。包括标本前处理、病毒核酸提取和核酸扩增3步。标本前处理:用无菌尿管留取2~5 mL 尿液,取1 mL 于EP 管中。病毒核酸提取:采用磁珠法对测定样本中的核酸进行提取。提取过程由Thermo公司KingFisher Flex全自动核酸提取仪完成。核酸扩增,采用上海宏石全自动荧光定量PCR仪进行检测。尿BKV-DNA和JCV-DNA实时荧光定量PCR 扩增反应体系分别应用北京鑫诺美迪基因检测技术有限公司的BKV-DNA和JCV-DNA检测试剂盒,血EBV-DNA和HCMV-DNA核酸扩增使用圣湘生物科技股份有限公司产品,采用LightCycier 480 实时荧光定量PCR 仪进行检测。按试剂盒说明书进行操作。
以患儿尿液中BKV-DNA 或JCV-DNA>2.00×
103拷贝/mL 为检测阳性;血液中EBV-DNA 和HCMV-DNA>4.00×102拷贝/mL为检测阳性。
1.4 统计学分析
数据处理与分析采用SPSS 26.0软件。计数资料以例数和率(%)表示,组间比较用χ2检验。计量资料以中位数(范围)表示,组间比较用Mann-WhitneyU检验。将单因素分析中P<0.1的变量纳入多因素logistic 回归分析。诊断价值用ROC 曲线分析,在P<0.05前提下,曲线下面积(area under the curve, AUC)越大,诊断效能越大。0.5<AUC≤0.7时准确性较低,0.7<AUC≤0.9时有一定准确性,AUC>0.9时准确性较高。P<0.05为差异有统计学意义。
2 结果
2.1 allo-HSCT后并发HC的单因素分析
247 例allo-HSCT TM 患儿中, 男157 例(63.6%),女90例(36.4%),中位年龄7.9(范围:2.6~17.7)岁,HC的发病率为36.8%(91/247)。单因素分析显示,年龄≥7 岁、供受者血型不一致、发生急性移植物抗宿主病(acute graft-versus-host disease, aGVHD)、尿BKV-DNA阳性和≥2种病毒感染的患儿在allo-HSCT 后容易并发HC(P<0.05),见表1。
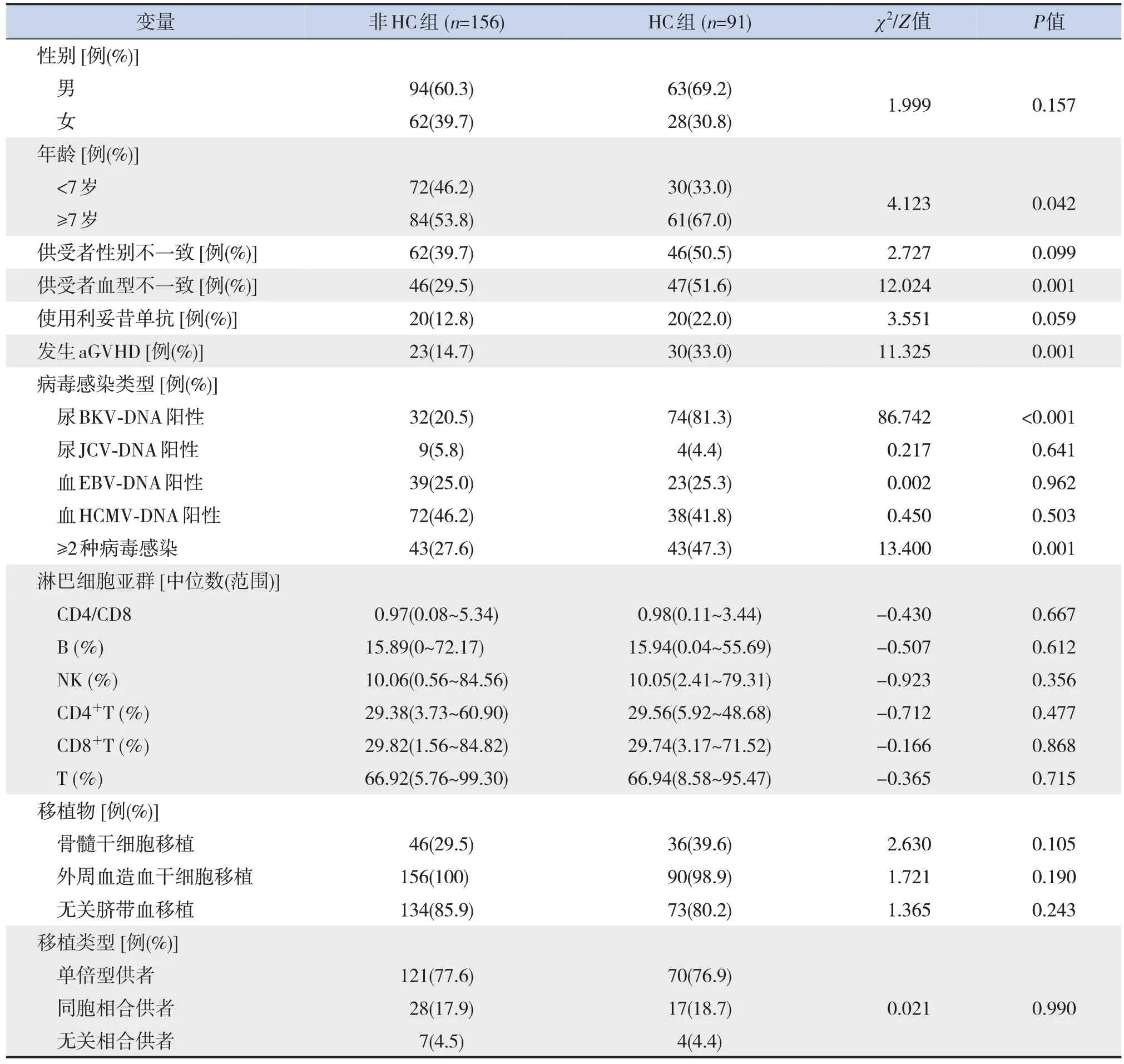
表1 allo-HSCT后并发HC的单因素分析
2.2 allo-HSCT 后并发HC 的多因素logistic 回归分析
多因素logistic 回归分析显示,供受者血型不一致、发生aGVHD 和尿BKV-DNA 阳性均为allo-HSCT 后并发HC 的独立危险因素(P<0.05),其中尿BKV-DNA 阳性时,风险因子较大(OR=21.878),见表2。
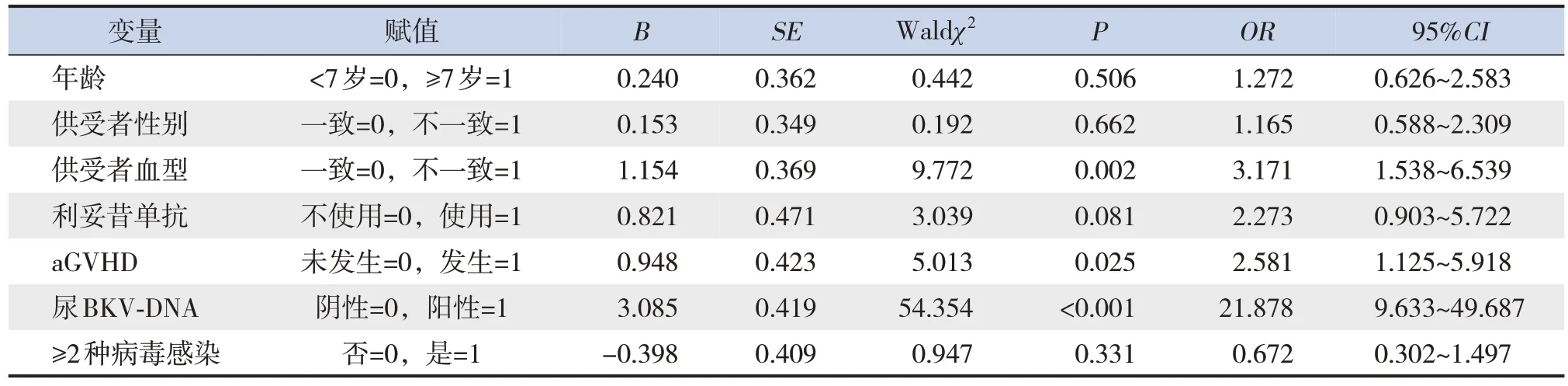
表2 allo-HSCT后并发HC的多因素logistic回归分析
2.3 不同指标预测allo-HSCT 后并发HC 的ROC曲线分析
供受者血型不一致预测allo-HSCT 后并发HC的AUC 为0.611,发生aGVHD AUC 为0.591,尿BKV-DNA阳性AUC为0.804,以上3项指标联合预测allo-HSCT 后并发HC 的AUC 为0.854 (均P<0.05)。其中,尿BKV-DNA阳性单一因素或联合其他2 种危险因素(发生aGVHD、供受者血型不一致)预测allo-HSCT 后并发HC 具有一定的准确性。见图1和表3。
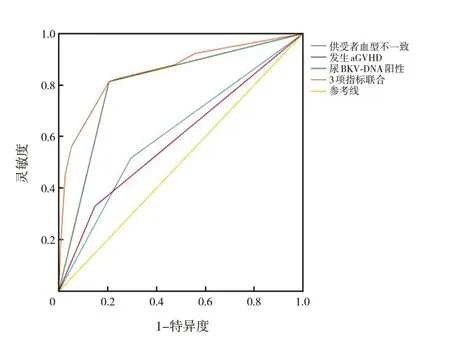
图1 不同指标预测allo-HSCT后并发HC的ROC曲线分析
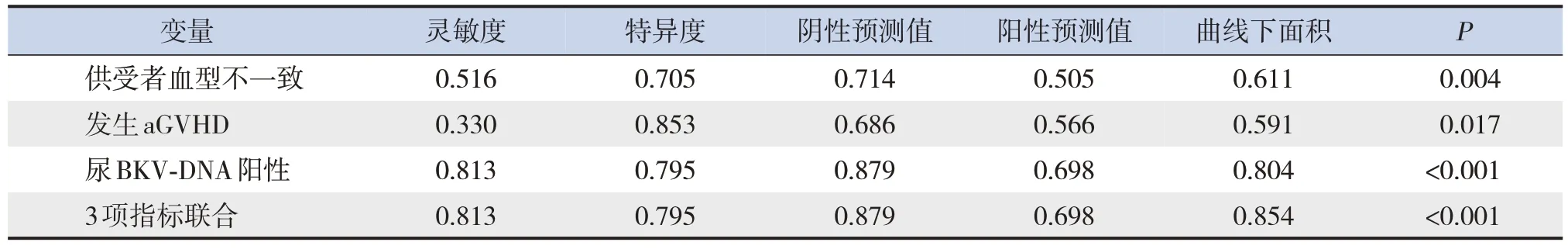
表3 allo-HSCT后并发HC的ROC曲线分析
3 讨论
对于输血依赖性地中海贫血患儿的管理策略包括输血、脾切除、铁螯合剂去铁治疗及allo-HSCT等,allo-HSCT是目前唯一根治TM的方法[5],而HC 是allo-HSCT 的常见并发症之一,是移植后防治的重点[6]。本研究仅以接受allo-HSCT 的TM患儿为研究对象,一方面是因为allo-HSCT 患儿以TM为主,其他类型较少;另一方面,HC的发生发展可能与原发病类型、预处理放化疗药物毒性、病毒感染、移植物抗宿主病、患儿年龄性别、供者类型和移植方式等有关,相关因素复杂多样且相互作用。不同的原发病类型和不同类型的地中海贫血在预处理方案及预防移植物抗宿主病的用药上有较大差异,也可能是并发HC 的影响因素。因此,尽量控制变量的复杂多样性,更有利于HC危险因素的识别。本研究显示,原发病为TM患儿进行allo-HSCT后并发HC的发生率为36.8%,这与Jiang等[7]和李莹等[8]的研究结果相近。
本研究以7 岁为界限分析不同年龄段allo-HSCT 后并发HC 的概率,年龄截断值与《造血干细胞移植治疗重型β 地中海贫血儿科专家共识》[3]年龄界限分析一致。结果显示,较大年龄(≥7岁)allo-HSCT患儿并发HC概率显著升高,差异有统计学意义。这与康栋梁等[5]和徐宏贵等[9]的研究一致,这可能是因为幼儿中枢神经系统及泌尿系统发育不成熟,缺乏意识性排尿,排尿次数的增加使得药物在膀胱内的停留时间减少,减少了对膀胱黏膜的刺激有关。
本研究发现发生aGVHD 的患儿并发HC 的概率升高,这与李祎[10]和叶璐等[11]的研究一致。这可能是由于aGVHD 本身会造成多器官损伤,而膀胱作为一个靶向器官遭到直接攻击,导致膀胱黏膜上皮细胞损伤和出血。同时针对aGVHD 的大量免疫抑制剂使用,极易造成病毒感染和大量复制,而病毒介导的固有免疫信号导致免疫攻击引起细胞病变、剥脱,或T淋巴细胞对病毒抗原的攻击使黏膜损伤持续存在,增加HC的概率[4,12]。
研究报道,BKV、JCV、EBV 和HCMV 感染均与儿童allo-HSCT 后引起HC 密切相关[13-15]。本研究发现,尿BKV-DNA 阳性和≥2 种病毒感染时,allo-HSCT 后并发HC 的概率显著升高,并且,尿BKV-DNA 阳性是allo-HSCT 后并发HC 的独立危险因素。BK 病毒是多瘤病毒科人多瘤病毒属,为DNA 病毒。感染通常发生在童年时期。在最初感染后,BK 病毒保持休眠状态,对于健康人群不造成严重症状[16]。有报道称,免疫抑制剂会导致病毒特异的记忆T细胞减少,容易引起原发性病毒感染或再激活,病毒通过血行感染、尿路逆行感染或胃肠道局部淋巴结播散等途径入侵膀胱黏膜,进而导致HC发生[4,17]。
国内孙春红等[1]和熊艺颖等[6]研究显示,血HCMV-DNA 阳性和aGVHD 是并发HC 的独立危险因素,但由于移植后未定期监测尿BKV-DNA 含量,故无法将其纳入因素分析。目前国外研究针对病毒相关HC研究多聚焦于BKV,近50%的allo-HSCT 患者尿液可检出BKV[18]。Bielorai 等[19]研究表明,HCMV 感染并不直接引起HC,而是通过促进BKV的扩增进而实现HC的发生发展,HCMV血症或移植物抗宿主病的存在可能有助于低拷贝数的BKV进展为HC。本研究通过ROC曲线验证了尿BKV-DNA 阳性对HC 的诊断具有一定的准确性(AUC=0.804),提示相对于血HCMV-DNA 而言,定期监测尿BKV-DNA 对HC 的早期诊断及治疗具有更加重要的临床意义,尿BKV-DNA 阳性可预测HC的发生并可作为抢先治疗的依据。
本研究发现供受者血型不一致也是allo-HSCT后并发HC 的独立危险因素。这与任瑞瑞等[20]研究一致。王显丁等[21]研究表明,血型抗原不仅在红细胞表达,也在血小板、白细胞、内皮细胞、黏膜上皮细胞等表达。所以,当供受者血型不一致时,受者的膀胱黏膜上皮细胞可能也因血型不合而受到一定的损伤,从而导致HC的发生。
综上所述,供受者血型不一致、发生aGVHD和尿BKV-DNA 阳性为allo-HSCT 后患儿并发HC 的独立危险因素。尿BKV-DNA 阳性单一因素或联合其他2种危险因素,对诊断allo-HSCT后并发HC具有一定的准确性,定期监测尿BKV-DNA 对早期诊断及治疗具有积极意义。
利益冲突声明:所有作者均声明无利益冲突。
