儿童眼肌型重症肌无力不同免疫抑制剂治疗方案的回顾性分析
2023-11-01王蕊艳陈辉黄志新陈勇钟建民
王蕊艳 陈辉 黄志新 陈勇 钟建民
(江西省儿童医院神经内科,江西南昌 330038)
重症肌无力(myasthenia gravis, MG)是常见的自身免疫性疾病,全球年发病率为(8~10)/100万[1]。既往研究表明乙酰胆碱受体抗体介导的体液免疫反应和T细胞介导的细胞免疫反应可能是其主要发病机制[2]。根据受累肌群的不同,MG可分为眼肌型MG(ocular myasthenia gravis, OMG)和全身型MG,其中OMG 多发于儿童期。目前儿童OMG 尚无公认的标准治疗方案,糖皮质激素(glucocorticoid, GC)起效快、价格低廉,是主要治疗药物之一[3]。但长期使用GC治疗可导致诸多不良反应,包括肥胖、高血压、高血糖、骨质疏松等[4],对儿童身心发育造成很大影响。如何改善用药方案,以减少GC不良反应成为临床工作者关注的重点问题。已有研究报道,添加免疫抑制剂可减少GC剂量,从而减少GC引起的不良反应[5]。但免疫抑制剂种类繁多,疗效及不良反应不确切,药物选择、具体使用方法、临床安全性等问题尚无明确定论,且应用于儿童的研究较少。本研究通过对2018—2023 年我院OMG 患儿使用不同免疫抑制剂治疗方案的疗效及安全性进行分析,以期为优化儿童OMG的临床用药方案提供依据。
1 资料与方法
1.1 研究对象
回顾性选择2018年2月—2023年2月在我院神经内科住院及门诊治疗的OMG 患儿130 例为研究对象。纳入标准:(1)符合中国免疫学会神经免疫分会制定的诊断标准[6];(2)年龄2~18 岁;(3)随访时间>12个月;(4)临床资料完整。排除标准:(1)合并严重系统性疾病者;(2)对本研究所用药物过敏者。
1.2 分组方案
GC 组根据Lindberg 等[7]治疗方案,静脉滴注甲泼尼龙15 mg/(kg·d),连续3 d,停4 d 后再次使用,共用3个疗程。随后改为口服泼尼松,每日顿服1 mg/kg,每2 周减5 mg;降低至每日0.75 mg/kg时,每1个月减5 mg;降低至每日0.5 mg/kg时,每2个月减5 mg;直至每日20 mg,维持2个月;后每日15 mg,维持3 个月;后每日10 mg,维持6个月。
加用免疫抑制剂患儿初始GC 方案同GC 组,改为口服泼尼松时,加用不同的免疫抑制剂。吗替麦考酚酯(mycophenolate mofetil, MMF)组加用MMF (上海罗氏制药有限公司,国药准字H20031240),第1~3天、第4~6天、第7~9天剂量依次是0.5、1、1.5 mg/(kg·d),维持剂量为4 mg/(kg·d)。氨甲蝶呤(methotrexate, MTX)组加用MTX(通化茂祥制药有限公司,国药准字H22022674),起始剂量为5 mg/m2,疗效欠佳时加至15 mg/m2;他克莫司(tacrolimus, FK506)组加用FK506(爱尔兰Astellas 公司;国药集团川抗制药有限公司,国药准字H20083943;浙江弘盛药业有限公司,国药准字H20133162) 以0.0375~0.0500 mg/(kg·d)起始,每隔7 d 增加0.0375~0.0500 mg/kg,分2 次口服,均在餐前1 h 服药。剂量改变且维持7 d 后检查血药谷浓度(谷浓度维持在20 ng/mL 以下),适当调整剂量。当患儿达到美国重症肌无力基金协会工作组规定的最轻微表现或更好状态且维持1个月以上[8],可尝试逐步减停GC。
1.3 评价量表
重症肌无力定量评分量表(Quantitative Myasthenia Gravis, QMG)是美国重症肌无力基金协会推荐进行MG临床试验优先选用的工具,重症肌无力日常活动量表(Myasthenia Gravis Activities of Daily Living, MG-ADL)用于对MG患者生活质量的定量评价[9]。QMG 与MG-ADL 分别包括13 个项目和8个项目,各项目评分均由轻至重评0~3分。分别于给药当天及治疗1、3、6、9、12 个月时进行量表评价,测评均在患儿回院复诊时由主治医师面对面询问,并记录测评结果。
1.4 临床疗效标准
根据治疗前后MG-ADL 评分情况进行疗效判定,改善≥90%为痊愈,50%~89%为显效,25%~49%为好转,<25%为无效[8]。有效率=(痊愈+显效+好转)例数/总例数×100%。
1.5 不良反应
不良反应包括GC 不良反应(满月脸、肥胖、高血糖、骨质疏松、高血压等)、胃肠道反应、白细胞降低、肝功能损害等。
满月脸判定标准:患儿面如满月、皮肤发红,伴皮质醇水平增高且昼夜节律消失,地塞米松抑制试验阳性者。肥胖判定标准参照2009 年《中国0~18 岁儿童、青少年身高、体重的标准化生长曲线》 标准[10]。高血糖判定标准:空腹血糖≥7.0 mmol/L 或餐后血糖≥11.1 mmol/L。骨质疏松判定标准:双能X线骨密度Z<-2。高血压判定标准:参考美国儿科学会2017 年发布的儿童、青少年高血压筛查与管理临床实践指南[11]及中国高血压防治指南[12],经3 个或以上时间点测量血压,婴幼儿、学龄前期儿童、学龄期儿童、13 岁以上儿童高血压临界值分别为100/60、110/70、120/80、140/90 mmHg。出现上述任何一种情况均判定为GC不良反应。
胃肠道反应包括腹胀、腹泻、呕吐等。白细胞降低判定标准[13]:≥10 岁儿童低于4.5×109/L;<10 岁低于5.0×109/L。肝功能指标正常范围:谷丙转氨酶0~40 U/L,谷草转氨酶0~50 U/L,升高至正常值2倍以上为肝功能异常[13]。
1.6 统计学分析
使用SPSS 19.0 软件进行统计学分析。不符合正态分布的计量资料采用中位数(四分位数间距)
[M(P25,P75)]进行描述,组间比较采用Kruskal-Wallis 秩和检验,组间两两比较采用Bonferroni 检验。计数资料采用例数和率或构成比(%)进行描述,组间比较采用χ2检验,组间两两比较采用Boferroni校正法。P<0.05表示差异有统计学意义。
2 结果
2.1 4组一般资料比较
4组患儿性别、年龄、病程、前驱感染、双眼受累、基线QMG 及MG-ADL 评分、基线泼尼松剂量、随访时间方面比较差异均无统计学意义(P>0.05),见表1。
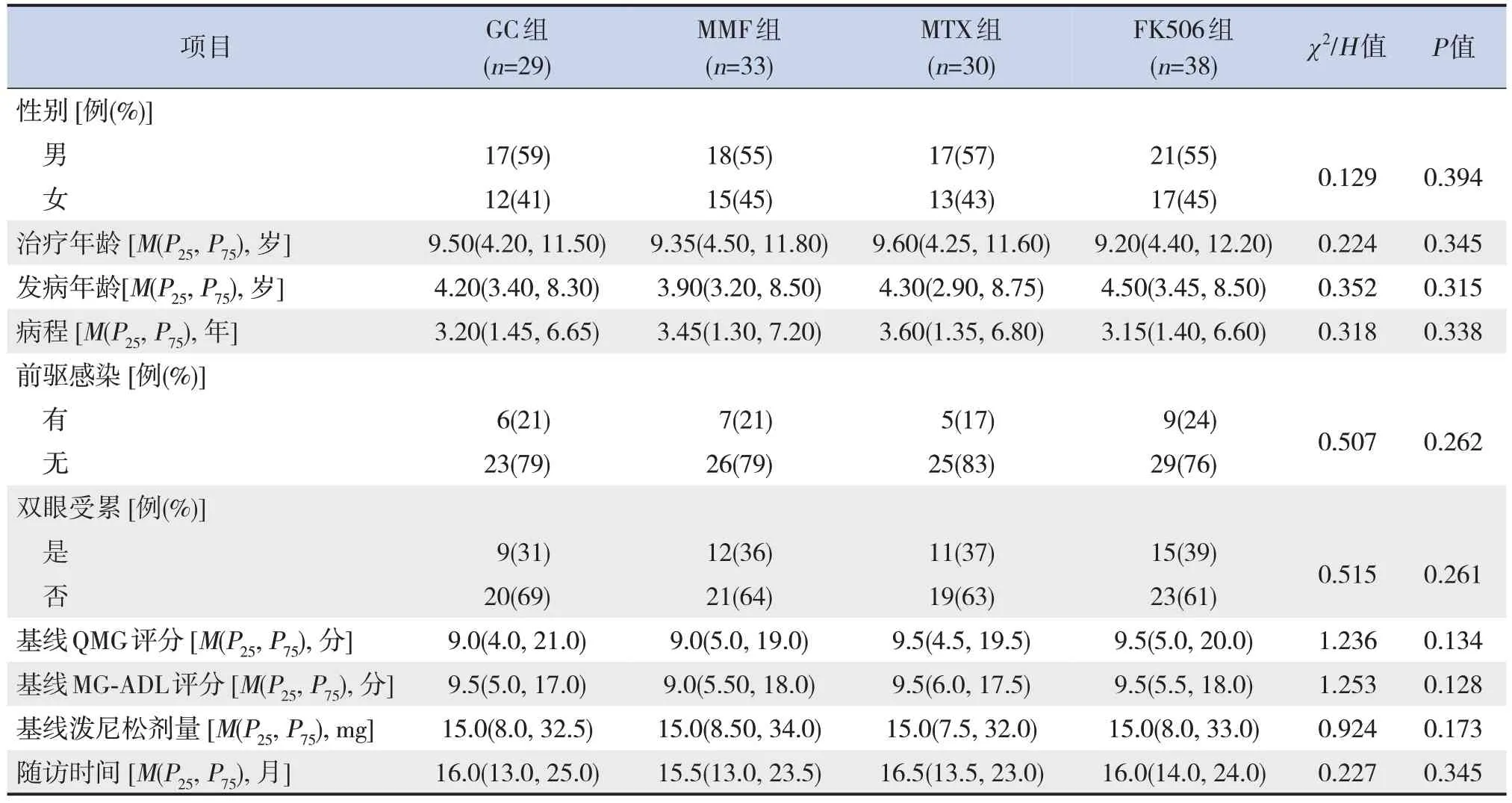
表1 4组OMG患儿一般资料比较
2.2 4组治疗后各时间点QMG评分比较
治疗3个月,FK506组QMG评分低于其他3组(P<0.05)。治疗1、6、9、12个月各组QMG评分比较差异无统计学意义(P>0.05)。见表2。

表2 4组治疗后各时间点QMG评分比较 [M(P25,P75),分]
2.3 4组治疗后各时间点MG-ADL评分比较
治疗3 个月,FK506 组MG-ADL 评分低于其他3 组(P<0.05)。治疗1、6、9、12 个月各组MGADL 评分比较差异无统计学意义(P>0.05)。见表3。
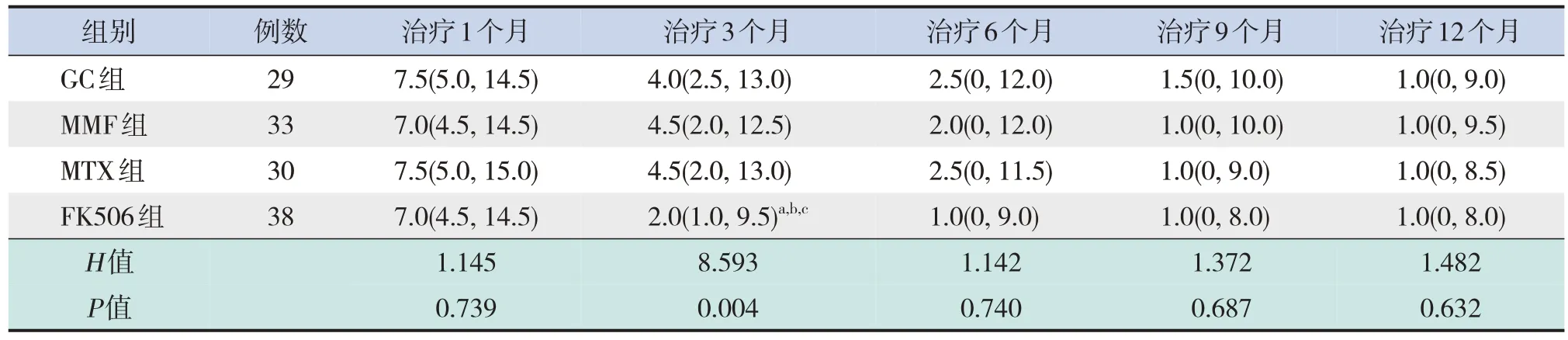
表3 4组治疗后各时间点MG-ADL评分比较 [M(P25,P75),分]
2.4 4组治疗后各时间点临床疗效比较
4组治疗各时间点有效率比较差异无统计学意义(P>0.05),见表4。

表4 4组各时间点有效率比较 [例(%)]
2.5 4组各时间点泼尼松剂量比较
治疗3 个月,FK506 组泼尼松剂量低于GC 组(P<0.05);治疗6 个月、9 个月,MMF 组、MTX组、FK506 组泼尼松剂量均低于GC 组(P<0.05)。见表5。

表5 4组各时间点泼尼松剂量比较 [M(P25,P75),mg/d]
2.6 4组不良反应比较
各组均无发生肌无力危象病例,各组治疗期间均出现不同程度的GC 不良反应。治疗12 个月后,MMF组、MTX组、FK506组分别出现GC不良反应6 例(18%)、5 例(17%)、6 例(16%),发生率低于GC组(12例,41%)(P<0.05),各组GC不良反应的具体症状表现见表6。治疗期间,MMF组出现1 例(3%),MTX 组出现3 例(10%)白细胞降低。其他轻微肠道不适、呕吐均在可耐受范围内。

表6 4组GC不良反应比较 [例(%)]
3 讨论
本研究结果显示,治疗3 个月,FK506 组QMG、MG-ADL 评分低于其他3 组,而治疗6、9、12 个月,各组QMG、MG-ADL 评分及有效率比较差异均无统计学意义,这提示FK506 可在治疗早期改善儿童OMG疗效,而MMF、MTX在改善疗效方面作用不明显。MMF 主要通过有效抑制鸟嘌呤核苷脱氢酶活性,影响鸟嘌呤代谢过程,进而选择性抑制T、B 淋巴细胞增殖和浸润过程,发挥抗炎作用[14]。有研究认为MMF 治疗MG 效果与泼尼松相当,且可有效避免泼尼松的不良反应,但部分研究发现MMF疗效并不明显[15]。MTX可通过抑制嘌呤和嘧啶的生物合成,最终抑制细胞的增殖,发挥抑制T、B 淋巴细胞的作用,但其治疗MG 的具体机制仍未明确[16]。Meta 分析发现,MTX 并未改善MG 患者MG-ADL 评分、肌力水平等指标[17]。FK506属于脂溶性药物,高度选择性地抑制辅助性T细胞,以及抑制炎症反应相关细胞因子的活化而产生较强的免疫抑制功能[18]。日本研究认为,FK506 起效时间短、疗效好,尤其适合高龄患者、儿童及难治性OMG[19],但欧美的研究持不同观点[20]。王钟情等[21]研究发现,使用FK506的患者达到完全缓解的时间更短,但随访28 个月后,最终达到完全缓解患者比例与对照组比较没有差异,因此指出,其他研究认为FK506 有更好的疗效可能是因为随访时间太短所致。Cron 等[22]报道,与全身型MG患者相比,FK506在治疗儿童OMG患者时较低的血药浓度即能得到较好疗效,并且几乎没有不良反应。本研究结果显示,FK506的主要优势在于起效快,在治疗早期(3个月)有助于改善患儿症状与生活质量,但在治疗6个月以后,其效果与其他3 组无明显差异,本研究结果与王钟情等[21]研究一致。
本研究结果显示,治疗3个月,FK506组泼尼松剂量低于GC 组;治疗6、9 个月,MMF 组、MTX 组、FK506 组泼尼松剂量均低于GC 组;治疗12个月后,MMF组、MTX组、FK506组GC不良反应分别为18%、 17%、 16%, 均低于GC 组(41%),表明加用免疫抑制剂可有效减少GC 剂量和不良反应。这主要是由于免疫抑制剂和GC具有协同免疫抑制作用,GC 通过诱导T 或B 淋巴细胞凋亡,抑制炎症介质的产生及树突状细胞的成熟而发挥免疫抑制作用,免疫抑制剂则通过抑制致敏淋巴细胞的增殖、活化而发挥免疫抑制作用,二者在MG免疫治疗中具有协同作用[8]。免疫抑制剂促进了GC 药效的发挥,同时免疫抑制剂具有“激素增敏”效应,改善了MG患者对GC治疗的敏感性,提高了GC 的利用率,进而减少GC 用量。但是,MG 免疫治疗的进行会引起MG 免疫病理机制的改变,导致基因表达变化,引起MG发病的免疫损伤途径、免疫损伤靶点发生变化,进而使MG对免疫抑制剂治疗的敏感性降低,其“激素增敏”效应也随之下降。
综上,儿童OMG 加用不同类型免疫抑制剂均可减少GC用量和不良反应,可能与药物协同效应有关。FK506 在治疗早期效果优于其他免疫抑制剂,对于病情较重的患儿,早期使用FK506 可较快起效,待病情稳定后,可考虑价格相对低廉的药物方案。此外,与MTX 比较,FK506 治疗较少出现白细胞降低。但本研究样本较小,可能存在一定偏倚,结论还需大样本随机对照研究验证。
利益冲突声明:所有作者声明无利益冲突。
