预测极早产儿早发型败血症发生风险的列线图模型的构建
2023-10-31魏欣雨张静郝庆飞杜延娜程秀永
魏欣雨 张静 郝庆飞 杜延娜 程秀永
(郑州大学第一附属医院新生儿科,河南郑州 450052)
早发型败血症(early-onset sepsis, EOS)是指在出生72 h内发生的新生儿败血症,主要通过母婴垂直传播的细菌病原体引起[1-2]。研究表明,早产、低出生体重、羊水异常、绒毛膜羊膜炎、产房气管插管、母亲围生期感染与极早产儿(胎龄<32周)EOS相关[3-4]。在临床上缺乏早期预测感染的可靠性指标,许多无症状的早产儿接受不必要的抗生素应用,同时也有部分早产儿因抗生素应用延迟而死亡[5]。由于极早产儿EOS临床表现隐匿,发病率和病死率较高,大约80%的极早产儿在出生时就予以经验性抗生素治疗[6]。长期抗生素暴露会导致极早产儿在儿童期发生支气管哮喘、肥胖、免疫系统性疾病等的风险增加[7-9]。有研究表明EOS与极早产儿死亡和2岁时神经发育障碍相关[10]。因此,早期预测极早产儿EOS发生的风险,有助于临床医生把握经验性抗生素的应用时机,从而降低病死率和改善存活患儿的预后。目前关于预测极早产儿EOS发生风险的模型研究甚少。Palatnik等[11]建立了一个极早产儿EOS发生风险的预测模型,但该预测模型未纳入产时的危险因素及生后首次相关实验室检查指标。本研究对极早产儿的围生期资料进行回顾性分析,探讨极早产儿发生EOS的危险因素,从而构建预测极早产儿EOS发生风险的列线图模型,为早期预测和干预极早产儿EOS提供依据。
1 资料与方法
1.1 研究对象
选取2020年1月—2022年12月在我院出生并于生后立即转入新生儿科住院治疗的早产儿作为研究对象。纳入标准:(1)胎龄<32周;(2)在我院新生儿科住院时间≥3 d。排除标准:(1)患有先天性畸形、遗传代谢病;(2)临床资料不完整。本研究经我院医学伦理委员会批准(审批号:2020-KY-228)。
1.2 资料收集
回顾性收集入组患儿住院3 d内及其母亲孕期资料。(1)患儿一般情况:胎龄、出生体重、性别、是否为试管婴儿、是否行产房气管插管、羊水情况、生后首日血清白蛋白(serum albumin,ALB)水平。(2)母亲孕期资料:产前糖皮质激素应用情况、分娩方式、是否有胎膜早破≥18 h、是否有绒毛膜羊膜炎、是否产前24 h使用抗生素,以及是否有妊娠糖尿病、妊娠期高血压疾病、宫内窘迫。
1.3 诊断标准
EOS的确定诊断:为生后72 h内有相关临床表现,且血培养或脑脊液(或其他无菌腔液)致病菌培养阳性[3]。
EOS的临床诊断:生后72 h内有相关临床表现,同时满足下列条件中任何一项,即(1)血液非特异性检查≥2项阳性;(2)脑脊液检查呈化脓性脑膜炎改变;(3)血中检出致病菌DNA[3]。
母亲孕期疾病诊断标准参考第4版《实用妇产科学》[12]。
1.4 研究对象分组
应用R语言(R4.2.1)将纳入的全部研究对象根据7∶3的比率随机分为训练集和验证集。训练集用于分析极早产儿EOS的影响因素和构建列线图预测模型,验证集用于验证。根据是否发生EOS,训练集和验证集均分为EOS组和非EOS组。
1.5 统计学分析
应用SPSS 26.0软件进行统计学分析。正态分布的计量资料用均值±标准差()表示,组间比较采用两样本t检验;非正态分布的计量资料用中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。计数资料以例数和百分率(%)表示,组间比较采用卡方检验。采用多因素logistic回归分析筛选EOS发生的独立危险因素。采用R语言(R4.2.1)绘制列线图预测模型。采用Hosmer-Lemeshow检验评估模型的拟合优度。采用验证集对列线图模型进行验证。采用受试者操作特征曲线(receiver operating characteristic curve, ROC曲线)曲线下面积(area under the curve, AUC)评估模型的区分度;采用校准曲线评价模型的校准度;采用决策曲线分析评估模型的临床净收益。鉴别和校准均采用1 000个重复抽样Bootstrap算法进行评估。所有统计检验均为双侧检验,P<0.05被认为差异具有统计学意义。
2 结果
2.1 一般资料
共纳入344例极早产儿,其中训练集241例,验证集103例。各变量在训练集和验证集中的比较差异均无统计学意义(P>0.05),见表1。
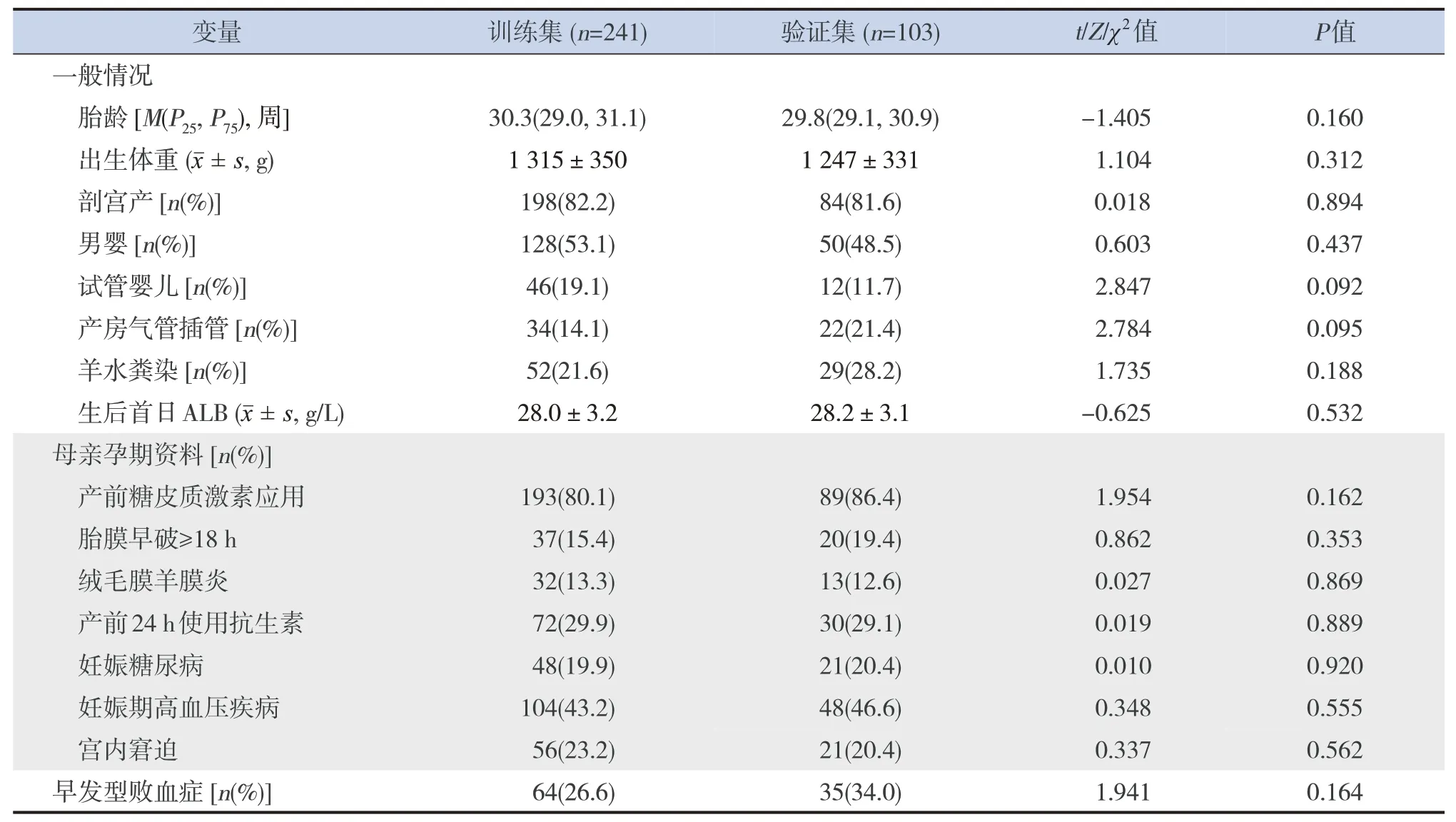
表1 训练集和验证集临床资料的比较
2.2 训练集EOS组与非EOS组临床资料的比较
训练集共纳入极早产儿241例,其中EOS组64例,非EOS组177例。单因素分析显示:胎龄、出生体重、剖宫产、产房气管插管、羊水粪染、生后首日ALB水平和绒毛膜羊膜炎与极早产儿EOS的发生有关(P<0.05),见表2。
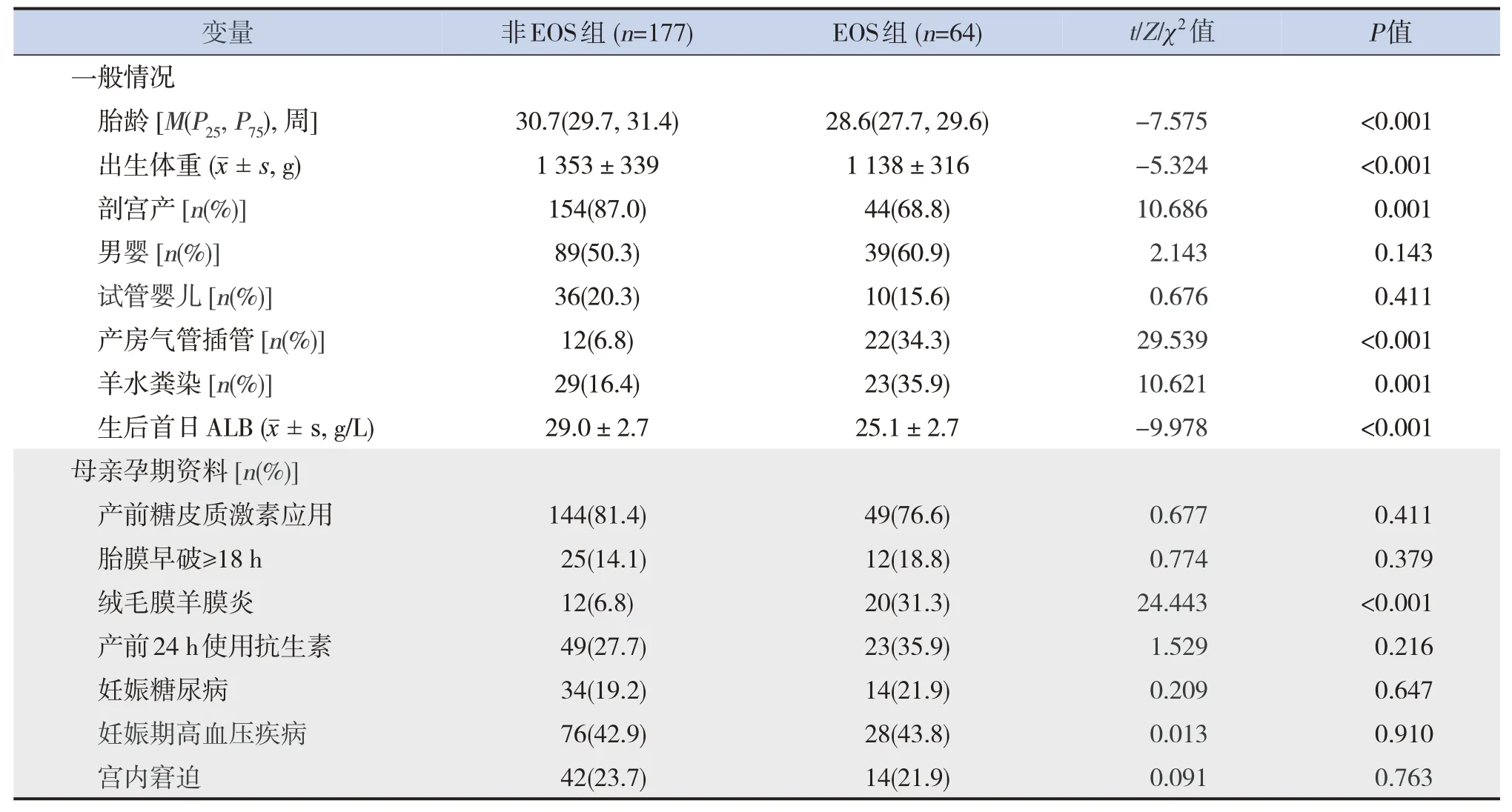
表2 训练集EOS组与非EOS组临床资料的比较
2.3 极早产儿EOS发生的多因素回归分析
将上述有统计学意义的7个变量(胎龄、出生体重、剖宫产、产房气管插管、羊水粪染、生后首日ALB和绒毛膜羊膜炎)纳入logistic回归模型进行多因素分析,结果显示:胎龄、产房气管插管、羊水粪染、生后首日ALB和绒毛膜羊膜炎是极早产儿EOS发生的独立危险因素(P<0.05),见表3。
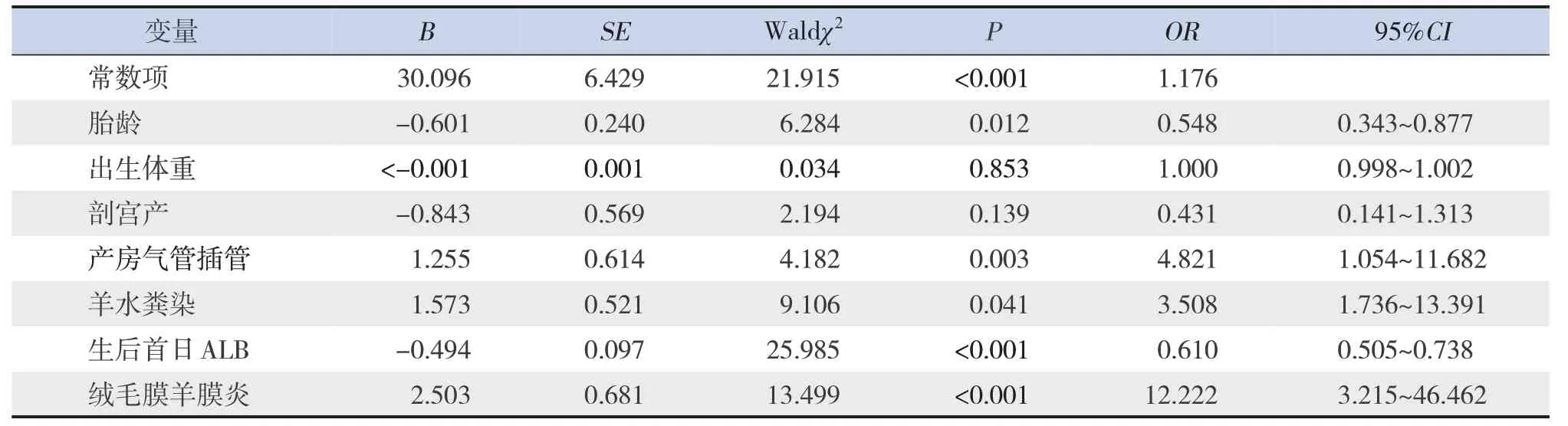
表3 极早产儿EOS发生的多因素logistic回归分析
2.4 构建极早产儿EOS发生风险的预测模型
根据上述多因素logistic回归分析中有意义的5个变量,即胎龄、产房气管插管、羊水粪染、生后首日ALB和绒毛膜羊膜炎,应用R软件绘制极早产儿EOS发生风险的列线图,见图1。根据变量情况得到相应分值,将各变量分值相加得到总分,总分对应到风险轴的值即为患儿发生EOS的概率。总分越高,患儿发生EOS的风险越高。例如,某患儿胎龄为29周(得20分),无羊水粪染(得0分),无产房气管插管(得0分),生后首日ALB为26 g/L(得60分),其母亲有绒毛膜羊膜炎(得25分),总分约为105分,根据列线图(图1)可以预测此患儿发生EOS的概率约为80%。
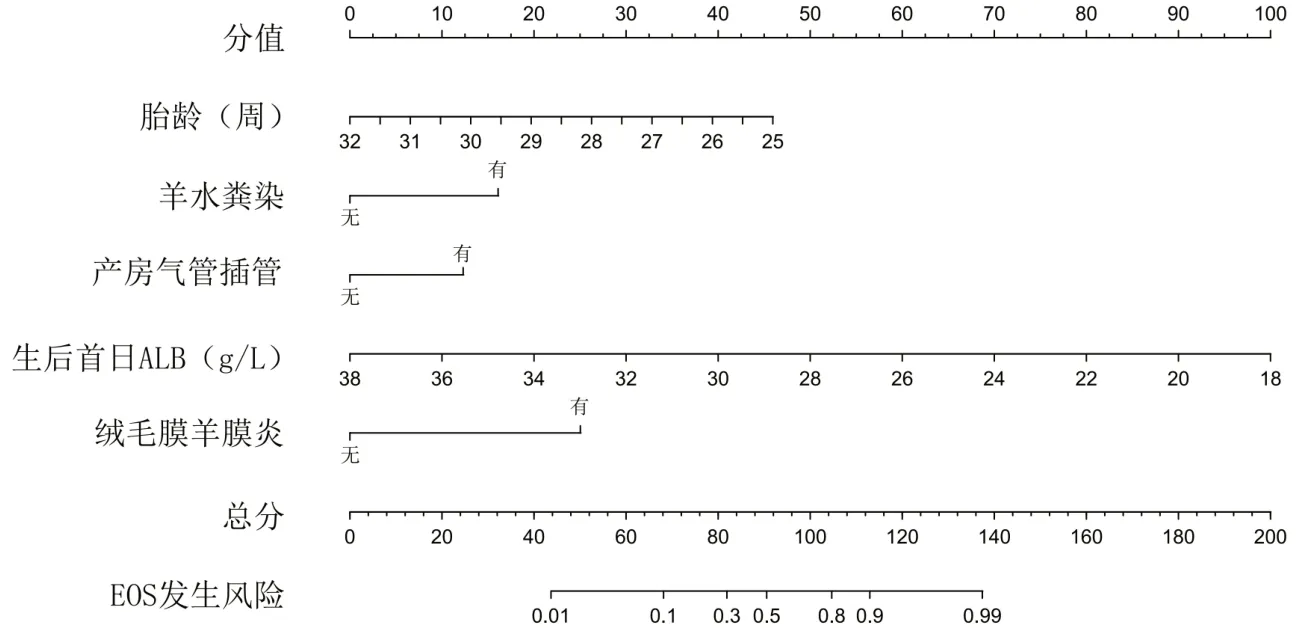
图1 极早产儿发生EOS风险的列线图预测模型
2.5 预测模型的验证与评价
列线图模型的ROC曲线分析结果显示:训练集中列线图模型预测极早产儿EOS发生的AUC为0.925(95%CI:0.888~0.963),验证集中列线图模型预测极早产儿EOS发生的AUC为0.796(95%CI:0.694~0.898),说明模型的鉴别能力较好,见图2。Hosmer-Lemeshow拟合优度检验表明模型拟合度良好(χ2=6.236,P=0.621)。绘制列线图模型的校正曲线,显示训练集和验证集的校正曲线与理想曲线均接近,提示模型预测效能良好,见图3。决策曲线分析显示该列线图模型的临床应用价值较高,见图4。
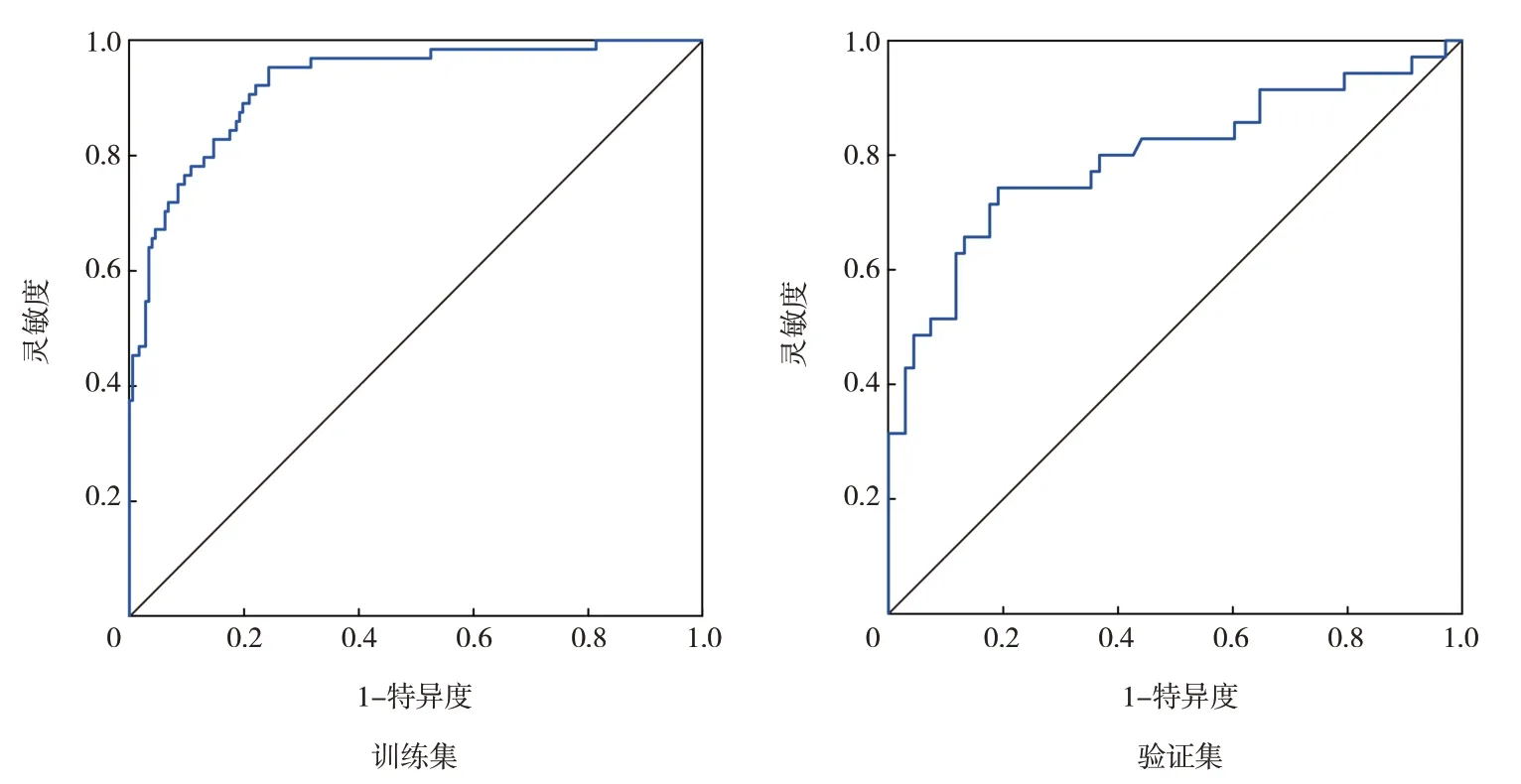
图2 列线图预测模型的ROC曲线
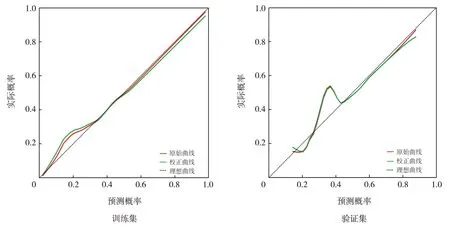
图3 列线图预测模型的校正曲线
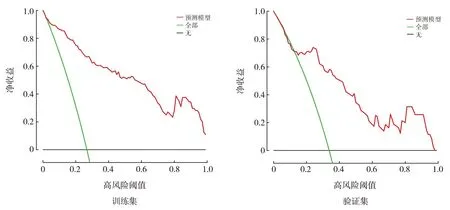
图4 列线图预测模型的决策曲线分析
3 讨论
尽管围生期保健及新生儿重症救治水平明显提高,新生儿EOS仍然是全球新生儿死亡的第三大原因[13]。由于缺乏早期预测感染的可靠性指标,在临床实践中,许多疑似EOS的极早产儿常规予以抗生素应用,但长期的抗生素暴露可能会对极早产儿在新生儿期的生长发育产生潜在的负面影响[14-15],还会增加极早产儿远期发生支气管哮喘、肥胖、免疫系统性疾病等的风险[7-9]。因此早期预测极早产儿EOS发生的风险,有助于临床医生及时治疗并减少不必要的抗生素应用。本研究对极早产儿的临床资料进行了回顾性分析,结果显示,胎龄、产房气管插管、羊水粪染、生后首日ALB和绒毛膜羊膜炎是极早产儿EOS发生的独立危险因素,据此构建了极早产儿发生EOS的列线图预测模型,并进行了验证。列线图将复杂的统计模型可视化,为患者提供一个精确的数字化的生存或者风险概率,辅助临床医生进行决策,体现了个体化医疗的思想。本研究训练集和验证集ROC曲线的AUC分别为0.925(95%CI:0.888~0.963)和0.796(95%CI:0.694~0.898),表明模型的区分度良好。Hosmer-Lemeshow拟合优度检验和校准曲线说明模型在预测概率和实际概率之间有较好的一致性和准确度,同时决策曲线分析显示模型的临床应用价值高。
据统计,不同地区极早产儿EOS发生率差异较大。Stoll等[16]报道美国胎龄<28周早产儿EOS的发生率为1.8%,Duggan等[17]报道澳大利亚和新西兰胎龄<32周早产儿EOS发生率为0.98%~1.94%。由于国内对于极早产儿EOS的发生率的流行病学调查极少,目前尚无明确的发生率报道。本研究显示,胎龄<32周早产儿EOS发生率较高(28.8%),可能与本研究将临床诊断和确诊诊断的病例均纳入总体样本中有关。胎龄越小,EOS发生率越高[16]。本研究也显示,随着胎龄减小,极早产儿发生EOS的风险增大。
有研究表明,绒毛膜羊膜炎明显增加EOS发生的风险[18]。一项Meta分析也证明了组织学确诊绒毛膜羊膜炎与血培养确诊的和临床诊断的新生儿EOS相关(OR分别为4.42、5.88),临床诊断绒毛膜羊膜炎也与血培养确诊的和临床诊断的新生儿EOS相关(OR分别为6.82、3.90)[19]。本研究显示绒毛膜羊膜炎对极早产儿EOS发生的影响最大(OR=12.22)。绒毛膜羊膜炎不仅增加极早产儿EOS发生的风险,还与极早产儿远期的不良预后相关。瑞典的一项回顾性研究发现绒毛膜羊膜炎会增加神经发育障碍的风险,尤其是脑性瘫痪、孤独症谱系障碍、注意力缺陷多动障碍和智力障碍[20]。因此,对于确诊绒毛膜羊膜炎孕母的极早产儿应注意监测有无EOS的发生。羊水粪染增加羊膜腔感染的风险,从而使胎儿受感染概率增高[21]。Taşkın等[22]研究发现,羊水粪染可能是新生儿EOS的危险因素。本研究发现羊水粪染(OR=3.508,95%CI:1.054~11.682)是极早产儿EOS发生的独立危险因素。极早产儿肺部发育不成熟,在出生后常需要予以呼吸支持,在极早产儿产房复苏中,气管插管占据重要地位。我国一项多中心的回顾性研究发现,极低出生体重儿的复苏气管插管率高达71.5%[23]。气管插管属于侵袭性操作,可能会对极早产儿的黏膜造成损伤,因此产房气管插管会增加极早产儿的感染风险。本研究发现产房气管插管(OR=4.821,95%CI:1.736~13.391)会增加极早产儿EOS发生的风险,这与我国一项关于极/超早产儿EOS的研究结果一致[4]。
ALB是在肝脏内合成的一种多功能血浆蛋白,参与调控血浆渗透压,调节炎症途径及微血管完整性,具有抗炎、抗氧化应激等作用[24]。有研究显示生后首日血清ALB水平与早产儿严重感染有关[25]。Torer等[26]通过对199例胎龄<32周极早产儿进行前瞻性研究发现,生后首日ALB水平越低,极早产儿EOS的发生率和病死率越高,ALB低于27.2 g/L与病死率相关。薛茹等[27]报道在出生体重<1 500 g的极低出生体重儿中,EOS组与非EOS组相比,EOS组发生低蛋白血症比例较高(52.8% vs 10.2%)。本研究发现生后首日ALB水平降低增加极早产儿EOS发生风险,提示首日ALB水平对极早产儿EOS的发生有早期预测价值。
综上所述,本研究显示,胎龄、产房气管插管、羊水粪染、生后首日ALB水平和绒毛膜羊膜炎与极早产儿EOS的发生独立相关,并根据这些因素构建了极早产儿EOS发生风险的列线图预测模型。该模型预测价值较高,有助于临床医生早期预测极早产儿发生EOS的风险。本研究存在的局限性:(1)血培养阳性是诊断新生儿EOS的金标准,由于极早产儿血培养阳性率极低,故该研究将临床诊断和确诊诊断的病例均纳入总体样本中;(2)本研究为单中心回顾性研究,总样本量偏少,可能存在选择偏倚,且缺乏外部数据对建立的模型进行验证。因此,未来还需要进行大样本、多中心的研究,对模型进行外部验证,进一步优化预测模型。
