注射HCG 后不同授精时间对IVF-ET 患者胚胎发育和妊娠结局的影响*
2023-10-30仲万霞
王 宁,仲万霞
(1 山东大学附属生殖医院,山东省生殖医学重点实验室,济南 250001;2 上海市辅助生殖与优生重点实验室,上海交通大学医学院附属仁济医院生殖中心)
体外受精(in-vitro fertilization,IVF)治疗是一种超生理过程,它模拟了正常人月经周期中发生的许多生理过程,即卵泡发育,卵母细胞成熟/排卵,受精和着床。控制性超排卵(controlled ovarian hyperstimulation,COH)是IVF-胚胎移植(embryo transfer,ET)的重要环节。促卵泡激素(follicle-stimulating hormone,FSH)可以诱导多个卵泡的生长,随着卵泡的生长,促黄体生成素(luteinizing hormone,LH)激增,通过使用促性腺激素释放激素(gonadotrophin releasing hormone,GnRH)拮抗剂[1-2],或持续使用GnRH 激动剂(GnRH agonist,GnRHa)下调GnRH 受体[3]从而抑制过早排卵。一旦卵泡达到所需的大小,注射LH,从而诱导卵母细胞成熟和排卵[4]。但获取的卵母细胞并非都具有相同的发育潜力,它们的细胞核与细胞质的成熟程度往往并不同步[5]。研究[6]发现,人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)注射后不同的授精时间可能影响卵母细胞的成熟、后续受精及发育潜能。目前,一般取卵手术在HCG 注射后34~36 h 进行,有学者[7]发现常规IVF 的最佳授精时间在HCG注射后40~41 h,因为此时间段的临床妊娠率较高、早期流产率较低。但HCG 注射后授精的时间尚未达成统一,因此本研究采用回顾性分析方法探讨HCG 注射后授精时间与胚胎发育及临床结局之间的关系,从而优化IVF-ET 实验室操作规程、改善临床结局。
1 对象与方法
1.1 研究对象及分组 本研究数据来源于山东大学附属生殖医院系统数据库,回顾性分析2019 年1月—2021 年12 月进行IVF-ET 助孕患者的病历资料。纳入标准:(1)女方年龄≤38 岁;(2)获卵数5~20枚;(3)本院第一周期促排卵;(4)行卵裂期胚胎移植;(5)夫妇双方染色体正常;(6)女方因盆腔输卵管因素不孕;(7)男方精液质量达到IVF-ET 治疗标准。最终有5 743 个周期纳入分析。根据HCG 注射后授精时间的不同分为3 组:38~39 h 授精(A 组,周期=474);>39~40 h 授精(B 组,周期=3 834);>40~41 h 授精(C组,周期=1 435)。
1.2 IVF-ET 方法
1.2.1 控制性超促排 本中心依据基础激素水平及窦卵泡计数选择5 种常用促排方案:超长方案、长方案、短方案、微刺激以及拮抗剂方案促排卵。经阴道B 超和激素水平监测卵泡发育,当至少2 个卵泡直径≥18 mm 时注射重组HCG[8],进行扳机处理。
1.2.2 取卵和卵母细胞的培养 HCG 注射后34~36 h 在阴道B 超引导下进行取卵操作,将获取的卵泡液倒入100 mm 大皿中并在体视显微镜下收集卵冠丘复合体(oocyte-corona-cumulus complex,OCCC),转于IVF 培养液(G-IVF PLUS,Vitrolife)或FM 培养液(fertilization medium,Cook)中,标记好获卵个数后放入6%CO2培养箱中培养。
1.2.3 IVF 和胚胎培养 精液采用密度梯度离心法结合上游法处理[9],精子质量符合IVF 授精要求,授精时间为患者HCG 注射38 h 后,将提前调好浓度的精子按照1∶100 000 加入包含卵子的受精液(K-SIFM-100,Cook 或G-IVF PLUS,Vitrolife)中,每个授精孔中卵子≤5 个,然后置于G185 三气培养箱中进行培养。授精5 h 后进行短时脱颗粒,将受精的卵子快速转移至卵裂培养液(Cook 或G1 PLUS,Vitrolife)并置于G185 三气培养箱中继续培养。
1.2.4 胚胎评分和移植 在胚胎受精后16~20、25~26、43~45 及67~69 h 观察早期胚胎发育的情况,根据F.PUISSANT 等[10]的早期胚胎评分标准进行评分:依据卵裂球形态大小以及有无核碎片进行分级。Ⅰ~Ⅱ级胚胎为优质胚胎,Ⅰ~Ⅲ级胚胎为可移植胚胎。综合考虑患者临床指征和早期胚胎发育评分,挑选1~2 枚正常受精(2PN)的胚胎进行移植。对于移植后有剩余胚胎的患者,经其知情同意后,进行第3 天早期胚胎冷冻或将剩余胚胎转移至囊胚培养液(Cook 或G2 PLUS,Vitrolife)中行囊胚培养至第5 或第6 天进行囊胚冷冻,囊胚评分标准参照文献[11]的方法。
1.2.5 分析指标及评价 主要分析指标有正常受精(2PN)率、多精受精率、优质胚胎率、囊胚形成率、优胚囊胚形成率、卵子利用率、临床妊娠率、着床率、早期流产率和活产率。其中,卵子利用率=(移植胚胎数+冷冻胚胎数)/获卵数×100%,临床妊娠率=临床妊娠周期数/移植周期数×100%,着床率=超声下可见孕囊数/移植胚胎数×100%,早期流产率=发生早期流产的周期数/临床妊娠周期数×100%,活产率=活婴出生周期数/胚胎移植周期数×100%。
1.2.6 临床结局判断 移植后2 周检测血β-HCG,≥10 mIU/mL 为生化妊娠,继续黄体支持,移植后1个月行B 超检查,若宫腔见孕囊及胎心管搏动则判定为临床妊娠;孕12 周内发生胚停或妊娠物排出则为早期流产;孕12~28 周间妊娠终止为中晚期流产;妊娠满28 周且至少有1 个存活新生儿分娩判定为活产[12]。
1.3 统计学方法 采用SPSS 22.0 统计软件进行分析。计量资料以±s 表示,组间比较采用单因素方差分析;计数资料以率表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组患者基本临床资料比较 3 组患者的女方平均年龄、不孕年限、BMI、基础FSH、雌二醇(estradiol,E2)、移植内膜厚度比较差异均无统计学意义(均P>0.05)(表1)。

表1 各组患者基本临床资料比较
2.2 3 组患者胚胎发育和临床结局的比较 3 组患者间正常受精率随着授精时间的延迟逐渐提高(P<0.05);C 组的多精受精率显著低于A、B 组(P<0.05);3组间优质胚胎率、囊胚形成率、优胚囊胚形成率、临床妊娠率、着床率、早期流产率和活产率差异均无统计学意义(均P>0.05);但3 组间卵子利用率差异有统计学意义,且随着授精时间的推迟,卵子利用率逐渐增高(P<0.05)(表2)。
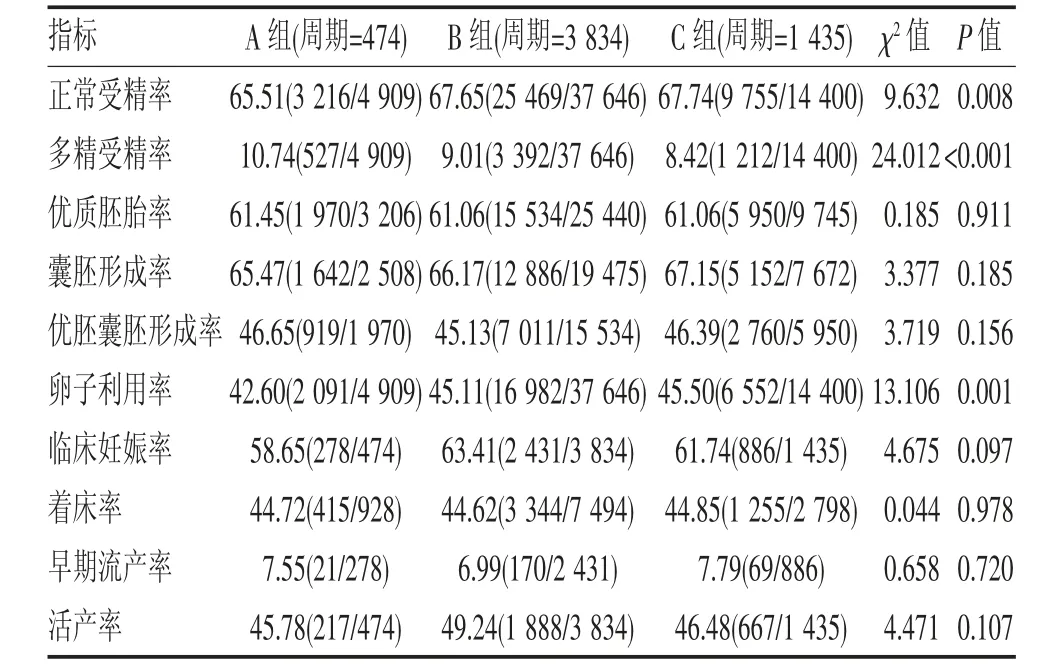
表2 3 组患者受精结局的比较(%,n)
2.3 不同促排卵方案患者受精结局比较 由于IVF-ET 患者在HCG 注射后40~41 h 授精可获得更好的胚胎发育结局,进一步对C 组中不同促排方案患者的受精结局进行分析,3 种主要促排方案包括长方案(周期=264)、短方案(周期=110)及拮抗剂方案(周期=988)。结果发现优胚囊胚形成率:长方案(49.22%)>拮抗剂方案(45.99%)>短方案(41.85%)(P<0.05);与短方案、拮抗剂方案患者相比,长方案患者的活产率最高(P<0.05)。3 组用药方案间正常受精率、多精受精率、优质胚胎率、囊胚形成率、卵子利用率、临床妊娠率、着床率和早期流产率差异均无统计学意义(均P>0.05)(表3)。
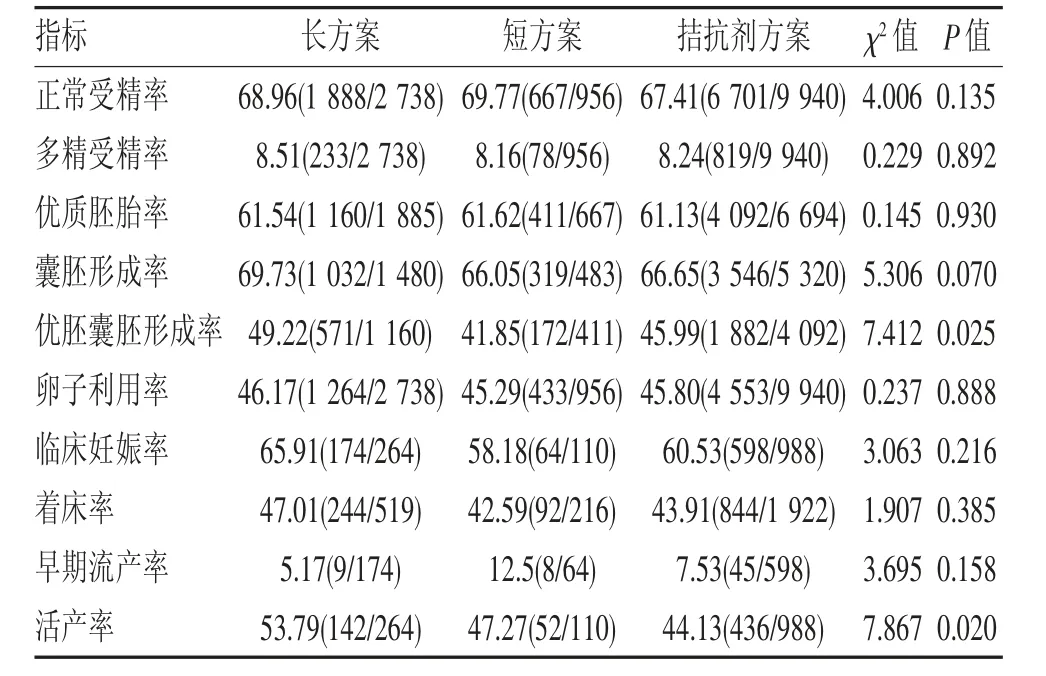
表3 C 组中不同促排方案患者受精结局比较(%,n)
2.4 不同胚胎培养体系患者受精结局比较 在最佳授精时间范围内(HCG 注射后40~41 h),对Vitrolife(周期=903)和Cook(周期=532)两种胚胎培养体系中IVF-ET 患者的受精结局进行分析,结果发现Cook胚胎培养体系的优质胚胎率、优胚囊胚形成率、卵子利用率均显著高于Vitrolife 胚胎培养体系(均P<0.05),两组胚胎培养体系间正常受精率、多精受精率、囊胚形成率、临床妊娠率、着床率、早期流产率和活产率差异均无统计学意义(均P>0.05)(表4)。
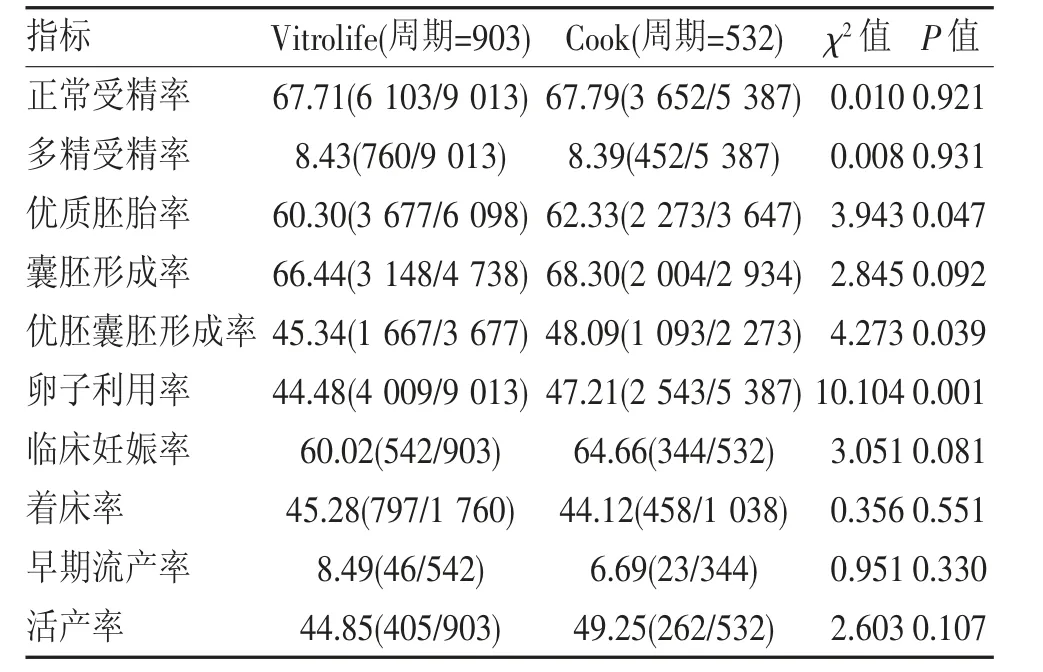
表4 不同培养体系患者受精结局比较(%,n)
3 讨论
近年来,辅助生殖技术发展迅速。特别是,为了提高IVF-ET 的成功率,通常需要进行COH 以对抗单卵泡发育过程来获得可观数量的卵母细胞,用于后续受精和ET。通常COH 周期中,取卵时会发现一些未成熟卵子,因此在胚胎实验室,通常在获卵和授精之间等待一段时间,由于颗粒细胞在卵泡发育和卵母细胞成熟中是必不可少的,颗粒细胞通过自分泌和旁分泌方式分泌各种细胞因子和类固醇激素影响卵母细胞的发育和成熟[13]。也有研究[14]支持延长体外培养时间可以促进卵母细胞充分成熟。同样,授精前培养卵母细胞可能会进一步促使胞质成熟,从而使卵母细胞完全激活,获得正常的发育潜能,进而可能会提高胚胎的受精率和临床妊娠率[15]。
然而有研究[16]发现授精前卵母细胞过度培养可能伴随纺锤体不稳定,导致一些不良后果,如胚胎质量差,受精率和临床妊娠率降低。在人类中,卵母细胞的衰老与卵母细胞超微结构的变化有关:线粒体-光滑内质网聚集物减少,线粒体-囊泡复合物的大小和数量增加,皮质颗粒和微绒毛减少,纺锤体结构改变[17]。据报道[18],取卵后与卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)授精之间2~4 h 的体外培养可以改善卵母细胞成熟、受精率和胚胎质量。此外,与HCG 注射后38~39 h 和40~42 h 相比,HCG 注射后36~37 h 具有可见纺锤体的卵母细胞数量更少[19],与无法看到纺锤体的卵母细胞相比,具有可见纺锤体的卵母细胞受精率更高。D.DOZORTSEV 等[6]发现卵母细胞的最佳授精时机是HCG注射后37~41 h,也有研究[7]发现,就受精率和妊娠率而言,ICSI 最佳时间是在HCG 注射后41~42 h。在较宽的时间范围内,ICSI 对胚胎发育和临床结局均无不良影响,这表明卵母细胞可能存在较长的受精窗口期[20]。
目前最佳授精时机尚未统一。董娟等[12]发现注射HCG 后38~42 h 授精获得的临床妊娠率和胚胎种植率均高于HCG 注射后42 h 授精的胚胎周期。本研究发现,在HCG 注射后38~41 h 范围内授精,随着授精时机的延迟,正常受精率逐渐提高(P<0.05),多精受精率逐渐降低(P<0.05)。提示适当延长HCG 注射后的授精时间,有可能利于胚胎早期正常受精发育,分析可能原因是COH 周期中获得的卵母细胞有一部分卵子未成熟,适当的延长体外培养时间,共培养的颗粒细胞分泌的各种细胞因子和类固醇激素促使卵母细胞和细胞质成熟,从而使卵母细胞完全激活,进而提高胚胎正常受精率降低多精受精率。但组间优质胚胎率、囊胚形成率、优胚囊胚形成率、临床妊娠率、着床率、早期流产率和活产率差异均无统计学意义(均P>0.05),这与既往研究结果[12,21-22]相似。本研究还发现,随着授精时间的推迟,卵子利用率逐渐增高(P<0.05),进一步验证在一定时间范围内,适当延迟授精增加卵子体外培养时间,可以促进卵子成熟,进而获得更佳的胚胎发育结局和更高的卵子利用率。长方案患者的优胚囊胚形成率和活产率明显高于短方案和拮抗剂方案(P<0.05),提示在最佳授精时间内,长方案患者可能获得更好的胚胎发育和临床结局,这与马超等[23]的研究结果一致。同时,本研究还发现Cook 胚胎培养体系的优质胚胎率、优胚囊胚形成率和卵子利用率要优于Vitrolife 胚胎培养体系(P<0.05)。提示在HCG 注射后40~41 h 进行授精,Cook 胚胎培养体系对胚胎发育有促进作用[24-25]。
综上所述,IVF-ET 患者在一定时间范围内(HCG 注射后38~41 h),适当延迟授精时机可提高胚胎正常受精率和卵子利用率,降低多精受精率,但不影响临床结局。在最佳授精时机内(HCG 注射后40~41 h 授精),长方案患者的胚胎发育和妊娠结局更优,同时Cook 胚胎培养体系仅促进胚胎发育并不影响妊娠结局。
考虑到本生殖中心用药方案以及HCG 注射时间较为集中,实验室胚胎培养体系与其他生殖中心可能存在差异,导致不同生殖中心在IVF-ET 治疗中HCG 注射后的最佳授精时间一直未能达到统一。本文也存在一些不足之处,由于实验室标准操作规程,HCG 注射后41 h 以上的患者较少,缺少对其结果的对比分析,且缺少对IVF-ET 患者后代的出生周数、体质量、性别、顺产与否等后续队列数据的跟踪报道,未对男性的一些基本临床指标和精液常规进行研究,也未对冻融周期ET 的患者进行比较。因此,实际工作中可以根据患者情况选择错时注射HCG,错时取卵,以便实验室人员根据患者HCG 注射时间选择最佳授精时机,后续工作也可以联合多中心进行更详细的HCG 注射时间分组以及队列随访数据的比较,尽可能使患者获得一个最佳的胚胎发育和妊娠结局,同时为临床医师提供较为细致的数据参考。
