泄化浊瘀方对急性痛风性关节炎患者血清炎症因子、氧化应激及相关基质金属蛋白酶表达的影响*
2023-10-30卢嘉琦李晓倩
姜 丹 卢嘉琦 李晓倩 吴 坚
(南京中医药大学南通附属医院,江苏南通 226001)
高尿酸血症(HUA)是痛风发生的病理基础,随着饮食结构的改变,患病率逐年上升,且年龄趋于年轻化[1]。HUA 和痛风是同一疾病的不同状态,约1/3 的HUA 最终发展为痛风,是糖尿病、慢性肾病、心脑血管疾病、高血压病等疾病的独立危险因素,是过早死亡的独立预测因子,已经成为多学科共同关注的重点疾病[2-3]。急性痛风性关节炎(AGA)为单钠尿酸盐(MSU)析出、沉积于关节及其他结缔组织所致的晶体相关性关节病,临床以受累关节剧烈疼痛、肿胀、功能障碍为主要表现,病情反复发作,逐渐加重,严重影响患者的身心健康和生活质量[4]。现代医学主要给予非甾体消炎药、秋水仙碱、糖皮质激素等对症处理,这些药物短时间内便见效,但具有普遍性的胃肠道和肾脏毒性不良反应,易产生耐药性,停药后病情易复发,严重影响了临床治疗效果[5]。
AGA 属于中医学“痹证”“白虎历节风”“肢体痹”等范畴,风寒湿邪滞留经脉乃其病机[1,5]。中医药已经成为我国治疗AGA 主要措施之一,可通过各活性成分多途径、多靶点作用于多个环节从而发挥协同治疗的功效,且具有安全性高、不良反应少的优点[4]。痛风急性期的核心证候为湿热蕴结证,治疗目标以改善症状、抗炎镇痛为主,急则治标,法以清热利湿、消肿止痛为主[1,6]。本院国医大师朱良春教授将AGA 归为“浊瘀痹”,认为本病与饮酒、喜进膏粱肥甘辛辣等饮食不节有关,浊瘀毒邪是本病重要病理因素,在治疗上着重泄浊化瘀、清热通络[7]。泄化浊瘀方正是基于朱老验方所创,经多年的临床观察与实践显示,泄化浊瘀方内服联合芙黄膏外用治疗AGA 有较好的消肿止痛效果,还能显著降低血尿酸,临床疗效确切[8]。本课题组进一步评价了泄化浊瘀方对AGA 患者血清炎症因子、氧化应激及基质金属蛋白酶(MMP-3、7、9)表达的影响,以进一步揭示其治疗AGA的机制。现报告如下。
1 资料与方法
1.1 病例选择 1)诊断标准:AGA 参照《2016 中国痛风诊疗指南》[9]制定;湿热蕴结证诊断标准根据《中医病证诊断疗效标准》[10]制定。2)纳入标准:符合AGA诊断标准;病程≤48 h,未采用止痛类药物治疗;符合湿热蕴结证诊断标准;疼痛视觉模拟评分法(VAS)评分≥4 分;年龄18~65 岁,性别不限;签署书面知情同意书。3)排除标准:继发性痛风患者、关节肿瘤、关节严重变形、关节结核者;合并其他类型的关节炎,如风湿型关节、强直性脊柱炎、关节退行性病变等者;妊娠或哺乳期妇女;合并严重心、肺、肝、肾功能衰竭者;酗酒、药物滥用者、精神病者、肿瘤者;严重过敏体质者,对本研究已知药物成分过敏者。
1.2 临床资料 选取本院2022 年2 月至2022 年12 月的100 例患者作为研究对象,根据随机数字表法分为对照组与观察组各50 例。两组年龄、性别、病程、发病部位、BMI及发病史等临床资料比较,差异无统计学意义(P>0.05)。见表1。本研究经南京中医药大学南通附属医院伦理委员会批准。
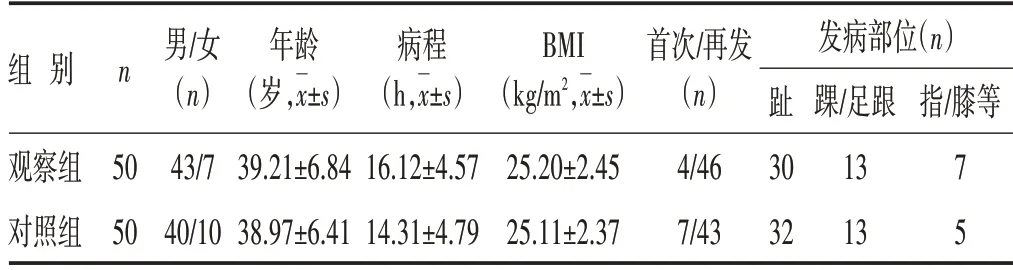
表1 两组患者临床资料比较
1.3 治疗方法 对照组口服美洛昔康片(上海勃林格殷格翰药业有限公司,国药准字H20020217),每次0.75 mg,每日1 次;双氯芬酸二乙胺乳胶(北京诺华制药有限公司,国药准字H19990291)适量外用患处,每日3 次。观察组口服泄化浊瘀方:土茯苓30 g,粉萆薢15 g,防己10 g,车前子10 g,秦皮15 g,赤芍10 g,蚕沙10 g,虎杖15 g,泽兰30 g,泽泻30 g,苍术10 g,黄柏10 g,威灵仙15 g,金钱草30 g,忍冬藤30 g。由南京中医药大学南通附属医院自动化免煎药房统一配制,每日1 剂,分成2 袋,早、晚2 次口服。芙黄膏(由芙蓉叶、大黄、赤小豆、冰片等组成,批准文号:苏药制字Z04000445)适量外敷患处,每日3 次。两组疗程均为5 d。给予健康指导,卧床休息,抬高患肢,清淡饮食,禁酒,足量饮水。
1.4 观察指标 1)疼痛程度。采用VAS 评分[11],由患者每日记录于日志卡中,记录3 次(早、中、晚),取每日最高的VAS 记分进行比较。2)主要症状、体征评分[12]。主要观察关节疼痛、关节压痛、肿胀、活动障碍,治疗前后各评价1 次。3)湿热蕴结证评分[12]:对疼痛、肿胀、皮肤潮红、局部灼热、活动受限、压痛、发热、口渴、心烦不安等症状根据无、轻、中、重,分别记0、1、2、3 分,各症状评分相加为湿热蕴结证积分。治疗前后各评价1 次。4)炎症因子。空腹抽肘静脉血2 mL,采用免疫比浊法测定超敏C 反应蛋白(hs-CRP),采用酶联免疫吸附法测定肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)。治疗前后各检测1 次。5)氧化应激。空腹抽肘静脉血2 mL,采用酶联免疫吸附法检测丙二醇(MDA)、超氧化物歧化酶(SOD)和8-羟基脱氧鸟苷(8-OHdG)。治疗前后各检测1 次。6)基质金属蛋白酶(MMP)。空腹抽肘静脉血2 mL,以酶联免疫吸附法检测基质金属蛋白酶-3(MMP-3)、基质金属蛋白酶-7(MMP-7)、基质金属蛋白酶-9(MMP-9)和金属蛋白酶抑制剂-1(TIMP-1)水平。治疗前后各检测1 次。7)安全性评价。记录生命体征(体温、心率、呼吸、血压)和不良事件情况,检测血尿常规、肝功能、肾功能和心电图等安全性指标。
1.5 疗效标准 参照《中医病证诊断疗效标准》[10]制定。临床痊愈:疗效指数减少≥95%。显效:疗效指数减少≥70%,<95%。有效:疗效指数减少≥30%,<70%。无效:疗效指数减少<30%。疗效指数=(治疗前湿热蕴结证积分-治疗后湿热蕴结证积分)÷治疗前湿热蕴结证积分×100%。总有效率(%)=(临床痊愈数+显效数+有效数)÷总例数×100%。
1.6 统计学处理 应用SPSS22.0 统计软件。计量资料符合正态分布以()表示,组间比较采用独立样本t检验,组内比较采用配对t检验,否则采用非参数检验,VAS 评分采用重复测量的方差分析。计数资料以“n、%”表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组治疗前后VAS评分比较 见表2。治疗后两组患者VAS 评分逐渐下降(P<0.05),观察组患者在治疗后2~5 d的VAS评分均低于对照组(P<0.05)。
表2 两组治疗前后VAS评分比较(分,±s)

表2 两组治疗前后VAS评分比较(分,±s)
注:与本组治疗前比较,*P<0.05;与对照组同期比较,△P<0.05。下同。
组别观察组对照组5 d 1.77±0.51*△2.45±0.53*n 50 50治疗前7.07±0.94 7.10±0.91 1 d 6.17±0.83*5.76±0.87*2 d 4.22±0.68*△4.94±0.65*3 d 3.37±0.56*△4.13±0.59*4 d 2.16±0.49*△3.57±0.52*
2.2 两组治疗前后主要症状、体征评分比较 见表3。治疗后,两组患者关节疼痛、压痛、肿胀和活动障碍评分明显下降(P<0.05),且观察组低于对照组(P<0.05)。
表3 两组治疗前后主要症状、体征评分比较(分,±s)
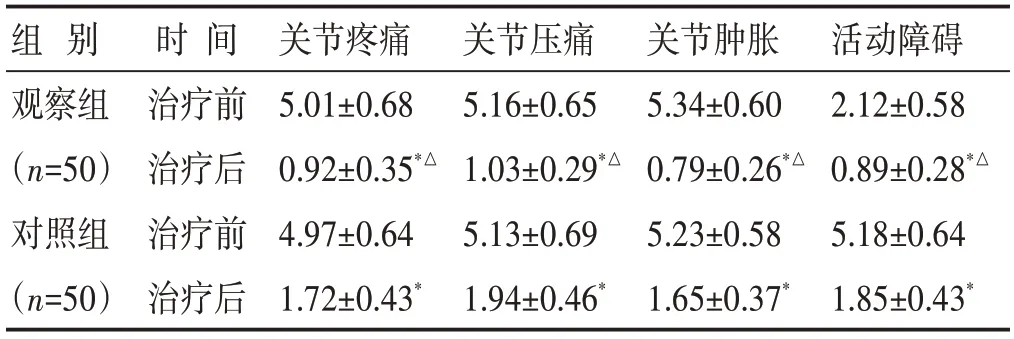
表3 两组治疗前后主要症状、体征评分比较(分,±s)
组 别观察组(n=50)对照组(n=50)时间治疗前治疗后治疗前治疗后关节疼痛5.01±0.68 0.92±0.35*△4.97±0.64 1.72±0.43*关节压痛5.16±0.65 1.03±0.29*△5.13±0.69 1.94±0.46*关节肿胀5.34±0.60 0.79±0.26*△5.23±0.58 1.65±0.37*活动障碍2.12±0.58 0.89±0.28*△5.18±0.64 1.85±0.43*
2.3 两组治疗前后hs-CRP、TNF-α、IL-1β 和IL-6 水平比较 见表4。治疗后,两组患者hs-CRP、TNF-α、IL-1β 和IL-6 水平下降(P<0.05);且治疗后观察组低于对照组(P<0.05)。
表4 两组治疗前后hs-CRP、TNF-α、IL-1β和IL-6水平比较(±s)

表4 两组治疗前后hs-CRP、TNF-α、IL-1β和IL-6水平比较(±s)
组 别观察组(n=50)对照组(n=50)时间治疗前治疗后治疗前治疗后hs-CRP(mg/L)20.36±3.44 7.15±1.38*△20.75±3.63 10.46±1.57*TNF-α(ng/L)35.15±4.24 18.76±2.84*△34.63±4.29 22.57±3.06*IL-1β(ng/L)49.27±6.03 23.37±3.91*△48.62±5.95 29.75±4.84*IL-6(μg/L)44.19±5.82 22.79±3.80*△43.64±5.71 28.03±4.25*
2.4 两组治疗前后MMP-3、MMP-7、MMP-9和TIMP-1 水平比较 见表5。治疗后,两组患者MMP-3、MMP-7、MMP-9 水平降低(P<0.05),TIMP-1 水平升高(P<0.05),且观察组MMP-3、MMP-7、MMP-9 水平低于对照组(P<0.05),TIMP-1 水平高于对照组(P<0.05)。
表5 两组治疗前后MMP-3、MMP-7、MMP-9和TIMP-1水平比较(±s)
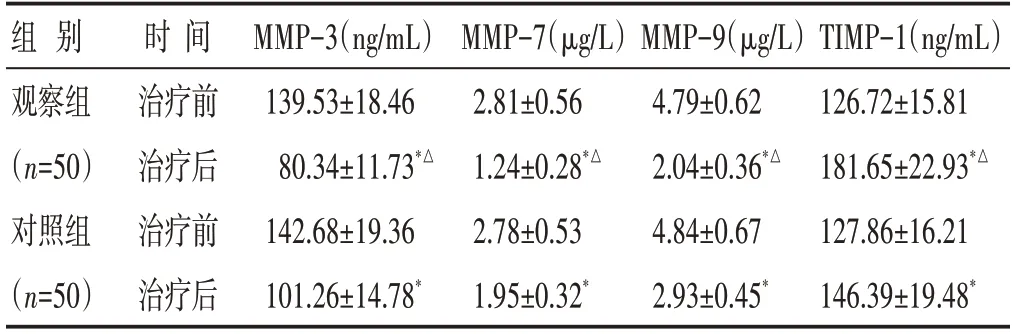
表5 两组治疗前后MMP-3、MMP-7、MMP-9和TIMP-1水平比较(±s)
组别观察组(n=50)对照组(n=50)时间治疗前治疗后治疗前治疗后MMP-3(ng/mL)139.53±18.46 80.34±11.73*△142.68±19.36 101.26±14.78*MMP-7(μg/L)2.81±0.56 1.24±0.28*△2.78±0.53 1.95±0.32*MMP-9(μg/L)4.79±0.62 2.04±0.36*△4.84±0.67 2.93±0.45*TIMP-1(ng/mL)126.72±15.81 181.65±22.93*△127.86±16.21 146.39±19.48*
2.5 两组治疗前后8-OHdG、MDA和SOD水平比较 见表6。治疗后,两组患者8-OHdG、MDA 下降(P<0.05),SOD 升高(P<0.05),且治疗后观察组8-OHdG、MDA 低于对照组(P<0.05),SOD 高于对照组(P<0.05)。
表6 两组治疗前后8-OHdG、MDA和SOD水平比较(±s)

表6 两组治疗前后8-OHdG、MDA和SOD水平比较(±s)
组 别观察组(n=50)对照组(n=50)时间治疗前治疗后治疗前治疗后8-OHdG(ng/mL)1.97±0.23 0.86±0.15*△2.03±0.24 1.22±0.18*MDA(μmol/L)4.26±0.71 1.85±0.34*△4.33±0.62 2.45±0.47*SOD(U/L)36.89±6.36 50.47±9.22*△37.24±6.53 43.17±8.06*
2.6 两组中医证候疗效比较 见表7。治疗后观察组中医证候疗效总有效率高于对照组(P<0.05)。

表7 两组中医证候疗效比较(n)
2.7 安全性评价 对照组有7例患者出现消化道症状(恶心、呕吐、腹胀、腹疼、腹泻),程度为轻度,3 例患者出现头晕,程度为轻度,4 例患者出现皮肤瘙痒、皮疹,考虑均与西药有关。观察组有3 例患者出现轻度恶心、呕吐,3 例患者出现轻度皮肤瘙痒、皮疹,考虑可能与中药相关。两组均无严重不良事件发生。
3 讨 论
目前HUA 和痛风的发病率显著增加,有数据显示我国痛风患病率已高达3.9%,且还在持续上升[13]。AGA 具有易诊难治、复发率较高的特点,并随疾病的发展逐渐加重,易造成关节畸形,还可累及肾脏损伤,引发心脑血管疾病等[4]。痛风急性发作期以抗炎止痛治疗为主,并不是以降低血尿酸为目的,长期降尿酸治疗是根治痛风的关键,但目前尚无药物能根治痛风[2]。
研究显示,AGA 患者以湿热蕴结证为主,且多为单一关节发病,发病最多的为第一跖趾关节,其次是踝关节,湿热蕴结型患者以年轻群体多见,与高热量、高蛋白、高嘌呤的饮食习惯有关,首要诱发因素为饮酒,其次为饮食[14-15]。《金匮要略》有云“盛人脉涩小,短气,自汗出,历节疼,不可屈伸,此皆饮酒汗出当风所致”。饮食不节,久食肥甘厚味,湿滞下焦,郁而化热。朱丹溪在《格致余论》所载“彼痛风者,大率因血受热已自沸腾,其后或涉冷水,或立湿地,或扇取凉,或卧当风,寒凉外抟,热血得寒,污浊凝涩,所以作痛,夜则痛甚”,进一步指出本病由风、痰、湿、瘀、浊毒等阻滞经脉所致[16]。朱良春教授对朱丹溪痛风病因病机进行继承与发展,创造性地提出“浊瘀痹”,湿浊瘀滞内阻是其主因,乃湿浊阻滞于血脉之中,难以泄化,与血相结而为浊瘀,滞留于经脉,变证丛生,浊瘀类似尿酸盐结晶,聚于体内,或从阳化,引发急性发作,或从阴化,见关节肿胀,经久难消,可见浊瘀是痛风炎症反应的病理基础,炎症反应是外证征象[7,17]。
泄化浊瘀方正是朱老根据泄化浊瘀、调益脾肾原则所创,方中土茯苓祛风湿,强筋骨,利关节;萆薢利湿浊、舒筋络;虎杖、泽泻、泽兰清热利湿;防己利水消肿;车前子、金钱草清热利湿;蚕沙、苍术燥湿健脾;赤芍活血化瘀;秦皮、黄柏清热燥湿;威灵仙祛风湿、通经络;忍冬藤清热解毒,疏风通络。全方共奏泄化浊瘀、蠲痹通络之效[8]。本组数据显示观察组患者在治疗后2~5 d 的VAS 评分均低于对照组,关节疼痛、压痛、肿胀和活动障碍评分低于对照组,中医证候疗效总有效率高于对照组,可见泄化浊瘀方联合芙黄膏外用治疗急性痛风性关节炎可有效减轻疼痛、肿胀,改善肢体活动范围,疗效优于常规抗炎止痛治疗措施,且使用安全。
AGA 是一种无菌性炎症反应,hs-CRP 可作为一种重要的炎症指标判断痛风患者病情活跃程度,动态检测可为诊断、治疗、疗效观察及预后判断提供支持[18]。沉积在关节部位的MSU 能激活NALP3 炎症小体,诱导IL-1β、TNF-α、IL-6 等炎症介质大量释放,IL-1β 被认为是启动痛风发作的主要细胞因子,能诱导中性粒细胞聚集启动炎症反应;IL-6 是启动痛风炎症反应主要因子之一,TNF-α 可增加IL-1β的表达[19]。本组资料显示治疗后观察组hs-CRP、TNF-α、IL-1β 和IL-6 水平低于对照组,提示了泄化浊瘀方可抑制炎症因子,减轻炎性损伤,有利于病情的控制。持续的高尿酸状态和MSU 晶体的析出,破坏了机体氧化与抗氧化平衡,使机体处于氧化应激状态,大量氧自由基参与了AGA 的病理生理过程[4]。MDA 为氧化代谢产物,可抑制SOD 等抗氧化物的表达,加重关节损伤,促使关节出现红肿热痛,反映了氧化应激损伤程度;SOD 能清除氧自由基,阻断脂质过氧化连锁反应,从而发挥保护细胞的功效,其水平的高低与过氧化引起的炎性反应有关[4,20]。8-OHdG 是公认的最稳定的DNA 氧化应激生物标志和RNA 氧化修饰的生物标志物,研究证实在AGA 患者中明显升高,促进了疾病的发生、发展[4,21]。本组资料显示治疗后观察组8-OHdG、MDA 低于对照组,SOD 高于对照组,提示了泄化浊瘀方提高了机体的抗氧化应激能力,减轻了急性氧化应激损伤,从而减轻了关节的病理损伤。
炎症反应持续存在可引发纤维化,引起组织粘连甚至畸形,多种细胞因子参与了骨破坏。高水平MMP-3 会加快细胞外基质降解进程,损伤软骨及韧带组织,且MMP-3 对于AGA 患者的关节滑膜炎症严重程度评估有较高的敏感性,与疼痛程度呈正相关[22]。MMP-9 可以降解所有细胞外基质,使关节滑膜组织出现炎症,导致关节软骨破坏[23]。MMP-7 具有强大的底物降解功能,它的增多导致关节软骨MMPs/TIMPs 平衡遭到破坏,AGA 模型动物中MMP-7水平显著升高,参与了痛风的急性发作[24]。TIMP-1是MMPs 抑制性物质,拮抗其后续活化进程,从而减轻了其对软骨和组织的破坏[22]。本组资料显示治疗后观察组MMP-3、MMP-7、MMP-9 水平低于对照组,TIMP-1 水平高于对照组,结果提示了泄化浊瘀方可调节MMP 水平,有助于减轻骨的破坏。
综上,泄化浊瘀方联合芙黄膏外用治疗急性痛风性关节炎(湿热蕴结证)患者,具有抗炎、抗氧化和调节基质金属蛋白酶作用,能减轻疼痛、肿胀,改善肢体活动范围,疗效优于常规抗炎止痛治疗措施,且使用安全。
