野生中华按蚊共生微生物群落与杀虫剂抗性关系
2023-10-30王明斌张玉娟
仇 鑫, 孟 晨, 王明斌, 陈 斌, 张玉娟
(重庆师范大学昆虫与分子生物学研究所, 媒介昆虫重庆市重点实验室, 重庆 401331)
蚊媒传染病已成为严重的公共健康问题之一(Fernandesetal., 2018)。以疟疾为例,作为蚊虫叮咬后而感染疟原虫的严重致命的全球流行性寄生虫病,目前已成为全球发病率最高的恶性蚊媒传染病之一。病媒控制是减少疟疾传播的关键措施(Christodoulou, 2011)。中华按蚊Anophelessinensis是中国、越南、柬埔寨和泰国等东南亚国家的主要疟疾媒介之一,长期以来以其分布广泛、种群密度高和媒介能力不断增强而闻名(Panetal., 2017)。然而,由于长期使用化学杀虫剂而引起的杀虫剂抗性暴发已成为控制病媒传播疾病的主要障碍。拟除虫菊酯是一类高效、低毒、低残留的杀虫剂,广泛应用于农林牧和医学害虫控制(Singhetal., 2009)。中华按蚊对拟除虫菊酯类杀虫剂产生抗性已屡见报道(Zhangetal., 2015)。为了更好地了解中华按蚊的生物学基础,特别是其抗药性的分子机制,已有研究大多聚焦于蚊虫的抗性基因的鉴定及其功能验证(Andriessenetal., 2015; Balabanidouetal., 2016)。
共生微生物在昆虫生物学性状、多样性形成、生态适应性、抗性等多方面发挥重要作用。例如,白蚁依赖于肠道中芽孢杆菌属Bacillus产生纤维素酶消化木质素获取营养物质(Brune and Dietrich, 2015),其次,研究发现共生微生物在昆虫入侵和在新环境中定殖方面起着促进作用(Krawczyketal., 2015)。更重要的是,共生微生物与昆虫杀虫剂抗性的关联研究已有报道,Kikuchi等(2012)证明,能降解苯硝硫磷的Burkholderia菌株与点蜂缘蝽Riptortuspedestris建立了有益的共生关系,并使寄主昆虫对苯硝硫磷产生抗性。还有报道表明,豆类点蜂缘蝽肠道共生微生物通过获得的杀虫剂降解酶将有机磷杀虫剂氟硝草酮降解为化合物 3-甲基-4-硝基苯酚,并由寄主昆虫排出体外(Satoetal., 2021)。也有研究发现褐飞虱Nilaparvatalugens共生微生物对寄主的杀虫剂抗性产生负作用,砷杆菌属Arsenophonus显著降低了褐飞虱对于吡虫啉杀虫剂抗性(Pangetal., 2018)。然而上述研究仅针对个别菌株或实验室样品分离的微生物进行种类鉴定,缺乏从高通量测序和组学的角度鉴定抗性和感性昆虫之间共生微生物差异性。
近年来,利用16S rRNA基因作为标记已成为研究微生物种类和多样性的有力工具(Mackelprangetal., 2011)。细菌16S rRNA具有复杂且高度保守的二级结构,包括9个可变(V)区(V1-V9)(Chakravortyetal., 2007)。超可变区域,如V3或V6区域能够提供可靠系统发育信息用于研究微生物(Huseetal., 2008)。其次,18S rRNA基因是真菌分类的重要标志之一,与16S rRNA基因类似,18S rRNA基因有9个可变区域(V1-V9),其中V4和V9区作为真菌系统发育研究提供准确的基因信息(Wuetal., 2015)。基于该技术,已经有一些关于昆虫及其共生微生物组成和多样性研究报道,如对小菜蛾Plutellaxylostella两种杀虫剂(毒死蜱和氟虫腈)抗性品系的16S rRNA可变区V6测序研究表明,乳酸菌或其他稀有类群在小菜蛾抗药性中发挥作用(Xiaetal., 2013)。但是对于中华按蚊拟除虫菊酯抗性蚊虫的共生微生物却知之甚少。
本研究采集中国重庆、云南和安徽3个地区的野生中华按蚊样本,以上地区已报道发现杀虫剂抗性中华按蚊(Cuietal., 2006)。经过抗性生测鉴定得到杀虫剂敏感(insecticide-sensitive, FS)和杀虫剂抗性(insecticide-resistant, FR)的野生中华按蚊雌成虫并进行基因组高通量测序;通过鉴定16S rRNA或18S rRNA基因可变区鉴定共生微生物的种类并分析多样性,研究敏感和抗性的野生中华按蚊的共生微生物组成、多样性和差异性。我们还讨论了共生微生物在野生中华按蚊抗药性中的潜在作用。本研究为中华按蚊抗药性研究领域提供参考。
1 材料与方法
1.1 样本采集
本研究使用2013年从重庆市璧山区(29°35′22.92″N,106°13′38.28″E)、云南省红河州元阳县(23°13′34.31″N,102°50′29.15″E)和安徽省蚌埠市五河县(33°8′43.08″N,117°53′8.52″E)野外采用紫外线灯诱法(Mooreetal., 2001)采集的野生中华按蚊成虫活体样品,其中:安徽省样品标记为AH;云南省样品为YN;重庆市样品为CQ。
1.2 野生中华按蚊生物测定
参照世界卫生组织的体外生物测定法(WHO, 2013),分别将1.1节采集的野生中华按蚊雌成虫放入0.05%拟除虫菊酯药膜的有机玻璃接触筒内(筒长12.5 cm,直径5 cm),共计3筒。药膜接触1 h后死亡的中华按蚊标记雌成虫为敏感株(FS),正常存活的中华按蚊将其转移至无杀虫剂环境葡萄糖喂养,稳定存活24 h后标记为抗性株(FR)。所有中华按蚊分为6组,分别标记为安徽地区杀虫剂抗性组(AH-FR)、安徽地区杀虫剂敏感组(AH-FS)、云南地区杀虫剂抗性组(YN-FR)、云南地区杀虫剂敏感组(YN-FS)、重庆地区杀虫剂抗性组(CQ-FR)和重庆地区杀虫剂敏感组(CQ-FS),每组6头雌成虫,共计36个样本。
1.3 野生中华按蚊共生微生物基因组测序
用75%乙醇冲洗1.2节中华按蚊样本90 s,然后用无菌水冲洗3次。将每头中华按蚊单独装入1.5 mL无菌离心管中, 3个地区的样本共计36管样本。总DNA提取使用酚-氯仿-异戊醇方法抽提。使用无菌手术刀将中华按蚊需切碎加入裂解液中;酚类物质可以结合蛋白释放DNA;通过氯仿可以使酚中的DNA形成两相体系,DNA会在氯仿和水相的交界处分布;加入异戊醇的可以在冷藏条件下沉淀DNA;沉淀的DNA经乙醇清洗并晾干,随后使用TE缓冲液溶解。最后用干冰低温寄送至深圳华大基因股份有限公司,采用Illumina Hiseq 2000平台进行全基因组测序。
1.4 共生微生物基因序列比对
使用SOAPnuke软件对测序获得的野生中华按蚊和共生微生物基因组原始读段进行质量控制。在获得有效数据后使用Burrows-Wheeler Aligner(BWA)软件,将质控后的读段与中华按蚊基因序列数据库进行比对。中华按蚊基因序列数据从ASDB数据库(Zhangetal., 2021)获取,根据比对结果过滤出中华按蚊基因序列。对于剩下的读段使用BLAST(http:∥www.ncbi.nlm.nih.gov/BLAST)软件将其与GenBank数据库的细菌、古细菌和真菌基因序列(16S rDNA或18S rDNA基因)进行比对(保留e≤1.0×10-10结果),根据比对结果可以获得共生微生物的基因序列读段。
1.5 数据分析
利用R语言的ggplot2包绘制各组样品的共生微生物在门和属水平上相对丰度大于1%的堆积图;利用iNEXT包计算共生微生物多样性指数,包括ACE指数(Chao and Lee, 1992)、Chao 1指数(Chaoetal., 1984);vegan包提供了计算多样性指数的功能,包括Shannon指数(Shannon, 1948)和Simpson指数(Simpsonetal., 1949)。使用MEGA软件绘制系统进化树(Zappia and Oshlack, 2018),样本间物种多样性分析通过邻接进化树以一个距离矩阵作为输入,得到每组分群之间的距离。R语言的ade4包提供了基于共生微生物组成的主坐标分析(principal coordinate analysis, PCoA)方法,这是一种基于样本的多元统计分析方法(Kumar and Cava, 2018),可用于反映不同组间的差异。使用TBtools软件绘制Venn图可以统计组内样品独有和共有的可操作分类单元(operational taxonomic units, OTUs)数量,直观地显示组内样品OTUs组成的相似性和重叠情况。此外,TBtools软件(版本号:MEGA-X)还可用于物种丰度热图分析,以比较敏感和抗性野生中华按蚊共生微生物群落组分的差异性。
2 结果
2.1 野生中华按蚊雌成虫共生微生物群落组成
经过测序数据质量筛选, 杀虫剂敏感(FS)和杀虫剂抗性(FR)野生中华按蚊6组样本共保留2 773 711 762个测序读段,其中123 943个读段属于共生微生物,读长均超过3 000 bp(图1)。这些序列分为3 284个微生物OTUs。

图1 野生中华按蚊雌成虫共生微生物可操作分类单元(OTUs)稀释曲线Fig. 1 Dilution curve of operational taxonomic units (OTUs) of the symbiotic microbiota in the female adults of wild Anopheles sinensisAH-FR: 安徽地区杀虫剂抗性组Insecticide-resistant group from Anhui; AH-FS: 安徽地区杀虫剂敏感组Insecticide-sensitive group from Anhui; YN-FR: 云南地区杀虫剂抗性组Insecticide-resistant group from Yunnan; YN-FS: 云南地区杀虫剂敏感组Insecticide sensitive group from Yunnan; CQ-FR: 重庆地区杀虫剂抗性组Insecticide-resistant group from Chongqing; CQ-FS: 重庆地区杀虫剂敏感组Insecticide-sensitive group from Chongqing.图2-7和表1同。The same for Figs. 2-7 and Table 1.
AH-FR共生微生物分为1 516个OTUs;AH-FS共生微生物分为1 047个OTUs;CQ-FR共生微生物分为480个OTUs;CQ-FS共生微生物分为422个OTUs;YN-FR共生微生物分为485个OTUs;YN-FS共生微生物分为1 058个OTUs(图2)。与其他两个地区相比,重庆野生中华按蚊雌成虫共生微生物OTUs数量明显较少。安徽野生中华按蚊雌成虫共生微生物有丰富的OTU种群。CQ-FR和CQ-FS共生微生物OTUs数量相似。YN-FS共生微生物OTUs数量高于YN-FR的,而AH-FR共生微生物OTUs数量高于AH-FS的。
2.2 野生中华按蚊雌成虫共生微生物群落多样性
Alpha多样性指数分析结果表明(表1),不同地区野生中华按蚊雌成虫共生微生物群落Shannon指数差异不大。杀虫剂敏感(FS)野生中华按蚊雌成虫共生微生物群落Shannon指数从低到高按照野生中华按蚊来源排名为CQ, AH和YN。CQ-FS组共生微生物群落多样性最低(Shannon指数值=3.120),YN-FS组的最高(Shannon指数值=4.660);杀虫剂抗性(FR)野生中华按蚊雌成虫共生微生物群落Shannon指数中AH-FR组微生物群落多样性最高(Shannon指数值=4.576),但接近其他CQ-FR和YN-FR两组的值。采用Simpson指数对不同地区中华按蚊雌成虫共生微生物多样性进行了评估,CQ-FS组共生微生物群落多样性差异最小。野生中华按蚊共生微生物群落微生物丰富度结果显示,丰富度最高的是AH-FR(ACE指数值=1 555.65),最低的是CQ-FS(ACE指数值=260.75)。该结果与Chao 1指数的评价结果一致(AH-FR Chao 1指数值=1 038.011,CQ-FS Chao 1指数值=245.438)。
从6组野生中华按蚊雌成虫共生微生物(不包括共生微生物相对丰度<1%)中共鉴定到14个门,优势种群结构相似,但相对丰度不同。在门水平,相对丰度前10个门占比90%以上(图3: A),占比最高的是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和蓝菌门(Cyanobacteria);共鉴定到52个属,相对丰度前30个属占比50%以上,其中,亚细亚菌属Asaia、棒状杆菌属Corynebacterium、蓝细菌属Cyanobacteria、奈瑟菌属Neisseria、Novispirillum属和葡萄球菌属Staphylococcus为优势属(图3: B)。
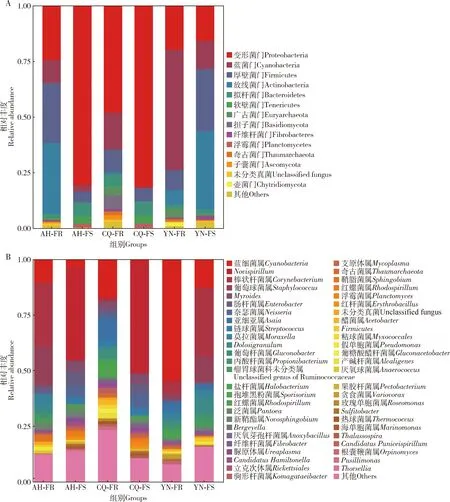
图3 野生中华按蚊雌成虫共生微生物门(A)和属(B)水平的相对丰度Fig. 3 Relative abundance of the symbiotic microbiota at the phylum (A) and genus (B) levels in the female adults of wild Anopheles sinensis
基于共生微生物组成结果表明,重庆、云南和安徽野生中华按蚊雌成虫共生微生物分别聚在一起,其中安徽野生中华按蚊雌成虫共生微生物遗传距离比重庆和云南的更远,3个地区对拟除虫菊酯敏感和抗的野生中华按蚊雌成虫显示出相似的共生微生物组成,其中,AH-FR和AH-FS之间共生微生物组成差异最大,YN-FR和YN-FS之间共生微生物组成差异最小(图4)。PCoA得到了类似的结果(图5),揭示生存环境是影响蚊子共生微生物多样性的主要因素。

图4 基于野生中华按蚊雌成虫共生微生物组成聚类树Fig. 4 Clustering tree based on the composition of the symbiotic microbiota in the female adults of wild Anopheles sinensis
2.3 杀虫剂敏感和抗性野生中华按蚊雌成虫共生微生物群落差异
在安徽地区AH-FR共有1 516个OTUs,AH-FS共有1 047个OTUs,其中AH-FR和AH-FS共有的OTUs数300个,AH-FR特有的OTUs数1 216个,AH-FS特有的OTUs数747个;在重庆地区CQ-FR共有480个OTUs,CQ-FS共有422个OTUs,其中CQ-FR和CQ-FS共有的OTUs数118个,CQ-FR特有的OTUs数362个,CQ-FS特有的OTUs数304个;在云南地区YN-FR共有485个OTUs,YN-FS共有1 058个OTUs,其中YN-FR和YN-FS共有的OTUs数292个,YN-FR特有的OTUs数193个,AH-FS特有的OTUs数766个。结果表明,各地区之间的中华按蚊敏感株和抗性株存在一定的共生微生物群落差异(图6)。

图6 基于野生中华按蚊雌成虫共生微生物分类操作单元(OTUs)组成的维恩图Fig. 6 Venn diagram based on the composition of operational taxonomic units (OTUs) of the symbiotic microbiota in the female adults of wild Anopheles sinensis
共生微生物丰度差异结果显示(图7),各地区拟除虫菊酯敏感的野生中华按蚊雌成虫共生微生物中8株细菌的丰度更高,包括1株脱氯单胞菌属Dechloromonas细菌、1株奇古菌门(Thaumarchaeota)细菌、1株不动杆菌属Acinetobacter细菌、2株肠杆菌科(Enterobacteriaceae)细菌、1株棒状杆菌属Corynebacterium细菌、1株黄杆菌属Flavobacterium细菌和1株蓝细菌属细菌。抗拟除虫菊酯的野生中华按蚊雌成虫共生微生物中10株细菌的丰度更高,包括2株蓝细菌属Cyanobacteria细菌、3株盐杆菌目(Halobacteria)细菌、3株瘤胃球菌科(Ruminococcaceae)细菌、1株赭黄嗜盐囊菌属Haliangium细菌和1株链球菌属Streptococcus细菌;对拟除虫菊酯敏感的野生中华按蚊雌成虫共生微生物中研究结果表明,各地区抗性中华按蚊雌成虫中共有一些相同的共生微生物菌落。
3 讨论
目前我国的疟疾主要分布在南部、中东部以及西南地区(Luetal., 2014)。中国云南省、安徽省和重庆市分别位于上述3个地区。杀虫剂使用通常作为控制蚊虫的策略(WHO, 2006)。以上地区已发现抗杀虫剂的中华按蚊(Cuietal., 2006)。了解以上地区中华按蚊共生微生物与抗性关系有利于制定新的防控策略。
我们采用全基因组高通量测序,调查研究了杀虫剂敏感和杀虫剂抗性的中华按蚊雌成虫共生微生物组成情况,结果表明:6组样本中OUTs数量的分布和相对 OTUs丰度表现出相似的趋势。中华按蚊菌群以变形菌门、厚壁菌门、放线菌门和蓝菌门为主(图3: A)。致倦库蚊Culexquinquefasciatus中前4的优势菌门包括变形菌门、拟杆菌门、放线菌门和厚壁菌门(Wangetal., 2021)。变形菌门是最大的优势菌门的结果与我们的研究结果一致。来自安徽、重庆和云南的中华按蚊雌成虫在共生微生物上是按照地理可区分的(图4和5),说明样本的微生物多样性和生存环境是密切关联的(Zengetal., 2017)。
重要的是,我们鉴定了杀虫剂抗性(FR)样品中高丰度存在的微生物,包括2株蓝细菌属细菌、3株盐杆菌目细菌、3株瘤胃球菌科细菌、1株赭黄嗜盐囊菌属细菌和1株链球菌属细菌(图7)。蓝细菌经过长时间的杀虫剂喷洒后,可以对有机磷杀虫剂进行降解(Hamedetal., 2021)。瘤胃球菌是降解甲基叔丁基醚(methyl tert-butyl ether, MTBE)等难以降解化合物的微生物(Liuetal., 2016)。赭黄嗜盐囊菌可以产生haliangicin,这是一种抗真菌和抗生素化合物(Sunetal., 2016)。抗性中华按蚊雌成虫中赭黄嗜盐囊菌的高丰度存在可能表明其在杀虫剂抗性方面的积极作用,这与抗生素抗性能力相关。链球菌是革兰氏阳性菌的一个家族,属于乳酸菌目(Lactobacillales),据报道链球菌可赋予宿主对毒素的抵抗力(Mackelprangetal., 2011)。在耐氯菊酯的冈比亚按蚊Anophelesgambiae中,链球菌属Streptococcus更为丰富(Omokeetal., 2021)。盐杆菌基因组包含海藻糖合成基因海藻糖-6-磷酸合成酶和海藻糖-6-磷酸酶。海藻糖-6-磷酸合酶在家蝇免疫中的作用已被报道(Zhangetal., 2019)。我们的结果表明中华按蚊微生物群落组成与其抗性能力之间存在相关性,提示了中华按蚊微生物分解杀虫剂的潜在机制。在以前的研究中,伯克霍氏菌Klebsiellapneumoniae、假单胞菌属Pseudomonas和黄杆菌属被报道为杀虫剂抗性相关细菌(Singh, 2009; Kikuchietal., 2012)。然而这些已报道的微生物没有在该项研究中被确认,可能是由于不同的昆虫种类和使用不同的杀虫剂导致的。
奇古菌门作为杀虫剂敏感(FS)样品中的一种共生微生物,可以氧化氨、固定碳并产生多种维生素(Haberetal., 2021)。埃及伊蚊Aedesaegypti共生肠杆菌可以协助宿主对进食的血液进行辅助消化(Gusmãoetal., 2010),这些微生物在蚊子的生长、发育和生命周期中起着关键作用(Xiaetal., 2013)。此外,我们发现一种黄杆菌只在CQ-FS样品中检测到。在埃及伊蚊肠道菌群的研究中,野生型蚊子也高表达黄杆菌(Muturietal., 2021)。脱氯单胞菌、不动杆菌、棒状杆菌在中华按蚊敏感株中较高,它们的作用有待进一步探讨。
不同种类的共生微生物可以通过各种代谢途径和酶系统来分解化合物,帮助宿主昆虫获得一定代谢抗性。目前还没有研究报道共生微生物在中华按蚊的其他抗性机制,如行为抗性、靶标抗性和穿透抗性中的作用。但是在黑腹果蝇Drosophilamelanogaster中有研究表明,共生肠道微生物醋杆菌属Acetobacter可以影响黑腹果蝇的嗅觉偏好,从而改变其觅食行为(Wongetal., 2017),这种影响是否会帮助昆虫产生行为抗性是值得研究的。在其他研究中报道了亚细亚菌属和肠杆菌可以通过卵共生方式传播给后代(Gusmãoetal., 2010),这提示微生物在亲本与子代之间的传递是子代产生抗性的潜在机制。我们将在后续的研究中挖掘其他抗性产生的机制与共生微生物之间的关系。
在本研究中,我们通过重测序方法鉴定了3个地区野生中华按蚊雌成虫共生微生物群落,揭示了不同地区敏感和抗性中华按蚊雌成虫微生物群落结构和差异,探索了一些微生物群与杀虫剂抗性之间的关系,并提出了一些可能与这种抗性相关的微生物。在未来的研究中,应该培养某些目标微生物或者使用抗生素将它们从蚊子生存环境中去除,以进一步阐明它们的功能。
