中华蜜蜂种群遗传分化与环境适应机制研究进展
2023-10-30骆家宇
陈 兵,骆家宇
(河北大学生命科学学院, 保定 071002)
中华蜜蜂Apisceranacerana为膜翅目(Hymenoptera)蜜蜂科(Apidae)蜜蜂属Apis东方蜜蜂Apiscerana亚种的昆虫,拥有所有亚洲蜜蜂属物种中最大的原生范围,是亚洲自然和农业种植系统中最重要的本地传粉媒介之一(国家畜禽遗传资源委员会, 2011)。我国除新疆和内蒙古北部外的其余各省市均有中华蜜蜂分布(杨冠煌, 2001)。在长期的自然选择作用下,中华蜜蜂很好地适应了当地的开花植物,融入了当地的自然环境,成为当地生态环境不可替代的一环,发挥着至关重要的生态作用(Abroletal., 2012)。尽管如此,中华蜜蜂正面临着前所未有的种群多样性下降,对亚洲区域的作物授粉服务功能造成直接损害,加剧了人类的食物短缺态势(Abrol, 2013; Theisen-Jones and Bienefeld, 2017)。研究人员认为,中华蜜蜂数量下降的原因包括气候变化和人为影响而加速的栖息地变化(Pottsetal., 2010)。
我国作为中华蜜蜂分布的大国,随着蜜蜂分子生物学领域的发展,从2000年开始应用形态标记和分子标记开展形态遗传分化和遗传多样性的研究(陈晶等, 2008; 刘之光和石巍, 2008)。通过形态学测量分析,在我国共发现中华蜜蜂14个形态类群,解释了中华蜜蜂在中国地理环境下的遗传分化和遗传资源分布(朱翔杰等, 2022)。采用线粒体DNA对我国中华蜜蜂遗传多样性分析,已发现多种线粒体非编码区序列单倍型(姜玉锁等, 2007)。采用基因组测序技术分析发现6个中华蜜蜂外周群是由一个中心群辐射分化出来的,并独立适应不同栖息地(Jietal., 2020)。这些研究为深入探究中华蜜蜂种群结构和遗传进化分析提供有力的支撑。
研究广泛分布的蜜蜂种群对揭示环境适应的遗传学基础具有重要意义。我国南方热带雨林到北方温带森林、草原及高原地带均有中华蜜蜂分布,生活在青藏高原的中华蜜蜂主要栖息于海拔3 300 m左右的山谷,且具有个体大、绒毛长、体色深等特点(杨冠煌, 2001)。而地处南方热带边缘的海南岛,其独特的地理资源环境和气候环境造就了具有个体小、分蜂性强、耐热等生物学特性的海南中华蜜蜂种群(杨冠煌, 1982, 1984)。这些多样性的中华蜜蜂种群为探究其遗传多样性以及环境适应性奠定了基础。
基于相关的研究进展,在本文中我们主要综述了环境因素对中华蜜蜂种群的遗传分化的影响,讨论中华蜜蜂在不同环境下的适应行为,提出未来关于中华蜜蜂环境适应性研究的重点方向,这对深入研究中华蜜蜂不同环境的适应性机制和制定有效的保护策略至关重要。
1 种群遗传分化与环境因素相关性
已有的研究比较分析了不同地理环境下中华蜜蜂种群遗传结构,以及与邻近大陆中华蜜蜂种群遗传分化,探索中华蜜蜂种群遗传分化的环境因素,从而促进蜜蜂种群遗传学理论的构建,为中华蜜蜂资源保护和区域性适应奠定基础。研究表明,促进中华蜜蜂种群遗传分化的环境因素主要如下。
1.1 生态环境
生态环境,特别是与海拔和经纬度相关的生态环境变化,是导致遗传分化的基因流限制的重要原因。首先是海拔相关的环境变化上,栖息在山区的中华蜜蜂与邻近的低海拔地区的种群在形态上不同,生理和行为上亦表现出差异。研究人员比较了从中国云南和甘肃两省采集的60头中华蜜蜂的基因组,基于种群遗传分化指数(Fst)、群体遗传多样性(θw)以及群体间扩展单倍型纯合度法(cross population extended haplotype homozygosity, XP-EHH)分析发现,候选区编码序列丰富,单倍型纯合度高,特别是与平原种群相比,高原蜜蜂种群的分化程度增加(Montero-Mendietaetal., 2019),表明中华蜜蜂在高海拔生境经历了选择。青藏高原平均海拔超过4 000 m唐古拉山脉将帕隆藏布河谷、金沙河谷、亚龙河谷和大渡河谷隔开,限制了青藏高原东部与南部低海拔地区中华蜜蜂种群的混合,从而将其分为波密种群,小金种群,雅江、九龙、木里种群以及巴塘、德荣、迪庆种群。其中波密种群有4个特有单倍型(Yuetal., 2019),说明高原山脉导致西藏种群出现特定遗传分化。Shi等(2020)在中国14个地点采集中华蜜蜂并对全基因组测序后,根据种群结构和主成分分析将中华蜜蜂分成7组,其中西藏和滇南种群与其他种群出现遗传分化。随后研究人员构建进化树分析这7个不同种群的系统发育关系,结果大致可以组合成3个主要的系统发育群,其中C1支是由亚热带地区的滇南和青藏高原地区的种群组成,这两个种群均来自中国西南部,与其余中华蜜蜂种群形成姊妹种群,共同代表了此研究中最早的分化谱系。从上可以看出,喜马拉雅山脉作为世界海拔最高的山脉,导致中华蜜蜂种群之间出现显著分化,故海拔在进化的相对速率中起着关键作用,可能会影响全球生物多样性的模式。
中华蜜蜂种群遗传分化还与纬度相关。Songram等(2006)在泰国的5个主要地点采集中华蜜蜂,研究发现北纬、中纬地区种群与南纬地区种群出现谱系分化,说明泰国地区的中华蜜蜂遗传多样性可能是受纬度影响。来自长白山的种群与青藏种群、南方种群、西北种群及北方种群的平均Fst值均高于0.21,显示长白山种群与其他种群间具有高度的遗传分化,中华蜜蜂长白山种群因此被认为是长白山区的独特生态型(Liuetal., 2022),这可能与长白山地区的纬度密切相关。
1.2 地理距离
遗传距离是研究种群遗传多样性的基础,可用来描述种内的遗传结构和种间变异,反映所研究种群的系统进化(Barker, 1994)。徐新建等(2013b)利用微卫星DNA分型技术分析黄土高原9个中华蜜蜂种群样本,计算得到黄土高原不同样点间的Fst范围为0.010~0.067,Monte Carlo检验结果也显示各样点间的遗传分化水平与地理距离呈正相关,这一结果表明地理距离越远,中华蜜蜂的遗传分化越大。但吉挺等(2009)对华东地区的6个中华蜜蜂种群进行遗传分析发现,在群体的形成过程中地理距离并不是影响其群体遗传结构的决定因素。随后,Chen等(2018)计算了中国各地18个中华蜜蜂种群的Fst值,发现一些相隔距离较远的种群被连接起来,如安康和纳雍种群等,而岷县和九寨种群等相隔距离较近的种群未被连接,这表明遗传距离和地理距离相关性并不显著。因此,地理位置的相对隔离是中国各地理种群中华蜜蜂形成重要因素之一,但地理因素并没有完全影响到其群体间的基因流动。
1.3 物理屏障
关于物理屏障对遗传分化影响的研究发现,在皖南山区与皖西大别山区中华蜜蜂群体间平均遗传分化系数为16.7%,这是由于山区阻碍种群间的基因交流,造成两个种群出现极显著的遗传分化现象(陈杨等, 2011)。基于微卫星DNA的研究发现,中华蜜蜂海南岛种群同大陆种群的遗传结构达到中等分化,推测了海南岛中华蜜蜂同大陆蜜蜂发生遗传分化是由于琼州海峡的隔离起到了重要作用(徐新建等, 2013a)。随后谷瑛等(2016)发现了3个新的东方蜜蜂单倍型,分别是大巴山CqH4、大娄山CqH7和西部丘陵CqH13,这表明中华蜜蜂在复杂地形下种群遗传资源丰富,所处山脉的不同会导致中华蜜蜂产生分化。Chen等(2018)发现,波密、海口和马尔康3个种群的Fst值均大于0.1,与其他种群相比分化明显,这也与主成分分析的结果相一致。这些种群主要生活在如岛屿和山区的物理屏障中,与其他种群独立,此研究很好的解释了强大的物理屏障是影响种群分化的主要原因之一,而非单纯的地理距离。
1.4 其他
中华蜜蜂囊状幼虫病是严重危害中华蜜蜂幼虫的传染性病害,发病时蜂群的死亡率常达50%以上(王双进, 2008),个体的死亡会造成等位基因丧失,最终导致遗传多样性的下降。郭慧萍等(2016)对暴发过中华蜜蜂囊状幼虫病的样点分析后发现,其微卫星位点遗传多样性显著低于未发病区的,部分位点出现大量等位基因丢失的现象,如Ac-2在发病区与未发病区等位基因数丢失50%,充分说明中华蜜蜂囊状幼虫病也是降低中华蜜蜂的遗传多样性的原因之一。人为干预或许也会使蜂种的遗传结构发生变异。例如,近年来大量内陆的中华蜜蜂由于利益驱使被贩卖到海南,内陆种群和海南种群产生基因交流,从而导致海南中华蜜蜂在遗传结构上发生显著变化(徐祖荫, 2022)。比较华中地区黄冈市和神农架地区的两个种群遗传参数,发现平原上的中华蜜蜂表现出比高山地区更高的遗传多样性(Fangetal., 2022),这很好地说明人类活动导致的平原过度城市化也会极大影响中华蜜蜂的种群分化。
2 形态变异与环境适应
昆虫形态发育受环境条件,包括温度、氧气、湿度、寄主等影响。昆虫作为变温动物,其体型与该物种活动时期的环境温度存在显著的相关性(Sheppard and Smith, 2000; Stillwell and Fox, 2007),该变化符合贝格曼法则或反贝格曼法则。除温度以外,湿度会比温度对黑腹果蝇Drosophilamelanogaster种内体型变异有更高度的相关性,暗示了湿度可能是一个比温度更重要的体型选择因素(Hoffmann and Harshman, 1999)。有研究者对远古化石的研究表明,在昆虫进化的前150百万年,随着空气中氧浓度的下降,昆虫的翅长逐渐缩短(Clapham and Karr, 2012)。而四纹豆象Callosobruchusmaculatus的体型与种子的大小显著相关,表明寄主大小限制了昆虫的生长(Stillwelletal., 2007)。同样,作为广布种,中华蜜蜂在不同环境因素的限制下,其形态发育会受到明显影响,我们将影响中华蜜蜂形态特征的主要环境因子汇总为表1。
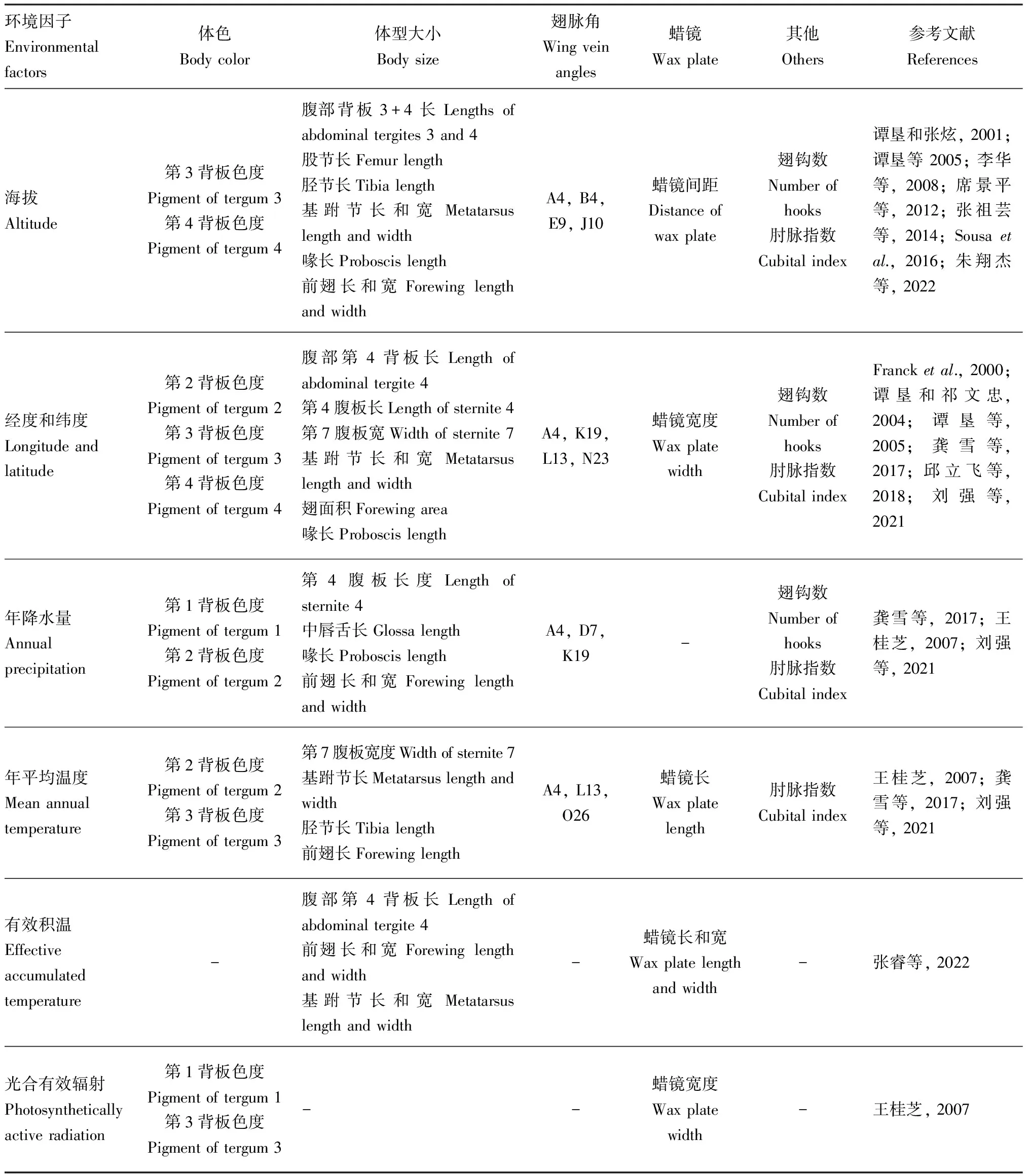
表1 影响中华蜜蜂形态特征的主要环境因子Table 1 Major environmental factors affecting the morphological characteristics of Apis cerana cerana
2.1 高原和海拔因素影响
高原地区较平原地区而言,一般具有更低温度和氧分压、更高紫外辐射和不一样的植被。为适应高海拔环境,高原上的动物在形态、生理和行为等方面具有适应性特征(Bush, 2001; Simonsonetal., 2013)。谭垦和张炫(2001)及谭垦等(2005)从我国34个不同地区采集中华蜜蜂样本,海拔范围为100~2 700 m,测定发现中华蜜蜂的38个形态特征中有13个表示体型大小的特征与海拔显著相关,随着海拔高度增加,中华蜜蜂个体逐渐变大,体色变深。李华等(2008)测量发现,青海民和县高海拔地区中华蜜蜂的形态特征包括前翅、后腿、腹部背板、绒毛长、腹片宽和蜡镜间距等值变大,腹部背板和喙的色度变深,可能与其高海拔低温的生境有关。席景平等(2012)发现,甘肃低海拔地区(海拔<1 200 m)的中华蜜蜂形态上比较接近东北、华中和北京的中华蜜蜂,高海拔地区(海拔>2 700 m)的中华蜜蜂则常表现为个体大、体色深、绒毛长的特点。体表附着的绒毛,除能黏附大量花粉粒外,还有保护和保温的作用(徐祖荫, 2022)。张祖芸等(2014)对云贵高原中华蜜蜂与滇南中华蜜蜂的38个形态特征的测定结果表明,滇南中华蜜蜂比云贵高原中华蜜蜂体型相对较小,这可能与高海拔低温环境有关,其体型变化符合贝格曼法则。Sousa等(2016)使用形态学分析了71个中华蜜蜂种群的形态,发现翅面积与海拔高度显著相关。此特征与高原低氧环境相关,因为在高海拔地区,稀薄的空气影响了个体的氧气供应(Klok and Harrison, 2009)。此外,空气密度随着高度的增加而降低,为拍打翅提供的支撑更少,从而改变了这些昆虫翅大小和重量之间的理想比例(Harrisonetal., 2010)。朱翔杰等(2022)测量了喜马拉雅山脉藏南蜜蜂的形态,并将其与中国其他地区的东方蜜蜂进行了比较,同样发现高海拔藏南群与中国其他类群在形态上有明显的差异,其体型仅次于川西高原的蜂群,并具有特殊的翅脉结构。因第5背板毛带较长,展示藏南蜂体色深的独特之处。综上,这些表型差异表明,中华蜜蜂已经进化出更好的能力来应对高原环境,这对我们理解中华蜜蜂对高海拔的适应性进化机制有重要意义。
2.2 经纬度因素影响
沿经、纬度梯度的变化的环境条件可以为构建生物体的适应性性状提供重要的选择力,在许多生物群中经纬度的变化会影响生物的形态特征(Mittelbachetal., 2007; Myersetal., 2020)。龚雪等(2017)对山东省沂蒙山区(沂源、蒙阴)和海南文昌采集的中华蜜蜂样本进行形态测量,与经纬度相关的形态特征有19项,包括腹部第2-4背板色度,腹部第4背板长,第7腹板宽度,第4腹板长度,后翅钩数,翅脉角A4, K19, L13和N23胫节长,基跗节长,基跗节宽, 前颏宽及总体长等,它们与纬度呈极显著正相关。刘强等(2021)对陕西省不同气候类型中华蜜蜂的形态进行测定发现,其体长、肘脉指数等表型与纬度呈显著正相关,与Franck(2000)等研究北纬的西方蜜蜂Apismellifera的地理形态趋化得出相同的结论。中华蜜蜂的体型随着纬度的北移而增大,体色随经度的东移而加深,这可能与经纬度协变相关的年气温降低有关(Vargasetal., 2010),即中华蜜蜂为了御寒,需要不断地补充食物以满足正常生命活动,因此导致个体发育变慢,个体变小。翅大小的变化一定程度上反映出体型大小的变化(Baietal., 2016)。邱立飞等(2018)对秦巴山区17个样点的中华蜜蜂前翅进行量化分析,发现不同样点翅大小的衡量指标CS(centroid size)值与经度、纬度之间存在显著相关性,翅大小随着纬度的升高而变大的结果与谭垦和祁文忠(2004)及谭垦(2005)对中华蜜蜂的体型及翅大小的研究结果一致。张睿(2022)对长白山地区中华蜜蜂种群所有形态特征测定发现,蜡镜宽度与经度呈显著正相关,蜡镜大小作为衡量蜜蜂分泌蜡能力的重要指标,与蜂群的生存和繁衍能力密切相关。以上的研究已经确定了中华蜜蜂在大尺度经度和纬度梯度上的几个关键特征的变化,这有助于更全面地了解经纬度是中华蜜蜂不同环境形态适应的驱动因素之一。
2.3 降水、湿度和气温(积温)等因素影响
体型变化还与其他气候因素的组合有关,体型较小与炎热潮湿条件有关,较大体型与较冷和干燥的条件有关(James, 1970)。Yom-Tov和Nix(1986)研究表明,湿度和降水指数与体型的相关性通常比与温度的相关性更好。王桂芝(2007)对华北等地区中华蜜蜂资源做了较为详细的调查后发现,体型大小随年均气温的降低而增大,体色随年均降雨量的减少、年均气温的降低而变深。龚雪等(2017)发现年降水量与中华蜜蜂的9项形态特征相关,体色随着年降雨量的增多而加深。刘强等(2021)同样发现了翅长和翅宽与年平均降水量呈显著负相关,喙长和翅面积与年平均气温呈显著正相关,体长与年平均湿度呈正相关。由此推测,中华蜜蜂为了适应高温高湿的气候环境,体色变浅有利于散热,而体型变大是蜜蜂自我调节的一种环境适应性体现,以保证采集更多的食物,保证正常生命活动。
此外,王桂芝(2007)发现,在紫外线辐射强的地区,中华蜜蜂体色多为黑色,而在山东平原及近海地区,光、温、水资源适宜,中华蜜蜂体色较强辐射地区偏浅,一般呈浅棕或黄色。张睿(2022)发现,蜡镜宽度与积温、光合有效辐射呈显著正相关,如前翅宽度、跗节长度、跗节宽度、蜡镜长度、蜡镜宽度、腹部第4背板长度,其中蜡镜宽度与≥15 ℃积温具有正相关性,这是由于15 ℃是大部分蜜源植物生长发育的起始温度,也是中华蜜蜂出巢采蜜的临界温度,因此,长白山地区的中华蜜蜂种群的生存和散布受到≥15 ℃积温的直接或间接影响,故积温也是影响蜜蜂的生长和分布的因素之一。
3 环境适应性生理和行为改变
蜜蜂的生命活动和地理分布具有很强的温度依赖性,这为我们研究中华蜜蜂环境适应性生理提供理论基础。研究表明,寒冷地区的昆虫面临着低温胁迫,严重制约其新陈代谢和生理活动(Colinetetal., 2017)。马海清(1988)发现,中华蜜蜂存活的最适温度是20~34 ℃,温度5~6 ℃时中华蜜蜂仍保有振翅飞行能力,这因为低温环境下中华蜜蜂个体具有极强的自我调节能力,通过减弱蒸发作用、消耗体内脂肪、促进肌肉收缩等运动产生热量,使体温高于环境温度,从而确保在短期的低温条件下保持活性(Tautzetal., 2003; Grohetal., 2004; Teets and Denlinger, 2013; Wangetal., 2016)。秦明等(2017)在低温环境检测到中华蜜蜂体内游离水含量会显著降低,将体内游离水转化为结合水,以降低过冷却点(Wolfeetal., 2002),这或许是蜜蜂重要的抗寒机制。甘油是中华蜜蜂体内重要的低温保护剂,参与蛋白质的稳定和细胞膜的保护途径(Kostáletal., 2007; Overgaard and MacMillanetal., 2017)。徐凯等(2018)研究表明低温处理后蜂体内甘油水平显著上调;苏晓玲等(2022)同样发现蜜蜂的甘油水平在低温下持续增加。上述种种现象证实甘油是蜜蜂应对低温环境的一种调节物质,起到了低温保护作用。苏晓玲等(2022)同时还发现低温环境中糖原含量显著降低,这可能与蜜蜂消耗大量的糖原以抵御寒冷相关(欧阳芳和戈峰, 2014)。相反,在高温胁迫下,昆虫会发生抗氧化反应,清除体内多余的氧自由基以维持正常的生理活动(Felton and Summers, 1995; Wuetal., 2011)。研究人员在35, 40和45 ℃的极端高温下对中华蜜蜂的失水率进行测定,发现失水率会随着温度的升高而增加,这与Roberts和Harrison(1999)的发现一致,当西方蜜蜂暴露在33 ℃后水分流失增加且抗氧化酶的活性显著增加,说明中华蜜蜂的抗氧化系统对高温胁迫高度敏感(Li Xetal., 2019)。
另外,氧气也是影响中华蜜蜂生命活动的重要环境因子。有研究表明氧气压力随着海拔高度的增加而逐渐降低,在海拔3 000 m时,氧气压力比平原降低25%(Zhaoetal., 2013)。昆虫通常含有特定的受体细胞,可以感知和检测环境中CO2(Robertson and Kent, 2009),西方蜜蜂利用这类受体检测环境中的CO2并通过振翅调节巢房中的CO2浓度(Seeley, 1974; Sudarsanetal., 2012)。经测定发现中华蜜蜂群内CO2浓度比外界环境高10~15倍(杨冠煌等, 1999),且随着季节变化,CO2的群体水平从0.5%~2%增加到5%~6%(Weast RC, 1972; Van Nerum and Buelens, 1997; Kozak and Currie, 2011),这为我们探究其低氧适应生理及和行为变化奠定基础。暴露于大于或等于9.7 kPa氧压的蜜蜂都可以持续地悬停飞行,暴露在4.9 kPa氧压的蜜蜂有低幅度翅运动的反应,并观察到了深层的腹部抽吸运动(Barbara, 1997),说明蜜蜂对低氧有一定的耐受能力。高浓度CO2会对蜂王的交配产生刺激,如中华蜜蜂蜂王羽化后形成的高CO2浓度环境会刺激卵巢会发生明显的发育(周建阳, 2022),进而促使卵母细胞发育和卵黄发生(Herrmann, 1969; Bergeretal., 2005)。
由于全球气候变化,地球表面紫外线(UV)辐射的强度有所增加(Williamsonetal., 1996; Andersonetal., 2012),从而对不同昆虫产生影响,如发育、生理(Gunn, 1998)、行为(Cowan and Gries, 2009)等过程。此外,紫外线辐射还会导致昆虫的氧化应激和光感受器损伤(Meyer-Rochow and Mishra, 2007; Lopez-Martinezetal., 2008)。研究人员对中华蜜蜂进行254 nm, 30 mJ/cm2强度的紫外照射后,其辐射干扰机体活性氧(reactive oxygen species, ROS)的动态平衡,进而增加氧化应激对生物体的损伤(Zhaietal., 2018; Zhangetal., 2021; Gongetal., 2022),但对其具体的生理代谢和行为尚未有研究。相对湿度在蜜蜂孵育期间对幼虫有显著影响,但对蜂群之外的成年工蜂的摄食行为没有直接影响(Joshi and Joshi, 2010),这是因为工蜂通过各种方法稳定地维持蜂群的湿度,包括蒸发花蜜水和收集水(Humanetal., 2006)。研究人员发现,在35或40 ℃恒温下,相对湿度为60%或70%时,工蜂的存活率随着湿度的增加而降低,但存活率下降可能是高湿度与高温互作的结果(Li Xetal., 2019)。综上,生理代谢和行为改变是中华蜜蜂适应不同环境的重要策略,无论是降低代谢率还是减弱行动能力,都是为了保持中华蜜蜂在不同栖息地中的代谢稳态与生存需求,但为了达到这一目的,中华蜜蜂应当具有更广泛的适应方式和更强的适应能力。因此,从多角度探寻中华蜜蜂生理代谢和行为改变可能是未来研究的重要方向。
4 环境适应性变异的遗传机制
研究物种的本地适应(local adaptation)对了解物种的进化和多样性以及预测环境变化对物种分布的影响具有重要意义。筛选参与当地适应的遗传区域和变异位置可以帮助濒危物种制定保护计划,也可以为种群结构和进化史提供帮助(Allendorfetal., 2010)。蜜蜂基因组学领域研究的日渐成熟,特别是2015年中华蜜蜂基因组的发表加快了我们对中华蜜蜂本地适应性的理解(Parketal., 2015),特别是通过种群全基因组重测序可以更好地了解自然种群间适应性差异的特定遗传机制(Radwan and Babik, 2012)。
为了寻找环境和等位基因变异之间的关联性,通过分析种群的进化历史,推断可能导致蜜蜂适应环境的候选基因。Montero-Mendieta等(2019)以海拔为环境变量,对中国云南和甘肃的不同海拔地区的东方蜜蜂样本进行重测序,筛出10个候选基因区域,获得23个与海拔高度显著相关的单核苷酸多态性(single nucleotide polymorphism, SNP),作为高海拔蜜蜂选择证据,其中在2个分别编码酯酶FE4-like和羧酸酯酶蛋白的基因中发现了大量的异常SNP。酯酶蛋白参与解毒、发育、求偶行为和繁殖等生命活动(Bloch Qazietal., 2003; Mackertetal., 2008),而且低温会影响中华蜜蜂的酯酶活性(Maetal., 2018)。此外,在与蜜蜂嗅觉学习和记忆活动的增强以及觅食行为有关的N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA)受体基因中发现大量SNP位点(Behrends and Scheiner, 2012; Kimetal., 2018),这与Park等(2015)重点关注的化学感受器基因相似,说明化学感应器在中华蜜蜂高原活动中扮演着十分重要的作用。
分布于青藏高原东南缘的中华蜜蜂是研究中华蜜蜂高原环境适应表型和遗传变异的良好模型,通过对不同地区中华蜜蜂进行比较基因组探究,揭示了4个区域中华蜜蜂的重复序列存在明显差异,且化学受体和免疫相关蛋白基因的缺失发生在不同的中华蜜蜂种群中,尤其是在阿坝种群。具体而言,阿坝种群包含最多的重复序列,并且丢失了最多的化学感觉受体和免疫相关蛋白以及亚家族(Lanetal., 2021)。
不同的自然环境影响当地植物的丰度和开花期,而蜜蜂紧密依赖于当地的花蜜和花粉资源,因此自然环境也是影响蜜蜂生活的一个重要因素。由于高原地区植物丰富度和年均开花期均低于非高原地区(Jietal., 2020),推测出高原环境中存在量较少的花蜜和花粉植物导致这一区域内的蜜蜂发育较少的化学感受器。通过对我国11个地区的中华蜜蜂种群筛选,获得121个SNP位点,功能富集分析突显了神经生物学、生物调节、行为和生长及物种间相互作用等基因(Li YCetal., 2019),表明与这些位点相关的基因参与本地适应。其次数百个受选择基因参与蜜蜂的大脑功能和生理行为,蜜蜂的社会行为有助于种群维持巢穴的稳态并抵消外部环境的变化(Seeley, 1985; Schmickl and Crailsheim, 2004)。此外,化学信号相关基因可能协调蜂群成员的行为和生理学,蛋白质编码序列的变化可能与蜜蜂中发现的化学通讯系统的进化有关(Woodardetal., 2011)。物种的生存取决于其对环境胁迫的耐受程度,生态环境气候的变化会影响物种的存活(Williamsetal., 2008)。研究人员对中国18个不同中华蜜蜂种群进行基因组测序后获得的受选择影响的基因主要富集在7个KEGG通路,其中最显著的KEGG通路是Hippo信号通路,在西方蜜蜂中,该通路参与适应低温气候的适应(Chenetal., 2016)。GO的生物过程中最显著富集的通路是对刺激的响应(response to stimuli)信号通路,这表明对外部信号的处理在中华蜜蜂适应不同环境中发挥重要作用(Chenetal., 2018)。Shi等(2020)通过对川西北高原中华蜜蜂种群和平原滇南种群比较转录组发现有151个差异基因,对这些不同功能基因进行通路富集分析,同样富集到Hippo信号通路和海藻糖-磷酸合成酶(alpha trehalose-phosphate synthase)信号通路,说明中华蜜蜂受到低温胁迫时,其中大多数基因参与了信号传导和能量代谢过程。唐相友等(2022)基于对青藏高原东缘及东南缘高原中华蜜蜂与邻近非高原中华蜜蜂的基因选择压力分析,发现受选择的基因参与多个信号通路,其中Wnt, MAPK和Notch信号通路在蜜蜂等昆虫的种群分化、胚胎形成、形态改变及器官大小调节等发育过程中发挥重要作用(Deardenetal., 2006; Wilsonetal., 2011);同时,Hippo和FoxO信号通路被认为参与其温度适应性过程(Halder and Johnson, 2011; Chenetal., 2018),这为中华蜜蜂适应低温环境以及蜂种演化提供了分子生物学依据(图1)。

图1 中华蜜蜂环境适应性的分子机制Fig. 1 Molecular mechanisms underlying environmental adaptation in Apis cerana cerana在不同栖息地的中华蜜蜂种群面临着不同的选择压力,受选择通路常涉及多种行为和重要的生命活动及环境适应。图中蓝色和黄色框代表参与本地适应的基因和通路。A. c. cerana populations in different habitats face different selective pressures. Selected pathways often involve a variety of behaviors, important life activities and environmental adaptation. Blue and yellow boxes represent genes and pathways involved in local adaptation.
一些关键基因可能在蜜蜂的快速辐射和栖息地适应过程中被重复选择利用。最近的研究表明,对中国及邻近地区306头中华蜜蜂成蜂进行基因组测序,筛选到候选基因共有179个,其中有26个基因在至少两个外周组中处于选择状态。上述部分基因可能与当地环境的适应有关,其中许多与食欲、昼夜节律、趋光性、视觉、交配、免疫和DNA修复相关,这表明中华蜜蜂的一些基因在种群辐射过程中倾向于重复选择,为适应性进化提供了有力的证据(Jietal., 2020)。在重复选择的基因中发现Lkr(leucokinin receptor)基因在5个外周组中均受选择,由于蜜蜂对蔗糖反应差异决定了它们采集任务的差异(Pankiw and Page, 2000),且该基因与双翅目蝇和蚊的进食和蔗糖反应有关(Al-Anzietal., 2010);结合RNAi技术,该研究直接证明了Lkr基因参与了蜜蜂采集分工决定的机制过程(Jietal., 2020)。以上结果表明,研究不同环境下中华蜜蜂的适应性可以对未来研究该蜂在不同栖息地环境适应性分子机制提供帮助,同时为后续深入研究社会性昆虫对不同环境的适应性机制和制定有效的保护策略奠定基础。
5 小结与展望
中华蜜蜂作为我国主要蜂种之一,对其遗传分化和环境适应的研究有助于我们加快对遗传资源多样性、种群扩散规律以及适应不同生境进化机制等问题的解析。以往研究表明,生态环境的变化,特别是海拔和纬度的变化是造成中华蜜蜂种群分化的主要原因。温度、氧气、辐射和湿度等气候因子对中华蜜蜂环境适应性的形态改变和生理生态特征产生重要影响。形态特征的变化主要体现在体型大小、翅大小和体色深浅上,代谢生理和行为改变是其适应环境的重要策略。同时,研究人员也基于种群遗传学和种群基因组学筛选出部分受到自然选择作用的基因或通路,其功能涉及蜜蜂的社会分工行为、学习感知行为、信息感知、生长发育、温度适应和新陈代谢等。目前研究主要集中在生境适应的表型进化以及进化历史的相关分析,而关于中华蜜蜂对不同环境的适应性行为和生理及背后具体的分子机制尚不明晰。例如,目前的多个研究主要关注引起中华蜜蜂种群分化的单个环境因素,但这些因素之间的互作是否也会导致遗传分化仍需要进一步研究。再者,不同气候因子对中华蜜蜂数量、遗传多样性和生理代谢及行为的影响是否存在关联性并不清楚。此外,对于长期生活在不同环境的中华蜜蜂,如何抵御温度、氧气、紫外线辐射等环境压力以及相应的分子机制尚未明确。对上述问题的深入研究,必然是未来面对的一大挑战,突破这一挑战不但能加深我们对古老蜂种演化历史和遗传多样性的理解,也有助于对理解蜜蜂种群应对剧烈气候变化适应机制以及制定蜜蜂的保护策略提供丰富的启示。
