基于中肠代谢组学意大利蜜蜂工蜂枣花病的发病机理研究
2023-10-30杜亚丽郑丽芳刘玉玲姜玉锁
杜亚丽, 徐 凯, 郑丽芳, 刘玉玲, 姜玉锁,*
(1. 山西农业大学动物科学学院, 太谷 030801; 2. 吉林省养蜂科学研究所, 吉林 132108)
红枣花属于虫媒花,花期长、泌蜜量大,是我国华北和西北地区主要的蜜源植物之一。然而蜜蜂,尤其是西方蜜蜂Apismellifera,在采集枣花花蜜后极易出现中毒现象,即“枣花病”或“五月病”,导致采集蜂大量死亡,蜂群发展和繁殖受到负面影响,同时大大降低了蜂农利用枣花蜜源的积极性,在北方许多地区甚至出现“宁可饲喂蜜蜂也不愿采集枣花蜜”的怪象(Maetal., 2020)。蜜蜂枣花病的流行已成为影响我国红枣产业和养蜂产业发展的主要因素之一。自20世纪50-60年代起,养蜂从业者多根据蜜蜂饲养管理经验推断枣花病的起因。张晓光(1959)在山西吕梁地区进行调研后发现,蜂群在气候干燥、西南风大且水源不足的情况下发病率较高,群势衰减达到30%~50%,因此提出蜜蜂枣花病可能是由于气候干旱和酷热郁闷所导致的推断。夕艮(1960)对河南中牟地区蜜蜂枣花病发病情况调研后推断,蜜蜂枣花病不属于传染性疾病,也不是花粉中毒,其认为气候干旱、花蜜浓稠以及工蜂劳动过度综合引起了该病的发生。20世纪90年代,研究者开始从枣花蜂蜜化学成分组成方面来阐释蜜蜂枣花病的发病机制。李晓立和范正友(1991)比较了枣花病和刺槐蜜中葱贰类、糖类、生物碱、矿物质和有毒物质等成分差异,结果发现枣花蜜中钾元素的含量是刺槐蜜的16倍多,高达0.141%,因此提出枣花蜜中钾离子的高含量可能是导致蜜蜂中毒的主要原因。还有报道称枣花蜜中生物碱含量过高是引发蜜蜂枣花病的主要因素(金丰, 1994)。随着物质检测和高通量测序技术的快速发展,研究者对枣花病进行了更深入的研究。马卫华等(2011)对枣花期蜜蜂体内的消化酶和解毒酶活性进行分析,发现枣花病使蜜蜂体内的淀粉酶、蛋白酶和果胶酶活性受到抑制,可以诱导细胞色素P450和谷胱甘肽S-转移酶(glutathioneS-transferase, GST)活性增高。Ma等(2020)通过16S rRNA测序对枣花病患病蜜蜂和正常蜜蜂肠道微生物多样性进行分析,发现患病工蜂中肠和后肠内厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)菌群的丰富度显著下降,包括糖、核苷酸和氨基酸在内的多个代谢通路与枣花病相关。关于枣花病的防治,蜂农多根据养蜂经验自己调配一些大黄、甘草、金银花、仁丹和食醋等配制的糖水,并辅助遮荫洒水来防治枣花病,效果均不明显(王国旺, 2010; 郭兴启, 2016; 刘耀斌, 2018)。虽然学者们对枣花病的病因及防治做了大量工作,但迄今为止有关蜜蜂枣花病的发生机制仍不清楚。
中肠作为昆虫消化和解毒代谢的主要组织器官,在昆虫取食消化、生长发育及防御外源有毒物质的过程中起着重要作用。目前尚无以中肠营养物质代谢的角度解析枣花病发病机制的研究报道。本研究以我国北方地区枣花期主要的生产蜂种意大利蜜蜂Apismelliferaligustica为研究对象,比较分析患枣花病和健康意大利蜜蜂工蜂中肠内代谢物组分和含量,挖掘差异代谢物及相关代谢通路,为深入了解蜜蜂枣花病的发病机制和枣花病防治提供理论依据,对促进我国北方地区蜜蜂产业的快速持续发展具有重要意义。
1 材料与方法
1.1 供试昆虫
枣花开花前期(5月15日左右)在山西省太谷区南洸村(37°23′2.00″N, 112°31′12.04″E)枣树林(周围5 km无其他蜜粉源作物)放置12箱群势强壮、健康无病的正常意大利蜜蜂蜂群,于枣花开花盛期(6月8-15日)即蜜蜂枣花病较为严重时,在蜂箱巢门口随机收集患枣花病意大利蜜蜂工蜂,症状为:腹部弓缩、反应迟钝、飞翔能力丧失、跳跃爬行,标记为患病组(diseased group, DG)。同期,在山西农业大学太谷校区(37°25′14.27″N, 112°35′14.18″E)试验蜂场(周围5 km无枣树)内选择12箱群势相近的正常意大利蜜蜂蜂群,随机抓取健康的归巢采蜜工蜂,表现为:腹部正常且发亮、动作敏捷,标记为健康组(healthy group, HG)。用纱笼把蜜蜂DG和HG样本迅速带回实验室,冷冻麻醉后依次用蒸馏水、75%酒精冲洗蜜蜂体表,然后使用经75%酒精消毒后的镊子夹住蜜蜂的腹柄和螫针或第7腹节拉出肠道,截取中肠迅速投入液氮,随后于-80 ℃保存。每30头工蜂中肠组织的混合样品作为1个生物学重复,每个样本设置6个生物学重复。
1.2 液相色谱-质谱联用(liquid chromatography-mass spectrometry, LC-MS)检测
样本检测使用Vanquish UHPLC色谱仪(Thermo Fisher,德国),色谱柱为Hypesil GoldTMC18 1.9 μm (100 mm×2.1 mm)。正模式下流动相A为0.1%甲酸, B为甲醇; 负模式下流动相A为5 mmol/L醋酸铵(pH 9.0),B为甲醇。色谱梯度洗脱程序为:0~1.5 min B相比例保持2%;1.5~12 min B相比例上升至100%;12~14 min B相比例保持100%;14~14.1 min B相比例从100%降至2%;14.1~16 min B相比例保持2%。柱温为40 ℃;流速为0.2 mL/min。联用Q ExactiveTMHFX质谱仪(Thermo Fisher,德国),设置条件为:扫描范围选择70~1 050 m/z;ESI源的设置为:喷雾电压: 3.2 kV;鞘气体流速:40 arb;辅助气体流速:10 arb;毛细管温度:320 ℃。MS/MS二级扫描为数据依赖性扫描。取1.1节DG和HG中肠样本各100 mg液氮研磨至粉末状,溶于500 μL含0.1%甲酸的80%甲醇水溶液中,涡旋震荡后冰浴5 min,随后15 000 r/min 4 ℃离心10 min。取一定量的上清液添加质谱级纯水稀释至甲醇含量为53%,置于带有0.22 μm滤膜的离心管中,15 000×g 4 ℃离心10 min,收集滤液进行LC-MS/MS分析。此外,代谢物的提取和检测过程极易受外界因素影响且变化迅速,因此,实验样本等体积混合制成的数据质量控制(quality control, QC)需插入检测分析中,用于评价整个检测过程中系统稳定性和可靠性。
1.3 气相色谱-质谱联用(gas chromatography-mass spectrometry, GC-MS)检测
Agilent 7890A气相色谱-飞行时间质谱联用仪配有Agilent DB-5MS毛细管柱(30 m×250 μm×0.25 μm),GC-TOF-MS分析条件为:以Splitless模式注入1 μL样本,载气为氮气,隔垫吹扫流速为3 mL/min,柱流速为1 mL/min。初始柱温为50 ℃并保持1 min,然后以20 ℃/min升至310 ℃停留6 min。前进样口、传输线和离子源温度分别为温度为280, 280和250 ℃,电离电压为-70 eV,在m/z范围为50~500之间进行全扫描,扫描速率为12.5 spectra/s;溶剂延迟时间为4.78 min。取1.1节DG和HG中肠样本50 mg加入450 μL提取液(甲醇∶氯仿=3∶1, v∶v)和10 μL L-2-氯苯丙氨酸,涡旋30 s,加入磁珠使用研磨仪以45 Hz研磨4 min,之后12 000 r/min 4 ℃离心15 min,移取300 μL上清于1.5 mL离心管中。经真空干燥后加入60 μL甲氧胺盐试剂,轻轻混匀,烘箱中80 ℃孵育30 min。各样品中加入80 μL BSTFA后70 ℃孵育1.5 h,冷却至室温,加入5 μL FAME后进行GC-MS分析。
1.4 抗氧化酶活性测定
分别将1.1节30头患枣花病和健康意大利蜜蜂工蜂中肠混合样本放在1.5 mL离心管中准确称重,按组织净重(g)∶生理盐水体积(mL)=1∶9的比例加入相应体积的生理盐水,然后在冰浴条件下机械匀浆,3 000 r/min离心10 min,取上清液用生理盐水稀释分别至10%。随后按照总超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)测定试剂盒(南京建成)说明在SynergyTMH1全功能微孔板检测仪上进行活性测定。设置3个生物学重复。
1.5 qRT-PCR检测
利用TRIzol试剂提取1.1节DG和HG中肠样本总RNA,测定浓度和纯度后根据PrimeScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒反转录合成cDNA,然后利用SYBR®Premix Ex TaqTMⅡ (Tli RNaseH Plus)试剂盒在7500实时荧光定量PCR系统(ABI,美国)中进行qRT-PCR,检测抗氧化基因Sod1,Sod2和CAT及免疫基因Defensin,Hymenoptaecin,Apidaecin和Abaecin的表达量,根据基因序列,利用Primer Premier 5.0软件设计引物序列(表1)。PCR反应体系: SYBR®Premix Ex TaqTMⅡ (2×) 7.5 μL, 上下游引物(10 μmol/L)各0.6 μL, cDNA模板100 ng, ROX Reference Dye Ⅱ(50×) 0.3 μL, ddH2O补充至15 μL。反应程序: 95 ℃ 30 s; 95 ℃ 30 s, 62 ℃ 34 s, 45个循环。熔解曲线生成条件: 95 ℃ 15 s, 62 ℃ 1 min。选用西方蜜蜂Arp1(GenBank登录号: GB44311)作为内参基因,所需引物均由上海生工生物工程股份有限公司合成。每个样品进行3次技术重复。
表1 引物信息Table 1 The information of primers
1.6 数据分析
使用CD3.1和Chroma TOF软件处理获得的患枣花病和健康意大利蜜蜂工蜂中肠代谢组数据,然后与二级谱图数据库mzCloud和mzVault及一级数据库MassList比对进行代谢物鉴定,对代谢物进行定量,计算各QC样本间的皮尔森相关系数。为明确各组样本之间的代谢物差异和组内样本之间的变异度,使用SMICA14.1软件进行主成分分析(principal component analysis, PCA),根据差异倍数(fold change, FC)>2.0、P<0.05值和偏最小二乘法判别分析(partial least squares discriminant analysis, OPLS-DA)模型获得的变量投影重要性(variable projection importance, VIP)>1.0筛选差异代谢物,然后在有机小分子生物活性数据库PubChem (https:∥pubchem.ncbi.nlm.nih.gov/)、代谢通路数据库KEGG (https:∥www.genome.jp/kegg/)和人类代谢组数据库HMDB(https:∥hmdb.ca/)中进行鉴定和注释。最后利用迈维云平台(https:∥cloud.metware.cn)对差异代谢物进行KEGG代谢通路富集分析。qRT-PCR检测数据应用7500软件分析标准曲线及扩增曲线的Ct值,采用2-ΔΔCt法进行数据处理。利用GraphPad Prism 9.0软件进行图形分析。使用SPSS 22.0进行独立样本t检验。
2 结果
2.1 数据质控
基于LC-MS代谢组学检测的正负离子模式下,患枣花病和健康意大利蜜蜂工蜂中肠代谢物各色谱峰的相应强度和保留时间基本稳定。数据质量控制样本的R2均大于0.99,说明整个实验重复性好,数据质量高,可用于后续分析。此外,基于GC-MS代谢组分析中数据质量控制样本的R2均大于0.91。
2.2 基于LC-MS检测获得的代谢组
患枣花病组和健康组意大利蜜蜂工蜂中肠代谢物的PCA结果表明(图1),正离子模式下,第1和第2主成分的解释率分别是34.7%和13.1%,两个主成分贡献率之和为47.8%;负离子模式下,第1和第2主成分的解释率分别是32.9%和18.8%,总和为51.7%。根据样本在PCA得分图上的分布来看,正负离子模式下各组样本均位于其 95%置信区间内,组内差异较小;DG和DG样本数据均能被明显区分,说明枣花病导致意大利蜜蜂中肠内各种代谢物的含量发生显著变化。

图1 基于LC-MS非靶向代谢组学鉴定正离子(A)和负离子(B)模式下患枣花病和健康意大利蜜蜂工蜂中肠代谢物主成分分析(PCA)Fig. 1 Principal component analysis (PCA) of metabolites in the midgut between the jujube flower disease-suffered and healthy Apis mellifera ligustica workers under positive (A) and negative (B) ion model based on LC-MS non-targeted metabolomicsHG: 健康组Healthy group; DG: 患病组Diseased group. 图2和5同。The same for Figs. 2 and 5. LC-MS: 液相色谱-质谱联用Liquid chromatography-mass spectrometry. 表2同。The same for Table 2.
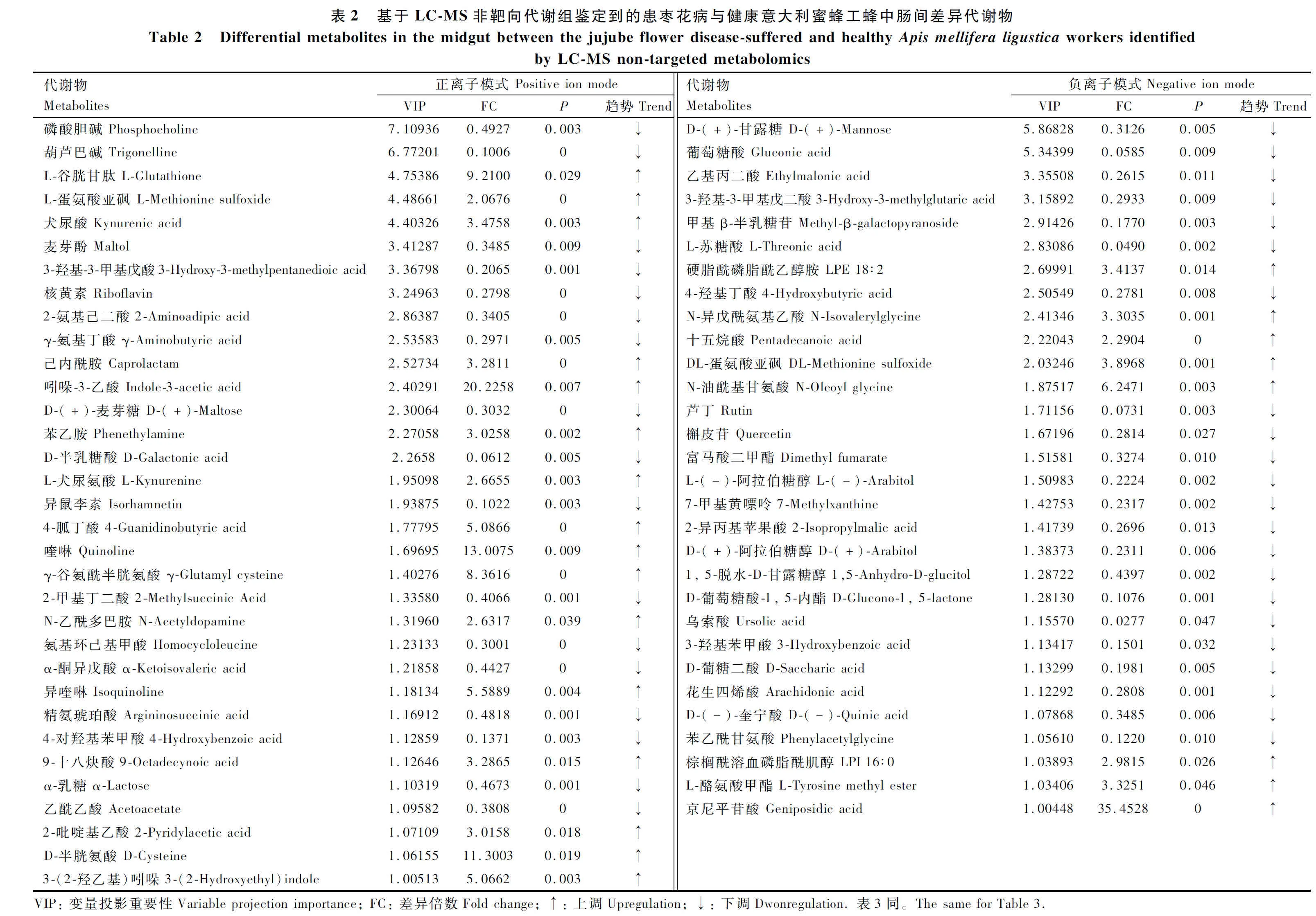
正离子模式下获得患枣花病和健康意大利蜜蜂工蜂中肠间差异代谢物49种,22种含量上调,27种含量下调,其中能够比对到KEGG和HMDB数据库中的有33种;负离子模式下获得差异代谢物43种,14种含量上调,29种含量下调,共30种鉴定到KEGG和HMDB数据库中(表2)。鉴定的差异代谢物主要属于碳水化合物及其代谢物、氨基酸及其代谢物、脂质和有机酸及其衍生物等。
2.3 基于GC-MS检测获得的代谢组
患枣花病组和健康组意大利蜜蜂工蜂中肠代谢物的PCA结果表明(图2),第1和第2主成分的解释率分别为31.3%和18.2%。筛选得到患枣花病和健康意大利蜜蜂工蜂间中肠挥发性差异代谢物22种,8种含量上调,14种含量下调,在KEGG和HMDB数据库中可鉴定的有11种(表3)。鉴定的差异代谢物主要属于碳水化合物及其代谢物、有机酸及其衍生物等。
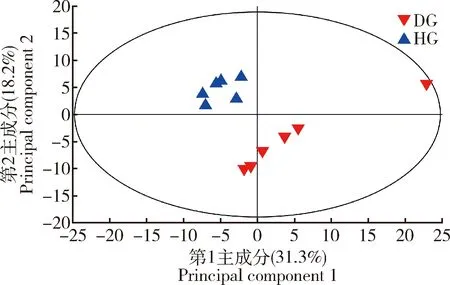
图2 基于GC-MS非靶向代谢组学的患枣花病和健康意大利蜜蜂工蜂中肠代谢物主成分分析(PCA)Fig. 2 Principal component analysis (PCA) of metabolites in the midgut between the jujube flower disease-suffered and healthy Apis mellifera ligustica workers based on GC-MS non-targeted metabolomicsGC-MS: 气相色谱-质谱联用Gas chromatography-mass spectrometry. 表3同。The same for Table 3.

表3 基于GC-MS非靶向代谢组学鉴定到的患枣花病与健康意大利蜜蜂工蜂中肠间差异代谢物Table 3 Differential metabolites in the midgut between the jujube flower disease-suffered andhealthy Apis mellifera ligustica workers identified by GC-MS non-targeted metabolomics
经PubChem对所有鉴定到的74种差异代谢物比较后发现,表2中的D-半乳糖酸与表3中的半乳糖酸为同一种物质,故基于 LC-MS 和GC-MS的代谢组学分析共鉴定获得 73 种差异代谢物,28种含量上调,45种含量下调。与健康意大利蜜蜂工蜂相比,患枣花病意大利蜜蜂工蜂中肠内乌索酸、L-苏糖酸、葡萄糖酸、D-半乳糖酸、苏糖酸和芦丁的含量下降幅度较大,而京尼平苷酸、吲哚-3-乙酸、喹啉和棉子糖则在枣花病工蜂中肠中大量积累(图3)。
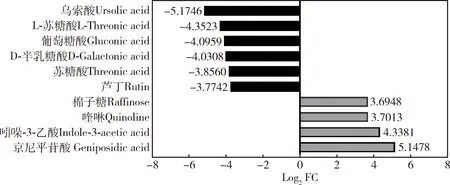
图3 患枣花病与健康意大利蜜蜂工蜂间中肠中前10的差异代谢物Fig. 3 Top 10 differential metabolites in the midgut between the jujube flower disease-suffered and healthy Apis mellifera ligustica workers
2.4 差异代谢物的KEGG通路富集
KEGG分析表明,患枣花病与健康意大利蜜蜂工蜂中肠代谢物比较,48种差异代谢物被注释到碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、辅助因子和维生素代谢(metabolism of cofactors and vitamins)等多种代谢通路上(图4: A),少数差异代谢物还对蜜蜂的生物体系统(organismal systems)、环境信息处理(environmental information processing)和细胞过程(cellular processes)有一定的影响。显著富集(P<0.05)的通路包括铁死亡(ferroptosis)、丁酸甲酯代谢(butanoate metabolism)、抗坏血酸和醛酸代谢(ascorbate and aldarate metabolism)、半乳糖代谢(galactose metabolism)和血管平滑肌收缩(vascular smooth muscle contraction)(图4: B),其中,丁酸甲酯代谢、抗坏血酸和醛酸代谢及半乳糖代谢均属于碳水化合物代谢通路。与HG相比,DG参与丁酸甲酯代谢通路中的4-氨基丁酸、乙酰乙酸和肌醇水平下降,α-酮戊二酸上升;抗坏血酸和醛酸代谢通路中,L-苏糖酸、D-葡糖二酸和肌醇水平下降,α-酮戊二酸上升;半乳糖代谢通路中肌醇、甘露糖、半乳糖酸水平下降,棉子糖水平上升。

图4 患枣花病与健康意大利蜜蜂工蜂间中肠中差异代谢物KEGG通路富集Fig. 4 KEGG pathway enrichment of differential metabolites in the midgut between the jujube flower disease-suffered and healthy Apis mellifera ligustica workersA: KEGG通路二级分类汇总Summary of KEGG pathway class Ⅱ; B: KEGG通路富集气泡Bubble of enriched KEGG pathway enrichment.
2.5 抗氧化能力及免疫基因表达
蜜蜂枣花病发生后意大利蜜蜂工蜂中肠内的抗氧化和免疫活性发生显著变化。与健康意大利蜜蜂工蜂相比,患枣花病意大利蜜蜂工蜂中肠内SOD(t=10.396,P=0.000)和CAT(t=6.578,P=0.001)活性极显著下降(图5: A, B)。由图5(C)可知,与健康意大利蜜蜂工蜂中的相比,患枣花病意大利蜜蜂工蜂中肠内抗氧化基因Sod1,Sod2和CAT表达量均有下降趋势,其中Sod2(t=4.463,P=0.011)和CAT(t=11.660,P=0.005)的表达量显著下降,Sod1表达量无显著差异(t=0.310,P=0.772)。免疫基因Defensin(t=6.688,P=0.003),Hymenoptaecin(t=10.980,P=0.000)和Apidaecin(t=14.161,P=0.005)在患枣花病意大利蜜蜂工蜂中肠内的表达量极显著低于健康蜜蜂中的,而Abaecin在患枣花病意大利蜜蜂工蜂的表达量极显著高于健康蜜蜂中的(t=-10.801,P=0.008)(图5: D)。
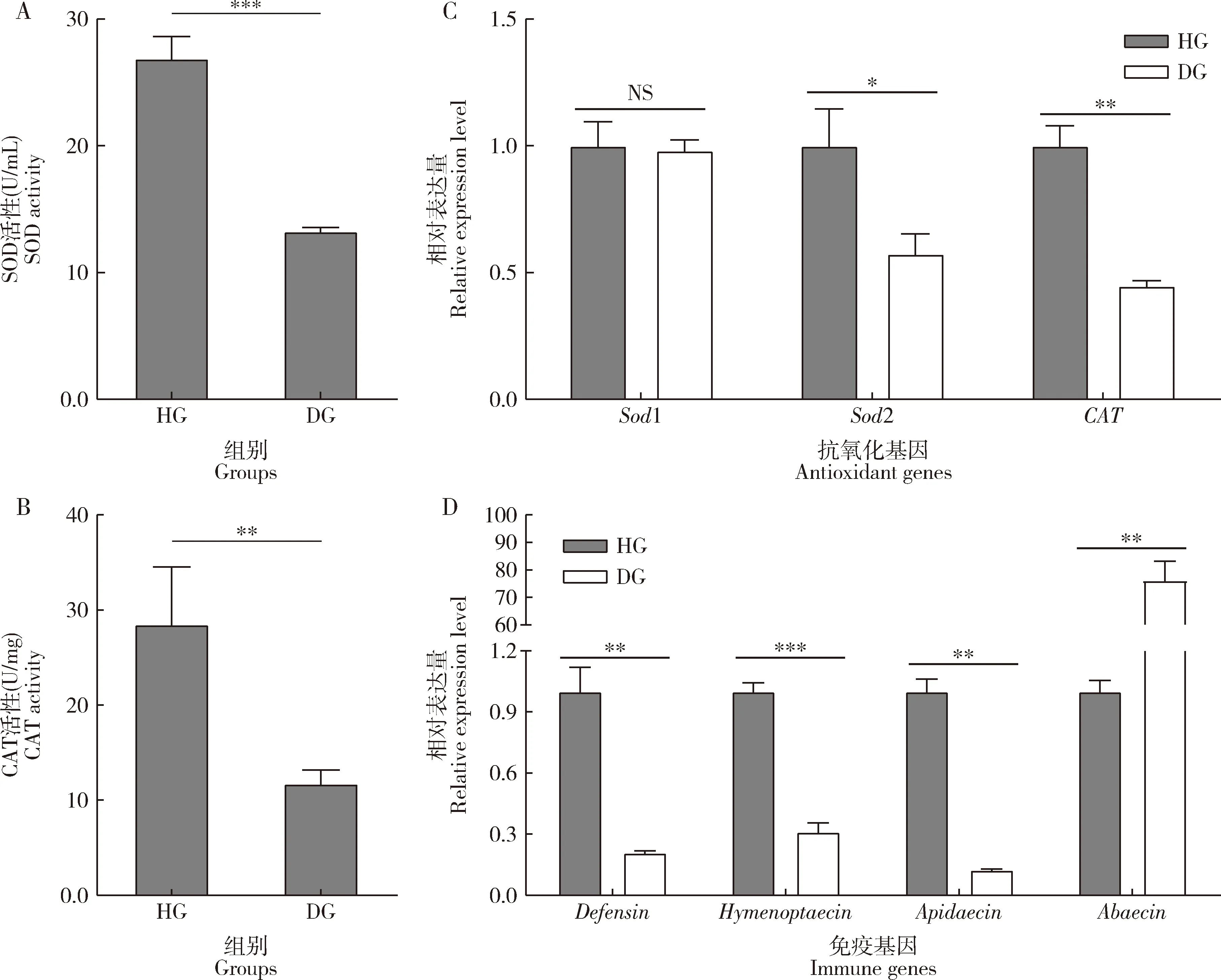
图5 患枣花病和健康意大利蜜蜂工蜂中肠中SOD(A)和CAT(B)活性及抗氧化基因(C)和免疫基因(D)的表达量Fig. 5 Activities of SOD(A) and CAT(B), and the expression levels of antioxidant genes (C) and immune genes (D) in the midgut of the jujube flower disease-suffered and healthy Apis mellifera ligustica workersSOD: 超氧化物歧化酶Superoxide dismutase; CAT: 过氧化氢酶Catalase. 图中数据为平均值±标准误;柱上符号表示两组间差异显著性(*P<0.05; **P<0.01; ***P<0.001; NSP>0.05)(t检验)。Data in the figure are mean±SE. The symbols above bars indicate the significance of differences between the two groups (*P<0.05; **P<0.01; ***P<0.001; NSP>0.05) (t-test).
3 讨论
3.1 蜜蜂枣花病差异代谢物分析
基于LC-MS和GC-MS两种技术对枣花病蜜蜂和健康蜜蜂中肠进行非靶向代谢组学分析,共筛选获得114种差异代谢物,鉴定的有73种。其中,京尼平苷酸、吲哚-3-乙酸、喹啉和棉子糖在枣花病蜜蜂中肠内的含量上升明显。京尼平苷酸(GPA)是一种具有环烯醚萜结构的葡萄糖苷,具有抗氧化、抗衰老等生理功效,常用于治疗皮肤和多种肝脏疾病的抗炎物质(Chenetal., 2016)。研究表明,GPA及其衍生物能够有效地减少活性氧ROS,降低细胞的氧化应激(Chengetal., 2022),或诱导自噬延长细胞的复制寿命(Wangetal., 2021)。吲哚-3-乙酸(IAA)是一种具有促进多类型细胞发育作用的生长素(Luoetal., 2016),已有研究表明生命体被微生物侵染后体内IAA水平显著升高,与机体受微生物侵害密切相关(Tsavkelovaetal., 2006)。棉子糖是一种由果糖、半乳糖和葡萄糖结合构成的可溶性非还原性寡糖,能促进肠道双歧杆菌、乳酸菌的增殖,降低致病性链球菌的数量,具有促进免疫、降低肠道疾病发生概率的作用(Xuetal., 2018)。对锦鲤的研究表明,棉子糖可增加血清中SOD水平和肠道中微生物多样性(李铁梁等, 2020)。这3种物质的含量上调预示着,枣花病会诱发产生大量活性氧,蜜蜂需要通过提高抗氧化活性物质的水平来应对氧化应激造成的损伤。此外,喹啉是一种来自多种植物的生物碱,具有一定的致畸、致癌、致突变作用,能够通过食物链在包括人类在内的高级生物体中大量积累,有着较大的潜在危害。这里我们并不能判断枣花花蜜中含有喹啉,其对蜜蜂的作用还需进一步分析。
除上述物质外,枣花病蜜蜂中肠内乌索酸、L-苏糖酸、葡萄糖酸、D-半乳糖酸、苏糖酸和芦丁的含量显著下调。这些物质大多与肠道稳态、抗氧化应激和免疫抗炎密切相关。乌索酸UA是一种具有抗炎、抗氧化和抗病毒等广泛的泛药理和生物活性的五环三萜类化合物(Luanetal., 2022),不仅能够降低肠道菌群丰度和调节免疫细胞的浸润来改善肠道屏障功能(Fengetal., 2015; Shengetal., 2021),还能提高SOD和CAT活性来防止病毒和有害物质导致的过度免疫反应、氧化应激和肠道损伤(Al-Kuraishyetal., 2022; Weietal., 2022)。芦丁是植物中最常见的类黄酮化合物,可以减少MDA, ROS, NO, GSSG, iNOS和促炎细胞因子的产生,增加CAT, SOD, GSH和GPx活性,发挥多功能剂的作用(Wangetal., 2012; Enogieruetal., 2018)。断奶仔鼠的日粮添加试验表明,芦丁能够提高空肠的抗氧化功能,显著改善肠道黏膜结构及屏障功能(张佳琦等, 2022)。肠道内的葡萄糖酸GA是由葡萄糖在葡萄糖氧化酶的作用下生成的一种酸性物质,能够促进有益细菌的生长繁殖,调节肠道微生态平衡,增强营养物质消化吸收的同时也提高了肠道黏膜的主动免疫功能(李虎等, 2012)。此外,GA还具有良好的抗氧化功能,可以显著提高肉鸡血清中的SOD含量,并能抑制细胞色素P450参与亲电子代谢物的形成(马可为, 2008)。半乳糖酸是半乳糖代谢分解形成的一种糖酸,参与半乳糖代谢通路。半乳糖可以改变肠道菌群组成,降低肠道炎症,改善肠道健康(陈履双等, 2022)。据此推测蜜蜂患枣花病后肠道黏膜结构受到破坏,肠道微生物失衡,免疫功能和抗氧化能力发生异常。
随后,我们对枣花病蜜蜂和健康蜜蜂中肠的抗氧化能力进行了比较分析,结果显示,枣花病蜜蜂中肠的SOD和CAT活性极显著低于健康蜜蜂中的。同样地,荧光定量PCR结果也表明,患枣花病蜜蜂中肠内抗氧化基因Sod1,Sod2和CAT表达量均呈下降趋势。蜜蜂体内天然抗菌肽主要有4种,分别是Apidaecin, Abaecin, Hymenoptaecin和Defensin(叶良等, 2022),它们作为蜜蜂先天体液免疫的重要组成部分,在抑制和清除微生物和寄生虫等生物有害因子方面发挥着重要的作用(Krongdangetal., 2019)。本研究发现,免疫基因Defensin,Hymenoptaecin和Apidaecin在患枣花病蜜蜂中肠内的表达量极显著低于健康蜜蜂中的。意外的是,Abaecin在枣花病蜜蜂中肠内的表达量极显著高于健康组,这可能与其对真菌和农药等外来刺激的抑制和解毒作用相关(Tesovniketal., 2019)。综上分析,枣花病会抑制蜜蜂中肠内抗氧化酶的活力,降低抗氧化和免疫基因的表达,对蜜蜂的氧化应激和免疫应答造成一定的影响。该结果进一步验证了我们上述的推测。
3.2 蜜蜂枣花病相关代谢通路
为进一步从营养物质代谢的角度阐释蜜蜂枣花病的发病机理,本研究对差异代谢物质进行了KEGG功能富集,发现抗坏血酸和醛糖酸代谢、丁酸甲酯代谢和半乳糖代谢这3条通路受到显著影响,且前两个通路的富集程度较高。抗坏血酸和醛酸代谢是重要的碳水化合物代谢通路之一,可以保护细胞免受有氧代谢和一系列不良因素引起的氧化损伤。动物饲喂试验已证实机体抗氧化性能的提高是由抗坏血酸和醛酸代谢上调引起的(张艳等, 2018; Lietal., 2022)。本研究发现枣花病蜜蜂中肠内抗氧化酶SOD和CAT的活性及相关基因的表达量均呈下降趋势,抗氧化能力降低,故我们认为枣花病会通过改变抗坏血酸和醛酸代谢来干扰氧化应激,造成急性肠损伤,使得蜜蜂无法正常取食和消化。丁酸甲酯代谢通常是肠道发酵产生一些短链脂肪酸或短链醇的代谢通路。丁酸是一种常见的肠道细菌代谢产物,参与维持肠上皮细胞,在调节肠道对抗原的免疫耐受方面发挥重要作用(Changetal., 2014)。此外,丁酸还能调节肠道内微生物代谢,改变细菌菌落的构成,间接影响机体健康(车浩等, 2022)。Ma等(2020)研究就发现枣花病会显著改变蜜蜂肠道菌群结构。结合本研究结果,我们推测丁酸代谢异常导致的肠道菌群失调可能在枣花病的发病机制中发挥重要作用。
