聚焦碳酸钠和碳酸氢钠考查的3个方向
2023-10-30李宁
李 宁
(山东省青岛市即墨区第二中学)
Na2CO3和NaHCO3是钠的两种重要化合物,是高中化学常考的知识点,考查内容包括根据溶液中加入盐酸的体积判断溶液中溶质的成分、实验装置的使用及操作的正确性、滴定曲线等.
1 根据加入盐酸的体积判断溶液中溶质的成分
在NaOH 溶液中通入CO2气体,得到的溶液中溶质可能是NaOH 和Na2CO3,可能是Na2CO3,也可能是Na2CO3和NaHCO3,还可能是NaHCO3.想要确定溶液中的溶质,可向得到的溶液中滴加盐酸,通过分析消耗盐酸的量的关系确定溶液的成分.
例1向NaOH 溶液中通入CO2,在得到的溶液中加入盐酸,依据图1的特点判断溶液中溶质的成分.

表1

图1
①当V(Oa)=V(ab)时,两段消耗的盐酸量相同,所以发生两个反应:+H+=H2O+CO2↑,所以溶质为Na2CO3.
②若V(Oa)>V(ab),说明Oa段除了外还有OH—消耗H+,所以溶质为NaOH 和Na2CO3,离子方程式为OH—+H+=H2O、+H+=+H+=H2O+CO2↑.
③若V(Oa)<V(ab),说明与反应的盐酸多于与反应的,即原溶质中含有碳酸钠,溶质为Na2CO3和NaHCO3,离子方程式为++H+=H2O+CO2↑.
④若a=0(即图像从原点开始),说明开始加入稀盐酸时就有气体产生,所以溶质为NaHCO3,对应的离子方程式为+H+=H2O+CO2↑.
a点之后加盐酸生成CO2,只能发生反应:+H+=H2O+CO2↑,根据Oa和ab大小可以判断溶液中溶质的成分.
2 实验装置的使用及操作的正确性
化学实验装置和操作的正误判断是高考的重要考点,特别是在探究性实验中,只有装置设计合理、试剂使用正确,才能保证实验的准确性.通过Na2CO3和NaHCO3的性质探究实验可比较这两者的性质.
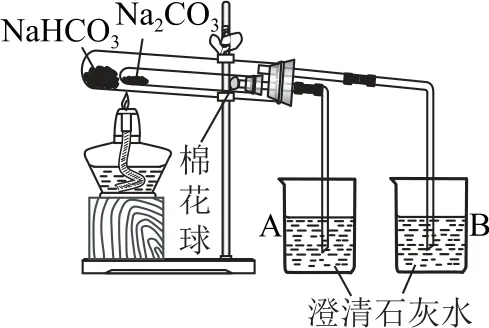
A.验证热稳定性:Na2CO3>NaHCO3
例2下列实验能达到目的的是( ).
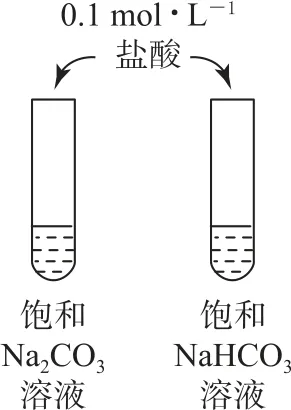
B.NaHCO3 与酸反应的速率快于Na2CO3

C.用该装置制备NaHCO3

D.探究Na2CO3 固体中混有NaHCO3
3 Na2CO3 和NaHCO3 的滴定曲线
用盐酸滴定Na2CO3、NaHCO3的曲线是高考考查的热点,主要考查曲线的分析、碳酸的电离常数计算、比较溶液中离子浓度大小及电荷守恒、物料守恒.
例3某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L—1Na2CO3溶液和40 mL 0.2mol·L—1NaHCO3溶液,再分别用0.4 mol·L—1盐酸滴定,利用pH 计和压力传感器检测,得到如图2所示曲线.
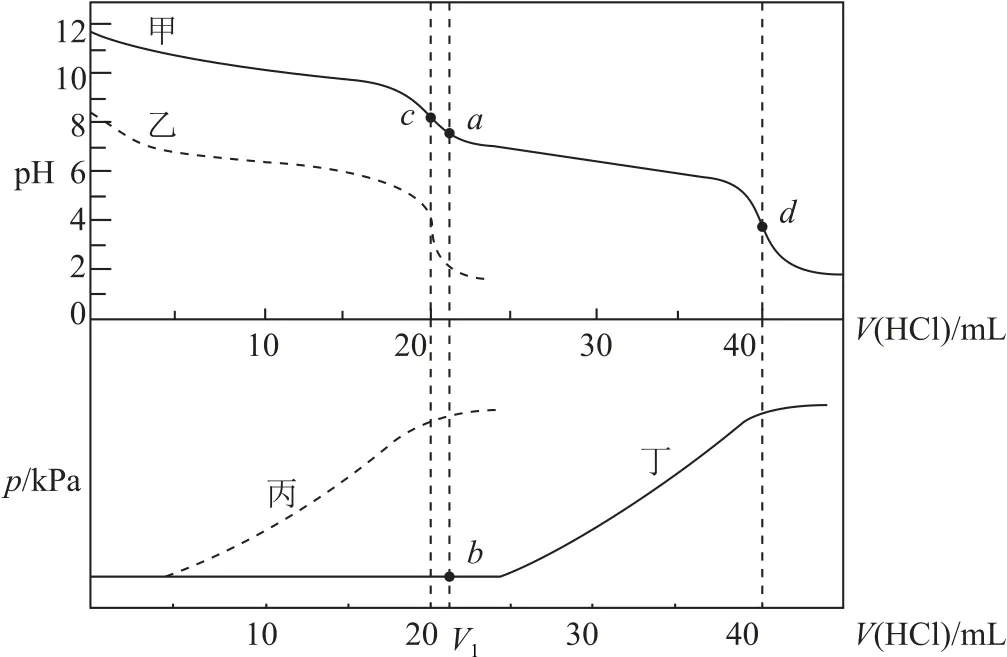
图2
(1)甲、乙两条线中表示向NaHCO3溶液中滴加盐酸的是_________,理由是_________.丙、丁两条线中表示向Na2CO3溶液中滴加盐酸的是________,理由是_________.
(2)当滴加盐酸的体积为V1mL 时(a点、b点),所发生的反应用化学方程式表示为_________.根据pH-V(HCl)图分析,滴定时c点可用_________、d点可用_________作指示剂指示滴定终点(选填“甲基橙”“石蕊”或“酚酞”).
(2)当滴加盐酸的体积为V1mL时(a点、b点),Na2CO3先和盐酸反应生成NaHCO3:Na2CO3+HCl=NaHCO3+NaCl;根据pH-V(HCl)图分析,c点为碱性、d点为酸性,则滴定时c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点.
总之,钠的化合物中Na2CO3、NaHCO3是高频考点,这两种盐不管是稳定性比较还是相互转化、除杂、离子浓度大小比较、中和滴定曲线分析,在化学学习中都有典型意义,掌握好这两种物质的性质对于学习溶液中的离子平衡有重大帮助.
(完)
