伏立康唑对肺移植患者术后他克莫司血药浓度影响的真实世界研究Δ
2023-10-28郭冬杰李朋梅陈文倩刘丽宏中日友好医院药学部北京100029
郭冬杰,李朋梅,陈文倩,刘丽宏 (中日友好医院药学部,北京 100029)
随着实体器官移植的快速发展,肺移植技术作为终末期肺病的唯一治疗方法已日益成熟。虽然肺移植改善了受者的生存质量并显著延长了生存期,但其长期生存率仍不乐观。据报道,肺移植受者的中位生存期为6.5年[1]。国际心肺移植学会的统计数据显示,肺移植术后患者1、3、5年的存活率分别仅为78.1%、61.1%、48.4%,远低于肝脏和肾脏移植受者的存活率[2]。
急性排斥反应和感染是肺移植患者围手术期死亡的重要原因[1]。肺移植患者发生侵袭性真菌感染(invasive fungal infection,IFI)的风险较高,尤其是在移植后早期[2—5]。覆盖美国11家移植中心的移植相关感染监测网络数据显示,肺移植术后8年,患者IFI的累计发病率为6.5%[6]。肺移植术后患者常采用伏立康唑作为侵袭性曲霉菌感染(invasive aspergillosis,IA)的预防和治疗方案,同时移植患者还需联合以他克莫司为基础的免疫抑制方案。由于他克莫司在体内主要通过细胞色素P450同工酶(cytochrome P450 proteins,CYP)3A4/CYP3A5代谢,而伏立康唑是CYP2C19、CYP2C9和CYP3A的底物和抑制剂[7],故联合使用伏立康唑会导致他克莫司血药浓度波动。他克莫司浓度过高会导致不良反应发生风险增加,如肾功能损害等;而他克莫司浓度不足则会增加肺移植患者急性排斥反应的发生率[8]。为此,本研究通过回顾性分析我院近3年肺移植患者术后联用伏立康唑前后他克莫司血药浓度的变化情况,探讨了伏立康唑对肺移植术后患者体内他克莫司暴露的影响,以期为肺移植术后患者联合使用伏立康唑和他克莫司的剂量调整提供依据。
1 资料与方法
1.1 研究对象
采用回顾性调查方法,收集2020年1月至2022年12月在我院行肺移植术,并在术后联合使用了伏立康唑和他克莫司的患者资料。患者的纳入标准包括:(1)首次肺移植术后;(2)年龄≥17岁;(3)住院患者;(4)在联合使用伏立康唑和他克莫司期间,两种药物浓度均达到稳态,且两种药物浓度在同一天测得;(5)联合使用伏立康唑和他克莫司前,已经应用过他克莫司,且他克莫司浓度达到稳态。患者的排除标准包括:(1)缺少他克莫司剂量和血药浓度数据者;(2)接受血液透析等肾脏替代治疗者;(3)接受其他CYP抑制剂或诱导剂治疗者;(4)血样采集前3 d内,他克莫司或伏立康唑的给药方案发生改变者。上述数据均来自我院实验室信息系统、医院信息系统和治疗药物监测(therapeutic drug monitoring,TDM)系统。本研究方案经医院医学伦理委员会批准,伦理审查编号为2022-KY-193-1。
1.2 给药方案
所有患者均口服或鼻饲给予他克莫司;当发生IA时,给予患者静脉或口服伏立康唑,并由临床医生根据患者情况并结合TDM结果调整他克莫司剂量。
1.3 血药浓度测定方法
他克莫司血药浓度测定方法为:于清晨患者服用他克莫司前30 min内采集静脉血2 mL,置于乙二胺四乙酸抗凝管中,使用Architect i1000SR型化学发光免疫分析仪(美国雅培公司),以化学发光微粒子免疫法测定他克莫司全血血药浓度。样品的预处理方法参考他克莫司胶囊检测试剂盒(美国雅培公司)说明书。
伏立康唑血药浓度采用超高效液相色谱-串联质谱法[9]测定。
1.4 数据收集
收集所有入选患者的下述资料:(1)基本资料,包括年龄、性别、体重;(2)肝肾功能指标,包括总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、肌酐(serum creatinine,Cr)等水平;(3)他克莫司谷浓度测定当日的红细胞计数(red blood cell count,RBC)和红细胞压积(hematocrit,HCT)水平;(4)使用伏立康唑前最后一次测定的他克莫司谷浓度以及对应的他克莫司日剂量,在同一天测得的伏立康唑和他克莫司的谷浓度和日剂量;并计算他克莫司标准化血药浓度。由于同一患者可能因发生多次IA而多次联用伏立康唑与他克莫司,且部分患者可能有多天药物浓度测量数据,为充分利用现有数据,故本研究纳入了所有符合要求的数据进行分析。
1.5 统计学方法
使用SPSS 21.0软件对数据进行统计分析。计数资料以例数和百分比表示,采用χ2检验;计量资料以±s表示,采用t检验;采用F检验分析一组多变量和多组间的差异性以及验证t检验的方差齐性;对可能影响他克莫司标准化血药浓度的因素进行多元回归分析。检验水准α=0.05。
2 结果
2.1 患者基本资料
本研究共纳入患者153例,其中男性127例、女性26例;年龄为17~78岁,平均(57.86±11.89)岁;体重为35~91 kg,平均(59.84±12.06)kg。153例患者中,单肺移植63例(41.18%),双肺移植90例(58.82%);明确IA感染60例(39.22%)。
本研究共收集到同一天测定的伏立康唑谷浓度和他克莫司谷浓度286对,联用伏立康唑前最后一次的他克莫司谷浓度168例次。其中,伏立康唑日剂量为200~800 mg,平均(378.15±91.78)mg,超过400 mg的仅27例次(9.44%,27/286);血药浓度为0.40~11.28 μg/mL,平均(2.90±1.49)μg/mL。联用伏立康唑前最后一次他克莫司日剂量为0.20~10 mg,平均(3.37±2.15)mg;血药浓度为2.00~16.60 ng/mL,平均(7.17±2.70)ng/mL。联合伏立康唑后他克莫司日剂量为0.13~3.00 mg,平均(0.76±0.45)mg;血药浓度为2.40~35.00 ng/mL,平均(8.99±4.11)ng/mL。
2.2 联合伏立康唑对他克莫司谷浓度、日剂量和标准化血药浓度的影响
联合伏立康唑治疗后,纳入患者的他克莫司平均日剂量从3.37 mg降至0.76 mg,减少了77.45%(P<0.000 1);而他克莫司的谷浓度和标准化血药浓度均显著升高(P<0.000 1),其中标准化血药浓度升高了383.80%。此外,伏立康唑的给药途径对他克莫司谷浓度和日剂量影响不大,但是对标准化血药浓度有显著影响(P<0.05),口服伏立康唑后的他克莫司标准化血药浓度显著高于静脉滴注伏立康唑后的他克莫司平均标准化血药浓度。结果见表1。
表1 联用伏立康唑对他克莫司谷浓度、日剂量和标准化血药浓度的影响(±s)
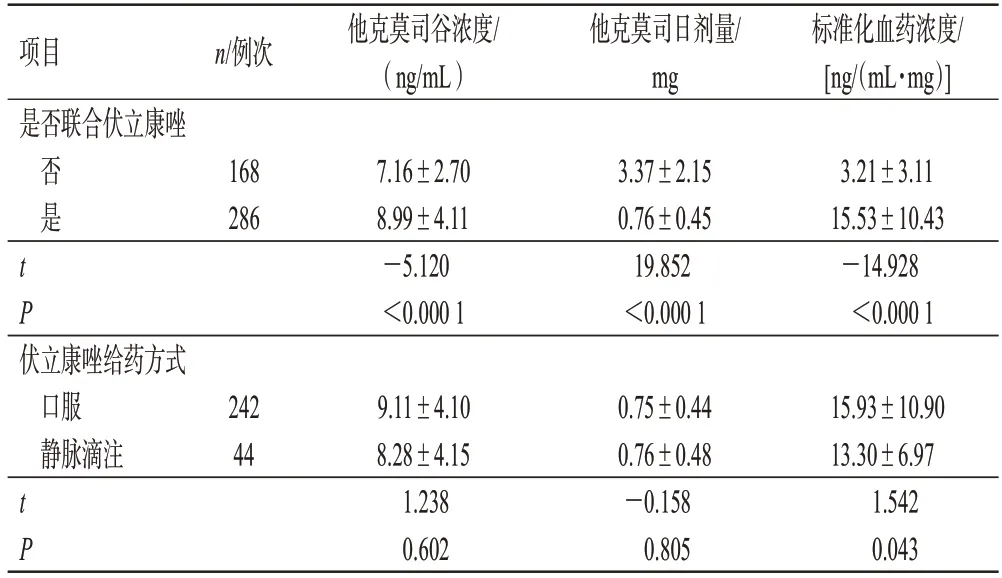
表1 联用伏立康唑对他克莫司谷浓度、日剂量和标准化血药浓度的影响(±s)
项目是否联合伏立康唑否是n/例次他克莫司谷浓度/(ng/mL)他克莫司日剂量/mg标准化血药浓度/[ng/(mL·mg)]168 286 t P 7.16±2.70 8.99±4.11-5.120<0.000 1 3.37±2.15 0.76±0.45 19.852<0.000 1 3.21±3.11 15.53±10.43-14.928<0.000 1伏立康唑给药方式口服静脉滴注242 44 t P 9.11±4.10 8.28±4.15 1.238 0.602 0.75±0.44 0.76±0.48-0.158 0.805 15.93±10.90 13.30±6.97 1.542 0.043
进一步对联用伏立康唑前后的他克莫司谷浓度与日剂量、标准化血药浓度的相关性进行分析,结果见图1。由图1可见,无论是否联用伏立康唑,他克莫司谷浓度与日剂量、平均标准化血药浓度均有显著相关性(P<0.05,r>0.2)。联用伏立康唑后,若要达到相同的他克莫司谷浓度,他克莫司日剂量要远低于未联用伏立康唑时,而他克莫司标准化血药浓度要显著高于未联用伏立康唑时。结果见图1。
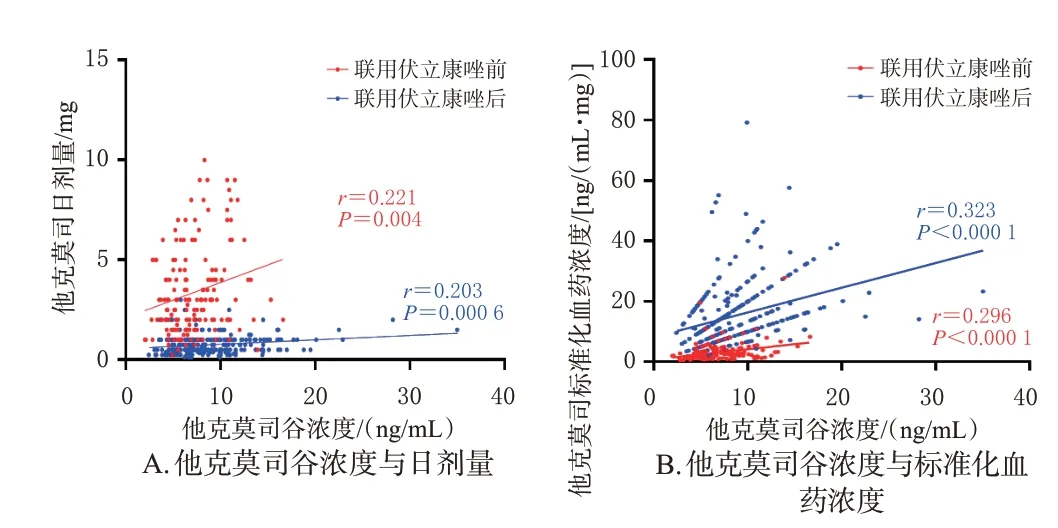
图1 联用伏立康唑前后他克莫司谷浓度与其日剂量、标准化血药浓度的相关性
2.3 伏立康唑日剂量及谷浓度与他克莫司谷浓度及标准化血药浓度的相关性
伏立康唑日剂量及谷浓度与他克莫司谷浓度及标准化血药浓度的相关性结果见图2。由图2A和图2B可以看出,伏立康唑日剂量与他克莫司谷浓度无显著相关性(P=0.561,r=-0.035),而与他克莫司标准化血药浓度呈显著性负相关(P=0.000 1,r=-0.224)。而由图2C和2D可以看出,伏立康唑谷浓度与他克莫司谷浓度(P<0.000 1,r=0.316)、标准化血药浓度(P<0.000 1,r=0.249)均呈显著正相关。

图2 伏立康唑日剂量及谷浓度与他克莫司谷浓度及标准化血药浓度的相关性
2.4 不同肺移植方案下伏立康唑对他克莫司谷浓度和标准化血药浓度的影响
本研究共纳入单肺移植患者63例(41.18%),在联用伏立康唑前测定了他克莫司谷浓度69例次,联用伏立康唑后测定他克莫司谷浓度113例次;双肺移植患者90例(58.82%),在联用伏立康唑前测定了他克莫司谷浓度99例次,联用伏立康唑后测定了他克莫司谷浓度173例次。分析结果表明,联用伏立康唑前,肺移植类型对他克莫司谷浓度及标准化血药浓度均无显著影响(P>0.05);而联用伏立康唑后,单肺移植患者的他克莫司谷浓度和标准化血药浓度均高于双肺移植患者,且二者的他克莫司标准化血药浓度有显著性差异(P=0.001)。结果见表2。
表2 不同肺移植方案下伏立康唑对他克莫司谷浓度及标准化血药浓度的影响(±s)
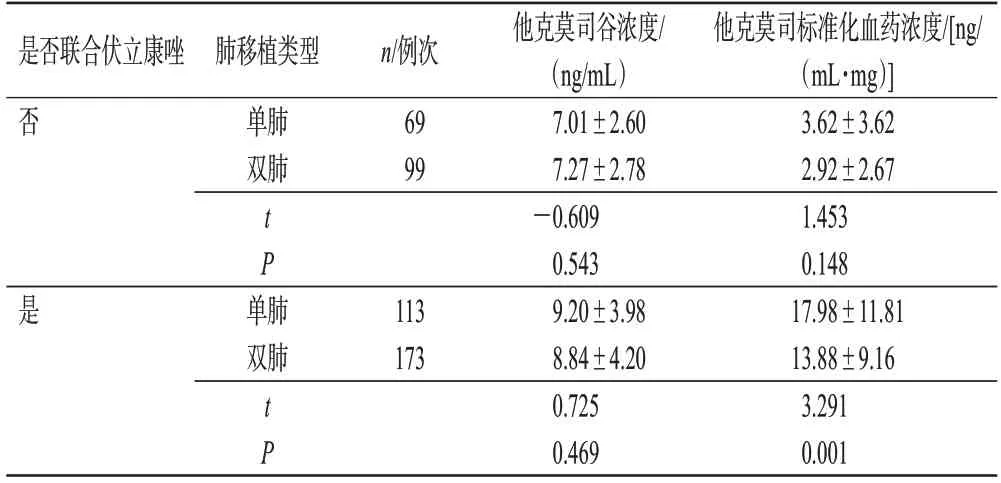
表2 不同肺移植方案下伏立康唑对他克莫司谷浓度及标准化血药浓度的影响(±s)
是否联合伏立康唑否肺移植类型单肺双肺n/例次69 99是t P单肺双肺113 173 t P他克莫司谷浓度/(ng/mL)7.01±2.60 7.27±2.78-0.609 0.543 9.20±3.98 8.84±4.20 0.725 0.469他克莫司标准化血药浓度/[ng/(mL·mg)]3.62±3.62 2.92±2.67 1.453 0.148 17.98±11.81 13.88±9.16 3.291 0.001
2.5 他克莫司联用伏立康唑对肺移植患者肝肾功能的影响
联用伏立康唑后,患者的ALT、AST和Cr水平均较联用伏立康唑前有升高趋势,其中AST较联用前显著升高(P<0.05);而TBIL和DBIL较联用前有下降趋势。结果见表3。
表3 他克莫司联用伏立康唑对肺移植患者肝肾功能的影响(±s)

表3 他克莫司联用伏立康唑对肺移植患者肝肾功能的影响(±s)
是否联用伏立康唑否是t P ALT/(IU/L)26.96±22.62 28.65±32.67-0.547 0.485 AST/(IU/L)26.73±19.84 30.69±29.81-1.422 0.033 TBIL/(μmol/L)14.85±38.67 12.19±27.93 0.717 0.056 DBIL/(μmol/L)5.79±23.63 4.96±17.03 0.366 0.297 Cr/(μmol/L)107.17±75.81 113.14±79.26-0.699 0.238
2.6 他克莫司标准化血药浓度的独立影响因素分析
将可能影响他克莫司标准化血药浓度的因素进行多元线性回归,结果显示,F=22.672,P<0.001,回归方程显著。其中,伏立康唑谷浓度对他克莫司标准化血药浓度有显著影响(P<0.001)。结果见表4。
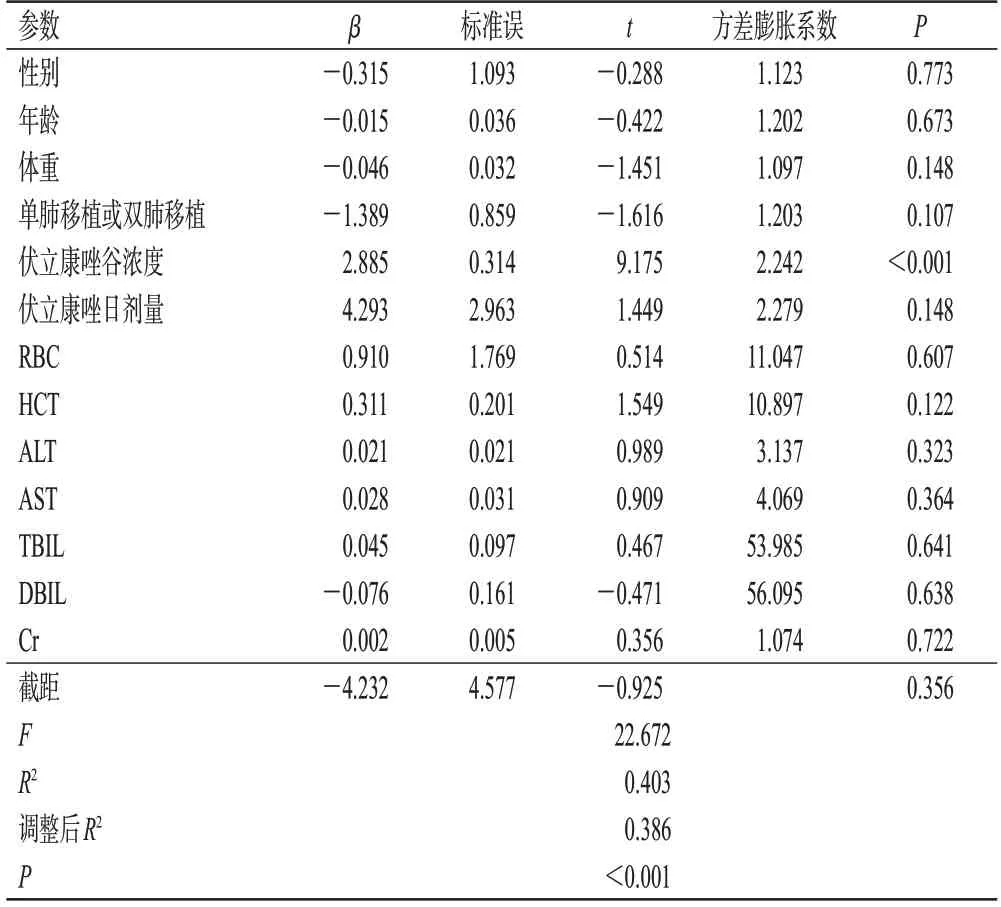
表4 他克莫司标准化血药浓度影响因素的回归分析结果
3 讨论
他克莫司是一种具有强效免疫抑制特性的大环内酯类药物,主要通过抑制钙调神经磷酸酶来影响T淋巴细胞的活化,从而发挥免疫抑制作用,该药已在器官移植领域广泛使用。他克莫司也是一种亲脂性药物,主要通过肠道和肝脏中的CYP3A4/CYP3A5代谢[10]。由于他克莫司具有治疗窗窄、个体化差异大、药物暴露影响因素多、药物相互作用广泛等不足,因此该药在治疗中的微小变化均可能产生较大的治疗风险,故诸多专家推荐对他克莫司开展TDM,以及时调整、优化其治疗方案[11]。
IA是实体器官移植受者中最常见的侵袭性霉菌感染,有1%~15%的受者会感染IA,感染IA后12周的病死率为 20%~60%[12]。在所有实体器官移植受者中,肺移植受者发生IA的风险最高,而伏立康唑是肺移植受者预防和治疗真菌感染的首选药物[13]。伏立康唑是一种广谱三唑类抗真菌药,是CYP2C19、CYP2C9和CYP3A的底物和抑制剂,其与他克莫司联用可使他克莫司血药浓度增加10倍[14],但这种影响因人而异,可能与CYP3A4和CYP3A5基因多态性有关[15]。美国FDA公布的他克莫司药品说明书明确指出,当与伏立康唑或泊沙康唑联用时,他克莫司应给予原剂量的1/3,并根据他克莫司全血谷浓度调整剂量。然而,大量研究表明,药品说明书推荐的剂量调整方法可能无法将他克莫司浓度维持在所需治疗范围内[16—18]。
本研究结果显示,肺移植患者联用伏立康唑后,他克莫司平均日剂量减少了77.45%,而标准化血药浓度急剧升高了383.80%,这与国内近期的一项肾移植研究结果[19]相似。本研究还发现,伏立康唑不同给药方式对他克莫司标准化血药浓度存在显著性影响,口服伏立康唑后的他克莫司标准化血药浓度高于静脉滴注伏立康唑后的他克莫司标准化血药浓度,这表明若要达到相同的他克莫司血药浓度,联用口服伏立康唑后,所需他克莫司剂量更小。这可能与肠道中的CYP3A酶有关,具体机制尚需相关研究进一步证实。
本研究结果还显示,伏立康唑谷浓度与他克莫司谷浓度、标准化血药浓度均呈显著正相关,这与Chen等[20]研究结果相似。由于伏立康唑具有非线性的药动学特点,其谷浓度与剂量之间并非正比例关系[21—23],因此如果临床仅根据伏立康唑给药剂量来调整他克莫司剂量,并不能保证他克莫司浓度在安全范围内。建议临床在联用伏立康唑与他克莫司时,应同时对伏立康唑和他克莫司进行TDM,以保证两者的浓度均处于安全范围内。同时,本研究还对比了不同肺移植类型患者伏立康唑对他克莫司浓度的影响,结果显示,联合伏立康唑后,单肺移植患者的他克莫司标准化血药浓度显著高于双肺移植患者,其具体机制还需后续进一步研究。但该结果提示,他克莫司体内暴露情况个体差异大,对他克莫司进行TDM非常必要。
肺移植术后患者急性肾损伤的发病率高达50%~60%,其中相当一部分患者(高达1/3)可能演变为慢性肾脏疾病[24]。慢性肾脏疾病与肺移植受者移植后死亡率增加有关[25]。他克莫司的主要毒性包括肾毒性、神经毒性、移植后新发糖尿病和胃肠道毒性[26]。有学者建议,可以通过减少剂量来降低他克莫司相关毒性反应的发生率[27]。伏立康唑最常见的不良反应是肝功能损伤,发病率为19.79%[28]。本研究结果显示,除AST外,肺移植患者的肝肾功能在联用伏立康唑前后未见显著变化。这可能与我院同时对患者的伏立康唑和他克莫司进行了积极有效的TDM和及时干预有关。
由于他克莫司标准化血药浓度更能体现他克莫司剂量与浓度的关系,故本研究进一步对影响他克莫司标准化血药浓度的因素进行了多因素回归分析,结果显示,伏立康唑谷浓度是影响他克莫司标准化血药浓度的独立因素,这再次证明了同时测定伏立康唑谷浓度和他克莫司谷浓度以及进行TDM的重要性。
4 结语
本研究回顾性分析了我院近3年153例肺移植患者伏立康唑和他克莫司联用前后的他克莫司剂量和血药浓度的变化,结果发现,联用伏立康唑对肺移植术后患者他克莫司的血药浓度有显著影响,大部分患者需要在联用伏立康唑后对他克莫司减量,但减量的多少存在个体差异;口服伏立康唑后所需他克莫司剂量更小,单肺移植患者的他克莫司标准化血药浓度显著高于双肺移植患者;同时,由于伏立康唑谷浓度对他克莫司标准化浓度的影响较大,因此监测伏立康唑的谷浓度可能更有助于控制他克莫司的谷浓度。但受限于分析技术,本研究未对所有联用伏立康唑和他克莫司的患者测定CYP3A基因型,也未将基因型的影响因素纳入分析范围,因此其基因型的影响有待进一步验证。
