卵巢巨大室管膜瘤1例并文献复习
2023-10-27夏作利潘丹周素英陈艳梅杨小敏
夏作利,潘丹,周素英,陈艳梅,杨小敏
温州市人民医院 病理科,浙江 温州 325000
室管膜瘤多为起源于中枢神经系统室管膜细胞的肿瘤,为中枢神经系统常见的胶质瘤类型之一,可原发于卵巢,但后者极罕见。自1984年KLEIMAN等[1]首次报道3例原发性卵巢室管膜瘤后,流行病学报道病例约31例[1-16]。最新版WHO(2020年版)将卵巢室管膜瘤划分在卵巢生殖细胞肿瘤一类,细分归为单胚层畸胎瘤的神经外胚层肿瘤高分化亚型。现报告卵巢巨大室管膜瘤1例。
1 病例资料
患者,女,17岁,因“发现腹部包块2个月余”于2013年6月22日入院。实验室检查:血清肿瘤标志物AFP、CEA、CA125、CA199、NSE等均在正常范围内。妇科彩超示:盆腔内偏右侧见一囊实性团块,考虑卵巢来源可能,肿物大小18.5 cm×15.8 cm× 9.3 cm,囊壁内见一菜花样回声团块,大小3.5 cm× 2.5 cm×0.5 cm。盆腔MRI示:盆腔囊实性占位,囊腺癌可能,肿物大小19.9 cm×17.0 cm×8.8 cm, 囊壁内可见乳头状结节影,结节大小4.2 cm× 3.9 cm×2.0 cm,盆腔见少量积液。患者完成相关检查后行盆腔肿块切除术。术中探查见:右卵巢囊实性肿物,囊性为主,表面灰红色,包膜完整,无粘连,肿物大小20.0 cm×18.0 cm×9.0 cm。术中冰冻诊断:“右卵巢低度恶性肿瘤,首先考虑神经外胚层肿瘤,确诊待常规切片”。临床结合冰冻诊断考虑卵巢神经外胚层肿瘤IA期,行“右附件+大网膜+ 左输卵管系膜囊肿+盆腔淋巴结清扫术”。手术顺 利,术后患者安全返回病房,术后按BEP(博来霉 素+依托泊苷+顺铂)方案化疗1次(12 d),拒绝再次化疗,此后改服中药。至今随访9年5个月,复查经阴道B超示:右卵巢未探及(既往有手术史),子宫及左附件未见明显异常。
病理镜下HE染色显示卵巢室管膜瘤的组织学与中枢神经系统室管膜瘤形态相同。低倍镜下,囊壁无明显内衬上皮;瘤细胞排列成大小不等囊腔结构,可见类似甲状腺滤泡样形态,或排列呈管状、条带状、乳头状或连接成实性区(见图1A);具有特征性的真菊形团和假菊形团结构:“真菊形”团中间有小孔,细胞核位于菊形团周边,围绕中心有多少不等粉染拉丝样物质呈放射状排列(见图1B);“假菊形团”中间为小血管,有瘤细胞围绕小血管呈放射状排列。高倍镜:瘤细胞核中等偏小,直径类似血管内皮细胞核大小,细胞核圆形或卵圆形,细胞形态较一致,核染色中等强,可见细小核仁(见图1C)。核分裂像较少,局灶细胞密集区可见核分裂 3~5个/10个高倍镜视野(见图1D)。细胞浆嗜酸性为主,局灶胞浆透亮,细胞轮廓呈柱状或锥形(见图1E)。
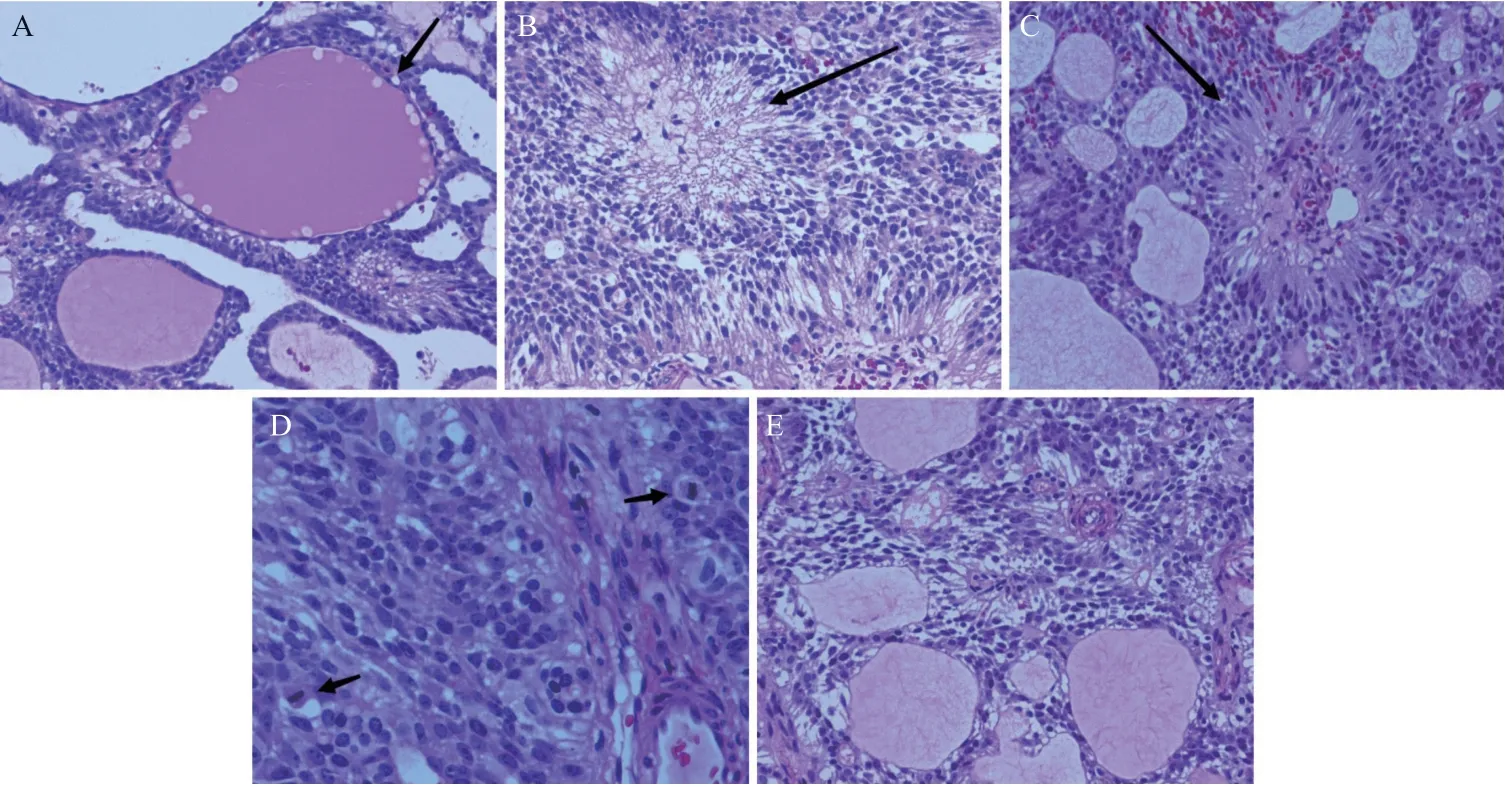
图1 卵巢室管膜瘤HE染色镜下形态图
病理示:右卵巢低度恶性肿瘤,结合免疫组化检查符合卵巢室管膜瘤伴灶区细胞增生活跃。免疫组化结果显示:瘤细胞表达Vim(+)、Pax8(+)、ER(+)、PR(+)、GFAP(+)、CD56(+)、Syn(+);S-100(灶+)、AE1/AE3(灶+)、P16(部分+);SOX10(-)、CD99(-)、CA125(-/+)、WT-1(+/-)、AFP(-)、α-inhibin(-)、EMA(-)、CR(-);Ki67(热点区15%+)(见图2A-G)。
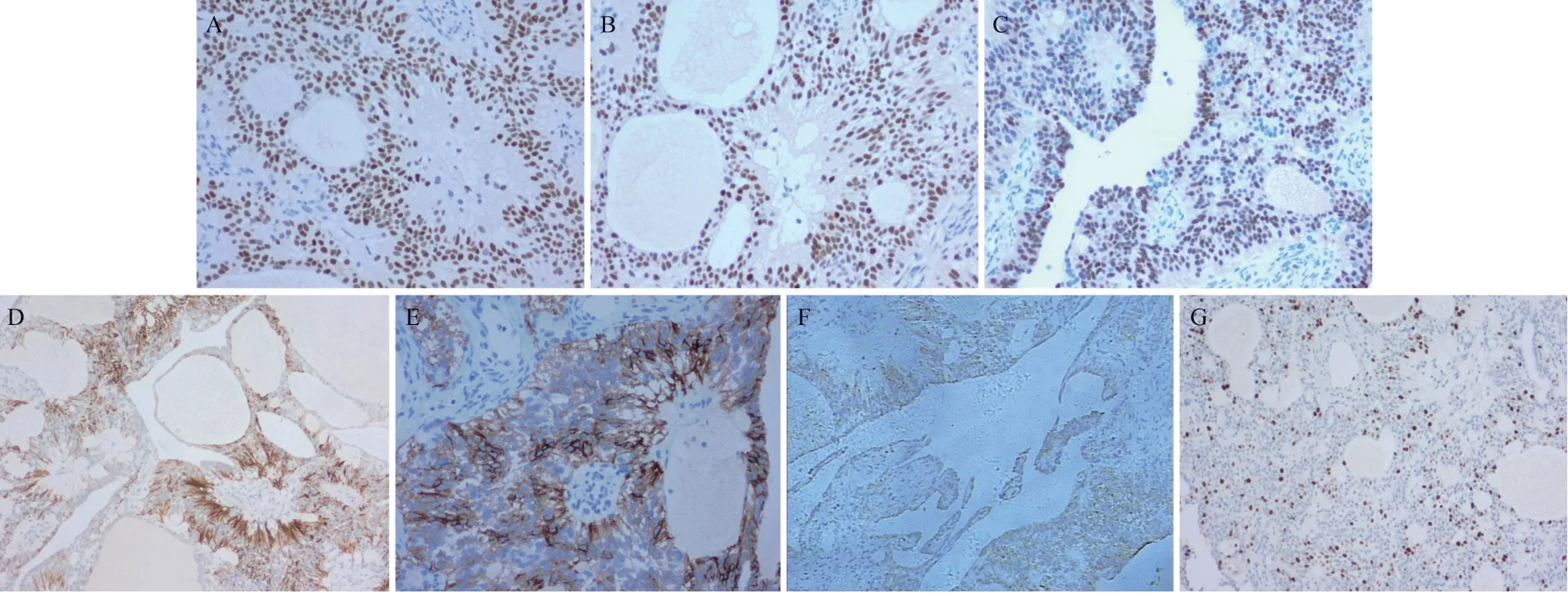
图2 卵巢室管膜瘤免疫组化镜下形态图
2 讨论
中枢神经系统以外的室管膜瘤起源未定。发生于骶尾部的室管膜瘤被认为起源于骶尾骨之上的皮下残余室管膜岛或硬脊膜外的终丝残余和尾髓遗 迹[3]。卵巢和盆腔的室管膜瘤起源观点不一。有研究认为卵巢室管膜瘤可能起源于生殖细胞,室管膜样结构为其卵巢单胚层畸胎瘤的唯一成分。此外,还有起源于先天性神经胶质细胞异位、苗勒源性神经上皮细胞化生[2]或腹膜间质细胞化生神经外胚层组织等学说。卵巢室管膜瘤是一种原发于卵巢的生殖细胞肿瘤,细分属于卵巢单胚层畸胎瘤的神经外胚层肿瘤一类,后者包含三种组织学类型:分化型、原始型和间变型。卵巢室管膜瘤则属于高分化型的神经外胚层肿瘤。卵巢室管膜瘤发病率极低,临床医师或病理医师对此类肿瘤的认识较少,笔者重点复习其中可检索并具有较可靠临床病理信息的病例约31例[1-16],见表1。
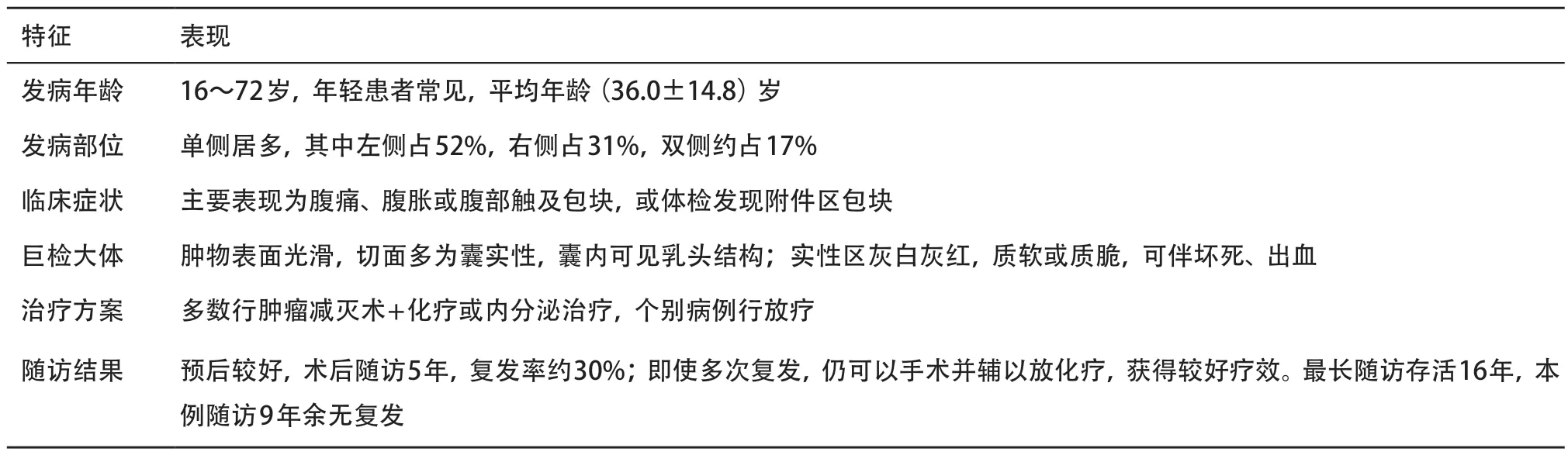
表1 卵巢室管膜瘤31例临床病理学特征
卵巢室管膜瘤的组织学与中枢神经系统室管膜瘤形态相同,免疫组化表达具有一定的特点,瘤细胞表达Vim(+)、GFAP(+)、CD56(+)、S-100(灶+)、Syn(+)等间叶或神经类标,而CD99、α-inhibin、CR、AFP阴性,Ki67表达偏低。与中枢神经系统室管膜瘤明显不同的是,卵巢室管膜瘤特异性高表达ER、PR、Pax8。有研究结果表明,Pax-8在卵巢苗勒氏管起源的良恶性肿瘤中具有较高的特异性及敏感性[4],ER和PR在颅内外发生的室管膜瘤表达不一,颅脑内ER表达率10%、PR表达率20%,而颅外的ER、PR的表达率分别为100%和80%[5]。ER、PR这一表达特点将为诊断卵巢原发性室管膜瘤提供佐证,为临床用药提供依据。LOPEZ等[6]报道卵巢室管膜瘤在组织学上与中枢神经系统室管膜瘤相似,但可能具有更广泛的免疫表型。他们的下一代测序显示ATRX和NF2基因拷贝数丢失。EWSR1荧光原位杂交在大于90%的细胞中显示22q的单生性,这些分子改变以前在卵巢或中枢神经系统外室管膜瘤中未见报道。
卵巢原发的室管膜瘤十分罕见,发病率极低,发病部位为中枢神经系统之外,尤其是在冰冻快速诊断的时候,没有良好的组织形态和染色效果,以及没有免疫组化,容易漏诊或误诊。诊断时应细心、谨慎,鉴别诊断总结如下:①卵巢上皮来源的肿瘤:浆液性肿瘤、子宫内膜样肿瘤、卵巢移形细胞癌等;当冰冻镜下出现一些真、假菊形团结构是诊断卵巢原发的室管膜瘤的关键;浆液性肿瘤则有或多或少的内衬立方状上皮及较多的乳头结构出现,核分裂易见;如果出现子宫内膜异位的间质、陈旧性出血背景或内膜腺上皮则支持子宫内膜样肿瘤;卵巢移形细胞肿瘤组织学表现为突向囊腔的分支状乳头,乳头中央可见纤维血管轴心,细胞具有典型的核沟,胞质嗜酸或透明,细胞较大,可见瘤细胞实性细胞巢,巢中央有空腔,腔内含嗜酸性黏液样物,内衬纤毛柱状上皮;上皮来源的恶性肿瘤多半有坏死,免疫组化不表达神经类标记可鉴别。②颗粒细胞瘤:属于性索-间质细胞肿瘤,具有特征性的细胞核沟、瘤细胞规则环形排列的Call-Exner小体,后者需与菊形团结构鉴别,虽然Call-Exner小体也有离心性排列,但没有无核空晕区和胞浆拉丝样形态;常规切片颗粒细胞瘤有α-inhibin、CD99、CR等表达;卵巢室管膜瘤GFAP、Pax8、ER、PR等表达。③未成熟畸胎瘤:未成熟畸胎瘤成分多样,呈多胚层组织形态,可以局灶出现室管膜样结构[6]或菊形团样结构,但不占绝对优势。免疫组化显示未成熟畸胎瘤多胚层特点。
据数据统计,约61%患者发病时已经发生肿瘤播散,其播散部位多为膀胱直肠窝、乙状结肠、盲肠、肝、脾、子宫、子宫阔韧带、膀胱、横膈、髂窝、网膜、腹壁等部位,也可出现颈部淋巴结转移[9]。多数患者行肿瘤减灭术,术后辅以化疗[10-15]、激素治疗[1-8]或前两者药物联合使用[13],个别放疗。传统化疗方案主要有: 长春新碱+更生霉素+环磷酰胺(VAC)[14]、环磷酰胺+顺铂+吡柔比星(CPA)、依托泊苷(VP-16)、博来霉素(BLM)、博来霉素+依 托泊苷+顺铂(BEP)、紫杉醇+异环磷酰胺+顺铂(TIP)[10]等方案。卵巢室管膜瘤高表达ER、PR的特点[5],提示三苯氧胺(商品名他莫昔芬)激素治疗可能有效[11-12]。KLEINMAN等[1]报道2例IIIc期患者,1例术后4年肿瘤多处复发,予三苯氧胺治疗继续存活5年,另1例术后5年死于肿瘤纵隔转移。患者行肿瘤减灭术并术后辅以化疗、激素治疗或两者药物联合使用。患者预后较好,即使有复发或转移,再次手术及化疗效果仍较理想。曾德华等[16]复习文献报道随访23例,5年以上存活13例,最长51年;5年以下10例,均带瘤存活;死亡3例(其中1例证实死于肠癌)。本例年轻患者术后予博来霉素+依托泊苷+顺铂(BEP)方案化疗1次(12 d),拒绝再次化疗,此后改服中药,门诊B超随访9年5个月,情况良好。
卵巢原发的室管膜瘤十分罕见,诊断具有较大的难度,尤其是在冰冻快速诊断时,组织形态和染色效果不理想,且没有免疫组化, 容易出现漏诊或误诊情况。但如果在冰冻诊断卵巢肿瘤的过程中考虑到此病,一般不容易误诊,病理医师有必要加强对该罕见肿瘤的认识。目前随访资料显示卵巢室管膜瘤属于低度恶性肿瘤,患者发病以年轻患者为主,预后较好,即使有术后多次复发病史或盆腹腔转移、大网膜播散及淋巴结转移等晚期病例,仍可以通过手术治疗并辅以放化疗,获得较好治疗效果,预后好于颅内原发性病例。患者术前的早发现、早期正确病理诊断以及初次手术较彻底的手术方式有助于减少术后复发率以及延长复发周期,建议术后长期随访。该病目前以肿瘤减灭术治疗为主,术后传统化疗方案如:VAC、CPA、VP-16、BLM、BEP,以上化疗方案效果不一,在复发病例中运用激素类药物治疗或TIP化疗方案取得了较好治疗效果,基因分子检测、寻找靶向药物、建立个体化治疗策略将是今后的方向。
