鸡传染性支气管炎病毒血清学和分子生物学检测技术研究进展
2023-10-27李倩
李 倩
青海民族大学预科教育学院,青海 西宁 810000
0 引言
鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)的致病性比较强,且传播范围广,传染速度快,不仅会对鸡的呼吸道和消化道产生极其严重的损害,还会对鸡群的生产性能产生影响,严重的可导致死亡。此外,病毒还会对繁殖系统产生损害,使输卵管永久性的退化。因IBV血清型别较多,且各血清型别之间缺少有效的相互防护,新毒株产生时会导致机体对IBV的免疫力降低。为寻找快速准确的检测方法,从血清学和分子生物学方面进行研究,是防控鸡传染性支气管炎(infectious bronchitis,IB)的重要研究内容。
1 血清学检测技术
1.1 常用检测技术及其方法比较
1.1.1 酶联免疫吸附试验
酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)法操作步骤比较简单,对于病毒的检测比较准确。从1971年Engvall等人创立了 ELISA技术后,ELISA因其灵敏度高、特异性强、操作简单、快速而被广泛用于各种动物病的诊断与免疫分析。美国、英国、日本在该技术的使用方面比较先进,都有相应的商业测试工具。在我国已有文献报导,利用免疫层析技术,将整个病毒包裹在一块反应盘上,用间接 ELISA法对鸡群进行检测。庄金秋 等[1]利用微分离心-非连续浓度梯度蔗糖离心-琼脂糖凝胶层析法,既能保证核酸质量,又能减少由于蔗糖浓度梯度导致的核酸丢失,从而增强核酸酶联免疫吸附试验的可信度。
1.1.2 病毒中和试验
病毒中和试验(virus neutralization,VN)主要针对鸡胚进行使用,采用气道环法,是一种在早期使用的鉴定方法,能够对IBV进行检测。刘秀芹 等[2]利用气道环切法,对山东地区 IBV病毒的血清型别进行了鉴别,并取得了较好的效果。尽管此法具有良好的敏感性和特异度,但是其存在步骤繁琐、费时费力、对实验条件要求苛刻等缺点。
1.1.3 琼脂扩散沉淀法
琼脂扩散沉淀法(agar diffusion precipitation,AGP)是一种快速、简便、特异性强的方法,自从这一方法被提出后,在 IBV的血清学分析中得到了广泛的使用。在鸡群体中,病毒的阳性比率升高,表明存在 IBV的感染,可在此基础上,对其进行抗体的配制。目前已有多种疫苗和疫苗的制备技术,既能保持病毒的完整,又能增强 AGP检测的特异性。另外,用受感染的小鸡的气道分泌液作抗原,用 AGP与一种已知的抗体结合,可以发现分泌液中所含的病毒。琼脂扩散试验抗原是由鸡胚胎中致命的博德特利菌系来生产的。
1.1.4 不同免疫状态下3种血清检测法的比较
对10只试验鸡进行第1次疫苗注射,20 d后采血进行初免抗体检测,同时对这10只鸡进行第2次疫苗注射,20 d后采血进行二免抗体检测。对照组20只鸡未进行疫苗注射,在同时期采血作为阴性血清。
表1显示出3种检测方法检测效果有区别,主要在于敏感性不同。ELISA法检测一免、二免的鸡血清中,血清中的血清学检测阳性率均为100%;VN检测结果显示免疫组之间差别较大;在一免和二免2种抗体中,AGP的阳性率分别为0%和40%。
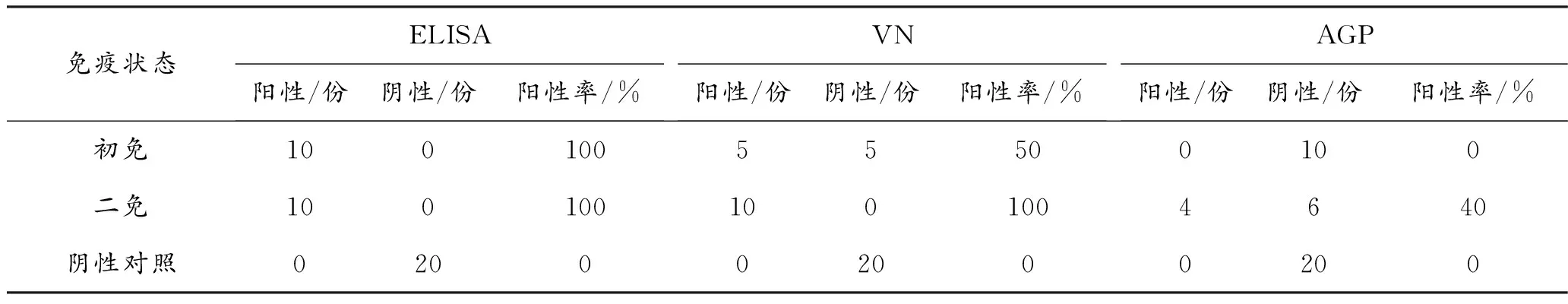
表1 不同免疫状态下3种血清学方法检测结果比较
1.1.5 3种血清学方法检测结果之间一致性的计算
通过对3种方法进行对比,得出了反映这3种方法两两之间相关性的Kappa值。在Kappa值为1时,表明这2种方法的符合度是100%,而在Kappa值为0时,表明这2种方法的符合度是0。从表2可以看出,ELISA与VN的Kappa值是0.69,ELISA与AGP之间的Kappa值是0.61,而VN与AGP之间的Kappa值是0.34,这2者之间的符合度是最低的。

表2 三种血清学方法检测结果之间 一致性的Kappa值的计算
1.2 其他血清检测方法
1.2.1 血凝和血凝抑制试验
血凝试验(Hemagglutination test,HA)是一种灵敏、特异的检测方法。蔡俊呈 等[4]研究表明,I-型磷酸酯酶 C 对IBV具有较强的凝血能力,且该凝血能力可被特异的抗血清阻断。后来,研究者将这一理论进行深入研究,提出了简便、准确的检测技术,阿克赛德使它规范化。这一技术已被公认为最有希望作为一种标准技术来监测产品中IB抗体含量的改变。已有研究表明,在IBV中,胰蛋白酶、卵磷脂酶C和乙醚等对7种血球有不同的凝集作用。IBV的血液凝聚能力与Na+、Mg2+有关,0.5 mol/L的IBV蛋白的血液凝聚能力最强,而甲醛对 IBV蛋白的杀伤作用最强。
对于IBV的凝集作用,人们普遍认为可能与其与IB病毒表面上的a-2,3位点上的半乳糖链相连所形成的一种唾液酸的结构有关。血凝抑制试验(Hemagglutination inhibition test,HI)是临床上使用较多的一种检测方法。HI的检测技术在养殖业使用更加切合实际,也更加节省时间和精力。然而,因为 HI抗原的制备过程非常繁琐,还需要超速离心,而且要进行长时间的冷冻存。且需要根据病毒的浓度进行使用,抗原具有不稳定性,该种技术还没有形成统一的使用规范,还有待于更多的改进。
1.2.2 荧光抗体技术
荧光抗体技术(fluorescent antibody technology,FA)在IBV血清学诊断方面应用比较多,也可以用于免疫学诊断。布劳恩赫公司第一个将萤光抗体技术用于鸡群诊断检测,在感染了急性疾病的鸡气道上使用萤光标记的抗体来侦测IBV。有研究者利用实验制备了抗原,对不同感染类型的鸡进行检测,发现在72 h内,人工感染的鸡的肾中100%出现了特异的荧光,而在其他时候,也有一些鸡出现了特异的荧光。经人工接种后,所有病死鸡的肾中都出现了100%的特异荧光;48~120 h在人工侵染的鸡胚中100%出现特异的荧光。在178个天然感染的样本中,有153个样本的免疫反应呈阳性,该技术检测免疫反应与传统技术监测免疫反应的结果一致,且大大缩短了免疫反应过程,适用于临床诊断和疫苗免疫反应的监控。目前,FA被公认为是一种简单、快速可靠、敏感度高、价格低廉的IBV诊断技术。
1.2.3 胶体金免疫层析技术
胶体金免疫层技术(GICA)是一种操作比较简单的方法,使用的时候不需要其他仪器的辅助,这种方法具有很好的开发价值,未来的使用前景较好。但该方法需要抗体的含量比较高,而且抗体都必须具有很好的活性。吴忆春[5]在相关实验中,研制出了一种新型的 IBV免疫胶体金检测试剂盒,该试剂盒可用于禽流感的早期检测、预防和治疗,并可对其他家禽呼吸系统疾病进行快速检测。
2 分子生物学检测方法
2.1 逆转录-聚合酶链反应
逆转录-聚合酶链反应技术(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)是一种准确度较高的检测方法,可以对不同的病毒亚型进行检测,对一种血清进行检测的时候,检测结果不受其他亚型的影响。而且还可以针对一些差别很大的菌种,进行特异性引物的筛选。对于突变频率高的病毒,可以对其进行血清型和基因分型;对于N、M等保守区,可以对其进行群体特异的扩增。唐第深[6]以IBV的N区段为基础,通过设计引物,采用RT-PCR技术,对IBV的N区段进行了检测。有研究者以IBV793/B毒株SI的基因序列为基础,通过RT-PCR技术,对793/B毒株进行了RT-PCR技术的研究。利用IBV强、弱毒疫苗毒株的序列特点,通过对其S1基因多变区进行扩增,扩增出的基因片段能够提升检测的准确性,这是一种复合鉴定技术,是一种很好的技术诊断方式。
2.2 环介导逆转录等温扩增技术
环介导逆转录等温扩增技术(Reverse Transcription Loop-Mediated Isothermal Amplifcation,RT-LAMP)是一种基于RT-PCR的快速、灵敏、新颖的核酸分析技术,适用于养殖场检测。有研究者以IBV M型株为研究对象,以RT-LAMP技术为基础,采用RT-PCR技术对IBV M型株进行鉴定,结果表明该技术对IBV M型株的检出率高于RT-PCR,且特异性强、灵敏度高。研究者分别以5a+5b为参考,以M为参考,以N为参考,用RT-LAMP技术对IBV进行了研究。
2.3 核酸探针技术
有研究者对IBV免疫后的鸡支气管内IBV全基因组进行了分析。在免疫后第1、3、9、14天时,利用PCR方法对其进行了扩增,并通过荧光素酶报告基因进行了定点杂交验证。核酸探针技术的应用为病毒的检测提供了新的方法,进一步提升不同群体的检测准确度。在8个群体中,电子显微镜检出4个群体,其中4个群体可用PCR法检出。核酸探针技术用于N基因的检测具有迅速特性,全部处理时间不大于12 h。在对该基因的检测过程中,需要确定基因的位点,N基因四位点构建了一种BV-PCR快速测定方法。与 PCR扩增法比较,2种试验均显示:在最初的感染过程中,该病毒对细胞内的细胞有广泛的嗜性,并随着时间的推移和其自身的特点而逐渐向目标器官转移。
2.4 基因芯片技术
基因芯片技术是以先进的芯片技术为基础研发出来的一种检测技术,该技术具有高通量、检测结果比较客观等优点。现在已成功地建立了NDV-IBV- AIV和IBDV的基因芯片。双荧光定量PCR技术,将非对称PCR技术与基因微阵列技术相融合,并通过增大cy3标签引物的密度,使微阵列与目标基因的杂交更加高效,更好地实现了对目标基因的检测。该技术可突破传统生物分析手段只能对几个目标基因进行快速、准确测定的局限,降低了分析结果的主观性,并可实现对不同类型的混杂传染病的同步诊断。
3 结束语
IBV的血清型别较多,变种层出不穷,不同种血清型之间的相互保护性较差,造成了机体的免疫应答失效,给 IB的防控带来了困难。近年来,国内外对 IBV的血清学和分子生物学检测技术进行了大量的研究,但是各种检测技术都有各自的优势和不足。在实际的养殖和临床研究中,需要根据实际情况选用合适的检测方法,情况比较复杂时,需要联合使用2种或多种检测方法。随着在分子水平上更加深入的研究,IBV检测技术将不断发展。
