碳青霉烯耐药质粒接合效率的评价方法比较
2023-10-26孙育坤张铭洋刘宝涛
孙育坤,张铭洋,公 啸,邹 明,刘宝涛
(1. 青岛农业大学动物医学院,山东 青岛 266109 ; 2. 临沂市平邑县畜牧发展促进中心,山东 临沂 273300)
大肠杆菌(Escherichiacoli)是导致普通感染和交叉感染的主要致病菌之一[1]。在多重耐药大肠杆菌等肠杆菌引起的感染中,碳青霉烯类药物是治疗效果最佳的药物,其抗菌谱最广[2]。但是,随着碳青霉烯类药物的不合理应用和碳青霉烯酶的出现,大肠杆菌和肺炎克雷伯菌等肠杆菌的耐药问题日趋严重[3,4]。基因水平转移是耐药质粒传播的主要机制[5],研究人员普遍认为抗生素可以促进基因的水平转移[6,7]。研究表明,抗生素在促进基因水平转移的过程中,主要有两种接合途径:第一种,当以亚抑菌浓度给药时,抗生素可通过激活从宿主染色体上切除的可转移基因或诱导接合机制(或两者)的表达来提高接合效率[8-12];第二种,已经推测但未被证实的是,抗生素可以引起整体细胞反应,例如细胞壁组成的变化或关键存活基因的上调,这可以间接提高接合效率[13]。
现有研究主要有两种评价接合效率的方法:在鄂顺梅等[14]和Matsuo等[15]的文章中,采用传统方法对接合效率进行评价,即接合效率=接合子数÷受体菌数;而Lopatkin等[16]在2016年发表的文章中提出,抗生素对接合效率的促进作用可能被高估,整体的接合动力学实际由2个部分(真实接合效率和接合子的生长速率)构成。目前,已有抗生素对接合效率的影响的研究[17-19],并已发现抗生素可以提高质粒的接合效率,但在这些研究中并未对真实接合效率进行探究,这导致了其研究结果在一定程度上缺乏说服力。要确定抗生素对质粒接合效率的真实影响,需对真实接合效率进行评价。为了达到这一目的,Lopatkin等[16]将接合时间控制在1 h以排除接合子生长带来的影响,并测定了氯霉素、羧苄青霉素、红霉素、链霉素、头孢曲松和诺氟沙星等多种抗生素分别对不同类型的标准质粒的真实接合效率的影响,结果显示,抗生素对质粒的真实接合效率并没有显著的促进作用(P>0.05),说明抗生素对质粒接合效率的提高作用可能被高估。目前,碳青霉烯类抗生素对耐药质粒真实接合效率影响的研究罕见。本试验分别运用传统方法和真实接合效率方法2种评价方法,测定不同亚抑菌浓度的碳青霉烯代表药物美罗培南对3种不同碳青霉烯耐药质粒的接合效率的影响,并对其结果进行比较,旨在探索抗生素对接合效率的真实影响,同时为接合效率评价方法的选择提供理论依据。
1 材料与方法
1.1 试验菌株 选择来源于家禽和鲜蔬且携带不同碳青霉烯耐药质粒的试验菌株,信息见表1。
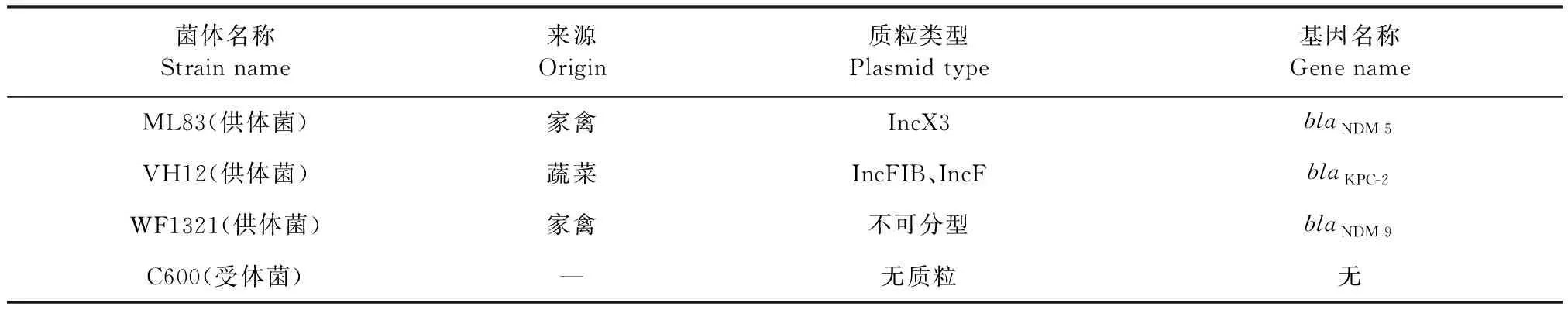
表1 试验菌株及其质粒类型和基因名称Table 1 Test strains and their plasmid types and gene names
1.2 主要试剂 链霉素标准品和美罗培南标准品,均购自北京索莱宝科技有限公司;MH肉汤、LB肉汤和麦康凯琼脂培养基,均购自青岛海博生物技术有限公司。
1.3 主要仪器 控温气浴摇床,常州高德仪器公司产品;37 ℃恒温培养箱,上海森信实验仪器有限公司产品;PCR扩增仪,BIO-RAD 公司产品。
1.4 试验方法
1.4.1 抗生素储存液的制备 制备浓度为2 560 μg/mL的抗生素储存液。按照药品说明书,精确称量抗生素标准品,加入相应溶剂(美罗培南的溶剂为N,N-二甲基甲酰胺;链霉素的溶剂为高压过的纯水),涡旋振荡混匀,过滤分装,-20 ℃保存备用。
1.4.2 美罗培南对C600的最小抑菌浓度(Minimum inhibitory concentration,MIC)值测定 根据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)中的微量肉汤稀释法测定美罗培南对C600的MIC值。将-80 ℃保存的C600以1∶1 000的比例复活培养于MH肉汤培养基中,37 ℃恒温过夜培养;随后将96孔板第1列每孔加 180 μL MH肉汤培养基,其余每孔加入100 μL MH肉汤培养基;第1列每孔加入20 μL 2 560 μg/mL 的美罗培南储存液,吹打混匀后吸出100 μL至第2列,依次倍比稀释至最后1列并吸弃100 μL;随后将复活培养的菌液于600 nm处用酶标仪将光密度(Optical density,OD)值调为0.5,用MH肉汤培养基将菌液连续2次10倍倍比稀释,作为接种菌液,每孔接种100 μL接种菌液;同时设置MH肉汤培养基+水、MH肉汤培养基+C600和MH肉汤培养基+25922对照组,37 ℃培养16~22 h读取结果。
1.4.3 亚抑菌浓度美罗培南对质粒接合效率影响的评价 在不添加美罗培南(对照组,Control组)的条件下,分别采用2种评价方法测定ML83、VH12和WF1321三种不同类型质粒的接合效率。同时,采用2种方法探究不同美罗培南浓度(1/4MIC组、1/8MIC组、1/16MIC组和1/32MIC组)对3种不同类型质粒接合效率的影响。
传统方法:将受体菌和供体菌分别以1∶1 000的比例加入空白LB肉汤培养基中复活培养,分别加入美罗培南至其最终浓度分别为0、1/4MIC、1/8MIC、1/16MIC和1/32MIC。供体菌培养12 h,受体菌由于不同的抗生素浓度需培养不同的时间;调整供体菌和受体菌的OD600 nm值,使二者的OD600 nm值相同,均为0.5;采用3.75 mL接合体系,吸取培养后的受体菌菌液3 mL和供体菌菌液0.75 mL于5 mL无菌离心管中,37 ℃静置培养6 h,重复3次试验;将培养后的菌液于4 000 r/min离心5 min,弃去上清;向离心管内加入0.5 mL 0.85%生理盐水混匀,并进行10倍倍比稀释,吸取100 μL稀释液在同时含1 μg/mL美罗培南和1 000 μg/mL链霉素的麦康凯琼脂培养基均匀涂布,37 ℃静置培养16~20 h,统计接合子菌落数;吸取100 μL稀释液在只含1 000 μg/mL链霉素的麦康凯琼脂培养基均匀涂布,37 ℃静置培养16~20 h,统计受体菌菌落数,并计算每毫升接合体系中的接合子数和受体菌数;采用传统方法按公式(1)计算接合效率。
接合效率=接合子数÷受体菌数
(1)
真实接合效率方法:接合试验过程同上,不同之处在于接合时间为2 h;细菌计数分别采用3种含不同抗菌药的麦康凯琼脂培养基,接合子计数采用同时含1 μg/mL美罗培南和1 000 μg/mL链霉素的麦康凯琼脂培养基,受体菌计数采用含1 000 μg/mL链霉素的麦康凯琼脂培养基,供体菌计数采用含1 μg/mL美罗培南的麦康凯琼脂培养基,分别计算每毫升接合体系中的接合子数、受体菌数和供体菌数;采用真实接合效率方法按公式(2)计算接合效率。
接合效率(Conjugation efficiency,η)=接合子数(Number of transconjugants,Y)÷[供体菌数(Number of donors,G)×受体菌数(Number of recipients,R)×接合时间(Time of incubation,Δt)]
(2)
1.5 统计分析 采用GraphPad Prism 7.0分别绘制亚抑菌浓度美罗培南对ML83、VH12和WF1321接合效率影响的结果图。*为P<0.05,**为P<0.01,***为P<0.001,****为P<0.000 1,ns为P>0.05。
2 结果
2.1 美罗培南对C600的MIC值测定 结果显示,美罗培南对C600的MIC值为0.018 μg/mL。
2.2 亚抑菌浓度美罗培南对质粒接合效率影响的2种评价方法的比较 2种评价方法得到的亚抑菌浓度美罗培南对质粒接合效率影响的比较结果如图1~3所示,对于3株供体菌ML83、VH12和WF1321,传统方法所获得的5个组接合效率介于1.94×10-6~2.47×10-5(图1A、图2A和图3A),而真实接合效率方法所获得的5个组接合效率仅为0.39×10-13~24.10×10-13(图1B、图2B和图3B)。对于ML83菌株,与对照组相比,2种评价方法中1/4MIC、1/8MIC和1/16MIC组均可显著提高ML83的碳青霉烯耐药质粒接合效率(P<0.05),且1/4MIC组的作用最显著(P<0.001),但1/32MIC组的美罗培南对接合效率并没有显著影响(P>0.05)(图1)。对于VH12菌株,与对照组相比,传统方法中仅1/4MIC组可极其显著提高VH12的接合效率(P<0.001)(图2A),而真实接合效率方法中1/4MIC和1/8MIC组VH12的接合效率均极显著提高(P<0.01),且1/4MIC组的促进作用最显著(P<0.001)(图2B)。对于菌株WF1321,与对照组相比,2种评价方法所获得的接合效率均仅有1/4MIC组有极显著提高(P<0.01),但真实接合效率方法的1/4MIC组与对照组的差异更显著(P<0.001)(图3)。由此可知,与真实接合效率方法相比,传统方法得到的接合效率更高且药物的促进作用更高,但真实接合效率方法得到的药物对接合效率影响的差异性更显著;不同亚抑菌浓度美罗培南对碳青霉烯耐药质粒的接合转移均有促进作用,且促进作用随着浓度的升高而增大。
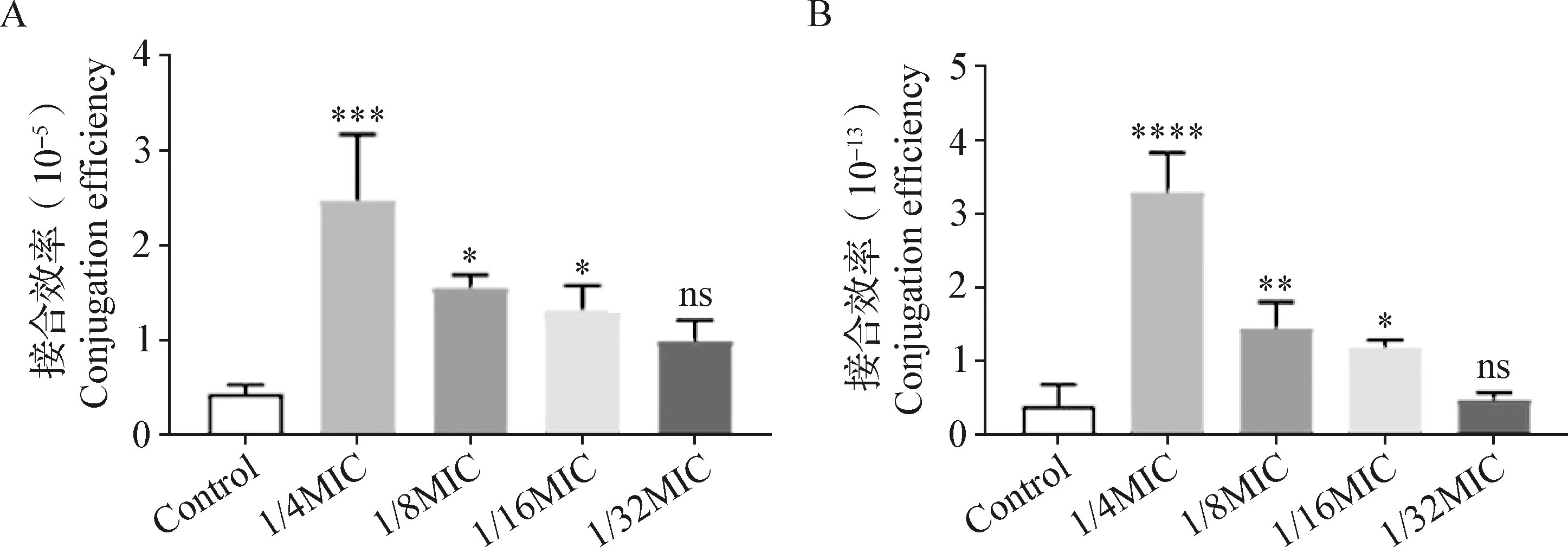
图1 亚抑菌浓度美罗培南对ML83接合效率评价方法的比较Fig.1 Comparison of evaluation methods for conjugation efficiency of strain ML83 at different sub-inhibitory concentrations of meropenemA:传统方法的接合效率; B:真实接合效率方法的接合效率; *:P<0.05; **: P<0.01; ***:P<0.001; ****:P<0.000 1; ns:P>0.05;下图同A:Conjugation efficiency calculated by traditional method; B:Conjugation efficiency calculated by real conjugation efficiency evaluation method;*:P<0.05; **:P<0.01; ***:P<0.001; ****:P<0.000 1; ns: P>0.05. The same as the following figures
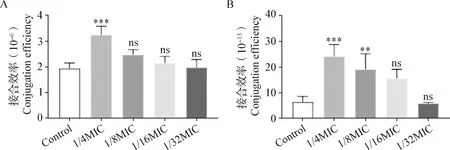
图2 亚抑菌浓度美罗培南对VH12接合效率评价方法的比较Fig.2 Comparison of evaluation methods for conjugation efficiency of strain VH12 at different sub-inhibitory concentrations of meropenem
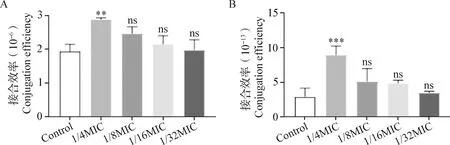
图3 亚抑菌浓度美罗培南对WF1321接合效率评价方法的比较Fig.3 Comparison of evaluation methods for conjugation efficiency of strain WF1321 at different sub-inhibitory concentrations of meropenem
3 讨论
质粒介导的耐药能通过接合使耐药基因水平转移到其他细菌中。抗生素对耐药质粒的水平传播有一定的促进作用,但抗生素对耐药质粒接合效率的真实作用如何,至今研究较少。本试验分别采用传统方法和真实接合效率方法分析1/4MIC、1/8MIC、1/16MIC和1/32MIC的美罗培南对3种不同类型质粒接合效率的影响,结果显示,2种评价方法得到的接合效率变化的趋势是一致的:亚抑菌浓度美罗培南处理组的接合效率高于对照组,并且随着亚抑菌浓度的增高,接合效率也增高,药物对接合效率有明显的促进作用。而在袁慧[20]的研究中,亚抑菌浓度美罗培南对接合效率的影响并未发现这一规律,可能是由于试验方法不同所导致的。袁慧[20]认为,对接合反应影响比较大的是供体菌,因为供体菌包括较多接合反应相关的元件,因此,其仅采用亚抑菌浓度抗生素处理供体菌。而研究表明,碳青霉烯类抗生素产生耐药性共有5种方式:产生碳青霉烯酶、青霉素结合蛋白(Penicillin binding proteins,PBPs)改变、膜孔蛋白缺失、药物主动外排泵过度表达和细菌生物膜(Bacterial biofilm,BF)形成[21],所以推测受体菌也会影响接合效率,故在本试验中同时用亚抑菌浓度美罗培南处理了供体菌和受体菌。与真实接合效率方法相比,传统方法得到的接合效率更高,这是因为其对“真实接合效率和接合子生长速率”两者进行了整体探究;而真实接合效率方法得到的接合效率组间差异性更显著,是因为在试验中缩短了接合时间,有效防止了“接合子的生长速率”这一过程,达到了对“实际接合效率”的单独探究。此外,传统方法中抗生素对接合效率升高的数量级高于真实接合效率方法获得的接合效率升高的数量级,这也说明了抗生素对接合效率的促进作用被高估[16]。本试验结果表明,细菌的真实接合主要发生在接合试验前期,后期会因接合子的生长繁殖导致总接合效率的升高。本试验通过对接合效率2种评价方法的比较,更加深入了解细菌接合效率的构成,为减缓碳青霉烯类抗生素耐药性的产生及其耐药质粒的传播提供指导,同时也为科学选择接合效率的评价方法提供参考。
